- Горение и виды горючих веществ
- Круговорот кислорода в природе
- Оксиды
- Получение кислорода в лаборатории
- Правила безопасности при использовании, хранении и транспортировке кислорода
- Применение кислорода в различных отраслях
- Распространенность оксигена в природе
- Свойства и применение кислорода
- Свойства кислорода — урок. химия, 9 класс.
- Строение и физические свойства простых веществ
- Химические свойства
Горение и виды горючих веществ
Реакция, протекающая с участием кислорода и сопровождающаяся выделением большого количества света и тепла, называется горением.
В чистом кислороде, по сравнению с воздухом, вещества горят во много раз быстрее (рис. 22). В обоих случаях выделяется равное количество теплоты, но в кислороде этот процесс протекает быстрее и выделяющаяся теплота не расходуется, как в случае с воздухом, на нагревание азота.
Температура при горении в чистом кислороде выше, чем в воздухе. Опуская тлеющую лучину в сосуд с чистым кислородом, можно увидеть, как она сразу загорается. А в воздухе тлеющая лучина может вскоре и потухнуть. Если эта лучина зажжена, то она продолжает гореть на воздухе, потому что выделяющееся при горении тепло требует большей температуры, чем температура воспламенения лучины.
Рис. 22. Горение магния в чистом кислороде
Рис. 23. Тушение пламени
Температура, необходимая для поджигания вещества на воздухе, называегся температурой воспламенения.
Значит, для обеспечения горения веществ, нужно нагревать их до температуры воспламенения и подавать кислород в достаточном количестве.
Для того чтобы потушить пламя, необходимо ликвидировать факторы, обеспечивающие его появление, т.е. охладить вещество до температуры ниже температуры возгорания и прекратить подачу кислорода (рис. 23).
Чтобы потушить горящую вещь, сначала следует понизить температуру, используя невоспламеняющиеся средства, затем накрыть источник возгорания одеялом или брезентом, чтобы прекратить подачу воздуха.
В непредвиденных ситуациях для тушения пожара необходимо использовать специальные средства, а если их нет, то применять указанный выше способ.
Вообще процесс горения имеет огромное значение в промышленности и в повседневной жизни.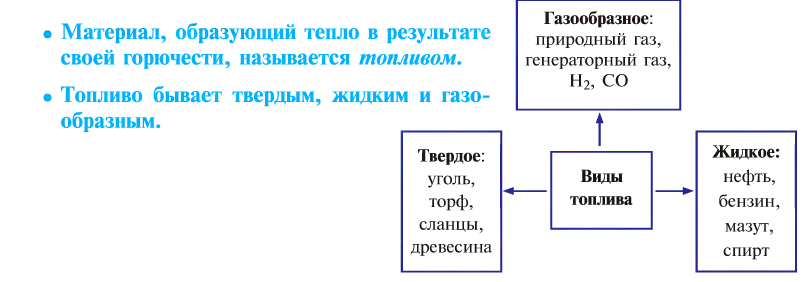
От твердого топлива остается минеральный осадок — пепел. Жидкое и газообразное топливо такого недостатка не имеет. Но любое топливо независимо от места добычи, промышленного объема, экономической эффективности имеет только свое место применения, и возможности по его взаимозамещению ограничены.
Неправильное сжигание топлива приносит вред народному хозяйству.
Топливо позволяет спокойно переносить холод, варить пищу, которая не употребляется в сыром виде, получать металлы из руд путем их выплавки, обеспечивать движение транспорта, получать другие виды энергии.
Круговорот кислорода в природе
О том, что кислород в большом количестве находится в литосфере, гидросфере и атмосфере, мы говорили в предыдущих разделах учебника (табл. 5).
Круговорот кислорода на Земле несущественно отличается от его круговорота в атмосфере, литосфере и гидросфере. На Земле круговорот в основном протекает в процессе фотосинтеза и дыхания. В процессе фотосинтеза углекислый газ, взаимодействуя с водой, образует органические вещества и кислород. В результате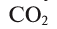
При дыхании, разложении умерших организмов и горении кислород из биосферы возвращается обратно в гидросферу и атмосферу:
В биомассе Земли кислород полностью меняется каждые 20—30 лет. В литосферу кислород переходит из атмосферы в виде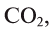
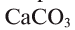
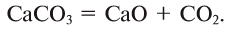
Эта реакция наблюдается в основном в зонах повышенной вулканической деятельности, тем самым постепенно обновляя углекислый газ в атмосфере.
Оксиды
Продуктами всех реакций, рассмотренных в параграфе, являются бинарные соединения элементов с Оксигеном.
Соединение, образованное двумя элементами, одним из которых является Оксиген, называют оксидом.
Общая формула оксидов — 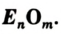
Таблица 4Формулы и названия некоторых оксидов
Выводы:
Кислород — химически активное вещество. Он взаимодействует с большинством простых веществ, а также со сложными веществами. Продуктами таких реакций являются соединения элементов с Оксигеном — оксиды.
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий
 Рис. 54.Получение кислорода нагреванием меркурий
Рис. 54.Получение кислорода нагреванием меркурий оксида
оксида
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
Небольшое количество катализатора — манган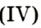
 Получение кислорода разложением гидроген пероксида
Получение кислорода разложением гидроген пероксида 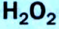 Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган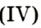
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 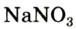

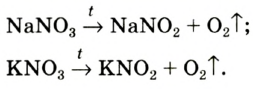
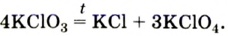
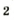 селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока: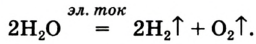
Правила безопасности при использовании, хранении и транспортировке кислорода
- Необходимо внимательно следить за тем, чтобы кислород не находился в контакте с горючими легковоспламеняющимися веществами.
- Следить за тем, чтобы не было утечки, поскольку даже при незначительном увеличении количества кислорода в воздухе может произойти самовозгорание горючих материалов или волос на теле, одежде и т.п.
- Все лица, в том числе и сварщики, работающие с кислородом никогда не должны надевать рабочую одежду, на которых присутствуют следы смазки или масла.
- Запрещено применение O2 вместо воздуха для запуска дизельного двигателя.
- Запрещено его использование с целью удаления пыли с рабочей одежды. При случайном попадание избыточного объема кислорода на одежду потребуется много времени для выветривания, вплоть до нескольких часов.
- Запрещено применение для освежения воздуха.
- Вся кислородная аппаратура, кислородопроводы и баллоны необходимо тщательно обезжиривать. В процессе эксплуатации исключить возможность попадания и накопления масел и жиров на поверхности деталей, работающих в контакте с O2.
- Оборудование, работающее в непосредственном контакте с кислородом не должно содержать пыль и металлические частицы во избежание самовозгорания.
- Перед проведением ремонтных работ или освидетельствованием трубопроводов, баллонов, стационарных и передвижных реципиентов или другого оборудования, используемого для хранения и транспортирования газа, необходимо продуть все внутренние объемы воздухом. Разрешается начинать работы только после снижения объемной доли O2 во внутренних объемах оборудования до 23%.
- Запрещается баллоны, автореципиенты и трубопроводы, предназначенные для транспортирования кислорода, использовать для хранения и транспортирования других газов, а также производить какие-либо операции, которые могут загрязнить их внутреннюю поверхность.
- При погрузке, разгрузке, транспортировании и хранении баллонов должны применяться меры, предотвращающие их падение, удары друг о друга, повреждение и загрязнение баллонов маслом. Баллоны должны быть защищены от атмосферных осадков и нагрева солнечными лучами и другими источниками теплоты.
- На всех кислородных вентилях должна находится табличка «кислород маслоопасно».
Все вышеуказанные свойства и особенности кислорода нужно принимать во внимание при его использовании, хранении и транспортировке.
Применение кислорода в различных отраслях
Кислород используют в различных отраслях, причем в больших количествах (схема 9). В металлургии он ускоряет процесс выплавки стали и улучшает ее качество. Этот газ необходим в производстве многих химических соединений, используется в специальных устройствах для резки и сварки металлов (водородно-кислородные, ацетиленово-кислородные горелки).
Баллоны, наполненные кислородом (рис. 66) или его смесью с инертным газом гелием, используют космонавты, военные летчики, пожарники, водолазы. Кислородные подушки применяют при некоторых заболеваниях для облегчения дыхания. С помощью сжиженного кислорода создают необходимые условия для сгорания горючего в космических ракетах.

Схема 9.Применение кислорода
Широко используется и кислород, входящий в состав воздуха. При его участии сгорает топливо на теплоэлектростанциях, горючее в двигателях автомобилей, обжигают металлические руды на заводах цветной металлургии.
Рис. 66. Баллон с кислородомВо время сжигания топлива и горючего образуется и попадает в воздух значительное количество угарного (СО) и сернистого 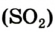
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 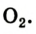
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 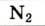 | 78,09 | 75,51 |
| Кислород | 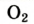 | 20,95 | 23,15 |
| Аргон | 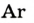 | 0,93 | 1,28 |
| углекислый газ | 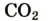 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой 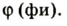
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52).
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 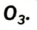 Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород:
Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород: 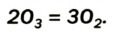
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
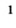
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 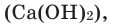
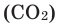
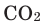
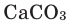
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ (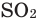
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (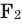
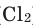
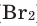
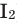
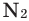
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (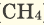
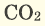
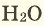
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода.
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Свойства кислорода — урок. химия, 9 класс.
Строение и физические свойства простых веществ
С простым веществом кислородом вы уже познакомились в курсе химии 7-го класса. Напомним, что простое вещество кислород в природе существует в виде двух аллотропных модификаций — обычного кислорода 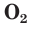 озона
озона 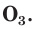
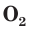
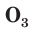
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Небольшие количества озона в воздухе оказывают целебное действие на людей. Однако сильное обогащение воздуха озоном может стать опасным для здоровья. Увеличение содержания озона в воздухе выше предельно допустимой концентрации приводит к появлению головных болей, раздражению дыхательных путей и глаз, а затем к ослаблению сердечной деятельности.
Источниками озона являются работающие приборы, в которых происходит высоковольтный электрический разряд — копировальные установки и лазерные принтеры, а также источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы, необходимо часто проветривать.
Озон сосредоточен в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от жесткого ультрафиолетового излучения Солнца. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов.
Кислород и озон в воде мало растворимы. При 20 °С в 100 объемах 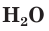
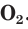
Химические свойства
Что такое Фенол? Гидроксибензол, что это такое? Согласно Википедии – это один из простейших представителей своего класса ароматических соединений. Фенолы – это органические ароматические соединения, в молекулах которых к гидроксильной группе присоединены атомы углерода из ароматического кольца.
Общая формула Фенолов: С6Н6n(ОН)n. Согласно стандартной номенклатуре, органические вещества этого ряда различают по числу ароматических ядер и ОН-групп. Различают одноатомные аренолы и гомологи, двухатомные арендиолы, терхатомные арентриолы и многоатомные формулы.
Также Фенолам свойственно иметь ряд пространственных изомеров. Например, 1,2-дигидроксибензол (пирокатехин), 1,4-дигидроксибензол (гидрохинон) являются изомерами.
Спирты и Фенолы отличаются друг от друга наличием ароматического кольца. Этанол является гомологом метанола. В отличие от Фенола, метанол взаимодействует с альдегидами и вступает в реакции этерификации. Утверждение, что гомологами являются метанол и Фенол неверно.
Его подробно рассмотреть структурную формулу Фенола, то можно отметить, что молекула представляет собой диполь. При этом бензольное кольцо – отрицательный конец, а группа ОН – положительный. Наличие гидроксильной группы обуславливает повышение электронной плотности в кольце.
Неподеленная пара электронов кислорода вступает в сопряжение с пи-системой кольца, а для атома кислорода характерна sp2 гибридизация. Атомы и атомные группы в молекуле обладают сильным взаимным влиянием друг на друга, и это отражается на физических и химических свойствах веществ.
Физические свойства. Химическое соединение имеет вид бесцветных игольчатых кристаллов, которые розовеют на воздухе, так как подвержены окислению. У вещества специфический химический запах, оно умеренно растворимо в воде, спиртах, щелочи, ацетоне и бензоле. Молярная масса = 94,1 грамм на моль. Плотность = 1,07 г на литр. Кристаллы плавятся при 40-41 градусах Цельсия.
С чем взаимодействует Фенол? Химические свойства Фенола. В связи с тем, что молекула соединения содержится, как ароматическое кольцо, так и гидроксильную группу, то оно проявляет некоторые свойства спиртов и ароматических углеводородов.
С чем реагирует группа ОН? Вещество не проявляет сильных кислотных свойств. Но является более активным окислителем, чем спирты, в отличие от этанола взаимодействует с щелочами образуя соли-феноляты. Реакция с гидроксидом натрия:
Фенол не реагирует с карбоновыми кислотами. Эфиры получают при взаимодействии солей фенолятов с галогенангидридами или ангидридами кислот. Для химического соединения не характерны реакции образования простых эфиров. Эфиры образуют феноляты при действии на них галогеналканов или галогенпроизводных аренов.
Химическое взаимодействие по ароматическому кольцу. Для вещества характерны реакции электрофильного замещения, алкилирования, галогенирования, ацилирования, нитрования и сульфирования. Особое значение имеет реакций синтеза салициловой кислоты: C6H5OH CO2 → C6H4OH(COONa), протекает в присутствии катализатора гидроксида натрия.
Реакция взаимодействия с бромной водой является качественной реакцией на Фенол. C6H5OH 3Br2 → C6H2Br2OH 3HBr. При бромировании образуется твердое белое вещество — 2,4,6-трибромфенол.
Реакция нитрования Фенола: C6H5OH 3HNO3 → C6H2(NO2)3OH 3 H2O. Для вещества также характерна реакция присоединения (гидрирования) в присутствии металлических катализаторов, платины, оксида алюминия, хрома и так далее. В результате образуются циклогексанол и циклогексанон.
Химическое соединение подвергается окислению. Устойчивость вещества значительно ниже, чем у бензола. В зависимости от условий реакции и природы окислителя образуются разные продукты реакции. Под действием перекиси водорода в присутствии железа образуется двухатомный Фенол; при действии диоксида марганца, хромовой смеси в подкисленной среде – пара-хинон.
Фенол реагирует с кислородом, реакция горения: С6Н5ОН 7О2 → 6СО2 3Н2О. Также особое значение для промышленности имеет реакция поликонденсации с формальдегидом (например, метаналем). Вещество вступает в реакцию поликонденсации до тех пор, пока не израсходуется полностью один из реагентов и не образуются огромные макромолекулы.
Получение. На данный момент существуют и активно применяются несколько методов синтеза гидроксибензола. Кумольный способ получения Фенола является наиболее распространенным из них. Таким способом синтезируют порядка 95% всего объема производства вещества.
При этом некаталитическому окислению воздухом подвергается кумол и образуется гидропероксид кумола. Полученное соединение разлагается под действием серной кислоты на ацетон и Фенол. Дополнительным побочным продуктом реакции является альфа-метилстирол.
Также соединение можно получить при окислении толуола, промежуточным продуктом реакции будет являться бензойная кислота. Таким образом, синтезируют около 5% вещества. Все остальное сырье для различных нужд выделяют из каменноугольной смолы.
Как получить из бензола? Фенол можно получить с помощью реакции прямого окисления бензола NO2 (закись азота) с дальнейшим кислотным разложением гидропероксида втор-бутилбензола.
Как из хлорбензола получить Фенол? Существует два варианта получения из хлорбензола данного химического соединения. Первый – реакция взаимодействия со щелочью, например, с гидроксидом натрия. В результате образуется Фенол и поваренная соль.
Получение бензола из Фенола. Для этого сначала требуется обработать бензол хлором (в присутствии катализатора), а затем прибавить к полученному соединению щелочь (например, NaOH). В итоге образуется Фенол и хлорид натрия.
Превращение метан — ацетилен — бензол — хлорбензол можно осуществить следующим образом. Сначала проводится реакция разложения метана при высокой температуре 1500 градусов Цельсия до ацетилена (С2Н2) и водорода.
Затем ацетилен при особых условиях и высокой температуре переводят в бензол. К бензолу прибавляют хлор в присутствии катализатора FeCl3, получают хлорбензол и соляную кислоту: C6H6 Cl2 → C6H5Cl HCl.
Одним из структурных производных Фенола является аминокислота тирозин, которая имеет важное биологическое значение. Данную аминокислоту можно рассмотреть в виде пара-замещенного Фенола или альфа-замещенного пара-крезола.
Гидроксибензол применяется:
- при производстве бисфенола А, эпоксидной смолы и поликарбоната;
- для синтеза фенолформальдегидных смол, капрона, нейлона;
- в нефтеперерабатывающей промышленности, при селективной очистке масел от ароматических соединений серы и смол;
- при производстве антиоксидантов, поверхностно-активных веществ, крезолов, лек. препаратов, аспирина, пестицидов и антисептических препаратов;
- в медицине в качестве антисептического и обезболивающего средства для местного использования;
- в качестве консерванта при изготовлении вакцин и копченых продуктов питания, в косметологии при проведении глубокого пилинга;
- для дезинфекции животных в скотоводстве.
Класс опасности. Фенол – крайне токсичное, ядовитое, едкое вещество. При вдыхании летучего соединения нарушается работа центральной нервной системы, пары раздражают слизистую глаз, кожу, дыхательные пути и вызывают сильные химические ожоги. При попадании на кожу вещество быстро всасывается в кровоток и достигает тканей мозга, вызывая паралич дыхательного центра. Смертельная доза при приеме внутрь для взрослого составляет от 1 до 10 грамм.

.jpg)