- Nh3 h2 = ? уравнение реакции
- Азотистая кислота
- Аммиак
- Аммиак, получение, свойства, химические реакции.
- Оксид азота (i)
- Оксид азота (ii)
- Оксид азота (iv)
- Оксид азота (v)
- Соли азотистой кислоты — нитриты
- Соли азотной кислоты — нитраты
- Способы получения азота
- Физические свойства аммиака:
- Химические свойства азота
- Химия 9 класс! помогите пожалуйста!!!! задание 1.простым веществом является 1)вода2)аммиак3)озон4)метан задание 2.к химическим явлениям относится 1)растворение сахара в воде2)помутнение известковой воды3)выпаривание раствора соли4)фильтрование раствора соли задание 3.распределение электронов по энергетическим уровням в атоме кальция: 1)2,8,8,22)2,8,18,23)2,8,24)2,18,2 задание 4.общая формула высшего оксида элементов iva группы периодической системы д.и.менделеева 1)r2o2)ro3)r2o34)ro2 задание 5.высшую валентность азот проявляет в соединении 1)nano32)mg3n23)kno24)nh4cl задание 6.одинаковый вид химической связи в соединениях 1)кислород и аммиак2)оксид магния и оксид серы (iv)3)вода и хлороводород4)водород и метанзадание 7.взаимодействие гидроксида натрия с серной кислотой относится к реакциям 1)замещения2)обмена3)разложения4)соединения задание 8.сера проявляет свойства окислителя при взаимодействии с 1)железом2)кислородом3)хлором4)водой задание 9.электрический ток проводит 1)хлорид натрия (тв.)2)кислород (ж.)3)сахар (р-р)4)хлороводород (р-р) задание 10.наибольшее количество ионов хлора образуется при диссоциации 1 моль1)хлорида алюминия2)хлорида кальция3)хлорида натрия4)хлорида цинка задание 11.выпадение осадка происходит при сливании растворов 1)серной кислоты и гидроксида калия2)хлорида калия и сульфата натрия3)гидроксида натрия и нитрата меди (ii)4)карбоната натрия и соляной кислоты задание12 .сокращенное ионное уравнение 2h s2– = h2s↑ соответствует взаимодействию 1)сульфида натрия и азотной кислоты2)соляной кислоты и сульфата калия3)нитрата кальция и сульфида бария4)сернистой кислоты и оксида магния задание 13.амфотерным гидроксидом является 1)fe(oh)22)zn(oh)23)ca(oh)24)mg(oh)2 задание 14.оксид кальция реагирует с 1)кислородом2)оксидом серы (vi)3)водородом4)оксидом магния задание 15.гидроксид калия взаимодействует с раствором 1)нитрата бария2)аммиака3)хлороводорода4)хлорида натрия задание 16.азотная кислота взаимодействует с веществами 1)оксидом магния и водородом2)цинком и хлоридом серебра3)оксидом углерода (ii) и аммиаком4)серебром и гидроксидом меди (ii) задание 17.раствор сульфата меди (ii) взаимодействует с 1)железом2)оксидом серы (vi)3)азотной кислотой4)ртутью задание 18.верны ли следующие суждения?а. синтез аммиака проводят с участием катализатора.б. для увеличения выхода аммиака процесс ведут при низкой температуре. 1)верно только а2)верно только б3)верны оба суждения4)оба суждения неверны — знания.site
Nh3 h2 = ? уравнение реакции
Аммиак представляет собой бесцветный газ, который при комнатной температуре под избыточным давлением сжижается (бесцветный); в твердом состоянии — белый. Хорошо растворяется в воде, образует гидрат состава ![]() , раствор которого имеет слабощелочную среду. Разбавленные растворы аммиака (10%) называют нашатырным спиртом, концентрированные растворы (25%) — аммиачной водой.
, раствор которого имеет слабощелочную среду. Разбавленные растворы аммиака (10%) называют нашатырным спиртом, концентрированные растворы (25%) — аммиачной водой.
Аммиак весьма реакционноспособен, склонен к реакциям присоединения. Сгорает в кислороде, реагирует с кислотами, металлами, галогенами, оксидами и галогенидами. Качественная реакция на аммиак — почернение бумажки, смоченной раствором ![]() , раствор которого имеет слабощелочную среду. Разбавленные растворы аммиака (10%) называют нашатырным спиртом, концентрированные растворы (25%) — аммиачной водой.
, раствор которого имеет слабощелочную среду. Разбавленные растворы аммиака (10%) называют нашатырным спиртом, концентрированные растворы (25%) — аммиачной водой.
Аммиак весьма реакционноспособен, склонен к реакциям присоединения. Сгорает в кислороде, реагирует с кислотами, металлами, галогенами, оксидами и галогенидами. Качественная реакция на аммиак — почернение бумажки, смоченной раствором 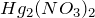 (образование ртути). Осушают аммиак оксидом кальция.
(образование ртути). Осушают аммиак оксидом кальция.
![]()
![]()
![]()
![]()
Жидкий аммиак — основный протонный растворитель; хорошо растворяет серу, галогениды (кроме фторидов) и нитраты щелочных металлов, галогениды аммония, перманганат калия; плохо растворяет неорганические фториды, сульфаты, карбонаты.
Основной промышленный способ получения аммиака предполагает реакцию взаимодействия азота с водородом при температуре ![]() , повышенном давлении и в присутствии катализатора – железа, платины:
, повышенном давлении и в присутствии катализатора – железа, платины:
![]()
Азотистая кислота
Азотистая кислота HNO2— слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты.
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например, соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 HCl → HNO2 AgCl
Химические свойства.
1.Азотистая кислота HNO2 существует только в разбавленных растворах, при нагревании она разлагается:
3HNO2 → HNO3 2NO H2O
без нагревания азотистая кислота также разлагается:
2HNO2 → NO2 NO H2O
2. Азотистая кислота взаимодействует с сильными основаниями.
Например, с гидроксидом натрия:
HNO2 NaOH → NaNO2 H2O
3.За счет азота в степени окисления 3 азотистая кислота проявляет слабые окислительные свойства. Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например, HNO2 окисляет иодоводород:
2HNO2 2HI → 2NO I2 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
2НNO2 2KI 2H2SO4 → K2SO4 I2 2NO 2H2O
Азотистая кислота окисляет соединения железа (II):
2HNO2 3H2SO4 6FeSO4 → 3Fe2(SO4)3 N2 4H2O
4. За счет азота в степени окисления 3 азотистая кислота проявляет сильные восстановительные свойства. Под действием окислителей азотистая кислота переходит в азотную.
Например, хлор окисляет азотистую кислоту до азотной кислоты:
HNO2 Cl2 H2O → HNO3 2HCl
Кислород и пероксид водорода также окисляют азотистую кислоту:
2HNO2 O2 → 2HNO3
HNO2 H2O2 → HNO3 H2O
Соединения марганца (VII) окисляют HNO2:
5HNO2 2HMnO4 → 2Mn(NO3)2 HNO3 3H2O
Аммиак
Аммиак впервые был синтезирован из азота и водорода. Установлено, что для оптимального протекания реакции необходимыми условиями являются давление 2 • 104 кПа, температура 500°С и присутствие соответствующего катализатора. Реакция экзотермична, поэтому согласно принципу Ле IНателье равновесие реакции будет смещено вправо тем больше, чем ниже температура. Образование аммиака сопровождается уменьшением объема, так как из четырех объемов реакционной смеси (ЗН2 и Ш2) получается только два объема аммиака.
Следовательно, с уменьшением объема уменьшается и давление. Для сдвига равновесия вправо, т.е. в сторону образования аммиака, необходимо поддерживать высокое давление. Для увеличения скорости реакции используют катализатор.
В лабораторных условиях аммиак получают нагреванием соли аммония со щелочью:

или хлорида аммония с гашеной известью:

Аммиак — бесцветный газ с характерным удушливым запахом. Очень легко растворим в воде (в 1 л воды при 0°С растворяется 1150 л NH3). Раствор аммиака, содержащий 10% NH3, называется нашатырным спиртом.
Из пяти электронов наружной оболочки азота в образовании химической связи с атомами водорода участвуют только три р-электрона (sp3—гибридизация), а неподеленная пара электронов отчетливо ориентирована в пространстве. Поэтому молекула NH3 — резко выраженный донор электронной пары и обладает высокой полярностью. Собственная ионизация NH3 очень мала:

Ионное произведение [NHJf |NH21 составляет всего 2 10 33 (при -50°С).
Нейтральная молекула аммиака, присоединяя ион Н , превращается в положительный однозарядный ион — катион аммония:

Молекула аммиака, предоставляя свою пару электронов, является донором электронов, а ион водорода — акцептором. Эта разновидность ковалентной связи называется донорно-акцепторной. При взаимодействии протона с молекулой аммиака положительный заряд его равномерно распределяется по всему иону аммония. По этому механизму аммиак реагирует с водой, а также с любым другим веществом, способным отщеплять протоны, в частности с кислотами. Во всех этих реакциях аммиак проявляет основные свойства.
Водный раствор аммиака имеет щелочную реакцию, так как присоединение иона 1Г приводит к увеличению концентрации ионов ОН—:

При взаимодействии ионов NH* и ОН вновь образуются NH3 и Н.;0, т.е. ионное соединение NH^OH (гидроксид аммония) не образуется. Правильнее считать, что между NH3 и Н20 существует водородная связь.
Для качественного обнаружения аммиака и его солей применяется реактив Несслера (K2[HgIJ КОН):

В результате образуется желто-бурый осадок [Hg2NH2I2]I — иодид дииодо- амидодиртути( II).
Газообразный аммиак взаимодействует и с кислотами, образуя соли аммония:

Поскольку кислоты отщепляют протон легче, чем вода, то концентрация ионов NHJ в растворе значительно больше. Водный раствор аммиака — слабое основание.
Соли аммония могут быть получены не только взаимодействием газообразного аммиака с кислотами, но и водных растворов аммиака с кислотами.
Сухой аммиак способен взаимодействовать с металлами. При этом атомы водорода могут замещаться на металл с образованием амидов, например для натрия:

Эта реакция указывает на то, что газообразный аммиак обладает кислотными свойствами, которые в целом выражены очень слабо.
Аммиак является восстановителем. Эти свойства аммиака можно объяснить тем, что азот находится в состоянии степени окисления -3 и может легко отдавать электроны и окисляться до N2 или N(11):
а) галогены обычно окисляют аммиак до свободного азота:

б) в смеси с кислородом аммиак горит зеленовато-желтым пламенем:

в) если взаимодействие с кислородом протекает в присутствии катализатора, то окисление NH3 сопровождается образованием оксида азота(П):

Эта реакция имеет важное практическое значение, так как лежит в основе промышленного способа получения азотной кислоты.
Являясь восстановителем, аммиак энергично восстанавливает некоторые металлы из их оксидов:

При 300°С аммиак взаимодействует с хлоратом калия, окисляясь до нитрат-иона:

Жидкий аммиак — сильный ионизирующий растворитель. Так, производные аммония NHj (например, NH4C1 и NH4N03) в жидком аммиаке ведут себя как кислоты, а производные NH2 (амиды) — как основания. Для иллюстрации этих свойств ниже приведены некоторые реакции:

Жидкий аммиак широко используется в промышленности. Устойчивые кристаллические соли тетраэдрического иона NH4 в большинстве растворимы в воде. В солях аммония катион NHj имеет заряд 1. Соли аммония — это кристаллические вещества, напоминающие по строению соли калия и рубидия. Они являются веществами ионного характера, почти полностью диссоциирующими на ионы:

В отличие от солей щелочных металлов соли аммония легко разлагаются при нагревании:

Однако при охлаждении аммиак и хлороводород вновь реагируют с образованием исходной молекулы NH4C1.
При обратимом разложении солей аммония, образованных нелетучими кислотами, улетучивается только аммиак, т.е. происходит частичное разложение:

В химическом отношении соли аммония очень реакционноспособны. Так, при нагревании с растворами гидроксидов соли аммония вступают в реакцию обмена, и при этом выделяется аммиак:

Соли аммония, в которых анион проявляет выраженные окислительные свойства, при нагревании подвергаются окислительно-восстановительным изменениям, вследствие чего разложение таких солей протекает необратимо:

При этом ион NHj окисляется, а анион — восстанавливается. Соли аммония находят широкое применение.
Хлорид аммония NH4C1 (нашатырь) используют при паянии и лужении металлов, в изготовлении гальванических элементов. При соприкосновении нагретого металла с NH4C1 происходит очистка поверхности его от пленки оксида:

В медицине NH4C1 применяют при отеках сердечного происхождения, для усиления действия ртутных диуретиков. Обладает отхаркивающим действием.
Сульфат аммония (NH4)2S04 и нитрат аммония NH4N03 применяют в качестве удобрений, причем в NH4N03, называемом аммиачной селитрой, содержание усвояемого азота выше, чем в других солях аммония. Нитрат аммония в сочетании с горючими веществами (например, углем и алюминием) используют в качестве взрывной смеси (аммоналы).
Гидрокарбонат аммония NH4HC03 применяют в хлебопечении (главным образом в кондитерском деле) для придания тесту необходимой пористости. Действие основано на способности его разлагаться с выделением газов, которые и придают пористость:


Рис. 24.1.Структура гидразина
Гидразин NH2—NH2можно представить как производное аммиака, в котором один водород замещен группой — NH2. Степень окисления азота в этом соединении равна -2. Гидразин — полярное соединение и имеет структуру, показанную на рис. 24.1.
В обычных условиях это бесцветная жидкость с Гкип = 113,5°С. Гидразин, будучи бифункциональным основанием, за счет собственной ионизации образует и катион, и анион:

В водных растворах наблюдается ионизация:

Поэтому можно получить два ряда гидразиниевых солей: [N2H5]C1, [N2H6]C12. Соли катиона N2H3 устойчивы в водных растворах, а соли N2H;? сильно гидролизованы.
Гидразин и соли гидразоний-иона более устойчивы, чем аммиак и его соли.
На воздухе гидразин горит со значительным выделением теплоты:

Как сильный восстановитель он окисляется до N2 в присутствии такого окислителя, как КМп04:

Гидроксиламин NH2OH по своему составу и структуре занимает промежуточное положение между гидразином и пероксидом водорода (рис. 24.2). Степень окисления азота в этом соединении равна -1.
NH2OH можно получить восстановлением азотной кислоты в реакции электролиза:


Рис. 24.2.Структура гидразина, гидроксиламина и пероксида водорода
Гидроксиламин является более слабым основанием, чем NH3:

Взаимодействуя с кислотами, гидроксиламин образует устойчивые соли:

Гидроксиламин в кислой среде проявляет окислительные свойства, а в щелочной — восстановительные:

Азотистоводородная кислота HNN2, или HN3, образуется при взаимодействии гидразина с азотистой кислотой:

Структура азотистоводородной кислоты и кислотного остатка азид-иона представлены на рис. 24.3.

Рис. 24.3.Структура азотистоводородной кислоты и кислотного остатка азид-иона
Для азид-иона характерна sp-гибридизация валентных орбиталей Н , что обусловливает линейную структуру.
По силе азотистоводородная кислота близка к уксусной, а по растворимости солей (азидов) похожа на НС1.
Для получения азидов обычно используют азид натрия, который образуется при действии N20 или NaN03 на амид натрия:

Азид-ион обладает окислительными свойствами, напоминая HN03. Так, если ГШ03 при взаимодействии с металлами восстанавливается до NO и Н20, то азотистоводородная кислота восстанавливается до N9 (нитрид азота) и NH3:

Азиды тяжелых металлов взрывчаты, поэтому, например, азид свинца Pb(NN2)2 применяется в детонаторах.
Аммиак, получение, свойства, химические реакции.
Аммиак, NH3 – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак, формула, газ, характеристики
Видеоурок “Аммиак”
Аммиак, жидкость, твердое тело, характеристики
Физические свойства аммиака
Химические свойства аммиака
Получение аммиака в промышленности и лаборатории
Химические реакции – уравнения получения аммиака
Применение и использование аммиака
Оксид азота (i)
Оксид азота (I) – это несолеобразующий оксид. Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получитьоксид азота (I) в лаборатории можно разложением нитрата аммония:
NH4NO3 → N2O 2H2O
Химические свойства оксида азота (I):
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя. Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O H2 → N2 H2O
N2O Mg → N2 MgO
N2O 2Cu → N2 Cu2O
3N2O 2NH3 → 4N2 3H2O
N2O H2O SO2 → N2 H2SO4
Еще пример: оксид азота (I) окисляет углерод и фосфор при нагревании:
N2O C → N2 CO
5N2O 2Р → 5N2 Р2O5
2. При взаимодействии с сильными окислителямиN2O может проявлять свойства восстановителя.
Например, N2O окисляется раствором перманганата в серной кислоте:
5N2O 3H2SO4 2KMnO4 → 10NO 2MnSO4 K2SO4 3H2O
Оксид азота (ii)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например, при действии 30 %-ной азотной кислоты на медь образуется NO:
3Cu 8HNO3(разб.) → 3Cu(NO3)2 2NO 4H2O
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
3FeCl2 NaNO3 4HCl → 3FeCl3 NaCl NO 2H2O
2HNO3 6HI → 2NO I2 4H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
N2 O2 → 2NO
3. В промышленностиоксид азота (II) получают каталитическим окислением аммиака:
4NH3 5O2 → 4NO 6H2O
Химические свойства.
1. Оксид азота (II) легко окисляется под действием окислителей.
Например, горит в атмосфере кислорода:
2NO O2 → 2NO2
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO Cl2 → 2NOCl
NO O3 → NO2 O2
2. В присутствии более сильных восстановителей проявляет свойства окислителя. В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например, оксид азота (II) окисляет водород и сернистый газ:
2NO 2H2 → N2 2H2O
2NO 2SO2 → 2SO3 N2
Оксид азота (iv)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2NO O2 → 2NO2
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например, при действии концентрированной азотной кислоты на медь:
4HNO3(конц.) Cu → Cu(NO3)2 2NO2 2H2O
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например, при разложении нитрата серебра:
2AgNO3 → 2Ag 2NO2 O2
Химические свойства.
1. Оксид азота (IV) реагирует с водойс образованием двух кислот — азотной и азотистой:
2NO2 H2O → HNO3 HNO2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 2H2O O2 → 4HNO3
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 H2O → 2HNO3 NO
2. При растворении оксида азота (IV) в щелочахобразуются нитраты и нитриты:
2NO2 2NaOH → NaNO3 NaNO2 H2O
4NO2 2Ca(OH)2 → Ca(NO2)2 Ca(NO3)2 2H2O
В присутствии кислорода образуются только нитраты:
4NO2 4NaOH O2 → 4NaNO3 2H2O
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор, уголь, сера, оксид серы (IV) окисляется до оксида серы (VI):
2NO2 2S → N2 2SO2
2NO2 2C → N2 2CO2
10NO2 8P → 5N2 4P2O5
NO2 SO2 → SO3 NO
4. Оксид азота (IV) димеризуется:
2NO2 ⇄ N2O4
Оксид азота (v)
N2O5– оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота:
2NO2 O3 → N2O5 O2
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V):
2HNO3 P2O5 → 2HPO3 N2O5
Химические свойства оксида азота (V).
1.При растворении в воде оксид азота (V) образует азотную кислоту:
N2O5 H2O → 2HNO3
2.Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например, оксид азота (V) реагирует с гидроксидом натрия:
N2O5 2NaOH → 2NaNO3 H2O
Еще пример: оксид азота (V) реагирует с оксидом кальция:
N2O5 CaO → Ca(NO3)2
3. За счет азота со степенью окисления 5 оксид азота (V) – сильный окислитель.
Например, он окисляет серу:
2N2O5 S → SO2 4NO2
4.Оксид азота (V) легко разлагается при нагревании (со взрывом):
2N2O5 → 4NO2 O2
Соли азотистой кислоты — нитриты
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна 3, то они проявляют как окислительныесвойства, так и восстановительные.
Кислород, галогены ипероксид водорода окисляют нитриты до нитратов:
2KNO2 O2 → 2KNO3
KNO2 H2O2 → KNO3 H2O
KNO2 H2O Br2 → KNO3 2HBr
Лабораторные окислители — перманганаты, дихроматы— также окисляют нитриты до нитратов:
5KNO2 3H2SO4 2KMnO4 → 5KNO3 2MnSO4 K2SO4 3H2O
3KNO2 4H2SO4 K2Cr2O7 → 3KNO3 Cr2(SO4)3 K2SO4 4H2O
В кислой среде нитриты выступают в качестве окислителей.
При окислении йодидов или соединений железа (II) нитриты восстанавливаются до оксида азота (II):
2KNO2 2H2SO4 2KI → 2NO I2 2K2SO4 2H2O
2KNO2 2FeSO4 2H2SO4 → Fe2(SO4)3 2NO K2SO4 2H2O
При взаимодействии с очень сильными восстановителями (алюминий или цинк в щелочной среде) нитриты восстанавливаются максимально – до аммиака:
NaNO2 2Al NaOH 6H2O → 2Na[Al(OH)4] NH3
Смесь нитратов и нитритов также проявляет окислительныесвойства. Например, смесь нитрата и нитрита калия окисляет оксид хрома (III) до хромата калия:
3KNO2 Cr2O3 KNO3 → 2K2CrO4 4NO
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
1. Нитраты термически неустойчивы, причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Нитраты щелочных и щелочноземельных металлов (до Mg в электрохимическом ряду) разлагаются до нитрита и кислорода.
Например, разложение нитрата натрия:
2KNO3 → 2KNO2 O2
Исключение – литий.
Видеоопытразложения нитрата калия можно посмотреть здесь.
- Нитраты тяжелых металлов (от Mg до Cu, включая магний и медь) и литийразлагаются до оксида металла, оксида азота (IV) и кислорода:
Например, разложение нитрата меди (II):
2Cu(NO3)2 → 2CuO 4NO2 O2
- Нитраты малоактивных металлов (правее Cu) – разлагаются до металла, оксида азота (IV) и кислорода.
Например, нитрат серебра:
2AgNO3 → 2Ag 2NO2 O2
Исключения:
Нитрит железа (II) разлагается до оксида железа (III):
4Fe(NO3)2 → 2Fe2O3 8NO2 O2
Нитрат марганца (II) разлагается до оксида марганца (IV):
Mn(NO3)2 → MnO2 2NO2
2. Водные растворы не обладают окислительно-восстановительными свойствами, расплавы – сильные окислители.
Например, смесь 75% KNO3, 15% C и 10% S называют «черным порохом»:
2KNO3 3C S → N2 3CO2 K2S
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды.
NaNO2 NH4Cl → NH4NO2 NaCl
NH4NO2 → N2 2H2O
Суммарное уравнение процесса:
NaNO2 NH4Cl → N2 NaCl 2H2O
Видеоопытвзаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
4NH3 3O2 → 2N2 6H2O
2. Наиболее чистый азот получают разложением азидовщелочныхметаллов.
Например, разложением азида натрия:
2NaN3 → 2Na 3N2
3.Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре ~700 °C:
3CuO 2NH3 → 3Cu N2 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Физические свойства аммиака:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | с резким характерным запахом (запах «нашатырного спирта») |
| Вкус | едкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность жидкости (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 682,8 |
| Плотность газа (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 0,8886 |
| Плотность (при 15 °C и атмосферном давлении 1 атм.), кг/м3 | 0,73 |
| Плотность (при 25 °C и атмосферном давлении 100 кПа ≈ 1 атм.), кг/м3 | 0,7723 |
| Температура плавления, °C | -77,73 |
| Температура кипения, °C | -33,34 |
| Критическая температура*, °C | 132,4 |
| Критическое давление, МПа | 11,32 |
| Критический удельный объем, м3/кг | 0,00426 |
| Коэффициент теплопроводности газа (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,026 |
| Температура самовоспламенения, °C | 651 ± 1 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 14,5 (15,0) до 33,6 |
| Взрывоопасные концентрации смеси газа с кислородом, % объёмных | от 13,5 до 82 |
| Удельная теплота сгорания, МДж/кг | 20,5 |
| Температура пламени, °C | 700 |
| Константа диссоциации кислоты | 9,21 ± 0,01 |
| Молярная масса, г/моль | 17,0304 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя(с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя(с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (3000оС-5000оС или действие электрического разряда) образуется атомарный азот, который реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой, фосфором, мышьяком, углеродом.
1.3.Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
N2 ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 6Li → 2Li3N
2.Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 3LiH → Li3N NH3
Химия 9 класс! помогите пожалуйста!!!! задание 1.простым веществом является 1)вода2)аммиак3)озон4)метан задание 2.к химическим явлениям относится 1)растворение сахара в воде2)помутнение известковой воды3)выпаривание раствора соли4)фильтрование раствора соли задание 3.распределение электронов по энергетическим уровням в атоме кальция: 1)2,8,8,22)2,8,18,23)2,8,24)2,18,2 задание 4.общая формула высшего оксида элементов iva группы периодической системы д.и.менделеева 1)r2o2)ro3)r2o34)ro2 задание 5.высшую валентность азот проявляет в соединении 1)nano32)mg3n23)kno24)nh4cl задание 6.одинаковый вид химической связи в соединениях 1)кислород и аммиак2)оксид магния и оксид серы (iv)3)вода и хлороводород4)водород и метанзадание 7.взаимодействие гидроксида натрия с серной кислотой относится к реакциям 1)замещения2)обмена3)разложения4)соединения задание 8.сера проявляет свойства окислителя при взаимодействии с 1)железом2)кислородом3)хлором4)водой задание 9.электрический ток проводит 1)хлорид натрия (тв.)2)кислород (ж.)3)сахар (р-р)4)хлороводород (р-р) задание 10.наибольшее количество ионов хлора образуется при диссоциации 1 моль1)хлорида алюминия2)хлорида кальция3)хлорида натрия4)хлорида цинка задание 11.выпадение осадка происходит при сливании растворов 1)серной кислоты и гидроксида калия2)хлорида калия и сульфата натрия3)гидроксида натрия и нитрата меди (ii)4)карбоната натрия и соляной кислоты задание12 .сокращенное ионное уравнение 2h s2– = h2s↑ соответствует взаимодействию 1)сульфида натрия и азотной кислоты2)соляной кислоты и сульфата калия3)нитрата кальция и сульфида бария4)сернистой кислоты и оксида магния задание 13.амфотерным гидроксидом является 1)fe(oh)22)zn(oh)23)ca(oh)24)mg(oh)2 задание 14.оксид кальция реагирует с 1)кислородом2)оксидом серы (vi)3)водородом4)оксидом магния задание 15.гидроксид калия взаимодействует с раствором 1)нитрата бария2)аммиака3)хлороводорода4)хлорида натрия задание 16.азотная кислота взаимодействует с веществами 1)оксидом магния и водородом2)цинком и хлоридом серебра3)оксидом углерода (ii) и аммиаком4)серебром и гидроксидом меди (ii) задание 17.раствор сульфата меди (ii) взаимодействует с 1)железом2)оксидом серы (vi)3)азотной кислотой4)ртутью задание 18.верны ли следующие суждения?а. синтез аммиака проводят с участием катализатора.б. для увеличения выхода аммиака процесс ведут при низкой температуре. 1)верно только а2)верно только б3)верны оба суждения4)оба суждения неверны — знания.site
Задание 2. К химическим явлениям относится 2)помутнение известковой воды
Задание 3. Распределение электронов по энергетическим уровням в атоме кальция:
2)2,8,18,2
Задание 4. Общая формула высшего оксида элементов IVA группы периодической системы Д.И.Менделеева 4)RO2
Задание 5. Высшую валентность азот проявляет в соединении 1)NaNO3
Задание 6. Одинаковый вид химической связи в соединениях 3)вода и хлороводород
Задание 7. Взаимодействие гидроксида натрия с серной кислотой относится к реакциям 2)обмена
Задание 8.Сера проявляет свойства окислителя при взаимодействии с 1)железом
Задание 9. Электрический ток проводит 4)хлороводород (р-р)
Задание 10. Наибольшее количество ионов хлора образуется при диссоциации 1 моль
1)хлорида алюминия
Задание 11. Выпадение осадка происходит при сливании растворов
3)гидроксида натрия и нитрата меди (II)
Задание12 . Сокращенное ионное уравнение 2H S2– = H2S↑ соответствует взаимодействию 1)сульфида натрия и азотной кислоты
Вообще нет правильного ответа, а тут будет ОВР, а не обмен
Задание 13 .Амфотерным гидроксидом является 2)Zn(OH)2
Задание 14.
Оксид кальция реагирует с
2)оксидом серы (VI)
Задание 15.
Гидроксид калия взаимодействует с раствором 3)хлороводорода
Задание 16. Азотная кислота взаимодействует с веществами
4)серебром и гидроксидом меди (II)
Задание 17
.Раствор сульфата меди (II) взаимодействует с 1)железом
Задание 18.
Верны ли следующие суждения?
А. Синтез аммиака проводят с участием катализатора.
Б. Для увеличения выхода аммиака процесс ведут при низкой температуре.
1)верно только А
