- Все тесты
- Ковалентная связь
- Определение валентности элементов по формулам
- Особенности протекания реакций в растворе
- Родственные связи между металлами и неметаллами
- Состав растворов
- Таблица валентности химических элементов (1 часть):
- Таблица валентности химических элементов (2 часть):
- Таблица валентности химических элементов (3 часть):
- Таблица валентности химических элементов.
- Теория электролитической диссоциации
- Тренировочные задания
- Химические свойства
Все тесты
- Тест на темуАнализ стихотворения «Не с теми я, кто бросил землю» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Перемена» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Петербурге» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Стихи к Блоку» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Клеветникам России» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Завещание» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Москве» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Молитва» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «И. И. Пущину!» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «День и ночь» Ф. Тютчева5 вопросов
- Тест на темуАнализ стихотворения «Весна в лесу» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Журавли» Р. Гамзатова5 вопросов
- Тест на темуАнализ стихотворения «Люблю» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Когда на меня навалилась беда» К. Кулиева5 вопросов
- Тест на темуАнализ стихотворения «Гамлет» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Русь» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Ночь» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения К. Симонова «Ты помнишь, Алёша, дороги Смоленщины…»5 вопросов
- Тест на темуАнализ стихотворения Жуковского «Приход весны»5 вопросов
- Тест на темуАнализ стихотворения Анны Ахматовой «Сероглазый король»5 вопросов
- Тест на темуАнализ стихотворения «Июль – макушка лета…»5 вопросов
- Тест на темуАнализ стихотворения «Мелколесье. Степь и дали…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Не позволяй душе лениться» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «На дне моей жизни» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Нивы сжаты, рощи голы…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Бабушкины сказки» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снежок» Н. Некрасова1 вопрос
- Тест на темуАнализ стихотворения «По вечерам» Н. Рубцова5 вопросов
- Тест на темуАнализ стихотворения «Вчерашний день, часу в шестом…» Н. Некрасова5 вопросов
- Тест на темуАнализ стихотворения «Цветы последние милей…» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Я знаю, никакой моей вины…» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Я не ищу гармонии в природе»Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Разбуди меня завтра рано» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снега потемнеют синие» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Осень» Н. Карамзина5 вопросов
- Тест на темуАнализ стихотворения «Молитва» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Вечер» А. Фета5 вопросов
- Тест на темуАнализ стихотворения «Не жалею, не зову, не плачу» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Тучи» М. Лермонтова5 вопросов
- Тест на темуАнализ стихотворения «Книга» Г. Тукая5 вопросов
- Тест на темуАнализ стихотворения «Необычайное приключение, бывшее с Владимиром Маяковским летом на даче» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Деревня» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Летний вечер» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Я убит подо Ржевом» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Элегия» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Зимнее утро» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Троица» И. Бунина5 вопросов
- Тест на темуАнализ стихотворения «Бабушке» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «О весна без конца и краю» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Море» В. Жуковского5 вопросов
Ковалентная связь
Неметаллы из числа всех элементов находятся в меньшинстве. Но имея некоторые особенности в строении и способности иметь переменную валентность, число соединений, построенных этими элементами внушительное.
Чтобы иметь представление, по которому атомы соединяются, начнём с молекулы водорода Н2.
Давайте дадим волю фантазии, представим то, что нельзя увидеть. Допустим, что мы взяли в руки две одинаковые детали, имеющие такой вид:
Существует одна только комбинация их соединения, и между ними будет одно общее звено. Переместимся с нашего воображения к молекулам. Представим, что перед нами, два атома водорода и наша задача их соединить в молекулу. Покрутите мысленно детали, чтобы они объединились, необходимо их поставить друг на друга, связав их в определённом месте. Точки рядом означают, сколько электронов, располагающихся на наружном слое.
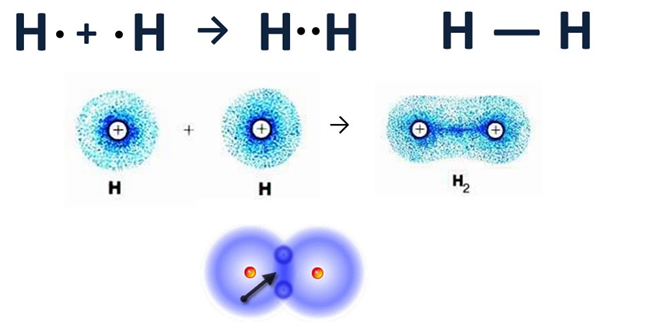
Источник
Атомы водорода, как детали, соединились одной связью, поэтому валентность в данном случае каждого из них будет равна I. Но степень окисления будет равна 0, так как вещество образовано элементом с одинаковым значением электроотрицательности.
Рассмотрим, как образуется молекула самого распространённого газа на нашей планете – азота N2.
Азот, имеет 3 неспаренных электрона. Это как взять две детали вида и соединить их.
Таким образом, азот трёхвалентен, а степень
окисления по-прежнему остаётся равна 0. За счёт общей электронной пары азот завершает внешний слой 2s22p6.
Ковалентная связь в молекуле, состоящей из одного типа атомов, а именно неметаллов, носит название неполярная.
Во время построения молекулы, количество электронов стремится к завершению. Рассмотрим как образуется молекула О2. Каждому атому не хватает 2 электронов и они эту недостачу компенсируют общей электронной парой.
Также обращаем внимание, что степень окисления 0, ибо атомы равноправные партнёры, и их валентность равна II.
Ковалентная химическая связь образованная разными неметаллами называется полярная.
Возьмём два неметаллических элемента Водород и Хлор. Укажем электронные формулы внешнего слоя.
Н 1s1
Cl 3s2 3p5
Проанализировав значения, Э(Н) < Э(Cl), приходим к выводу, чтобы принять конфигурацию благородного газа, хлор будет притягивать на себя единственный электрон водорода.
Схема ковалентной связи, образованной разными элементами, записывается в таком виде.
Столь важно отметить, что в этой ситуации Cl и Н не будут равноправными партнёрами, поскольку общая плотность электронов сосредоточена у Cl. Водород в неравном бою, уступает 1 электрон хлору, у которого в наличии их целых 7. Водород приобретает положительный заряд, хлор – отрицательный. Валентности Н и Cl равны I.В то время степени окисления будут Н Cl−.
Такой вид образования соединений происходит по обменному механизму. Это значит, чтобы получить завершённую конфигурацию более электроотрицательные принимают электроны, менее – отдают, но при этом существует общая электронная пара.
Неметаллы образуют не только бинарные соединения, а возможно в состав будет входить три и более элемента. К примеру, молекула угольной кислоты H2СO3 состоит с 3 элементов. Как они между собой соединяться. Электроотрицательность возрастает в ряду ЭО (Н) <ЭО (С) <ЭО(O).
Чтобы построить структурную формулу, в центре записываем углерод. У него неспаренных 4 электрона. Поскольку атомов кислорода в количестве 3, каждый из них может принять 2 электрона. То путём не хитрых вычислений, видим что 4 электрона придёт от С и по одному от каждого Н. проверяем наш расчёт, учитывая нейтральность молекулы, считаем положительные и отрицательные заряды.
Н2 С 4О3−2 ( 1 ∙ 2) ( 4 ∙ 1) (-2 ∙ 3) = 0
Существует ещё один механизм ковалентной связи, под названием донорно-акцепторный.
Чтобы понять этот принцип, опишем образование молекулы, имеющей не совсем приятный резкий, удушающий запах, аммиак NH3.
H 1s1
N 2s2 2p3
Из 5 электронов, находящиеся в распоряжении атома N, связываются только 3. Валентность атома N приобретает значение III. При этом степень окисления N−3 (оттянув на себя 3 электрона от каждого атома Н, становится отрицательным), водород, наоборот совершив «благородный поступок», отдав электрон, приобретает положительный заряд Н .
Два электрона никак не задействованы, они выделены красным цветом. Они способны поселиться в свободной ячейке иона Н . Это место займут электроны азота, которые обозначены красным цветом. Образуется катион аммония по донорно-акцепторному механизму.
Незадействованные до этого «красные» электроны N «заселяются» в пустой s-орбитали, принадлежащей катиону водорода. Ион аммония имеет 3 связи, которые происходят по обменному механизму, а также одну, по донорно-акцепторному. Именно поэтому NH3 легко взаимодействует с кислотами и водой.
Определение валентности элементов по формулам
На рисунке изображены молекулы известных Вам веществ: это аммиак NH3, запах этого газа очень резкий и его трудно забыть, если хоть раз ощущали запах нашатырного спирта, с помощью его приводят людей в чувство после обморока.
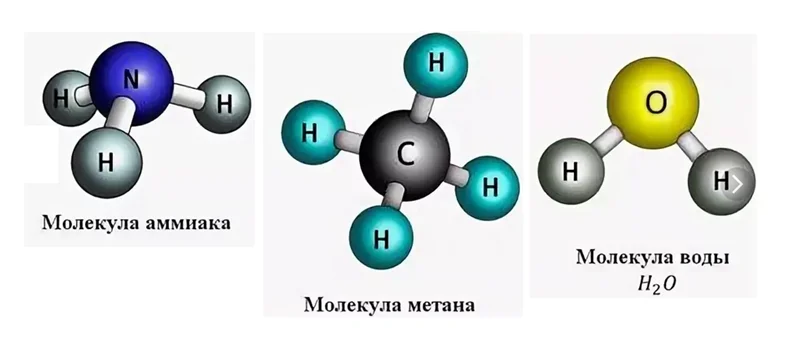
Источник
С молекулой метана СН4 Вы встречаетесь на кухне, когда открываете газовый кран, чтобы приготовить пищу. На самом деле, метан не имеет запаха, но поскольку он относится к взрывоопасным веществам, то к нему прибавляют специальные соединения, имеющие запах, чтобы в случае утечки, его можно было обнаружить.
Молекула Н2О окружает нас повсюду. Во всех этих соединениях имеются атомы водорода, только в разных количествах. Давайте попробуем определить валентность по формуле вещества. Вспомним, что водород одновалентен. Если в аммиаке водорода насчитываем 3 атома, значит азот, условно, можем изобразить в виде такой детали.
Как видно с рисунка, он имеет валентность III. Поэтому принципу определим валентность углерода, приходим к выводу, что он четырёхвалентен.
Но не всегда мы видим структурные формулы, которые отображают связи между атомами, и не всегда имеем дело с одновалентными элементами. Возьмём, к примеру, вещество состава Р2О5. На два атома фосфора приходится 5 атомов кислорода.
Встречаются такие соединения, где необходимо определить валентность остатков, входящих в состав кислот. Например, вещество состава Mg3(PO4)2.
Выполним согласно алгоритму. Магний всегда двухвалентен.
Искомая валентность кислотного остатка равна III. Следует заметить, что в веществе всегда находиться элемент, который проявляет постоянную валентность.
При написании уравнений реакций возникает необходимость составления формул веществ. Рассмотрим реакцию обмена между оксидом алюминия и соляной кислотой.
В результате обмена образуется два вещества состава AlCl и НО. Чтобы определить количественный состав в веществах, воспользуемся следующим алгоритмом.
Составление химических формул по валентности
Уравнение приобретает вид
Обратите внимание, что количество атомов отличается в реагентах и продуктах, его необходимо уравнять.
Составим формулы веществ по валентности элементов.
Немаловажную роль наравне с валентностью играет такое понятие как степень окисления (СО).
Термин валентность применим для соединений, имеющих молекулярное строение. Но, как известно, ещё существуют вещества ионного строения, которые образуются за счёт электростатического притяжения между разноимёнными зарядами. Каким образом они образуются? Чтобы ответить на данный вопрос, вспомним об электроотрицательности.
При образовании вещества, одни атомы будут отдавать свои электроны, другие – принимать. Рассмотрим на примере соединений молекулярного строения Cl2, HCl и ионного NaCl.
Обратите внимание, что вещества молекулярного строения, имеют структурную формулу, соединение атомов между собой показывается в виде черты – между ними. Для веществ имеющих строение, отличающее от молекулярного, более применимо понятие степени окисления, которое имеет универсальное применение для всех типов веществ.
Каким образом получается молекула вещества HCl? У водорода имеется один-единственный электрон, который располагается на 1s уровне, у хлора целых 7, занимающих уровни 3s2 и 3р5. Как Вы считаете, какой атом будет отдавать, а какой принимать электроны?
При всём своём желании, атом водорода никак не сможет принять электроны хлора, ему просто некуда. Как он сможет расположить в своей 1s ячейке целых 7 электронов хлора. Логично предположить, что принимать будет хлор. Ему как раз не хватает одного электрона, чтобы завершить свой уровень.
А вот какую степень окисления имеет простое вещество. Атомы равноценные партнёры, поэтому она будет нулевая.
При образовании ионного соединения NaCl натрий, как элемент имеющий малое число электронов на внешнем слое, а именно 1, подобно водороду, отдаёт его хлору, образуя при этом катион Na , хлор при этом становится отрицательным анионом Cl−.
Особенности протекания реакций в растворе
Химические реакции, в отличие от физических, характеризуются образованием новых веществ. Судить об их получении, мы можем, наблюдая изменение окраски, либо выделение газа или осадка.
Вспомним, что происходит с веществом, когда оно попадает в воду. Оно распадается на ионы. Тем не менее, этот процесс характерен не для всех веществ, а только для сильных электролитов, к которым относятся растворимые соли и кислоты, а также щёлочи.
Также необходимо вспомнить, какие реакции относятся к типу обмена.
Судить произошла реакция или нет, мы можем, если будет выполняться хотя бы одно из условий.
Условия протекания реакций между ионами сложных веществ.
Рассмотрим подробно каждое условие и составим алгоритм написания уравнений.
Выпадение осадка является подтверждением того, мы визуально видим, что реакция произошла. Составим уравнение между щёлочью – гидроксидом калия и солью – сульфатом меди (II). Запишем молекулярное уравнение.
Выполняя данный опыт, Вы могли бы наблюдать образование осадка голубого цвета.
Чтобы понять, какое вещество выпало в осадок, воспользуемся таблицей растворимости, а также составим полное ионно-молекулярное уравнение, которое отображает все частицы, находящиеся в растворе, с учётом коэффициентов.
Таким образом, KOH, K2SO4 и CuSO4 – это сильные электролиты, которые запишем в ионном виде. Cu(OH)2 – нерастворимое вещество, будет в молекулярном виде со стрелкой ↓. Также обращаем внимание, что перед щёлочью КОН находится коэффициент 2. Значит, образуется по два моля ионов К и ОН−.
При написании уравнений реакций, не забываем о законе сохранения вещества. Поэтому количество атомов, а также ионов, до реакции и после должны быть равны.
Следует отметить, что в полном ионно-молекулярном уравнении, слева и справа, имеются одинаковые частицы, их можно сократить.
Эти ионы при взаимодействии не образуют вещества, поэтому находятся в растворе в свободном виде как K и SO4−2.
Сокращённая реакция ионного обмена отображает суть химического процесса, а именно, между какими частицами происходит реакция.
Следственно, Cu(OH)2 будет осадком в растворе состоящем из ионов SO42−и К .
Вторым из условий является выделение газа. Эту реакцию Вы наблюдаете, когда гасите соду кислотой, не важно, какой уксусной, лимонной, яблочной, или же при добавлении к ней кефира, результат будет один и тот же, образование пузырьков углекислого газа.
Возникает закономерный вопрос, в уравнении отсутствует газ, однако раствор «шипит». Чтобы разобраться в этой проблеме, следует вспомнить, что угольная кислота относится к слабым электролитам и происходит выделение углекислого газа, а также образование молекулы воды. Поэтому полное молекулярно-ионное уравнение приобретает вид.
После сокращение одинаковых частиц левой и правой части, получаем сокращённое ионное уравнение.
Именно по причине наличия ионов водорода, сода «шипит» во всех кислотах.
И к третьему условию относится образование слабого электролита, зачастую это молекула воды, однако могут получаться и другие вещества. Ярким примером является реакция нейтрализации.
Почему этот тип реакции носит такое название? Рассмотрим на примере взаимодействия оснований КОН и Cu(OH)2 с раствором соляной кислоты.
В каждом случае происходит образование воды. В случае нерастворимых оснований, реакция идёт с образованием растворимой соли.
Уравнение реакции нейтрализации показывает, как два противоположных по свойствам класса неорганических соединений, отдавая по своей частице (Н и ОН-), образуют нейтральное вещество Н2О.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют.
Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.

Источник
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Пример 1.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Состав растворов

Источник
Чтобы приготовить сладкий напиток, необходимо взять сахар (растворимое вещество) и воду, которая будет играть роль растворителя. Масса раствора состоит из входящих в неё компонентов.
Растворённое вещество в данном случае сахар, поскольку его количество малое по отношению к воде.
Чтобы выразить, какую часть занимает растворённое вещество, введём понятие массовая концентрация или массовая доля.
Вернёмся к примеру с сахаром, массовая концентрация вещества будет составлять:
Чем выше масса растворённого вещества, тем более концентрированный раствор.
И снова вспомним наш сладкий раствор, допустим, вы утром ещё не очень проснулись, и вместо одной ложечки сахара, положили две. Как выйти из ситуации? Правильно, добавить воды. При этом доля растворённого вещества (сахара) уменьшается и образуется разбавленный раствор.
Разберёмся ещё с одним понятием – растворимость.

Источник
Обратите внимание, что указывается растворимость при определённой температуре. Возьмём два стакана объёмом 100 мл, в одном горячая, а во втором холодная вода. В оба добавим 3 столовых ложки сахара. Как вы думаете, где лучше и быстрее растворится сахар? Конечно там, где температура воды выше.
Существует зависимость между растворимостью и природой вещества.

Источник
Растворимость сахара при температуре 20 °C составляет 2000 г на 1л, раствор с такими данными будет насыщенным. При меньшем содержании растворённого вещества – ненасыщенным, большем – пересыщенным.

Источник
Химия не только удивительная наука, но она ещё и экспериментальная. С разрешения взрослых, Вы можете выполнить эксперимент. Вырастить замечательный «сад». Чтобы выполнить данный опыт, необходимо приготовить насыщенный раствор медного купороса или другой соли.
А как Вы думаете, может концентрированный раствор вещества быть ненасыщенным. Математические расчёты помогут дать ответ. Допустим, что растворили 200 г сахара в 100 г воды при температуре 20°C. Необходимо определить массовую концентрацию.
Как показывают расчёты, этот раствор будет концентрированным, однако является ненасыщенным.
Насыщенность и концентрация – это разные понятия.
Рассмотрим на примере сахара и гипса (CaSO4∙2H2O).
Поскольку большинство химических процессов происходит между растворами, важно знать, какое количество вещества там содержится. Содержание растворённого вещества можно выразить в массовых долях, а также с помощью ещё одного вида, которая носит название молярная концентрация.
Если массовая доля растворённого вещества показывает содержание вещества в растворе (%), то молярная концентрация указывает, сколько моль содержится в 1 литре раствора.
Промоделируем лабораторную ситуацию. Разбавленный раствор щёлочи был приготовлен путём растворения 10 г гидроксида натрия в 500 мл воды. Наша с Вами задача, определить массовую и молярную концентрации.
Таблица валентности химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Валентность | Примеры соединений | Примечание |
| 1 | Водород | H | I | HCl, H2O2 | |
| 2 | Гелий | He | отсутствует | ||
| 3 | Литий | Li | I | LiOH, Li2O | |
| 4 | Бериллий | Be | I, II | ||
| 5 | Бор | B | III | B2O3 | |
| 6 | Углерод | C | II, IV | ||
| 7 | Азот | N | I, II, III, IV |
| В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным |
| 8 | Кислород | O | II | (NO)F, CaO, O2, H2O2,Cl2O, H2O | |
| 9 | Фтор | F | I | HF, (NO)F | |
| 10 | Неон | Ne | отсутствует | ||
| 11 | Натрий | Na | I | Na2S, Na2O | |
| 12 | Магний | Mg | II | Mg(NO3)2 | |
| 13 | Алюминий | Al | III | Al2O3, Al2S3, AlCl3 | |
| 14 | Кремний | Si | II, IV | ||
| 15 | Фосфор | P | III, V |
| |
| 16 | Сера | S | II, IV, VI |
| |
| 17 | Хлор | Cl | I, III, IV, V, VI, VII |
| |
| 18 | Аргон | Ar | отсутствует | ||
| 19 | Калий | K | I | KOH, K2O, K2S | |
| 20 | Кальций | Ca | II | Ca(OH)2 | |
| 21 | Скандий | Sc | III | Sc2O3 | |
| 22 | Титан | Ti | II, III, IV | ||
| 23 | Ванадий | V | II, III, IV, V | ||
| 24 | Хром | Cr | II, III, VI | ||
| 25 | Марганец | Mn | II, III, IV, VI, VII |
| |
| 26 | Железо | Fe | II, III |
| |
| 27 | Кобальт | Co | II, III | ||
| 28 | Никель | Ni | II, III | ||
| 29 | Медь | Cu | I, II | ||
| 30 | Цинк | Zn | II | ZnSO4, ZnO, ZnS |
Таблица валентности химических элементов (2 часть):
| 31 | Галлий | Ga | I, II, III | ||
| 32 | Германий | Ge | II, IV | ||
| 33 | Мышьяк | As | III, V | ||
| 34 | Селен | Se | II, IV, VI | ||
| 35 | Бром | Br | I, III, V, VII | ||
| 36 | Криптон | Kr | отсутствует | ||
| 37 | Рубидий | Rb | I | RbOH | |
| 38 | Стронций | Sr | II | SrO | |
| 39 | Иттрий | Y | III | Y(NO3)3 | |
| 40 | Цирконий | Zr | II, III, IV | ||
| 41 | Ниобий | Nb | I, II, III, IV, V | ||
| 42 | Молибден | Mo | II, III, IV, V, VI |
| |
| 43 | Технеций | Tc | II, III, IV, V, VI, VII |
| |
| 44 | Рутений | Ru | II, III, IV, V, VI, VII, VIII |
| |
| 45 | Родий | Rh | II, III, IV, V, VI |
| |
| 46 | Палладий | Pd | II, IV | ||
| 47 | Серебро | Ag | I, II, III | ||
| 48 | Кадмий | Cd | I, II | ||
| 49 | Индий | In | I, II, III | ||
| 50 | Олово | Sn | II, IV | ||
| 51 | Сурьма | Sb | III, V | ||
| 52 | Теллур | Te | II, IV, VI | ||
| 53 | Йод | I | I, III, V, VII | ||
| 54 | Ксенон | Xe | отсутствует | ||
| 55 | Цезий | Cs | I | Cs2O | |
| 56 | Барий | Ba | II | Ba(OH)2 | |
| 57 | Лантан | La | III | La2(SO4)3 | |
| 58 | Церий | Ce | III, IV | ||
| 59 | Празеодим | Pr | II, III, IV | ||
| 60 | Неодим | Nd | II, III |
Таблица валентности химических элементов (3 часть):
| 61 | Прометий | Pm | III | PmBr3 | |
| 62 | Самарий | Sm | II, III | ||
| 63 | Европий | Eu | II, III | ||
| 64 | Гадолиний | Gd | II, III | ||
| 65 | Тербий | Tb | II, III, IV | ||
| 66 | Диспрозий | Dy | II, III | ||
| 67 | Гольмий | Ho | III | Ho2(SO4)3 | |
| 68 | Эрбий | Er | III | Er2O3 | |
| 69 | Тулий | Tm | II, III | ||
| 70 | Иттербий | Yb | II, III | ||
| 71 | Лютеций | Lu | III | LuBr3 | |
| 72 | Гафний | Hf | I, II, III, IV | ||
| 73 | Тантал | Ta | I, II, III, IV, V |
| |
| 74 | Вольфрам | W | II, III, IV, V, VI |
| |
| 75 | Рений | Re | I, II, III, IV, V, VI, VII |
| |
| 76 | Осмий | Os | I, II, III, IV, V, VI, VII, VIII |
| |
| 77 | Иридий | Ir | I, II, III, IV, V, VI |
| |
| 78 | Платина | Pt | II, III, IV, V, VI | ||
| 79 | Золото | Au | I, II, III, V | ||
| 80 | Ртуть | Hg | I, II | ||
| 81 | Таллий | Tl | I, II, III | ||
| 82 | Свинец | Pb | II, IV | ||
| 83 | Висмут | Bi | III, V | ||
| 84 | Полоний | Po | II, IV, VI | ||
| 85 | Астат | At | нет данных | ||
| 86 | Радон | Rn | отсутствует | ||
| 87 | Франций | Fr | I | FrOH | |
| 88 | Радий | Ra | II | Ra(OH)2 | |
| 89 | Актиний | Ac | III | Ac2O3 | |
| 90 | Торий | Th | II, III, IV | ||
| 91 | Протактиний | Pa | II, III, IV, V | ||
| 92 | Уран | U | III, IV, V, VI | ||
| 93 | Нептуний | Np | III, IV, V, VI, VII | ||
| 94 | Плутоний | Pu | III, IV, V, VI, VII | ||
| 95 | Америций | Am | II, III, IV, V, VI | ||
| 96 | Кюрий | Cm | II, III, IV | ||
| 97 | Берклий | Bk | III, IV | ||
| 98 | Калифорний | Cf | II, III, IV | ||
| 99 | Эйнштейний | Es | II, III | ||
| 100 | Фермий | Fm | II, III |
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента.
Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента.
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Коэффициент востребованности 5 698
Таблица валентности химических элементов.
Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число | Русское / Английское наименование | Химический символ | Валентность |
1 | Водород / Hydrogen | H | (-1), 1 |
2 | Гелий / Helium | He | 0 |
3 | Литий / Lithium | Li | 1 |
4 | Бериллий / Beryllium | Be | 2 |
5 | Бор / Boron | B | -3, 3 |
6 | Углерод / Carbon | C | ( 2), 4 |
7 | Азот / Nitrogen | N | -3, -2, -1, ( 1), 2, 3, 4, 5 |
8 | Кислород / Oxygen | O | -2 |
9 | Фтор / Fluorine | F | -1, ( 1) |
10 | Неон / Neon | Ne | 0 |
11 | Натрий / Sodium | Na | 1 |
12 | Магний / Magnesium | Mg | 2 |
13 | Алюминий / Aluminum | Al | 3 |
14 | Кремний / Silicon | Si | -4, ( 2), 4 |
15 | Фосфор / Phosphorus | P | -3, 1, 3, 5 |
16 | Сера / Sulfur | S | -2, 2, 4, 6 |
17 | Хлор / Chlorine | Cl | -1, 1, ( 2), 3, ( 4), 5, 7 |
18 | Аргон / Argon | Ar | 0 |
19 | Калий / Potassium | K | 1 |
20 | Кальций / Calcium | Ca | 2 |
21 | Скандий / Scandium | Sc | 3 |
22 | Титан / Titanium | Ti | 2, 3, 4 |
23 | Ванадий / Vanadium | V | 2, 3, 4, 5 |
24 | Хром / Chromium | Cr | 2, 3, 6 |
25 | Марганец / Manganese | Mn | 2, ( 3), 4, ( 6), 7 |
26 | Железо / Iron | Fe | 2, 3, ( 4), ( 6) |
27 | Кобальт / Cobalt | Co | 2, 3, ( 4) |
28 | Никель / Nickel | Ni | ( 1), 2, ( 3), ( 4) |
29 | Медь / Copper | Сu | 1, 2, ( 3) |
30 | Цинк / Zinc | Zn | 2 |
31 | Галлий / Gallium | Ga | ( 2). 3 |
32 | Германий / Germanium | Ge | -4, 2, 4 |
33 | Мышьяк / Arsenic | As | -3, ( 2), 3, 5 |
34 | Селен / Selenium | Se | -2, ( 2), 4, 6 |
35 | Бром / Bromine | Br | -1, 1, ( 3), ( 4), 5 |
36 | Криптон / Krypton | Kr | 0 |
37 | Рубидий / Rubidium | Rb | 1 |
38 | Стронций / Strontium | Sr | 2 |
39 | Иттрий / Yttrium | Y | 3 |
40 | Цирконий / Zirconium | Zr | ( 2), ( 3), 4 |
41 | Ниобий / Niobium | Nb | ( 2), 3, ( 4), 5 |
42 | Молибден / Molybdenum | Mo | ( 2), 3, ( 4), ( 5), 6 |
43 | Технеций / Technetium | Tc | 6 |
44 | Рутений / Ruthenium | Ru | ( 2), 3, 4, ( 6), ( 7), 8 |
45 | Родий / Rhodium | Rh | ( 2), ( 3), 4, ( 6) |
46 | Палладий / Palladium | Pd | 2, 4, ( 6) |
47 | Серебро / Silver | Ag | 1, ( 2), ( 3) |
48 | Кадмий / Cadmium | Cd | ( 1), 2 |
49 | Индий / Indium | In | ( 1), ( 2), 3 |
50 | Олово / Tin | Sn | 2, 4 |
51 | Сурьма / Antimony | Sb | -3, 3, ( 4), 5 |
52 | Теллур / Tellurium | Te | -2, ( 2), 4, 6 |
53 | Иод / Iodine | I | -1, 1, ( 3), ( 4), 5, 7 |
54 | Ксенон / Xenon | Xe | 0 |
55 | Цезий / Cesium | Cs | 1 |
56 | Барий / Barium | Ba | 2 |
57 | Лантан / Lanthanum | La | 3 |
58 | Церий / Cerium | Ce | 3, 4 |
59 | Празеодим / Praseodymium | Pr | 3 |
60 | Неодим / Neodymium | Nd | 3, 4 |
61 | Прометий / Promethium | Pm | 3 |
62 | Самарий / Samarium | Sm | ( 2), 3 |
63 | Европий / Europium | Eu | ( 2), 3 |
64 | Гадолиний / Gadolinium | Gd | 3 |
65 | Тербий / Terbium | Tb | 3, 4 |
66 | Диспрозий / Dysprosium | Dy | 3 |
67 | Гольмий / Holmium | Ho | 3 |
68 | Эрбий / Erbium | Er | 3 |
69 | Тулий / Thulium | Tm | ( 2), 3 |
70 | Иттербий / Ytterbium | Yb | ( 2), 3 |
71 | Лютеций / Lutetium | Lu | 3 |
72 | Гафний / Hafnium | Hf | 4 |
73 | Тантал / Tantalum | Ta | ( 3), ( 4), 5 |
74 | Вольфрам / Tungsten | W | ( 2), ( 3), ( 4), ( 5), 6 |
75 | Рений / Rhenium | Re | (-1), ( 1), 2, ( 3), 4, ( 5), 6, 7 |
76 | Осмий / Osmium | Os | ( 2), 3, 4, 6, 8 |
77 | Иридий / Iridium | Ir | ( 1), ( 2), 3, 4, 6 |
78 | Платина / Platinum | Pt | ( 1), 2, ( 3), 4, 6 |
79 | Золото / Gold | Au | 1, ( 2), 3 |
80 | Ртуть / Mercury | Hg | 1, 2 |
81 | Талий / Thallium | Tl | 1, ( 2), 3 |
82 | Свинец / Lead | Pb | 2, 4 |
83 | Висмут / Bismuth | Bi | (-3), ( 2), 3, ( 4), ( 5) |
84 | Полоний / Polonium | Po | (-2), 2, 4, ( 6) |
85 | Астат / Astatine | At | нет данных |
86 | Радон / Radon | Rn | 0 |
87 | Франций / Francium | Fr | нет данных |
88 | Радий / Radium | Ra | 2 |
89 | Актиний / Actinium | Ac | 3 |
90 | Торий / Thorium | Th | 4 |
91 | Проактиний / Protactinium | Pa | 5 |
92 | Уран / Uranium | U | ( 2), 3, 4, ( 5), 6 |
Чего не указано в таблице валентности, это то, что валентность элемента может быть постоянной и переменной.
Виды валентности | ||
Постоянная (у металлов главных подгрупп) | Переменная (у неметаллов и металлов побочных подгрупп) | |
Высшая (равна номеру группы) | Низшая (равна разности между числом 8 и номером группы) | |
Знание валентности элементов необходимы для правильного составления химических формул соединений.
Теория электролитической диссоциации
Вернёмся к раствору, который состоит из хлорида натрия и воды. Если взять отдельно два этих вещества и каждое проверить на электропроводность, то результат будет отрицательный – они не проводят ток. Однако смесь этих веществ – раствор,будет электропроводный, т.е. являться электролитом.
Как Вам известно, с курса физики, электрический ток – это поток заряженных частиц. Однако, откуда они берутся? При растворении образуются ионы, которые и будут причиной электропроводности.
Т.е. диссоциацию хлорида натрия можно записать в следующем виде:
NaCl -> Na Cl-
Рассмотрим, как происходит диссоциация веществ с ионным типом связи. Данный тип локализуется в солях и основаниях.
Рассмотрим NaOH, Ba(OH)2, Fe(OH)3. Из них NaOHи Ва(ОН)2 относятся к щелочам (растворимые) основания и Fe(OH)3, который является нерастворимым. Если соединениене способно раствориться в воде, то такой раствор не будет проводить электрический ток. Молекула воды не может разрушить кристаллическую решётку, поэтому ионы не образуются и эти вещества неэлектролиты.
Раствор гидроксида натрия и гидроксида бария считаются электролитами, так как они диссоциируют на ионы. Следует обратить внимание, чтобы записать уравнение диссоциации оснований, запишем металл (указав его степень окисления) и гидроксильную группу, которая всегда имеет заряд минус 1. Число гидроксильных групп указываем коэффициентом.
Соли в воде распадаются на ионы металла и кислотного остатка. Как и в случае с основаниями, записываем: металл плюс кислотный остаток. Предварительно смотрим в таблицу растворимости, где можем уточнить заряд кислотного остатка и металла, а также проверить растворимость вещества.
Рассмотрим, как происходит диссоциация кислот, на примере соляной кислоты.
Для этого соединения характерна ковалентная полярная связь. Водород имеет положительный заряд, хлор – отрицательный.
Обычно в уравнении диссоциации записывают просто ион водорода Н , а не ион гидроксония Н3О .
Также следует обратить внимание, что молекула изначально нейтральное вещество. При написании уравнения, необходимо смотреть, чтобы количество положительных и отрицательных зарядов было равно.
Диссоциация электролитов имеет количественную характеристику.
Степень диссоциации зависит от следующих параметров:
Сила электролита определяется числом молекул, которые продиссоциировали. Чем выше это число, тем сильнее будет электролит.
Соответственно, электролитом является вещество с ионным или ковалентным типом связи. Его сила будет зависеть от природы вещества.
Обобщим всё выше сказанное, попробуем вывести положения теории электролитической диссоциации. Первый пункт можно записать в следующем виде.
Если же к электролитам относятся растворимые соли, кислоты и основания, рассмотрим, на какие частицы они будут диссоциировать.
Второй пункт даст ответ на вопрос, что является причиной диссоциации.
Если же через растворы электролитов пропустить электрический ток, то ионы принимают упорядоченное движение. Третий постулат звучит так.

Источник
Каждое вещество индивидуально, имеет определённый качественный и количественный состав, а также отличается строением. Именно по этой причине молекулы веществ в водном растворе могут распадаться полностью на ионы или частично. Выделим 4 пункт.
Поскольку в растворах слабых электролитов одновременно происходит два процесса распад молекул на ионы и их взаимодействие, то в уравнении принято ставить не знак равно или →, а две стрелки .
Каким образом мы можем прогнозировать силу электролитов. Если в случае солей и оснований достаточно посмотреть в таблицу растворимости, растворимые вещества это сильные электролиты, то в случае кислородсодержащих кислот этого будет недостаточно. К примеру, угольная кислота Н2СО3 по данным таблицы растворимости, относится к растворимым веществам, однако она считается слабым электролитом.
Из этого следует, что серная кислота – это сильный электролит, сернистая кислота относится к слабым электролитам.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна 5?
1) HPO32) H3PO33) Li3P4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO32) H3PO33) Li3PO44) AlP
3. В каком соединении степень окисления азота равна 4?
1) HNO22) N2O43) N2O4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH32) N2H43) N2O54) HNO2
5. В каком соединении степень окисления серы равна 2?
1) Na2SO32) SO23) SCl24) H2SO4
6. В каком соединении степень окисления серы равна 6?
1) Na2SO32) SO33) SCl24) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) 2, 3, 62) 3, 6, 63) 2, 6, 54) 2, 6, 6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода2) порядковому номеру химического элемента3) числу электронов, недостающих до завершения внешнего электронного слоя4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода2) порядковому номеру химического элемента3) номеру группы4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO32) H3PO33) Na3P4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO32) H3PO33) Na3PO44) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, 32) –3, 53) 3, –34) 3, 5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –22) II, –13) I, 44) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, 52) II, –13) II, 64) III, 4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –32) III, 33) IV, –24) III, 4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом2) натрием3) фтором4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций2) железо3) сера4) хлор
18. Степень окисления 3 в своих соединениях могут проявлять
1) хлор и фтор2) фосфор и хлор3) углерод и сера4) кислород и водород
19. Степень окисления 4 в своих соединениях могут проявлять
1) углерод и водород2) углерод и фосфор3) углерод и кальций4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор2) железо3) кислород4) фтор
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя(с большинством химических элементов) и свойства восстановителя(только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремниемс образованием оксидов:
S O2 → SO2
Si O2 → SiO2
1.3.Фосфоргорит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P 5O2 → 2P2O5
1.4.С азотомкислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca O2 → 2CaO
Однако при горении натрияв кислороде преимущественно образуется пероксид натрия:
2Na O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe O2→ 2FeO
4Fe 3O2→ 2Fe2O3
3Fe 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS 7O2→ 2Fe2O3 4SO2
Al4C3 6O2→ 2Al2O3 3CO2
Ca3P2 4O2→ 3CaO P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S 3O2→ 2H2O 2SO2
Аммиакгорит с образованием простого вещества, азота:
4NH3 3O2→ 2N2 6H2O
Аммиакокисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 5O2→ 4NO 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 3O2→ CO2 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 O2 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 2O2→ CO2 2H2O
2CH4 3O2→ 2CO 4H2O
CH4 O2→ C 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 O2 → 2CH3-CH=O

