- Основное и возбужденное состояние атома
- «положение кислорода и серы в периодической системе химических элементов, строение их атомов. озон-аллотропная модификация кислорода»
- Глава 6. физика атома и атомного ядра
- Положение в периодической системе; состав, строение, свойства атома кислорода; состав, строение, свойства молекулы кислорода; нахождение в природе; получение; — презентация
- Свойства кислорода (таблица): температура, плотность, давление и пр
- Строение электронной оболочки
- Строение атома кислорода
- Химические свойства кислорода
- Электронные формулы ионов
- Электронные формулы элементов первых четырех периодов
Основное и возбужденное состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома. Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи, атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов. А химические связи энергетически очень для атома выгодны.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться, и один из электронов спаренной пары может переходить на вакантную орбиталь.
Таким образом число неспаренных электронов увеличивается, и атом может образовать больше химических связей, что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии боримеет следующую конфигурацию энергетического уровня:
5B 1s22s22p1 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
5B* 1s22s12p2 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
«положение кислорода и серы в периодической системе химических элементов, строение их атомов. озон-аллотропная модификация кислорода»
Технологическая карта урока.
Учитель Дьячук Е.Ю. учитель химии МБОУ СОШ №1 г.Оха Сахалинская область
- Предмет
- химия
- Класс
- 9
- Тема урока
- «Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон-аллотропная модификация кислорода»
- Тип урока
- Урок «открытия нового знания»
- Цели
- Формирование на предметном уровне системы знаний о веществе ( химическом элементе, атоме, молекуле )
УМК
Г.Е. Рудзитис, Ф.Г.Фельдман
- Планируемые образовательные результаты
- Предметные
- Метапредметные
- Личностные
- Использовать умение составлять электронные формулы атомов элементов кислорода и серы; объяснять зависимость и закономерные изменения свойств химических элементов от электронного строения их атомов; анализировать, делать выводы, обобщать полученные знания;
- самостоятельно использовать материалы учебника и справочные таблицы, применять ранее полученные знания;
- наблюдать демонстрируемые опыты;
- делать выводы и умозаключения из наблюдений.
- грамотно обращаться с веществами в повседневной жизни;
- понимать смысл и необходимость соблюдения предписаний, предлагаемых в инструкциях по использованию лекарств, средств бытовой химии и др.;
- —регулятивные: следовать определенному алгоритму при составлении электронных формул;
- применять знания о закономерностях периодической системы химических элементов для объяснения и предвидения свойств конкретных веществ;
- —познавательные: прогнозировать химические свойства веществ на основе их состава и строения;выделять информацию из текста учебника; высказывать суждения, обосновывать и доказывать свой выбор, приводя факты, взятые из материалов учебника; использовать знаки, символы, схемы для выполнения заданий; находить закономерности, устанавливать причинно- следственные связи между реальными объектами и явлениями; осуществлять поиск информации в соответствии с поставленной задачей, используя различные ресурсы информационной среды;
- —коммуникативные: уметь слушать собеседника, понимать и /или принимать его точку зрения; оценивать высказывания и действия партнера, сравнивать их со своими высказываниями; формулировать высказывания, задавать вопросы, адекватные ситуации и учебной задаче;
- проявлять интерес к предлагаемой деятельности и с учетом собственных интересов;
- оценивать свою деятельность, определяя по заданным критериям ее успешность или неуспешность и способы ее корректировки, бережно и уважительно относиться к людям и результатам их деятельности;
- руководствоваться этическими нормами (сотрудничество, взаимопомощь, ответственность) при выполнении групповой работы
- Основные понятия, изучаемые на уроке
- Аллотропия, аллотропные модификации
- Организационная структура урока
- № этапа
- Этап урока
- УУД
- Деятельность
- ЭОР
- Время
- учителя
- учащихся
- 1
- Оргмомент
- Коммуникативные- планирование учебного сотрудничества с учителем и сверстниками.
- 2
- Актуализация знаний.
- Регулятивные:волевая саморегуляция.Личностные: действие смыслообразования
из каких частей состоит атом любого химического элемента?
От чего зависит величина положительного заряда ядра атома и как определить ее по таблице Д.И.Менделеева?
Количество каких частиц в атоме определяет значение заряда ядра атома?
В какой части атомного пространства располагаются электроны?
Как по таблице Д. И. Менделеева определить количество внешних электронов в атомах элементов главных подгрупп?
Отвечают на вопросы
Выставляют оценку готовности к уроку.
Электронная периодическая таблица Д.И. Менделеева
- 10
- 3
- Самоопределение к деятельности
- Познавательная-анализ объектов с целью выделения признаков.
Регулятивные: целеполагание как постановка учебной задачи, прогнозирование. Коммуникативные- планирование учебного сотрудничества с учителем и сверстниками.
Положение кислорода и серы в периодической таблице химических элементов, строение их атомов.
- Создание проблемной ситуации
- Продолжая рассматривать вместе с учащимися особенности строения атомов элементов-халькогенов, точнее, электронное строение их внешнего энергетического уровня, составляем общую формулу: ns2np4
- При далее :
- Какая высшая валентность характерна для элементов семейства халькогенов (подгруппы кислорода)?
- Для всех ли элементов семейства характерна валентность равная ᴠɪ?
- Постановка учебной проблемы
- Почему, в отличие от остальных представителей подгруппы, кислород не может проявлять валентность, равную ᴠɪ?
- Доказательство и применение найденного решения
Задание. Приведите примеры соединений рассмотренных элементов с наиболее характерными степенями окисления.
Строение простых веществ. Аллотропия.
- Создание проблемной ситуации
- Задание: сравните два вещества кислород и озон ( состав, физические и химические свойства, получение).
- Постановка учебной проблемы
- Как вы думаете, чем по отношению друг к другу и к химическому элементу кислороду являются данные простые вещества: кислород и озон?
Поскольку у учащихся нет необходимых опорных знаний, объясняю сущность явления, признаки которого ученики обнаружили на уроке. Формирую представление об аллотропии и аллотропных модификациях. Отмечаю обязательное условие, позволяющее говорить о каких-либо веществах как об аллотропных модификациях одного элемента (возможность превращения этих веществ друг в друга).
- Доказательство и применение найденного решения
- Рассказываю о том, что элементам подгруппы кислорода свойственна аллотропия: сера образует кристаллическую и пластическую модификации, селен- серую и красную модификации ( серый и красный селен).
- Учащиеся ставят цель урока.
- Строение атома кислорода
- Строение атома серы
- O 8)2)6
- 1s22s22p4
- P — элемент
- S 16)2)8)6
- 1s22s22p63s23p4
- P — элемент
- Учащиеся выявляют факт, требующий теоретического обоснования.
Учащиеся выдвигают гипотезу: в 8 классе они знакомились с семейством галогенов. Им помогают знания о том, что фтор в отличие от других галогенов, не проявляет высшей валентности, равной ᴠɪɪ. Опираясь на эти знания, они отвечаю на поставленный вопрос.
Учащиеся заполняют таблицу: сравнение свойств кислорода и озона.
Видеофрагмент CD «Подгруппа кислорода»
Глава 6. физика атома и атомного ядра
К 20-м годам XX века физики уже не сомневались в том, что атомные ядра, открытые Э. Резерфордом в 1911 г., также как и сами атомы, имеют сложную структуру. В этом их убеждали многочисленные экспериментальные факты, накопленные к этому времени: открытие радиоактивности, экспериментальное доказательство ядерной модели атома, измерение отношения e / m для электрона, α-частицы и для так называемой H-частицы – ядра атома водорода, открытие искусственной радиоактивности и ядерных реакций, измерение зарядов атомных ядер и т. д.
В настоящее время твердо установлено, что атомные ядра различных элементов состоят из частиц двух видов – протонов и нейтронов.
Первая из этих частиц представляет собой атом водорода, из которого удален единственный электрон. Эта частица наблюдалась уже в 1907 г. в опытах Дж. Томсона, которому удалось измерить у нее отношение e / m.
В 1919 году Э. Резерфорд обнаружил ядра атома водорода в продуктах расщепления ядер атомов многих элементов. Резерфорд назвал эту частицу протоном. Он высказал предположение, что протоны входят в состав всех атомных ядер. Схема опытов Резерфорда представлена на рис. 6.5.1.
Прибор Резерфорда состоял из вакуумированной камеры, в которой был расположен контейнер К с источником α-частиц. Окно камеры было закрыто металлической фольгой Ф, толщина которой была подобрана так, чтобы α-частицы не могли через нее проникнуть.
За окном располагался экран Э, покрытый сернистым цинком. С помощью микроскопа М можно было наблюдать сцинтилляции (т. е. световые вспышки) в точках попадания на экран тяжелых заряженных частиц. При заполнении камеры азотом низкого давления на экране возникали световые вспышки, указывающие на появление потока каких-то частиц, способных проникать через фольгу Ф, практически полностью задерживающую поток α-частиц.
Отодвигая экран Э от окна камеры, Резерфорд измерил среднюю длину свободного пробега наблюдаемых частиц в воздухе. Она оказалась приблизительно равной 28 см, что совпадало с оценкой длины пробега H-частиц, наблюдавшихся ранее Дж. Томсоном.
Исследования действия на частицы, выбиваемые из ядер азота, электрических и магнитных полей показали, что эти частицы обладают положительным элементарным зарядом и их масса равна массе ядра атома водорода. Впоследствии опыт был выполнен с целым рядом других газообразных веществ. Во всех случаях было обнаружено, что из ядер этих веществ α-частицы выбивают H-частицы или протоны.
По современным измерениям, положительный заряд протона в точности равен элементарному заряду e = 1,60217733·10–19 Кл, то есть равен по модулю отрицательному заряду электрона. В настоящее время равенство зарядов протона и электрона проверено с точностью 10–22.
Масса протона, по современным измерениям, равна mp = 1,67262∙10–27 кг. В ядерной физике массу частицы часто выражают в атомных единицах массы (а. е. м.), равной 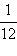
Следовательно, mp = 1,007276 а. е. м. Во многих случаях массу частицы удобно выражать в эквивалентных значениях энергии в соответствии с формулой E = mc2.
Таким образом, в опыте Резерфорда было открыто явление расщепления ядер азота и других элементов при ударах быстрых α-частиц и показано, что протоны входят в состав ядер атомов.
После открытия протона было высказано предположение, что ядра атомов состоят из одних протонов. Однако это предположение оказалось несостоятельным, так как отношение заряда ядра к его массе не остается постоянным для разных ядер, как это было бы, если бы в состав ядер входили одни протоны.
В 1920 г. Резерфорд высказал гипотезу о существовании в составе ядер жестко связанной компактной протон-электронной пары, представляющей собой электрически нейтральное образование – частицу с массой, приблизительно равной массе протона. Он даже придумал название этой гипотетической частице – нейтрон.
Это была очень красивая, но, как выяснилось впоследствии, ошибочная идея. Электрон не может входить в состав ядра. Квантово-механический расчет на основании соотношения неопределенностей показывает, что электрон, локализованный в ядре, т. е. области размером R ≈ 10–13 см, должен обладать колоссальной кинетической энергией, на много порядков превосходящей энергию связи ядер в расчете на одну частицу.
Однако идея о существовании тяжелой нейтральной частицы казалась Резерфорду настолько привлекательной, что он незамедлительно предложил группе своих учеников во главе с Дж. Чедвиком заняться ее поиском. Через 12 лет, в 1932 г. Чедвик экспериментально исследовал излучение, возникающее при облучении бериллия α-частицами, и обнаружил, что это излучение представляет собой поток нейтральных частиц с массой, примерно равной массе протона. Так был открыт нейтрон. На рис. 6.5.2 приведена упрощенная схема установки для обнаружения нейтронов.
При бомбардировке бериллия α-частицами, испускаемыми радиоактивным полонием, возникает сильное проникающее излучение, способное преодолеть такую преграду, как слой свинца толщиной в 10–20 см. Это излучение почти одновременно с Чедвиком наблюдали супруги Ирен и Фредерик Жолио-Кюри (Ирен – дочь Марии и Пьера Кюри), но они предположили, что это γ-лучи большой энергии.
Они обнаружили, что если на пути излучения бериллия поставить парафиновую пластину, то ионизирующая способность этого излучения резко возрастает. Они доказали, что излучение бериллия выбивает из парафина протоны, которые в большом количестве имеются в этом водородосодержащем веществе.
Дж. Чедвик в 1932 г. выполнил серию экспериментов по всестороннему изучению свойств излучения, возникающего при облучении бериллия α-частицами. В своих опытах Чедвик использовал различные методы исследования ионизирующих излучений. На рис. 6.5.
2 изображен счетчик Гейгера, предназначенный для регистрации заряженных частиц. Он состоит из стеклянной трубки, покрытой изнутри металлическим слоем (катод), и тонкой нити, идущей вдоль оси трубки (анод). Трубка заполняется инертным газом (обычно аргоном) при низком давлении.
Заряженная частица, пролетая в газе, вызывает ионизацию молекул. Появившиеся в результате ионизации свободные электроны ускоряются электрическим полем между анодом и катодом до энергий, при которых начинается ударная ионизация. Возникает лавина ионов, и через счетчик проходит короткий разрядный импульс тока.
Другим важнейшим прибором для исследования частиц является так называемая камера Вильсона, в которой быстрая заряженная частица оставляет след (трек). Траекторию частицы можно наблюдать непосредственно или фотографировать. Действие камеры Вильсона, созданной в 1912 г., основано на конденсации перенасыщенного пара на ионах, образующихся в рабочем объеме камеры вдоль траектории заряженной частицы. С помощью камеры Вильсона можно наблюдать искривление траектории заряженной частицы в электрическом и магнитном полях.
Дж. Чедвик в своих опытах наблюдал в камере Вильсона треки ядер азота, испытавших столкновение с бериллиевым излучением. На основании этих опытов он сделал оценку энергии γ-кванта, способного сообщить ядрам азота наблюдаемую в эксперименте скорость.
Она оказалась равной 100–150 МэВ. Такой огромной энергией не могли обладать γ-кванты, испущенные бериллием. На этом основании Чедвик заключил, что из бериллия под действием α-частиц вылетают не безмассовые γ-кванты, а достаточно тяжелые частицы.
Эти частицы обладали большой проникающей способностью и непосредственно не ионизировали газ в счетчике Гейгера, следовательно, они были электронейтральны. Так было доказано существование нейтрона – частицы, предсказанной Резерфордом более чем за 10 лет до опытов Чедвика.
Нейтрон – это элементарная частица. Ее не следует представлять в виде компактной протон-электронной пары, как первоначально предполагал Резерфорд.
По современным измерениям, масса нейтрона mn = 1,67493∙10–27 кг = 1,008665 а. е. м. В энергетических единицах масса нейтрона равна 939,56563 МэВ. Масса нейтрона приблизительно на две электронные массы превосходит массу протона.
Сразу же после открытия нейтрона российский ученый Д. Д. Иваненко и немецкий физик В. Гейзенберг выдвинули гипотезу о протонно-нейтронном строении атомных ядер, которая полностью подтвердилась последующими исследованиями. Протоны и нейтроны принято называть нуклонами.
Для характеристики атомных ядер вводится ряд обозначений. Число протонов, входящих в состав атомного ядра, обозначают символом Z и называют зарядовым числом или атомным номером (это порядковый номер в периодической таблице Менделеева).
Общее число нуклонов (т. е. протонов и нейтронов) называют массовым числом A:
Ядра химических элементов обозначают символом 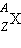
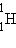
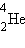
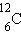
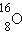
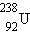 изотопами. У большинства химических элементов имеется несколько изотопов. Например, у водорода их три:
изотопами. У большинства химических элементов имеется несколько изотопов. Например, у водорода их три: 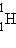
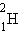

Химические элементы в природных условиях обычно представляют собой смесь изотопов. Существование изотопов определяет значение атомной массы природного элемента в периодической системе Менделеева. Так, например, относительная атомная масса природного углерода равна 12,011.

Положение в периодической системе; состав, строение, свойства атома кислорода; состав, строение, свойства молекулы кислорода; нахождение в природе; получение; — презентация
- 1
- 2
- 3 Положение в периодической системе; Состав, строение, свойства атома кислорода; Состав, строение, свойства молекулы кислорода; Нахождение в природе; Получение; Физические свойства простого вещества кислорода; Химические свойства; Применение
- 4
5 строение атома 8 О s21s2 2s22s2 2 р 4 Электронно-графическая Электронно-графическая Электронная формула- Валентные возможности Мидакова Н.В. 1s21s2 2 р 4 2s22s2 Валентность II
7 6
8 Яковлева О.А.
9 Яковлева О.А.
12 11 1.
В лаборатории: а) 2KMnO 4 t K 2 MnO 4 MnO 2 O 2 б) 2Н 2 О 2 MnO 2 2Н 2 О О 2 в) 2NaNO С 2NaNO 2 О 2 г) 2KClO 3 t 2KCl 3О 2 д) 4К 2 Сr 2 О 7 4К 2 CrO 4 2Сr 2 О 3 O 2 Катализатор вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции В замкнутых помещениях : а)
13 Вытеснением воды Вытеснением воздуха
14 13 2. В промышленности: 1) фракционной перегонкой жидкого воздуха, основанную на разных температурах кипения компонентов воздуха. Воздух охлаждают примерно до -200 °С и затем медленно нагревают.
При достижении температуры -183 °С из жидкого воздуха улетучивается кислород, остальные компоненты сжиженного воздуха при этой температуре остаются в жидком агрегатном состоянии; 2) электролизом воды. Ежегодно во всем мире получают свыше 80 млн. т кислорода 2Н 2 О электролиз 2Н 2 О 2 3.
В атмосфере: Кислород атмосферы имеет биологическое происхождение и образуется в зеленых растениях из воды при фотосинтезе с участием хлорофилла и энзимов: 12Н 2 О 6СО 2 = 6О 2 С 6 Н 12 О 6 6Н 2 О
16 Более сильным окислителем, чем кислород О 2, является озон О 3. Он образуется в атмосфере при грозовых разрядах ЗО 2 = 2О к Дж 2КI О 3 Н 2 О = I 2 2КОН О 2 Более сильным окислителем, чем кислород О 2, является озон О 3. Он образуется в атмосфере при грозовых разрядах ЗО 2 = 2О к Дж 2КI О 3 Н 2 О = I 2 2КОН О 2 Мидакова Н.В.
17 Мидакова Н.В.16 Кислород Озон Общие признаки 1. Простые вещества, которые образованы одним и тем же элементом – кислородом, т.е. являются его аллотропными модификациями. 2. При обычных условиях газы. 3. Сильные окислители. Отличительные признаки Молекула состоит из 2 атомов Молекула состоит из 3 атомов При н.у.
без цвета и запаха, жидкий – голубой, твердый – синие кристаллы. Мало растворим в воде. У.Ф. лучи не задерживает. Синий газ, запах резкий. В воде растворяется в 10 раз лучше, чем кислород. У.Ф. лучи задерживает. Не ядовит. Необходим для аэробного дыхания В больших дозах ядовит. Сильно раздражает глаза и дыхательные пути.
Бактерициден.
18 Мидакова Н.В.
19 Мидакова Н.В.18 Реактивное топливо В медицине На взрывных работах В сварке металлов В металлургии В пищевой промышленности
20 Горение –это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света. Оксид – сложные вещества, состоящие из двух элементов, одним из которых является кислород.
Изотоп – разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре. Катализатор -вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции Мидакова Н.В.
21 Мидакова Н.В.20 Проверка знаний 1. Катализатор – это вещество, ускоряющие реакцию, но не входящее в состав продуктов реакции. 3. Валентность кислорода равна двум. 4. При нормальных условиях имеет газообразное агрегатное состояние. 5. Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород
22 Мидакова Н.В.21 Проверка знаний Допишите уравнения реакции 2Н 2 О 2 MnO2 2KClO 3 t 2Н 2 О электр-з 2NaNO С
Свойства кислорода (таблица): температура, плотность, давление и пр
| Общие сведения | |
| Название | Кислород/ Oxygenium |
| Символ | О |
| Номер в таблице | 8 |
| Тип | Неметалл |
| Открыт | Джозеф Пристли, Англия, 1774 г. |
| Внешний вид и пр. | Газ без цвета, запаха и вкуса |
| Содержание в земной коре | 46 % |
| Содержание в океане | 86 % |
| Свойства атома | |
| Атомная масса (молярная масса)* | 15,99903-15,99977 а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p4 |
| Радиус атома | 60 (48) пм |
| Химические свойства | |
| Степени окисления | -2, −1, 0, 1, 2 |
| Валентность | -2 |
| Ковалентный радиус | 73 пм |
| Радиус иона | 132 (-2e) пм |
| Электроотрицательность | 3,44 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 1313,1 кДж/моль (13,61 эВ) |
| Электродный потенциал | 0 |
| Физические свойства | |
| Плотность (при 0 °C и нормальных условиях) | 0,00142897 г/см3 (газ); 1,141 г/см³ (жидкость) |
| Плотность (при 20 °C и нормальных условиях, состояние вещества – газ) | 0,001429 г/см3 |
| Плотность (при -183 °C и нормальных условиях, состояние вещества – жидкость) | 1,14 г/см3 |
| Плотность (при -183 °C и нормальных условиях, состояние вещества – твердое тело) | 1,27 г/см3 |
| Температура плавления | -218,35 °C (54,8 K) |
| Температура кипения | -182,96°C (90,19 K) |
| Уд. теплота плавления | 0,444 кДж/моль |
| Уд. теплота испарения | 3,4099 кДж/моль |
| Молярная теплоёмкость | 29,4 Дж/(K·моль) |
| Молярный объём | 14,0 см³/моль |
| Критическая температура | -118,37 °C |
| Критическое давление | 5,08 МПа |
| Критическая плотность | 0,41 г/см3 |
| Давление паров | 1 мм.рт.ст. (при -219 °C), 10 мм.рт.ст. (при -210,7 °C), 100 мм.рт.ст. (при -198,7 °C) |
| Стандартная энтальпия образования ΔH (при 298 К, для состояния вещества – газ) | 0 кДж/моль |
| Стандартная энергия Гиббса образования ΔG (при 298 К, для состояния вещества – газ) | 0 кДж/моль |
| Стандартная энтропия вещества S (при 298 К, для состояния вещества – газ) | 205,04 Дж/(моль·K) |
| Удельная теплоемкость при постоянном давлении | 0,911 Дж/г·K (при 15 °C) 0,9125 Дж/г·K (при 100 °C) 0,915 Дж/г·K (при 200 °C) 0,926 Дж/г·K (при 400 °C) 0,938 Дж/г·K (при 600 °C) |
| Теплопроводность (при 300 K) | 0,027 Вт/(м·К) |
| Диэлектрическая проницаемость | 1,000486 (при 25°C) |
| Электропроводность в твердой фазе | |
| Сверхпроводимость при температуре | |
| Твёрдость | |
| Структура решётки | моноклинная |
| Параметры решётки | a = 5,403 Å, b = 3,429 Å, c = 5,086 Å, β = 135,53 Å |
| Температура Дебая | 155 К |
Примечание:
* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным (стационарным) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией.
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень. Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.
В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l 1. На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l 1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда.На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной.
Например, заполнение 2р-орбитали тремя электронами будет происходить так: ![]() , а не так:
, а не так: ![]() , а не так:
, а не так:
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом,энергетический ряд орбиталей выглядит так:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p <
5s < 4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например,энергетическая диаграмма для атома углерода:
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например, электронная формула углерода выглядит так: 1s22s22p2.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например, электронную формулу азотаможно записать так: 1s22s22p3 или так: [He]2s22p3.
1s2 = [He]
1s22s22p6 = [Ne]
1s22s22p63s23p6 = [Ar] и так далее.
Строение атома кислорода
Кислород (O) – жизненно важный газ, необходимый для дыхания, поддержания горения, окисления. Относится к группе халькогенов. Самый распространённый на Земле элемент. Строение атома кислорода позволяет ему соединяться с металлами и неметаллами, образуя оксиды.
По положению в периодической таблице Менделеева можно определить строение атома элемента кислорода. Это восьмой элемент, расположенный в VI группе, втором периоде. Относительная атомная масса – 16. Существует три изотопа элемента:
Наиболее распространён 16O.
Рис. 1. Положение кислорода в периодической таблице.
Электронная конфигурация атома кислорода – 1s22s22p4. Ядро атома кислорода имеет заряд 8. Кислород относится к элементам р-семейства. На внешнем энергетическом уровне находится шесть валентных электронов. Два спаренных электрона находится на 2s-орбитали.
Рис. 2. Строение атома.
Молекула кислорода имеет два атома – О2. При присоединении ещё одного атома образуется озон – О3.
Кислород – бесцветный и безвкусный газ, плохо растворимый в воде и спирте. Хорошо растворим в жидком серебре. В сжиженном виде приобретает светло-голубой цвет, в твёрдом – синий. Занимает 21 % атмосферного воздуха.
Рис. 3. Твёрдый кислород.
Кислород поддерживает горение, поэтому его легко обнаружить с помощью тлеющей лучины (вспыхивает).
Благодаря электронному строению обладает высокой степенью окисления. Однако большую активность проявляет при нагревании из-за прочных двойных связей между атомами. При комнатной температуре быстро реагирует с наиболее активными элементами – щелочными и щелочноземельными металлами, некоторыми неметаллами.
Соединяясь с элементами, образует оксиды. Окисляет органические вещества. Примеры реакций с простыми веществами:
- K O2 → KO2;
- 3Fe 2O2 → Fe3O4;
- S O2 → SO2.
С фосфором, серой, углеродом (графитом), водородом кислород реагирует при нагревании:
- 4Р 5О2 → 2Р2О5;
- S O2 → SO2;
- С О2 → СО2;
- 2Н2 О2 → 2Н2О.
Быстро пропуская фтор через щёлочь, получают реакцию кислорода с фтором:
2F2 2NaOH → 2NaF H2O OF2.
Кислород с фтором непосредственно взаимодействует при электрическом разряде. В этом случае кислород играет роль восстановителя:
Кислород реагирует со сложными веществами, образуя оксиды:
- 2CuS 3O2 → 2CuO 2SO2;
- 2H2S 3O2 → 2SO2 2H2O;
- 2C6H6 15O2 → 12CO2 6H2O;
- CH4 2O2 → CO2 2H2O.
Кислород не реагирует с золотом и инертными газами. Взаимодействие с галогенами происходит в условиях ультрафиолета или электрического тока.
Кислород – распространённый в природе бесцветный газ. Схема строения атома – 8 О)2)6. Кислород всегда проявляет валентность II за счёт двух неспаренных электронов.
Кислород – сильный окислитель, проявляющий в некоторых реакциях свойства восстановителя. Взаимодействует с металлами и неметаллами, сложными неорганическими и органическими веществами.
Наибольшую активность проявляет при нагревании. Не реагирует с благородными газами и золотом.
Химические свойства кислорода
 Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 2s2 2p4 находится 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя.
 отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
 Кислород легко реагирует с щелочными и щелочноземельными металлами:
Кислород легко реагирует с щелочными и щелочноземельными металлами:- 4Li O2 → 2Li2O,
- 2K O2 → K2O2,
- 2Ca O2 → 2CaO,
- 2Na O2 → Na2O2,
- 2K 2O2 → K2O4
- Мелкий порошок железа ( так называемого пирофорного железа) самовоспламеняется на воздухе, образуя Fe2O3, а стальная проволока горит в кислороде, если ее заранее раскалить:
- 3 Fe 2O2 → Fe3O4
- 2Mg O2 → 2MgO
- 2Cu O2 → 2CuO
- С неметаллами (серой, графитом, водородом, фосфором и др.) кислород реагирует при нагревании:
- S O2 → SO2,
- C O2 → CO2,
- 2H2 O2 → H2O,
- 4P 5O2 → 2P2O5,
- Si O2 → SiO2, и т.д
- Почти все реакции с участием кислорода O2 экзотермичны, за редким исключением, например:
- N2 O2 → 2NO – Q
- Эта реакция протекает при температуре выше 1200 oC или в электрическом разряде.
- Кислород способен окислить сложные вещества, например:
- 2H2S 3O2 → 2SO2 2H2O (избыток кислорода),
- 2H2S O2 → 2S 2H2O (недостаток кислорода),
- 4NH3 3O2 → 2N2 6H2O (без катализатора),
- 4NH3 5O2 → 4NO 6H2O (в присутствии катализатора Pt ),
- CH4 (метан) 2O2 → CO2 2H2O,
- 4FeS2 (пирит) 11O2 → 2Fe2O3 8SO2.
Известны соединения, содержащие катион диоксигенила O2 , например, O2 [PtF6]— (успешный синтез этого соединения побудил Н. Бартлетта попытаться получить соединения инертных газов).
Озон сильно ядовит, его ядовитые свойства сильнее, чем, например, у сероводорода. Однако в природе озон, содержащийся в высоких слоях атмосферы, выполняет роль защитника всего живого на Земле от губительного ультрафиолетового излучения солнца.
Тонкий озоновый слой поглощает это излучение, и оно не достигает поверхности Земли. Наблюдаются значительные колебания в толщине и протяженности этого слоя с течением времени (так называемые озоновые дыры) причины таких колебаний пока не выяснены.
Применение кислорода O2: для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов, как окислитель в различных химических производствах, для жизнеобеспечения на подводных кораблях, как окислитель ракетного топлива (жидкий кислород), в медицине, при сварке и резке металлов.
Применение озона О3: для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы— это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаётэлектроны, то общий заряд образовавшейся частицы будет положительный(вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов).
11Na 1s22s22p63s1 -1е = 11Na 1s22s22p63s0
Если атом принимаетэлектроны, то приобретает отрицательныйзаряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора образуется так:
17Cl 1s22s22p63s23p5 1e = 17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома. Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень.
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2
19. Ион S2-
20. Ион Ni2
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na и F—.
Электронная формула катиона натрия: Na 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na и F— — изоэлектронные. Также они изоэлектронны атому неона.
Тренажер по теме «Строение атома» — 10 вопросов, при каждом прохождении новые.
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлораравно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
7N 1s22s22p3 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
6. Электронная формула кислорода:
8О 1s22s22p4 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
7. Электронная формула фтора:
8. Электронная формула магния:
12Mg 1s22s22p63s2 1s ![]() 2s
2s ![]() 2s
2s 2p
![]() 3s
3s ![]() 3s
3s
9. Электронная формула алюминия:
13Al 1s22s22p63s23p1 1s ![]() 2s
2s ![]() 2s
2s 2p
![]() 3s
3s ![]() 3s
3s 3p
![]()
10. Электронная формула кремния:
14Si 1s22s22p63s23p2 1s ![]() 2s
2s ![]() 2s
2s 2p
![]() 3s
3s ![]() 3s
3s 3p
![]()
11. Электронная формула фосфора:
15P 1s22s22p63s23p3 1s ![]() 2s
2s ![]() 2s
2s 2p
![]() 3s
3s ![]() 3s
3s 3p
![]()
12. Электронная формула серы:
16S 1s22s22p63s23p4 1s ![]() 2s
2s ![]() 2s
2s 2p
![]() 3s
3s ![]() 3s
3s 3p
![]()
13. Электронная формула хлора:
14. Электронная формула аргона:
18Ar 1s22s22p63s23p6 1s ![]() 2s
2s ![]() 2s
2s 2p
![]() 3s
3s ![]() 3s
3s 3p
![]()
15. Электронная формула углеродав возбуждённом состоянии:
6C* 1s22s12p3 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
16. Электронная формула бериллияв возбуждённом состоянии:
4Be 1s22s12p1 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2 : 20Ca2 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: 16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2 : 28Ni2 1s22s22p63s23p63d84s0. Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водородазаполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
1H 1s1 1s ![]()
У гелия1s-орбиталь полностью заполнена:
2He 1s2 1s ![]()
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у литияначинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
3Li 1s22s1 1s ![]() 2s
2s ![]() 2s
2s
У бериллия2s-подуровень заполнен:
4Be 1s22s2 1s ![]() 2s
2s ![]() 2s
2s
Далее, у боразаполняется p-подуровень второго уровня:
5B 1s22s22p1 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
6C 1s22s22p2 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
10Ne 1s22s22p6 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
У натрияначинается заполнение третьего энергетического уровня:
11Na 1s22s22p63s1 1s ![]() 2s
2s ![]() 2s
2s 2p
![]() 3s
3s ![]() 3s
3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргонасамостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
19K 1s22s22p63s23p64s11s![]() 2s
2s![]() 2s
2s 2p
![]() 3s
3s![]() 3s
3s 3p
![]() 4s
4s![]() 4s
4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
19K [Ar]4s1 [Ar] 4s ![]()
У кальция4s-подуровень заполнен:
20Ca [Ar]4s2 [Ar] 4s ![]()
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
21Sc [Ar]3d14s2 [Ar] 4s ![]() 3d
3d ![]() 3d
3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титанадо ванадия:
22Ti [Ar]3d24s2 [Ar] 4s ![]() 3d
3d ![]() 3d
3d 23V [Ar]3d34s2 [Ar] 4s
![]() 3d
3d ![]() 3d
3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хроматакая:
24Cr [Ar]3d54s1 [Ar] 4s ![]() 3d
3d ![]() 3d
3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае —
3d44s2
) ровно одна ячейка в
d
-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически
менее выгодно
. А
более выгодно
, когда
d
-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с
4s
-подуровня. И небольшие затраты энергии на перескок электрона с
4s
-подуровня с лихвой покрывает энергетический эффект от заполнения всех
3d-
орбиталей. Этот эффект так
и называется
— «провал»
или
«проскок»электрона
. И наблюдается он, когда
d
-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
25Mn [Ar]3d54s2
Аналогично у кобальтаи никеля. А вот у медимы снова наблюдаем провал (проскок) электрона— электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
29Cu [Ar]3d104s1
На цинке завершается заполнение 3d-подуровня:
30Zn [Ar]3d104s2
У следующих элементов, от галлиядо криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
31Ga [Ar]3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Например, у меди ([Ar]3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома ( 24Cr [Ar]3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.

-870x400.jpg)