Второй этап гликолиза
Второй этап гликолиза – это освобождение энергии, содержащейся в глицеральдегидфосфате, и запасание ее в форме АТФ.
Шестая реакция гликолиза (фермент глицеральдегидфосфат-дегидрогеназа) – окисление глицеральдегидфосфата до кислоты и присоединение к ней фосфорной кислоты приводит к образованию макроэргического соединения 1,3-дифосфоглицериновой кислоты и НАДН.
В седьмой реакции (фермент фосфоглицераткиназа) энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тратится на образование АТФ. Реакция получила дополнительное название – реакция субстратного фосфорилирования, что уточняет источник энергии для получения макроэргической связи в АТФ (от субстрата реакции) в отличие от окислительного фосфорилирования (использование энергии электрохимического градиента ионов водорода на мембране митохондрий).
Восьмая реакция – синтезированный в предыдущей реакции 3-фосфоглицерат под влиянием фосфоглицератмутазы изомеризуется в 2-фосфоглицерат.
Девятая реакция – фермент енолаза отрывает молекулу воды от 2-фосфоглицериновой кислоты и приводит к образованию макроэргической фосфоэфирной связи в составе фосфоенолпирувата.
Десятая реакция гликолиза – еще одна реакция субстратного фосфорилирования – заключается в переносе пируваткиназой макроэргического фосфата с фосфоенолпирувата на АДФ с образованием пировиноградной кислоты и АТФ.
Последняя реакция бескислородного окисления глюкозы, одиннадцатая – образование молочной кислоты из пирувата под действием лактатдегидрогеназы. Важно то, что эта реакция осуществляется только в анаэробных условиях.
Первый этап гликолиза
Первый этап гликолиза – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов.
Первая реакция гликолиза сводится к превращению глюкозы в реакционно-способное соединение за счет фосфорилирования 6-го, не включенного в кольцо, атома углерода. Эта реакция является первой в любом превращении глюкозы, катализируется гексокиназой.
Вторая реакция необходима для выведения еще одного атома углерода из кольца для его последующего фосфорилирования (фермент глюкозофосфат-изомераза). В результате образуется фруктозо-6-фосфат.
Третья реакция – фермент фосфофруктокиназа фосфорилирует фруктозо-6-фосфат с образованием почти симметричной молекулы фруктозо-1,6-дифосфата. Эта реакция является главной в регуляции скорости гликолиза.
В четвертой реакции фруктозо-1,6-дифосфат разрезается пополам фруктозо-1,6-дифосфат-альдолазой с образованием двух фосфорилированных триоз-изомеров – альдозы глицеральдегида (ГАФ) и кетозы диоксиацетона (ДАФ).
Пятая реакция подготовительного этапа – переход глицеральдегидфосфата и диоксиацетонфосфата друг в друга при участии триозофосфатизомеразы. Равновесие реакции сдвинуто в пользу диоксиацетонфосфата, его доля составляет 97%, доля глицеральдегидфосфата – 3%. Эта реакция, при всей ее простоте, определяет дальнейшую судьбу глюкозы:
Химические свойства глюкозы. получение, применение
I. Получение глюкозы
1. В промышленности
(C6H10O5)n nH2O t,H → nC6H12O6
крахмал глюкоза
2. В лаборатории
- Из формальдегида (1861 г А.М. Бутлеров):
6 HCOH Ca(OH)2→ C6H12O6
формальдегид
3. В природе
6CO2 6H2O hν, хлорофилл → C6H12O6 6O2
4. Другие способы
C12H22O11 H2O t,H → 2 C6H12O6
мальтоза глюкоза
C12H22O11 H2O t,H → C6H12O6 C6H12O6
сахароза глюкоза фруктоза
II. Химические свойства глюкозы
1. Специфические свойства
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH 2CO2↑
2. Молочнокислое брожение:
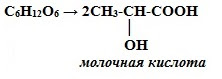
3. Маслянокислое брожение:
C6H12O6 → C3H7COOH 2H2 ↑ 2CO2↑
2. Свойства альдегидов
1. Реакция серебряного зеркала:
Видео-опыт: «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
СH2OH(CHOH)4-COH Ag2O t.NH3→ СH2OH(CHOH)4-COOH 2Ag↓
или
СH2OH(CHOH)4-COH 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 2Ag↓ 3NH3 H2O
СH2OH(CHOH)4-COOH — глюконовая кислота
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH 2Cu(OH)2 t → СH2OH(CHOH)4-COOH Cu2O 2H2O
голубой красный

Рис. 1 Cu2O↓
3. Восстановление:
СH2OH(CHOH)4-COH H2 t,Ni → СH2OH(CHOH)4-CH2OH
сорбит – шестиатомный спирт
3. Свойства многоатомных спиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
Видео-опыт: «Качественная реакция глюкозы с гидроксидом меди (II)»

Рис. 2. Глюконат меди (II)
4. Реакции окисления
Видео-опыт: “Окисление глюкозы кислородом воздуха в присутствии метеленового голубого”
Видео-опыт: “Определение глюкозы в виноградном соке”
Видео-опыт: “Распознавание глюкозы с помощью качественных реакций”
III. Применение

Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
C6H12O6 6O2 → 6H2O 6CO2 2800 кДж
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива.


IV. Тренажеры
Тренажер №1: “Химические свойства глюкозы”
ЦОРы
Видео: «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
Видео: «Качественная реакция глюкозы с гидроксидом меди (II)»
Видео: “Окисление глюкозы кислородом воздуха в присутствии метеленового голубого”
Видео: “Определение глюкозы в виноградном соке”
Видео: “Распознавание глюкозы с помощью качественных реакций”

