- Щелочные (Li-Fr), щелочно-земельные (Ca-Ra) металлы, Mg
- Алюминий
- Железо
- Хром
- Медь
- Цинк
- Взаимодействие металлов друг с другом
- Взаимодействие металлов с кислотами
- Металл азот
- Металл вода
- Металл водород
- Металл галогены
- Металл кислород
- Металл углерод
- Металл фосфор
- Полезные ссылки
- Получение кислорода
- Физические свойства кислорода
- Химические свойства кислорода
- Химические свойства металлов
- Химические свойства неметаллов
Щелочные (Li-Fr), щелочно-земельные (Ca-Ra) металлы, Mg
1) Реагируют с кислородом (подробнее)
Все Щ металлы, кроме Li, образуют не оксиды, а пероксиды:
2Li O2 → 2Li2O
2Na O2 → Na2O2
Оксиды получают взаимодействием пероксидов с металлом:
Na2O2 2Na → 2Na2O
2) Реагируют с водородом (подробнее)
3) Реагируют с водой (подробнее)
4) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
3Mg 2P → Mg3P2 (t)
2Na Cl2 → 2NaCl
Ca 2C → CaC2 (t)
5) Реагируют с некоторыми кислотными оксидами:
CO2 2Mg → 2MgO C
SiO2 2Mg → 2MgO SiSiO2 2Ca → 2CaO SiSiO2 2Ba → 2BaO Si
6) Магний как восстановитель используется в производстве кремния и некоторых металлов:
2Mg TiCl4 → 2MgCl2 Ti (t)
7) Реакции Щ и ЩЗ металлов с растворами солей или кислот не рассматриваются, так как эти металлы очень бурно взаимодействуют с водой, и суммарная реакция изменится.
Алюминий
1) Реагирует с кислородом: 4Al 3O2 → 2Al2O3
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с водой, если удалить оксидную пленку:
2Al 6H2O → 2Al(OH)3 3H2
4) Реагирует с щелочами с выделением водорода (также Be и Zn):
2Al 2NaOH 6H2O → 2Na[Al(OH)4] 3H2
5) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
2Al 3Cl2 → 2AlCl3
4Al 3C → Al4C3
2Al N2 → 2AlN (t)
6) Используется для восстановления менее активных металлов (алюмотермия):
3FeO 2Al → 3Fe Al2O3Cr2O3 2Al → 2Cr Al2O3
7) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Al H2SO4 (р) → Al2(SO4)3 H2
8) Вытесняет менее активные металлы из их солей:
2Al 3CuSO4 → Al2(SO4)3 3Cu
9) На холоде пассивируется концентрированными растворами серной и азотной кислот. При нагревании реагирует без выделения водорода:
Al 4HNO3(конц.) → Al(NO3)3 NO
8Al 30HNO3(разб.) → 8Al(NO3)3 3NH4NO3 9H2O (при любой температуре, возможно образование N2O)
2Al 6H2SO4(конц.) → Al2(SO4)3 3SO2 H2
H2
Железо
1) Реагирует с кислородом:
3Fe 2O2 → Fe3O4 (железная окалина)
В присутствии воды образуется ржавчина:4Fe 3O2 6H2O → 4Fe(OH)3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Fe H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
3Fe 4H2O → Fe3O4 4H2 (t)
4) Не реагирует с щелочами
Fe NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Fe 3F2 → 2FeF3 (образуется соль Fe 3)
2Fe 3Cl2 → 2FeCl3 (образуется соль Fe 3)
2Fe 3Br2 → 2FeBr3 (образуется соль Fe 3)
Fe I2 → FeI2 (образуется соль Fe 2)
Fe S → FeS
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Fe H2SO4 (разб.) → FeSO4 H2 2)
2)
Fe 2HCl → FeCl2 H2
7) Вытесняет менее активные металлы из их солей:
Fe CuSO4 → FeSO4 Cu (образуется соль Fe 2)
8) На холодe пассивируется концентрированными растворами серной и азотной кислот (т.е. реакция не протекает). При нагревании реагирует без выделения водорода:
Fe 6HNO3(конц.) → Fe(NO3)3 3NO2 3)Fe 4HNO3(разб.) → Fe(NO3)3 NO
3)Fe 4HNO3(разб.) → Fe(NO3)3 NO 3)2Fe 6H2SO4(конц.) → Fe2(SO4)3 3SO2
3)2Fe 6H2SO4(конц.) → Fe2(SO4)3 3SO2 3)
3)
9) Соединения Fe 3 реагируют с железом, медью, восстанавливаясь до Fe 2:
2FeCl3 Fe → 3FeCl2
Fe3O4 Fe → 4FeO
Fe2O3 Fe → 3FeO
Хром
1) Реагирует с кислородом:
4Cr 3O2 → 2Cr2O3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cr H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
2Cr 3H2O → Cr2O3 3H2 (t)
4) Не реагирует с щелочами
Cr NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Cr 3Cl2 → 2CrCl3 (образуется соль Fe 3)
2Cr 3Br2 → 2CrBr3 (образуется соль Fe 3)
Cr S → Cr2S3 (образуется соль Fe 3)
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Cr H2SO4 (разб.) → CrSO4 H2 2)Cr 2HCl → CrCl2 H2
2)Cr 2HCl → CrCl2 H2 2)
2)
7) Пассивируется концентрированными растворами серной и азотной кислот (реакция идут только при нагревании)
Cr 6HNO3(конц.) → Cr(NO3)3 3NO2

Медь
1) Реагирует с кислородом:
2Cu O2 → 2CuO
2) Реагирует с соединениями Cu 2 с образованием промежуточной степени окисления 1:
CuO Cu → Cu2O
CuCl2 Cu → 2CuCl
3) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cu H2 → реакция не идет
4) Не реагирует с парами воды (так как находится в ряду напряжений после водорода):
Cu H2O → реакция не идет
5) Не реагирует с щелочами
Cu NaOH → реакция не идет
6) Реагирует с кислородом, серой, галогенами при нагревании:
Cu Cl2 → CuCl2 (образуется соль Cu 2)
Cu Br2 → CuBr2 (образуется соль Cu 2)
2Cu I2 → 2CuI (образуется соль Cu 1)
Cu S → CuS (образуется соль Cu 2)
7) Не реагирует с N2, C, Si.
8) Не реагирует с кислотами-неокислителями, так как находится правее водорода в ряду напряжений:
Cu H2SO4(р) → реакция не идет.
9) Реагирует с кислотами-окислителями как слабый восстановитель:
Cu 4HNO3(конц.) → Cu(NO3)2 2NO2


Цинк
1) Реагирует с кислородом: 2Zn O2 → 2ZnO
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с парами воды, т.е. при сильном нагревании, с образованием оксида:
Zn H2O → ZnO H2
4) Реагирует с твердыми щелочами и растворами щелочей с выделением водорода (также Be и Al):
Zn 2NaOH(тв.) → Na2ZnO2 H2 (t)
Zn 2NaOH 2H2O → Na2[Zn(OH)4] H2
5) Реагируют с галогенами, серой при нагревании:
Zn Cl2 → ZnCl2
Zn S → ZnS
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Zn H2SO4 (разб.) → ZnSO4 H2
8) Реагирует с кислотами-окислителями:
4Zn 5H2SO4(конц.) → 4ZnSO4 H2S
Так как Zn находится примерно в центре ряда напряжений, то в реакциях с азотной кислотой могут образовываться разные продукты:
Zn 4HNO3(конц.) → Zn(NO3)2 2NO2
4Zn 10HNO3(разб.) → 4Zn(NO3)2 NH4NO3 3H2O.
Взаимодействие металлов друг с другом
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
3Cu Au = Cu3Au
Взаимодействие металлов с кислотами
Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
2Al 6HCl = 2AlCl3 3 H2↑
Zn 2HCl = ZnCl2 2H2↑
Fe H2SO4 = FeSO4 H2↑
Неактивные металлы взаимодействуют с кислотами при особых условиях. Так, концентрированная серная кислота способна растворять медь (1), а при взаимодействии меди с концентрированной азотной кислотой в зависимости от её концентрации (60% или 30%) образуются различные продукты реакции (2, 3):
Cu 2H2SO4 = CuSO4 SO2↑ 2H2O (1)
Cu 4HNO3(60%) = Cu(NO3)2 2NO2↑ 2H2O
3Cu 8HNO3(30%) = 3Cu(NO3)2 2NO↑ 4H2O
Металл азот
С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании
Металл вода
С водой — гидроксиды. Активные металлы (щелочные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода
- 2Nа 2Н2О = 2NаОН Н2
- Са 2Н2О = Са(ОН)2 Н2
Металл водород
С водородом самые активные металлы образуют ионные гидриды — солеподобные вещества, в которых водород имеет степень окисления -1.
Металл галогены
С галогенами металлы образуют соли галогеноводородных кислот:
Металл кислород
С кислородом большинство металлов образует оксиды — амфотерные и основные:
- 4Li O2= 2Li2O
- 4Al 3O2 = 2Al2O3
Щелочные металлы, за исключением лития, образуют пероксиды:
Металл углерод
С углеродом образуются карбиды
Металл фосфор
С фосфором — фосфиды
Полезные ссылки
Источник материала
Получение кислорода
Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 MnO2 O2↑
4K2Cr2O7 = 4K2CrO4 2Cr2O3 3 O2↑
2KNO3 = 2KNO2 O2↑
2KClO3 = 2KCl 3 O2↑
Физические свойства кислорода
Кислород – самый распространенный элемент на земле (47% по массе). В воздухе содержание кислорода составляет 21% по объему. Кислород – составная часть воды, минералов, органических веществ. В растительных и животных тканях содержится 50 -85 % кислорода в виде различных соединений.
В свободном состоянии кислород представляет собой газ без цвета, вкуса и запаха, плохо растворимый в воде (в 100 л воды при 20![]()
Химические свойства кислорода
Кислород является сильным окислителем, т.к. для завершения внешнего электронного уровня ему не хватает всего 2-х электронов, и он легко их присоединяет. По химической активности кислород уступает только фтору. Кислород образует соединения со всеми элементами кроме гелия, неона и аргона.
Непосредственно кислород нее вступает в реакции взаимодействия с галогенами, серебром, золотом и платиной (их соединения получают косвенным путем). Почти все реакции с участием кислорода – экзотермические. Характерная особенность многих реакций соединения с кислородом — выделение большого количества теплоты и света. Такие процессы называют горением.
Взаимодействие кислорода с металлами. Со щелочными металлами (кроме лития) кислород образует пероксиды или надпероксиды, с остальными – оксиды. Например:
4Li O2 = 2Li2O;
2Na O2 = Na2O2;
K O2 = KO2;
2Ca O2 = 2CaO;
4Al 3O2 = 2Al2O3;
2Cu O2 = 2CuO;
3Fe 2O2 = Fe3O4.
Взаимодействие кислорода с неметаллами. Взаимодействие кислорода с неметаллами протекает при нагревании; все реакции экзотермичны, за исключением взаимодействия с азотом (реакция эндотермическая, происходит при 3000![]()
4P 5O2 = 2P2O5;
S O2 = SO2;
С O2 = СО2;
2Н2 O2 = 2Н2О;
N2 O2 ↔ 2NO – Q.
Взаимодействие со сложными неорганическими веществами. При горении сложных веществ в избытке кислорода образуются оксиды соответствующих элементов:
2H2S 3O2 = 2SO2↑ 2H2O (t![]() 3 3O2 = 2N2↑ 6H2O (t
3 3O2 = 2N2↑ 6H2O (t![]() 3 3O2 = 2N2↑ 6H2O (t
3 3O2 = 2N2↑ 6H2O (t 3 5O2 = 4NO↑ 6H2O (t
3 5O2 = 4NO↑ 6H2O (t![]() 3 4O2 = 2H3PO4 (t
3 4O2 = 2H3PO4 (t![]() 3 4O2 = 2H3PO4 (t
3 4O2 = 2H3PO4 (t
SiH4 2O2 = SiO2 2H2O;
4FeS2 11O2 = 2Fe2O3 8 SO2↑ (t![]()
Кислород способен окислять оксиды и гидроксиды до соединений с более высокой степенью окисления:
2CO O2 = 2CO2 (t![]() 2 O2 = 2SO3 (t
2 O2 = 2SO3 (t![]() 2 O2 = 2SO3 (t
2 O2 = 2SO3 (t 2O5);
2O5);
2NO O2 = 2NO2;
4FeO O2 = 2Fe2O3 (t![]()
Взаимодействие со сложными органическими веществами. Практически все органические вещества горят, окисляясь кислородом воздуха до углекислого газа и воды:
CH4 2O2 = CO2↑ H2O.
Кроме реакций горения (полное окисление) возможны также реакции неполного или каталитического окисления, в этом случае продуктами реакции могут быть спирты, альдегиды, кетоны, карбоновые кислоты и другие вещества:
Окисление углеводов, белков и жиров служит источником энергии в живом организме.
Химические свойства металлов
Урок посвящён изучению химических свойств металлов: реакциям взаимодействия с простыми веществами (кислородом, серой, галогенами), а также со сложными веществами (водой, кислотами, солями). В этом видеофрагменте приведены основные уравнения химических реакций, характеризующие химические свойства металлов. Каждая реакция дополняется либо рисунком, либо опытом. Кроме этого, все реакции рассматриваются с позиции процессов окисления – восстановления.
Химические свойства металлов
Сегодня
мы с вами изучим общие химические свойства металлов.
В
реакциях металлы проявляют восстановительные свойства, то есть они отдают
электроны и превращаются в положительные ионы, сами при этом окисляются.
Сначала
разберём реакции металлов с простыми веществами – неметаллами.
Например,
с кислородом взаимодействуют практически все металлы, кроме золота и
платины, при этом образуются оксиды.
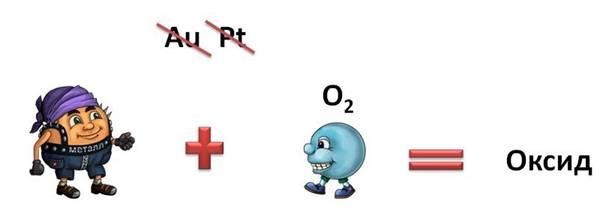
Щелочные
и щелочноземельные металлы при обычной температуре легко окисляются на воздухе,
поэтому их обычно хранят в закрытых сосудах или под слоем масла.

Так,
в реакции лития с кислородом воздуха образуется оксид лития, при
этом литий повышает свою степень окисления с 0 до 1, а кислород понижает свою
степень окисления с 0 до -2, литий является восстановителем, а кислород
– окислителем, четыре атома лития отдают по одному электрону молекуле
кислорода.
В
реакции кальция с кислородом, кальций также повышает свою степень
окисления с 0 до 2, а кислород понижает свою степень окисления с 0 до -2.
Металл кальций выступает в роли восстановителя, а кислород – в роли
окислителя, при этом два атома кальция отдают по два электрона молекуле
кислорода. В результате реакции образуется оксид кальция.

Такие
металлы, как алюминий, цинк, свинец при обычной температуре реагируют с
кислородом воздуха, покрываясь тонкой плёнкой оксида, которая защищает
их от дальнейшего окисления. Слой оксида, образующегося на поверхности
алюминия, настолько тонок, что металл не теряет своего блеска. Так, в реакции алюминия
с кислородом, образуется оксид алюминия, алюминий повышает свою
степень окисления с 0 до 3, являясь при этом восстановителем, а кислород,
наоборот, понижает свою степень окисления с 0 до -2. В этой реакции четыре
атома алюминия отдают по три электрона молекуле кислорода.

Многие
металлы взаимодействуют с кислородом при нагревании: например, медь
при нагревании на воздухе чернеет, так как покрывается плёнкой чёрного
оксида меди два.
В
этой реакции медь выступает в роли восстановителя и повышает свою степень
окисления с 0 до 2, а кислород – окислитель, понижает свою степень окисления с
0 до -2. При этом два атома меди отдают по два электрона молекуле кислорода.
При
прокаливании железа образуется железная окалина – это смешанный оксид,
который состоит из оксида железа два и оксида железа три.
Железо,
в данном случае, является восстановителем, оно повышает свою степень окисления
с 0 до 2 и 4, значит, железо – это восстановитель, а кислород – окислитель,
он понижает свою степень окисления с 0 до -2. В этой реакции три атома железа
отдают восемь электронов молекуле кислорода.

А
вот магний при поджигании на воздухе сгорает яркой вспышкой, образуя
оксид магния.
Магний
также является восстановителем, потому что повышает свою степень окисления с 0 до
2, а кислород понижает свою степень окисления с 0 до -2 и является
окислителем. В результате реакции образуется оксид магния, а два атома магния
отдают по два электрона молекуле кислорода.

Таким
образом, большинство металлов реагируют с кислородом с образованием оксидов,
активные металлы вступают во взаимодействие с кислородом при обычных условиях,
менее активные при нагревании, а такие, как золото или платина не реагируют с
кислородом.
Металлы
в этих реакциях являются восстановителями и, соответственно, повышают свою
степень окисления, а кислород является окислителем и понижает свою степень
окисления.
С
серой все металлы, кроме золота, способны
взаимодействовать при незначительном нагревании, образуя сульфиды:

В
реакции натрия с серой образуется сульфид натрия, натрий повышает
свою степень окисления с 0 до 2, он является восстановителем, сера является
окислителем и понижает свою степень с 0 до -2. В результате
взаимодействия два атома натрия отдают по одному электрону молекуле серы.
В
реакции кальция с серой образуется сульфид кальция, кальций также
повышает свою степень окисления с 0 до 2, являясь при этом восстановителем, а
сера понижает свою степень окисления с 0 до -2 и является окислителем, при
этом, каждый атом кальция отдаёт по два электрона молекуле серы.
А
в реакции железа с серой образуется сульфид железа два. Здесь
также железо является восстановителем, повышает свою степень окисления с 0 до
2, а серя, являясь окислителем, понижает свою степень окисления с 0 до -2.
Каждый атом железа здесь отдаёт по два электрона молекуле серы.

Если
смешать небольшое количество порошка алюминия с порошком серы и нагреть
сверху смесь пламенем лучинки, то в результате бурной реакции образуется сульфид
алюминия:
Алюминий
выступает в роли восстановителя и повышает свою степень окисления с 0 до 3, а
сера понижает свою степень окисления с 0 до -2 и является окислителем. В этой
реакции два атома алюминия отдают по три электрона молекуле серы.

Таким
образом, с серой при определённых условиях реагируют все металлы кроме золота,
в результате этого взаимодействия образуются сульфиды, в которых степень
окисления серы равна мину двум. В этих реакциях металлы выступают в роли
восстановителей, а сера – в роли окислителя.
C
фтором,
хлором, бромом и йодом – металлы
реагируют с образованием галогенидов.

Так,
в реакции алюминия с йодом образуется йодид алюминия, а
катализатором в этой реакции является вода.
В
этой реакции алюминий также повышает свою степень окисления с 0 до 4, являясь
при этом восстановителем, а йод является окислителем и понижает свою степень
окисления с 0 до -1. При этом два атома алюминия отдают по три электрона
молекуле йода.

Таким
образом, в реакциях с галогенами, металлы являются восстановителями и повышают
свою степень окисления, а сами галогены являются окислителями и понижают свою
степень окисления, при этом металлы окисляются, а галогены восстанавливаются. В
результате этих реакций образуются галогениды.
Металлы
не только реагируют с неметаллами – простыми веществами, но и вступают в
реакции со сложными веществами.
Например,
с водой эффективно реагируют щелочные и щелочноземельные металлы.
Если натрий поместить в ёмкость с водой, в которую добавили несколько
капель фенолфталеина, то он будет двигаться по поверхности воды, бурно
реагируя с ней. При этом выделяется водород и образуется гидроксид натрия,
окрашивающий фенолфталеин в малиновый цвет.
Металлический
натрий выступает в качестве восстановителя, он повышает свою степень окисления
с 0 до 1, а ионы водорода выступают в качестве окислителя и водород понижает
свою степень окисления с 1 до 0. В этой реакции два атома натрия отдают по
одному электрону ионам водорода.

Некоторые
металлы взаимодействуют с водой при определённых условиях, например, цинк
– при нагревании, железо – в раскалённом виде с парами воды. При этом
образуются оксиды металлов и выделяется водород.
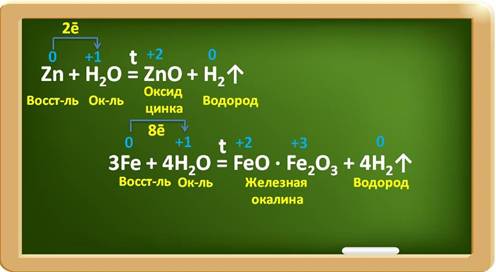
Так,
в реакции с цинком образуется оксид цинка и водород. Цинк при этом,
являясь восстановителем, повышает свою степень окисления с 0 до 2 и отдаёт по
два электрона ионам водорода. Катионы водорода выступают в роли окислителя и
понижают свою степень окисления с 1 до 0. В реакции с железом, аналогично,
железо является восстановителем, повышает свою степень окисления с 0 до 2 и
3, при этом три атома железа отдают по восемь электронов ионам водорода, а
ионы водорода понижают свою степень окисления с 1 до 0 и являются
окислителями.
Если
металл стоит в ряду активности после водорода, то он не вытесняет водород из
воды ни при каких условиях.

Таким
образом, щелочные и щелочноземельные металлы реагируют с водой с образованием
щелочей, при этом выделяется водород, некоторые металлы реагируют с водой
только при нагревании, при этом образуются оксиды и выделяется водород, а
металлы, стоящие в ряду активности после водорода не реагируют с водой. В этих
реакциях металлы выступают в роли восстановителей, а ионы водорода – в роли
окислителя.
Металлы
реагируют и с кислотами. Активность металлов при взаимодействии с
растворами кислот зависит от положения металла в ряду активности.
Металлы, стоящие в ряду активности до водорода, способны вытеснять водород
из разбавленных растворов кислот.
Следует
учитывать и следующее металл реагирует с кислотой:
·
металл
должен стоять в ряду активности до водорода
·
если
образуется растворимая соль
·
концентрированная
серная и азотная кислота любой концентрации иначе реагируют с металлами, при
этом водород не выделяется
·
на
щелочные металлы это правило не распространяется, так как они реагируют активно
с водой, а речь в данном случае идёт о растворах кислот
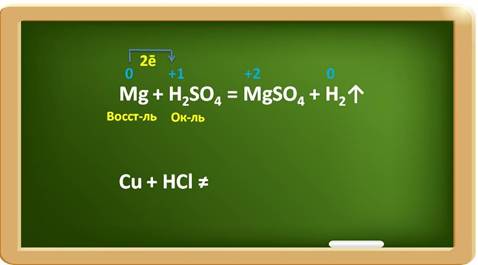
Например,
в реакции магния с раствором серной кислоты, магний выступает в роли
восстановителя, а ионы водорода в качестве окислителя.
При
этом магний повышает свою степень окисления с 0 до 2, а водород понижает свою
степень окисления с 1 до 0. Каждый атом магния отдаёт по два электрона ионам
водорода.
Металлы,
стоящие в ряду активности после водорода, к такому взаимодействию не способны:
Например,
медь стоит в ряду активности после водорода, поэтому она не реагирует с
раствором соляной кислоты.
Если
налить в две пробирки растворы кислот: в первую – раствор соляной кислоты,
во вторую – раствор серной кислоты, а затем поместить в каждую по грануле
цинка, то в результате у нас появляются пузырьки газа и в первой, и
во второй пробирке. Значит, цинк стоит в ряду активности металлов до
водорода, поэтому он способен вытеснять водород из раствора кислот.
Цинк
в обеих реакциях является восстановителем, он повышает свою степень окисления с
0 до 2, а водород понижает свою степень окисления с 1 до 0, при этом выступая
в роли окислителя. В этих двух реакциях атом цинк отдаёт по два электрона ионам
водорода.

Следует
помнить, что металлы, стоящие в ряду активности до водорода, реагируют с
растворами кислот, но в результате этих реакций должна образоваться растворимая
соль, на щелочные металлы эти правила не распространяются, концентрированная
серная и азотная кислота любой концентрации иначе реагируют с металлами.
Металлы
реагируют с растворами солей, при этом нужно также использовать ряд
активности металлов: более активный металл способен вытеснять другой металл
из раствора соли, однако при этом должна образоваться растворимая соль и
щелочные металлы брать нельзя, потому что они реагируют с водой, а реакции эти
протекают в растворе.
Если
в две пробирки налить раствора сульфата меди (II) и поместить в первую
кусочек железа, а во вторую гранулу цинка, то реакция будет у нас
идти в двух пробирках. На кусочке железа и грануле цинка оседает медь
и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на
жёлтую, во второй – с голубой на более светлую.
В
этой реакции железо выступает в роли восстановителя, само при этом окисляясь.
Атомы железа превращаются в ионы железа. Ионы меди выступают в роли
окислителя, они восстанавливаются, превращаясь в атомы меди. В
результате окислительно-восстановительной реакции электроны от атомов железа
переходят к ионам меди.
Во
второй реакции, в роли восстановителя выступает цинк, сам он окисляется,
атомы цинка превращаются в ионы цинка, ионы меди выступают в роли
окислителя, ионы меди восстанавливаются и превращаются в атомы меди,
электроны от атомов цинка переходят к ионам меди.

Следовательно,
металлы реагируют и с растворами кислот, но нужно помнить, что каждый металл
вытесняет из раствора соли другой металл, стоящий правее него в ряду напряжений
металлов, при этом должна образоваться растворимая соль и щелочные металлы
брать нельзя, так как они реагируют с водой.
Сделаем
вывод:
·
металлы
реагируют с простыми веществами, такими, как:
·
кислород
·
сера
·
галогены
·
со
сложными:
·
вода
·
кислоты
·
соли
Химические свойства неметаллов
Взаимодействие с металлами. В этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
- 2Na Cl2 = 2NaCl
- Fe S = FeS
- 6Li N2 = 2Li3N
- 2Ca O2 = 2CaO
Взаимодействие с другими неметаллами. Взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения — ковалентные гидриды.
- 3H2 N2 = 2NH3
- H2 Br2 = 2HBr
Взаимодействуя с кислородом, все неметаллы, кроме фтора, проявляют восстановительные свойства.
- S O2 = SO2
- 4P 5O2 = 2P2O5
При взаимодействии с фтором фтор является окислителем, а кислород — восстановителем.
Неметаллы взаимодействуют между собой: более электроотрицательный металл играет роль окислителя, менее электроотрицательный — роль восстановителя.
- S 3F2 = SF6
- C 2Cl2 = CCl4
