2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C≡ | R-COOH | -COOMe |
| CH≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C≡, поэтому образуется уксусная кислота:
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
| Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C≡, поэтому образуется соль уксусной кислоты – ацетат калия |
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
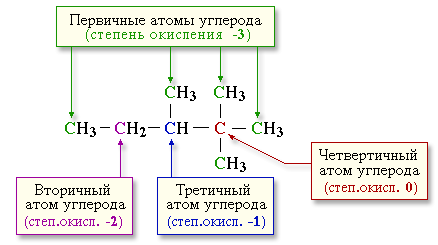
5.4. Реакции окисления алканов
2.5.4. Реакции окисления алканов
В органической химии реакции окисления и восстановления рассматриваются как реакции, связанные с потерей и приобретением органическим соединением атомов водорода и кислорода. Эти процессы, естественно, сопровождаются изменением степеней окисления атомов (часть I, раздел 6.4.1.6).
Окисление органического вещества – введение в его состав кислорода
и (или) отщепление водорода. Восстановление – обратный процесс (введение
водорода и отщепление кислорода).
Учитывая состав алканов (СnH2n 2), можно сделать
вывод о их неспособности
вступать в реакции восстановления, но возможности участвовать в реакциях
окисления.
Алканы – соединения с низкими степенями окисления углерода, и в зависимости от условий реакции они могут окисляться с образованием различных соединений.
При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.). При внесении в открытое пламя алканы горят. При этом в избытке кислорода происходит их полное окисление до СО2
, где углерод имеет высшую степень окисления 4, и воды. Горение углеводородов приводит к разрыву всех связей С-С и С-Н и сопровождается выделением большого количества тепла(экзотермическая реакция).
Примеры:
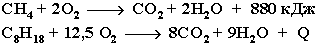
Низшие (газообразные) гомологи – метан, этан, пропан, бутан – легко воспламеняются и образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее.
Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Уравнение реакции горения алканов в общем виде:
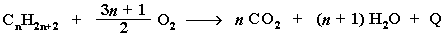
Из этого уравнения следует, что с увеличением числа углеродных атомов (n) в алкане увеличивается количество кислорода, необходимого для его полного окисления. При горении высших алканов (n >>1) кислорода, содержащегося в воздухе, может оказаться недостаточно для их полного окисления до СО2. Тогда образуются продукты частичного окисления:
угарный газ СО (степень окисления углерода 2),
сажа (мелкодисперсный углерод, нулевая степень окисления).
Поэтому высшие алканы горят на воздухе коптящим пламенем, а выделяющийся попутно токсичный угарный газ (без запаха и цвета) представляет опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
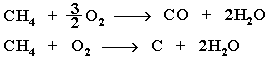
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С-С и С-Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов. Например, при неполном окислении бутана (разрыв связи С2-С3) получают уксусную кислоту:
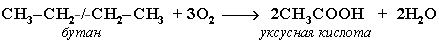
Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12-С18, которые используются для получения моющих
средств и поверхностно-активных веществ.
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом — «синтез-газ»:

Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp2 и sp3-гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp2 | sp3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н , т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
| Ацетилен и его гомологи с тройной связью на конце молекулы R–C≡C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов. |
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
| Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия. |
| Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия. |
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
| Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы. |
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Исследование кинетики окисления бутана на mn-la-alsi блочном катализаторе
УДК 544.42.032
ИССЛЕДОВАНИЕ КИНЕТИКИ ОКИСЛЕНИЯ БУТАНА НА Mn-La-AISi БЛОЧНОМ КАТАЛИЗАТОРЕ
STUDY OXIDATION KINETICS OF BUTANE OF Mn-La-AISi BLOCK CATALYSTS
Гаврилова АннаАлексеевна1, аспирант, e-mail: zri@catalysis.ru
Gavrilova Anna A.aspirant Яшник Светлана Анатольевна1, канд.хим. наук, с. н. е., e-mail: zri@catalysis.ru
Yashnik Svetlana А. C.Sc.(chemical) Шикина Надежда Васильевна1, научный сотрудник, e-mail: zri@catalysis.ru
Shikina Nadejda V. researcher Теряева Татьяна Николаевна3, докт. техн. наук, профессор,
e-mail: tnt.tppm@kuzstu.ru Teryaeva Tatyana N.3, Dr.Sc. (Engineering), professor Исмагилов Зинфер Ришатович член-корреспондент РАН, директор института, зав. кафедрой, e-mail: zinferl@mail.ru
Ismagilov Zinfer R. Corresponding member of the RAS
1 Институт катализа им. Г.К.Борескова СОР АН, проспект Лаврентьева, 5, г. Новосибирск, Россия, 630090
1 Boreskov institute of catalysis, pr. Lavrentieva 5, Novosibirsk, Russia, 630090
2 Институт углехимии и химического материаловедения ФИЦ СО РАН, проспект Советский, 18, г. Кемерово, Россия, 650000
2 Institute of Coal Chemistry and Material Science SB RAS, Russia, 650000, Kemerovo, Sovietsky Av., 18
3 Кузбасский государственный технический университет имени Т.Ф. Горбачева, ул. Весенняя,28, г. Кемерово, Россия, 650000
3 T.F. Gorbachev Kuzbass State Technical University, 28 street Vesennyaya, Kemerovo, Russia, 650000
Аннотация: Представлены результаты экспериментального исследования кинетики гетерогенно-каталитического окисления бутана кислородом воздуха при варьировании размера зерна катализатора, линейной скорости газового потока, времени контакта. Определены значения наблюдаемой энергии активации, установлены кинетические параметры окисления бутана в присутствии (Mn02 La203)/AlSi катализатора, подобраны оптимальные условия для исследования каталитической активности образцов, обеспечивающие проведение реакции в кинетической области.
Abstract. The results of experimental studies of the kinetics of heterogeneous catalytic oxidation of methane by oxygen air by varying the grain size of the catalyst, the linear velocity of the gas flow, the contact time. The values of the observed activation energy, kinetic parameters established butane oxidation in the presence of (Mn02 La203) / AISi catalyst, optimal conditions for the study of the catalytic activity of samples to ensure carrying out the reaction in the kinetic region.
Ключевые слова: оксидные катализаторы, глубокое окисление углеводородов, кинетические параметры
Keywords: oxide catalysts, deep oxidation of hydrocarbons, kinetic parameters
ВВЕДЕНИЕ
Проблема каталитического сжигания, как альтернатива термического горения, является в последнее время весьма актуальной. Прежде всего, это связано с усилением требований к экологической чистоте сжигания углеводородных топлив и существенному снижению вредных выбросов в атмосферу. Использование катализаторов для
сжигания топлив позволяет уменьшить эмиссию вредных выбросов в атмосферу, снизить концентрацию СО, N0* и углеводородов в дымовых и отходящих газах тепловых электростанций, промышленных предприятий и теплогенерирующих устройств [1-10].
К эффективным катализаторам сжигания углеводородных топлив относятся: (1) благородные
металлы (Pt,Pd) [11], но их использование ограниченно из-за высокой стоимости и склонности к дезактивации при высоких температурах [5]; (2) оксидные катализаторы на основе индивидуальных и сложных оксидов переходных металлов [12-15], которые являются более экономичной альтернативой благородным металлам, но склонные к спеканию и образованию фаз взаимодействия с носителем при повышенных температурах; и (3) смешанные катализаторы, содержащие благородные металлы и оксиды переходных металлов, зачастую обладающие синергетическим эффектом в каталитическом окислении углеводородов [16-20].
Ранее нами были синтезированы и исследованы физико-химические свойства наноструктури-рованных катализаторов на основе индивидуальных и смешанных оксидов переходных металлов (Mn, Fe, Со, Си), модифицированных добавкой оксида La и нанесенных на блочные алюмосили-катные носители [10, 20]. Для корректной постановки экспериментов по изучению и сравнению каталитической активности катализаторов, различающихся природой активного компонента и методами приготовления, необходимо исключить процессы массопереноса и теплопереноса. Известно, что как внешняя, так и внутренняя диффузия реагентов и продуктов реакции могут оказывать существенное влияние на наблюдаемую кинетику реакции [21-23], приводя к изменению энергии активации и константы скорости реакции.
Целью настоящей работы было исследование кинетики гетерогенно-каталитического окисления бутана кислородом воздуха на (Mn02 La2Cb)/AlSi катализаторе и выбор условий проведения процесса в кинетической области. Данный катализатор был выбран на основании анализа совокупности данных, полученных нами ранее [10], при исследовании текстурных свойств и фазового состава активного компонента ряда катализаторов, а также с учетом высокой каталитической активности марганецсодержащих катализаторов в реакциях глубокого окисления углеводородов [12, 13, 20].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез катализатора
В качестве носителя использовали керамический блок сотовой структуры из алюмосиликатной керамики с размером каналов 2×2 мм, толщиной стенок 0,5 мм, удельной поверхностью 13,5 м2/г, влагоемкость ~ 0,2 мл/г.
Катализатор был приготовлен методом пропитки по влагоемкости фрагмента блока раствором смеси азотнокислых солей Мп^Оз^’бНгО и Ьа(Ы0з)з’6Н20 с последующей отдувкой сжатым воздухом, сушкой под лампой ИК и прокаливанием при температуре 450 °С четыре часа. Суммарное содержание оксидов 5 мае. %. В тексте образец обозначен (Mn02 La203)/AlSi.
Исследование кинетики окисления бутана
Кинетику глубокого окисления бутана на (Mn02 La203)/AlSi катализаторе изучали на лабораторной установке с проточным кварцевым реактором при температурах от 200 до 600 °С. Для кинетических измерений фрагмент блока измельчали и использовали определенную фракцию.
Для определения возможного вклада внутри-диффузионного торможения опыты проводили с варьированием среднего размера фракции (зерна) катализатора от 0,375 до 1,75 мм, при постоянных: объеме катализатора (1 см3), скорости потока (200 см3/мин), и времени контакта (х 0,30 с). За средний размер фракции (dcp) принято средневзвешенное значение, которое рассчитывали путем усреднения размеров узких фракций и с учетом их массовых долей. Для этого навеску катализатора рассеивали на отдельные фракции с более узким интервалом размеров зерна, определяли ее массу и рассчитывали ее массовую долю. Например, dcp 0,76 мм рассчитано из рассева фракции размером 0,5-1 мм (табл. 1) на фр>1 — доля 0,02; фр 1-0,8 -0,43; фр 0,8-0,5 — 0,51; фр<0,5 — 0,04.
Таблица 1. Фракционный состав катализатора и
рассчитанный средний размер зерна Table 1. Fractional composition of the catalyst and calculated the average grain size
Фракция катализатора, мм dcp, мм
0,25-0,5 0,375
0,5-1 0,760
1-1,25 1,125
1,5-2 1,750
Влияние внешнедиффузионных торможений на скорость реакции исследовали на фракции катализатора 0,5-1 мм путем варьирования линейной скорости газового потока при постоянном времени контакта т 0,30 с, что достигали пропорциональным изменением объёма катализатора в пределах 0,5 — 2см3 и скорости потока в пределах 100 до 400 см3/мин.
В кинетической области эксперименты проводили при варьировании времени контакта т в интервале от 0,15 до 0,30 с на фракции катализатора 0,5-1 мм. Для этого изменяли объем катализатора от 0,5 до 1 см3 при постоянной скорости потока 200 см3/мин.
Исходная реакционная смесь содержала 1об.% С4Н10 в воздухе, коэффициент избытка кислорода (а) составлял 3, т.е. концентрацию кислорода считали постоянной при небольших конверсиях бутана (до 20 %).
Анализ газовой реакционной смеси до и после реактора проводили на газовом хроматографе ЛХМ- 8МД с помощью детектора по теплопроводности.
Для разделения бутана и диоксида углерода использовали колонку с Poropak Т при температуре 110 °С. Газ носитель Не, скорость потока — 30 см3/мин.
При тестировании катализаторов рассматривали гетерогенно-каталитическую реакцию (I):
kat
С4Н10 13/202 —>4СОг 5НгО (I)
В ходе эксперимента определяли концентрацию бутана при разных температурах, на основе которых рассчитывали степень превращения (конверсию) бутана (л:): (1)
v _ СС4Н10~СС4НЮ m
х — r0 VU
С4НЮ
где С°с4ню -исходная концентрация бутана; Сс4ню-текущая концентрация бутана.
С использованием экспериментальных данных по конверсии бутана вычисляли константу скорости (к, с»1) и строили Аррениусовские зависимости lnk=F(l/T), предполагая режим идеального вытеснения и первый порядок реакции по бутану. Для этого использовали уравнение описывающее скорость окисления бутана (2):
w=kCnc4HioCmo2 (2)
где w- скорость реакции; ¿-константа скорости реакции; Сс4ню- текущая концентрация бутана; Со2- текущая концентрация кислорода; п- порядок реакции по С4Н10, равный 1; т- порядок реакции по О2, равный 0.
Для расчета константы скорости (к, с1) реакции использовали уравнение (3): -1п( 1-х) к= (3)
где ^-конверсия С4Н10; г-время контакта (с).
Константа скорости и наблюдаемая энергия активации Еа связаны между собой уравнением Аррениуса (4):
Еа
к= ко е RT (4)
где к- константа скорости реакции; ко- предэкспо-ненциальный множитель; Еа- энергия активации; R- газовая постоянная; Т- температура;
Использование уравнения Аррениуса (4) в логарифмическом виде позволило графическим способом определить значения наблюдаемых энергий активации (Еа, кДж/моль) и предэкспонециального множителя (ко, с»1).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние внутридиффузионного торможения на кинетику реакции
Влияние внутридиффузионных торможений на кинетику реакции окисления бутана на (Mn02 La203)/AlSi катализаторе исследовали путем варьирования гранулометрического состава катализатора, а именно среднего размера зерна катализатора (dcp) от 0,375 до 1,75 мм. Конверсия бутана существенно зависит от гранулометрического состава катализатора, в частности при оди-
наковых экспериментальных условиях конверсия бутана снижается при увеличении размера гранул (рис.1). Максимальные расхождения в конверсии бутана наблюдаются в высокотемпературной области. Следовательно, при использовании гранул катализатора размера 1,75 мм и более, реальная кинетика окисления бутана может включать в себя торможение реакции за счет внутренней диффузии.
100-80-
ó
60-
0
к
1 40-ф
0
1 о
* 20-0-
Рис. 1. Температурные зависимости конверсии бутана на (Mn02 La203)/AlSi катализаторе со средним размером фракции катализатора:0,760 мм
(1) и 1,75 мм (2). C°c4Hio=l об.%, скорость потока 200 см3/мин, объем фракции 1 см3. Fig. 1. Temperature dependence on the methane conversion (МпОг ЬагОз) / AIS i catalyst with an average catalyst size fractions: 0.760 mm (1) and 1.75 mm (2).
C°c4Hio = 1 vol.%, the flow rate 200 cm3/min, fraction volume 1 cm3.
Для наглядности влияния внутри-диффузионных торможений на кинетику реакции окисления бутана, на рис. 2 представлены зависимости степени превращения бутана при 400 и 430 °С от среднего размера гранул катализатора. Из данных рис.2 видно, что при температуре 400 °С (кр.1) уменьшение размера зерна катализатора dcp от 1,75 до 1,125 мм сопровождается увеличением конверсии бутана, что свидетельствует о наличии внутридиффузионного торможения при dCp>l,125 мм. Дальнейшее уменьшение размера зерна dcp от 1,125 до 0,375 мм не приводит к увеличению конверсии бутана, что свидетельствует об отсутствии внутридиффузионных торможений и протекании реакции в кинетической области [23]. При температуре 430 °С, (рис.2, кр.2) достигаемый уровень конверсии бутана составляет 41-71 %, кинетическая область окисления бутана на (Mn02 La20s)/AlSi катализаторе реализуется при среднем размере зерна в интервале 0,375-0,760 мм.
Температура, ОС
100-80-
в5 о
Х*60-о
20-0-
0,25 0,50 0,75 1,00 1,25 1,50 1,75 dcp,MM
Рис.2. Зависимости конверсии бутана на (Mn02 La203)/AlSi катализаторе от среднего размера (dcp) фракции катализатора при температуре:
400 °С (1) и 430 °С (2). C°c4Hio=l об.%, скорость потока 200 см3/мин, объем фракции 1 см3. Fig.2. Depending on the butane conversion (МпОг ЬагОз) / AISi average size of the catalyst (dcp) catalyst
fraction at 400 °C (1) and 430 °C (2). C°c4hio = 1 vol.%, the flow rate 200 cm3/min, fraction volume 1 cm3.
На основании полученных экспериментальных данных, можно заключить, что максимальный размер зерна, при котором не наблюдается вклад внутридиффузионного торможения,
средневзвешенное значение размера зерна dcp=0,760 мм.
Влияние внешнедиффузионного торможения на кинетику реакции
Для оценки влияния внешнедиффузионного торможения исследовали каталитическую активность (Мп0г Ьа20з)/А181 образца с размером зерна 0,5-1,0 мм при варьировании линейной скорости газового потока и сохранении скорости потока 200 см3/мин, которая соответствует времени контакта 0,30 с. Изменение объема катализатора от 0,5 до 2 см3 позволяло изменять линейную скорость потока от 105 до 420 см/мин. Температурные зависимости конверсии бутана при низких и высоких линейных скоростях газового потока представлены на рис.3. Анализ этих данных показывает, что при увеличении линейной скорости потока в 4 раза, кривые конверсии бутана от температуры практически идентичны.
На рис.4 рассмотрено влияние линейной скорости потока на достигаемую конверсию бутана в области умеренных и повышенных температур: 400 и 430 °С. При температуре 400 °С (кр.1), увеличение скорости потока от 105 см/мин до 210 см/мин приводит к снижению конверсии бутана с 55 % до 47%, дальнейшее увеличение скорости потока до 420 см/мин не оказывает влияния на величину, достигаемой конверсии бутана. При
Т-■-1—1-■-1-■-г
200 250 300 350 400 450 500 Температура, °С
Рис.3.Температурные зависимости конверсии бутана на (Mn02 La203)/AlSi катализаторе при линейной скорости потока (v): 105 см/мин (1) и
420 см/мин (2). С°с4Н1о=1 об.%, скорость потока 200 см3/мин,т-
0,30 с, размер зерна -0,5-1 мм. Fig.3. Temperature dependence on the methane conversion (МпОг ЬагОз) / AISi catalyst at a linear flow velocity (v): 105 cm / min (1) and 420 cm / min (2).
C°c4h10 = 1 vol.%, the flow rate 200 cm3/min, т-0,30 s, grain size -0,5-1 mm.
составляет 0,760 мм. Для дальнейших экспериментов нами была выбрана фракция катализатора с размером 0,5-1,0 мм, которой соответствует
повышении температуры процесса до 430 °С достигаемый уровень конверсии бутана составляет 72±7 %. Увеличение скорости потока от 105
Таблица 2. Значения Еа и ко окисления бутана на (Mn02 La203)/AlSi катализаторе, рассчитанные из
экспериментов с варьированием линейной скорости реакционной смеси Table 2. The values of A and ko, methanol oxidation (МпОг ЬагОз) / AISi catalyst calculated from experiments with varying the linear velocity of the reaction mixture
Объем кат., см3 Линейная скорость и, см/мин Еа, кДж/мОЛЬ ко, с»1
0,5 105 86 4 1,4*107
1,0 210 88±3 1,4*107
2,0 420 71±3 6,3*105
100-80-
х 60″
| 40-
0
100 200 300 400
Линейная скорость и, см/мин
3 2 1 0
л £
-1 -2 -3 -4
1,2 1,3 1,4 1,5 1,6 1,7 1,8 1,9 1*103/Т,К
см/мин до 420 см/мин не приводит к увеличению конверсии бутана, что свидетельствует об отсутствии внешнедиффузионных торможений при данных линейных скоростях.
Для проверки правильности определения области внешнедиффузионных и внутридифузион-ных торможений, графическим способом были рассчитаны наблюдаемые энергии активации и предэкспонециальный множитель (табл.2).
Согласно данным приведенным в табл.2 и на рис.5 экспериментальные точки, соответствующие разным линейным скоростям, хорошо описываются в рамках одной Аррениусовской зависимости с наблюдаемой энергией активации около 85±3 кДж/моль и предэкспоненциальным множителем 9,2*106 с»1, что свидетельствует о прохождение реакции в кинетической области.
На основании полученных экспериментальных данных, можно заключить, что при линейных скоростях газового потока от 105 до 420 см/мин внешнедиффузионное торможение не оказывает влияние на макрокинетику реакции окисления бутана. Для определения кинетических параметров процесса была использована линейная скорость газового потока — 210 см/мин.
Исследование кинетики реакции окисления бутана в кинетической области
Рис.4. Зависимости конверсии бутана Ha(Mn02 La203)/AlSi катализаторе от линейной скорости потока при температуре :400 °С (1) и 430 °С (2).
С°с4ню=1 об.%, скорость потока 200 см3/мин, т-0,30 с, фракция-0,5-1 мм. Fig. 4. Depending on the methane conversion (Mn02 ЬагОз) / AISi catalyst from the linear flow rate at a temperature of 400 °C (1) and 430 °C (2). C°c4hio = 1 vol.%, the flow rate 200 cm3/min, x-0,30 c, fraction- 0.5-1 mm.
Рис.5. Зависимость Ink от 1/T при различной линейной скорости потока: 105 см/мин (1)210 см/мин (2) и 420 см/мин (3). С0с4ню=1 об. %, скорость потока 200 см3/мин, т- 0,30 с, фракция-0,5-1 мм. Линейная аппроксимация константы
скорости от температуры. Fig. 5. Dependence Ink from 1 / T at various linear flow rate of: 105 cm / min (1)210 cm / min (2) and 420 cm / min (3). C°c4hio = 1 vol. %, flow rate 200
cm3 / min, х- 0,30 s, fraction — 0.5-1 mm. Linear approximation of the speed constant versus temperature.
Исключив внешне- и внутреннедиффузные торможения, можно определить наблюдаемую энергию активации и предэкспоненциальный множитель реакции окисления бутана в присутствии (Мп0г Ьа20з)/А181 катализатора, протекающей в кинетической области. Для этого были получены температурные зависимости конверсии бутана при различных временах контакта (рис.6), для катализатора с гранулометрическим размером фракции 0,5-1,0 мм и скорости потока 200 см3/мин.
Уменьшение времени контакта с 0,30 до 0,15 секунды приводит к снижению достигаемых уровней конверсии. При времени контакта 0,30 с, температура 50%-ной конверсии бутана (Т5о% С4ню,°С) составляет 400°С, при времени контакта 0,15 с — Т5о%с4н ю повышается до 440°С.
В таблице 3 приведены значения наблюдаемой энергии активации и предэкспоненциального множителя, рассчитанные из отдельных экспериментов. Анализ этих данных и рис.7 показывает, что при времени контакта 0,15 и 0,30 с экспериментальные точки хорошо описываются в рамках одной Аррениусовской зависимости с наблюдаемой энергией активации около 90±3 кДж/моль и предэкспоненциальным множителем 1,9*107с»1.
X 60-
Рис.6. Температурные зависимости конверсии бутана на (Mn02 La2C>3)/AlSi катализаторе при различных временах контакта(г):г -0,30 с (1),г -0,15 с (2). С°с4ню=1об.%, скорость потока 200 см3/мин, фракция — 0,5-1 мм. Fig. 6. Temperature dependence of the conversion of methane to (МпОг ЬагОз) / AISi catalyst at different contact times (т): т -0,30 with (1),т -0,15 with (2). C°c4Hio = lvol.%, flow rate 200 cm3 / min, fraction — 0.5-1 mm.
Температура, С
почт,к
Рис.7. Зависимость Ink от 1/Т при различных временах контакта: г-0,30 с(1), г-0,15 с (2). С°с4ню=1 об.%, скорость потока 200 см3/мин,
фракция- 0,5-1 мм. Линейная аппроксимация константы скорости от температуры. Figure 7. Dependence Ink of 1/T at different contact times: т -0,30 s (1), x -0,15 s (2). c°c4hi = 1 vol.%, flow rate 200 cm3 / min , fraction — 0.5-1 mm. Linear approximation of the speed constant versus temperature
Таблица 3. Значения Ea и ко окисления бутана на (Mn02 La203)/AlSi катализаторе, рассчитанные из экспериментов с варьированием времен контакта Table 3. The values of Ea and ко butane oxidation (МпОг ЬагОз) / AISi catalyst calculated from experiments with varying contact time
Объем кат., см3 Время контакта, т, с Еа, кДж/моль к0, с1
0,5 0,15 89±6 1,7*107
1,0 0,30 88 3 1,4*107
.Таким образом, для корректного сопоставления активности в окислении бутана катализаторов на основе блочных А181 носителей с нанесенным активным компонентом различного состава можно использовать следующие условия: фракция 0,5-1,0 мм, скорость потока от 100 до 400 см3/мин и времена контакта 0,15-0,30 с, при которых реализует-
ся протекание реакции в кинетической области.
ВЫВОДЫ
Проведены исследования кинетики гетероген-но-каталитического окисления бутана кислородом воздуха на (МпОг ЬагОзУА^ катализаторе и определены условия реализации макрокинетики реакции в кинетической области и исключения внешне- и внутридиффузионных торможений. Для кинетической области определены кинетические параметры Еа и ко. Показано, что для катализатора нанесенного типа на основе блочного А181 носителя кинетический режим окисления бутана реализуется при следующих условиях: гранулометрический состав фракции образца — 0,5-1 мм; скорость потока 200 см3/мин; время контакта — 0,15 -0,30 с. На основании проведенных исследований выбраны оптимальные условия для исследования и сравнения каталитической активности образцов на основе данного носителя с различным составом активного компонента.
СПИСОК ЛИТЕРАТУРЫ
1. Исмагилов, З.Р. Экологически чистое сжигание топлив и каталитическая очистка дымовых газов ТЭС от оксидов азота: состояние и перспективы / З.Р. Исмагилов, М.А. Керженцев // Ж. Всес. хим. о-ва им Д.И. Менделеева. — 1990. — Т. 35. — № 1. — С. 43-54.
2. Ismagilov, Z.R. Catalytic fuel combustion — a way of reducing emission of nitrogen-oxides / Z.R. Ismagilov,
М.А. Kerzhentsev // Catal. Rev.-Sci. Eng. — 1990. — V. 32. — N 1-2. — P. 51-103.
3. Исмагилов, З.Р. Катализаторы и процессы каталитического горения / З.Р. Исмагилов, М.А. Керженцев // Хим. пром. — 1996. — № 3. — С. 197-201.
4. Ismagilov, Z.R. Fluidized bed catalytic combustion / Ismagilov Z.R., Kerzhentsev M.A. // Catalysis Today. -1999. — V. 47. — N 1-4. — P. 339-346.
5. Исмагилов, З.Р. Катализаторы для эффективного сжигания топлива / З.Р. Исмагилов, М.А. Керженцев, С.А. Яшник, Н.В. Шикина // Российские нанотехнологии. — 2009. — Т. 4. — № 11-12. — С. 32-34.
6. Пармон, В.Н. Применение каталитических камер сгорания в газотурбинных установках децентрализованного энергоснабжения / В.Н. Пармон, З.Р. Исмагилов, О.Н. Фаворский, А.А. Белоконь, В.М. Захаров // Вестник РАН. — 2007. — Т. 77. — № 9. — С. 819-827.
7. Исмагилов, З.Р. Разработка и испытание гранулированных катализаторов для камер сгорания газотурбинных установок регенеративного цикла / З.Р. Исмагилов, Н.В. Шикина, С.А. Яшник, А.Н. Загоруйко, С.Р. Хайрулин, М.А. Керженцев, В.Н. Коротких, В.Н. Пармон, Б.И. Брайнин, В.М. Захаров, О.Н. Фаворский // Кинетика и катализ. — 2008. — Т. 49. №6. — С. 922-935.
8. Yashnik, S.A. Structured catalyst and combined reactor loading for methane combustion in a gas turbine power plant / Yashnik S.A., Shikina N.V., Ismagilov Z.R., Zagoruiko A.N., Kerzhentsev M.A., Parmon V.N., Zakha-rov V.M., Braynin B.I., Favorski O.N. and Gumerov A.M. // Catalysis Today. — 2009. — V. 147. — P. 237-243.
9. Ismagilov, Z.R Technology of methane combustion on granulated catalysts for environmentally friendly gas turbine power plants / Ismagilov Z.R., Shikina N.V., Yashnik S.A., Zagoruiko A.N., Kerzhentsev M.A., Ushakov V.A., Sazonov V.A., Parmon V.N., Zakharov V.M., Braynin B.I., Favorski O.N. // Catalysis Today. — 2022. — V. 155. -P. 35-44.
10. Гаврилова, А.А. Структурные, текстурные и морфологические свойства блочных наноструктуриро-ванных катализаторов для воздухонагревателей / А.А. Гаврилова, Н.В. Шикина, В.А. Ушаков, А.В. Ищенко, Н.А. Рудина, З.Р. Исмагилов // Альтернативная энергетика и экология. — 2022. — № 3. — С. 15-24.
11. Hayes, R.E The palladium catalysed oxidation of methane: reaction kinetics and the effect of diffusion barriers / R.E. Hayes, S.T. Kolaczkowski, P.K.C. Li, S. Awdry // Chemical Engineering Science. — 2001. V. 56. — P. 4815-4835.
12. Tsyrulnikov, P.G. Deep Oxidation of Methane on Alumina-Manganese and Pt-Containing Catalysts / P.G. Tsyrulnikov, V.S. Sal’nikov, V.A. Drozdov, A.S. Noskov, N.A. Chumakova, V.K. Ermolaev, I.V. Malakhova // J. Catal. — 2001. — V. 198. — P. 164-171.
13. Цырульников, П.Г. Эффект термоактивации в каталитических системах Мп0х/А1203 для процессов глубокого окисления углеводородов // Российский химический журнал. — 2007. — Т. 51. — № 4. — С. 133-139.
14. Larsson, P. Oxide of copper, ceria promoted copper, manganese and copper manganese on AI203 for the combustion of CO, ethylacetate and ethanol / P. Larsson, A. Andersson // Appl. Catal. A: General. — 2000. — V. 24. — P. 175-192.
15. Zwinkels, M.F.M. Catalytic Materials for High-Temperature Combustion / M.F.M. Zwinkels, S.G. Jaras, P.G. Menon, T.A. Griffin // Catal. Rev.-Sci. Eng. — 1993. -V.35. N 3. — P. 319-358.
16. Yashnik, S.A. Development of monolithic catalysts with low noble metal content for diesel vehicle emission control / S.A. Yashnik, V.V. Kuznetsov, Z.R. Ismagilov, V.A. Ushakov, N.M. Danchenko, S.P. Denisov // Topics in Catal. -2004. — V. 30/31. — P. 293-298.
17. Yashnik, S.A. Dependence of Synergetic Effect of Palladium-Manganese-Hexaaluminate Combustion Catalyst on Nature of Palladium Precursor / S.A. Yashnik, Z.R. Ismagilov // Topics in Catalysis. — 2022. — V. 55. — N. 11-13.-P. 818-836.
18. Carno, J. Mixed manganese oxide/platinum catalysts for total oxidation of model gas from wood boilers / J. Carno, M. Ferrandon, E. Bjornbom, S. Jaras // Appl. Catal. A: Gen. — 1997. — V. 155. — N. 2. — P. 265-281.
19. Grbic, B. Influence of manganese oxide on the activity of Pt/A1203 catalyst for CO and n-hexane oxidation / B. Grbic, N. Radic, B. Markovic, P. Stefanov, D. Stoychev, Ts. Marinova // Applied Catalysis B: Env. — 2006. — V. 64. -P. 51-56.
20. Шикина, Н.В. Наноструктурированные катализаторы блочного типа для глубокого окисления углеводородов / Н.В. Шикина, А.А. Гаврилова, В.А. Ушаков, З.Р. Исмагилов // Вестник КузГТУ. — 2022. — №5. — С.31-39.
21. Иоффе, И.И. Инженерная химия гетерогенного катализа. / И.И. Иоффе, JI.M. Письмен. — Л.: Химия, 1972.-464 с.
22. Боресков Г. К. Гетерогенный катализ. М.: Наука, 1986. — 303 с.
23. Панченков, Г.М. Химическая кинетика и катализ / Г.М. Панченков, В.П. Лебедев. — М.: Химия, 1985. -592 с.
REFERENCES
1. Ismagilov, Z.R. Jekologicheski chistoe szhiganie topliv i kataliticheskaja ochistka dymovyh gazov TJeS ot oksidov azota: sostojanie i perspektivy / Z.R. Ismagilov, M.A. Kerzhencev // Zh. Vses. him. o-va im D.I. Mendeleeva. — 1990.-T. 35.-№ l.-S. 43-54.
2. Ismagilov, Z.R. Catalytic fuel combustion — a way of reducing emission of nitrogen-oxides / Z.R. Ismagilov, M.A. Kerzhentsev // Catal. Rev.-Sci. Eng. — 1990. — V. 32. -N 1-2. — P. 51-103.
3. Ismagilov, Z.R. Katalizatory i processy kataliticheskogo gorenija / Z.R. Ismagilov, M.A. Kerzhencev // Him. prom. — 1996. — № 3. — S. 197-201.
4. Ismagilov, Z.R. Fluidized bed catalytic combustion / Ismagilov Z.R., Kerzhentsev M.A. // Catalysis Today. -1999. — V. 47. — N 1 -4. — P. 339-346.
5. Ismagilov, Z.R. Katalizatory dlja jeffektivnogo szhiganija topliva / Z.R. Ismagilov, M.A. Kerzhencev, S.A. Jashnik, N.V. Shikina // Rossijskie nanotehnologii. — 2009. — T. 4. — № 11-12. — S. 32-34.
6. Parmon, V.N. Primenenie kataliticheskih kamer sgoranija v gazoturbinnyh ustanovkah decentralizovannogo jenergosnabzhenija / V.N. Parmon, Z.R. Ismagilov, O.N. Favorskij, A.A. Belokon1, V.M. Zaharov // Vestnik RAN. -2007. — T. 77. — № 9. — S. 819-827.
7. Ismagilov, Z.R. Razrabotka i ispytanie granulirovannyh katalizatorov dlja kamer sgoranija gazoturbinnyh ustanovok regenerativnogo cikla / Z.R. Ismagilov, N.V. Shikina, S.A. Jashnik, A.N. Zagorujko, S.R. Hajrulin, M.A. Kerzhencev, V.N. Korotkih, V.N. Parmon, B.I. Brajnin, V.M. Zaharov, O.N. Favorskij // Kinetika i kataliz. — 2008. -T. 49. №6. — S. 922-935.
8. Yashnik, S.A. Structured catalyst and combined reactor loading for methane combustion in a gas turbine power plant / Yashnik S.A., Shikina N.V., Ismagilov Z.R., Zagoruiko A.N., Kerzhentsev M.A., Parmon V.N., Zakha-rov V.M., Braynin B.I., Favorski O.N. and Gumerov A.M. // Catalysis Today. — 2009. — V. 147. — P. 237-243.
9. Ismagilov, Z.R Technology of methane combustion on granulated catalysts for environmentally friendly gas turbine power plants / Ismagilov Z.R., Shikina N.V., Yashnik S.A., Zagoruiko A.N., Kerzhentsev M.A., Ushakov V.A., Sazonov V.A., Parmon V.N., Zakharov V.M., Braynin B.I., Favorski O.N. // Catalysis Today. — 2022. — V. 155. -P. 35-44.
10.Gavrilova, A.A. Strukturnye, teksturnye i morfologicheskie svojstva blochnyh nanostrukturirovannyh katalizatorov dlja vozduhonagrevatelej / A.A. Gavrilova, N.V. Shikina, V.A. Ushakov, A.V. Ishhenko, N.A. Rudina, Z.R. Ismagilov // Al’ternativnaja jenergetika i jekologija. — 2022. — № 3. — S. 15-24.
11. Hayes, R.E The palladium catalysed oxidation of methane: reaction kinetics and the effect of diffusion barriers / R.E. Hayes, S.T. Kolaczkowski, P.K.C. Li, S. Awdry // Chemical Engineering Science. — 2001. V. 56. — P. 4815-4835.
12.Tsyrulnikov, P.G. Deep Oxidation of Methane on Alumina-Manganese and Pt-Containing Catalysts / P.G. Tsyrulnikov, V.S. Sal’nikov, V.A. Drozdov, A.S. Noskov, N.A. Chumakova, V.K. Ermolaev, I.V. Malakhova // J. Catal. — 2001. — V. 198. — P. 164-171.
13.Cyrul’nikov, P.G. Jeffekt termoaktivacii v kataliticheskih sistemah Mn0x/A1203 dlja processov glubokogo okislenija uglevodorodov // Rossijskij himicheskij zhurnal. — 2007. — T. 51. — № 4. — S. 133-139.
14.Larsson, P. Oxide of copper, ceria promoted copper, manganese and copper manganese on AI203 for the combustion of CO, ethylacetate and ethanol / P. Larsson, A. Andersson // Appl. Catal. A: General. — 2000. — V. 24. — P. 175-192.
15.Zwinkels, M.F.M. Catalytic Materials for High-Temperature Combustion / M.F.M. Zwinkels, S.G. Jaras, P.G. Menon, T.A. Griffin // Catal. Rev.-Sci. Eng. — 1993. -V.35. N 3. — P. 319-358.
16. Yashnik, S.A. Development of monolithic catalysts with low noble metal content for diesel vehicle emission control / S.A. Yashnik, V.V. Kuznetsov, Z.R. Ismagilov, V.A. Ushakov, N.M. Danchenko, S.P. Denisov // Topics in Catal. -2004. — V. 30/31. — P. 293-298.
17. Yashnik, S.A. Dependence of Syncrgctic Effect of Palladium-Mangancsc-Hcxaaluminatc Combustion Catalyst on Nature of Palladium Precursor / S.A. Yashnik, Z.R. Ismagilov // Topics in Catalysis. — 2022. — V. 55. — N. 11-13.-P. 818-836.
18.Carno, J. Mixed manganese oxide/platinum catalysts for total oxidation of model gas from wood boilers / J. Carno, M. Ferrandon, E. Bjornbom, S. Jaras // Appl. Catal. A: Gen. — 1997. — V. 155. — N. 2. — P. 265-281.
19.Grbic, B. Influence of manganese oxide on the activity of Pt/A1203 catalyst for CO and n-hexane oxidation / B. Grbic, N. Radic, B. Markovic, P. Stefanov, D. Stoychev, Ts. Marinova // Applied Catalysis B: Env. — 2006. — V. 64. -P. 51-56.
20. Shikina, N.V. Nanostrukturirovannye katalizatory blochnogo tipa dlja glubokogo okislenija uglevodorodov / N.V. Shikina, A.A. Gavrilova, V.A. Ushakov, Z.R. Ismagilov //Vestnik KuzGTU. — 2022. — №5. — S.31-39.
21.Ioffe, I.I. Inzhenernaja himija geterogennogo kataliza. /1.1. Ioffe, L.M. Pis’men. — L.: Himija, 1972. — 464 s.
22.Boreskov G. K. Geterogennyj kataliz. M.: Nauka, 1986. — 303 s.
23.Panchenkov, G.M. Himicheskaja kinetika i kataliz / G.M. Panchenkov, V.P. Lebedev. — M.: Himija, 1985. -592 s.
Поступило в редакцию 19.02.2022 Received 19 February 2022
УДК 662.8.053.33
АНАЛИЗ ВОЗМОЖНОСТИ ПОЛУЧЕНИЯ БРИКЕТИРОВАННОГО ТОПЛИВА ИЗ ОТХОДОВ ПИРОЛИЗА АВТОШИН С ИСПОЛЬЗОВАНИЕМ СВЯЗУЮЩЕГО — ВТОРИЧНОГО ПОЛИМЕРА
ANALYSIS OF POSSIBILITIES OF PRODUCING A WASTE FUEL PYROLYSIS AUTOTYRES WITH USING OF COMMUNICATION — SECONDARY POLYMERS
Попов Василий Сергеевич,
студент, e-mail: vasiliywinter@gmail.com Popov Vasiliy S., student Папин Андрей Владимирович,
канд. техн. наук, доцент, e-mail: papinandrey@rambler.ru Papin Andrey V., С. Sc. in Engineering, assistant professor
Игнатова Алла Юрьевна, канд. биолог, наук, доцент, e-mail: allaignatova@rambler.ru Ignatova Alia Y., С. Sc. in Biology, assistant professor
Кузбасский государственный технический университет имени Т.Ф. Горбачёва, 650000, Россия, г. Кемерово, ул. Весенняя, 28
T.F. Gorbachev Kuzbass State Technical University, 28 street Vesennyaya, Kemerovo, 650000, Russian Federation
Аннотация: В данной статье раскрываются эколого-экономические проблемы утилизации изношенных шин в России методом низкотемпературного пиролиза. Предлагается получение композитного топлива на основе твердого остатка пиролиза автошин с применением вторичного полимера как связующего.
Abstract: In this article the ecological and economic problem of recycling waste tires in Russia by low-temperature pyrolysis. It proposes to obtain a composite of fuel-based solid pyrolysis of tires to-Application-tion of the secondary polymer as a binder.
Ключевые слова: Утилизация шин, переработка, пиролиз, углеродный остаток, композитное топливо, связующее, вторичные полимеры.
Keywords: Tire Recycling Processing, pyrolysis carbon residue, a composite fuel, a binder, a secondary polymers.
В настоящее время одним из главных факторов, загрязняющих окружающую среду в мире является рост количества отработанных шин. С каждым годом количество пневмоколесного транспорта на душу населения увеличивается, что приводит к появлению огромного количества отработанных шин.
В России данная проблема имеет высокий уровень актуальности. Например, исходя из исследований научно-исследовательского института шинной промышленности (НИИШП), в нашей стране ежегодно выходит из эксплуатации около 1 млн. тонн шин, а учитывая, что в одну тонну шин входит около 600-650 кг резины, 130-150 кг текстиля, 130-200 кг металла, амортизированную шину можно считать важным источником вторичного сырья. В среднестатистический состав шины легкового автомобиля входит 65-70 % резины (каучук), 15-25 % технического углерода, 10-15 %
высококачественного металла [1-2].
Отработанные шины являются бытовым отходом четвертого класса опасности, вследствие чего требуется их сертификация. Предприятия сдают шины на переработку специализированным заводам, имеющим лицензию на право обращения с опасными видами отходов. Документы, подтверждающие сдачу шин на утилизацию, требуются предприятиям для сдачи соответствующих форм экологической отчетности [3]. Отработанные шины крайне огнеопасны, и в случае возгорания температура их горения близка температуре горения каменного угля. При горении шин, в атмосферу выбрасываются вредные продукты сгорания, в том числе канцерогены [4-5].
Данные отходы очень специфичны, не поддаются гниению, саморазрушению, занимают земельные площади, загрязняя населенные пункты, водоёмы и воздух.
Каталитическое окисление метана
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.

