- В таблице приведены основные характеристики горючих газов
- Ацетилен
- Горение и виды горючих веществ
- Горение и кислород
- История открытия
- Кислород
- Кислород и воздух
- Классификация газов — окислители, инретные и нейтральные газы
- Круговорот кислорода в природе
- Нахождение в природе
- Оксиды
- Получение кислорода в лаборатории
- Применение кислорода в сварке
- Применение кислорода в различных отраслях
- Пропан
- Распространенность оксигена в природе
- Реакция с серой
- Свойства и применение кислорода
- Строение и физические свойства простых веществ
- Физические свойства
- Химические свойства
В таблице приведены основные характеристики горючих газов
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ацетилен
Ниже будут рассмотрены кратные сведения об ацетилене, а статьи с подробной информацией можно найти, перейдя по ссылкам:
Ацетилен С2Н2 является основным горючим газом для газовой сварки и резки металлов, температура его плавления при сгорании в смеси с технически чистым кислородом достигает 3150°С.
Ацетилен является химическим соединением углерода и водорода. Технический ацетилен при нормальных давлении и температуре представляет собой бесцветный газ с резким специфическим чесночным запахом, обусловленным содержащимися в нем примесями сероводорода, аммиака, фосфористого водорода и др. Длительное вдыхание его вызывает тошноту, головокружение и даже отравление.
Ацетилен легче воздуха, 1 м3 при нормальном атмосферном давлении и температуре 20°С имеет массу 1,09 кг. При нормальном давлении и температуре от -82,4°С (190,6 К) до -84,0°С (189 К) он переходит в жидкое состояние, а при температуре -85°С (188 К) затвердевает.
Ацетилен — самое распространенное горючее, используемое в процессах газопламенной обработки. При его использовании необходимо учитывать его взрывоопасные свойства. Ацетилен — высокое эндотермическое соединение, при разложении 1 кг С2Н2 выделяется 8373,6 кДж. Температура самовоспламенения колеблется в пределах 240-630°С и зависит от давления и присутствия в нем различных веществ.
Повышение давления существенно снижает температуру самовоспламенения. Присутствие в ацетилене других веществ увеличивает поверхность контакта и тем понижает температуру самовоспламенения.
Зависимость температуры воспламенения ацетилена от давления приведена ниже:
При взрыве ацетилена происходит резкое повышение давления и температуры, что может вызвать большие разрушения и тяжелые несчастные случаи. Ацетилен с воздухом образует взрывоопасные смеси в пределах от 2,2 до 81% С2Н2 по объему при нормальном атмосферном давлении, а с технически чистым кислородом — в пределах от 2,3 до 93%.
Присутствие окиси меди снижает температуру самовоспламенения ацетилена до 240°С. При определенных условиях ацетилен реагирует с медью, образуя взрывоопасные соединения, вот почему категорически запрещается при изготовлении ацетиленового оборудования применение сплавов, содержащих более 70% меди.
Взрываемость ацетилена понижается при растворении его в жидкостях. Особенно хорошо он растворяется в ацетоне. В одном объеме технического ацетона при 20°С и нормальном атмосферном давлении можно растворить до 20 объемов ацетилена. Растворимость в ацетоне увеличивается с увеличением давления и понижением температуры.
Технический ацетилен получают двумя способами:
Ацетилен, полученный из природного газа, называется пиролизным. Получение его из природного газа на 30-40% дешевле, чем из карбида кальция.
К месту сварки ацетилен доставляется в специальных стальных баллонах, заполненных пористой пропитанной ацетоном массой, под давлением 1,9 МПа.
Кроме ацетилена при сварке и резке металлов применяют и другие более дешевые и менее дефицитные горючие газы и пары горючих жидкостей. Основная область применения газов-заменителей — кислородная резка, однако в последние годы они находят широкое применение и при других видах газопламенной обработки металлов — пайке, наплавке, газопламенной закалке, металлизации, газопрессовой сварке, сварке цветных металлов и сплавов.
При сварке температура пламени должна примерно в два раза превышать температуру плавления металлов, поэтому газы-заменители, температура пламени которых ниже, чем у ацетилена, необходимо использовать при сварке металлов с более низкой температурой плавления, чем у сталей.
- Теплотворная способность
- количество теплоты в килоджоулях, получаемое при полном сгорании 1 м3 газа
Чем выше теплотворная способность газа, тем меньше его расход при сварке и резке металлов. Для полного сгорания одинакового объема различных горючих газов требуется различное количество кислорода, от этого зависит эффективная мощность пламени.
- Эффективной мощностью пламени
- называется количество тепла, вводимое в нагреваемый металл в единицу времени
Для расчетов замены ацетилена другим газом-заменителем пользуются коэффициентом замены ацетилена.
- Коэффициент замены ацетилена
- отношение расхода газа-заменителя V3 к расходу ацетилена Va при одинаковой эффективной тепловой мощности: ?=V3/Va
Горение и виды горючих веществ
Реакция, протекающая с участием кислорода и сопровождающаяся выделением большого количества света и тепла, называется горением.
В чистом кислороде, по сравнению с воздухом, вещества горят во много раз быстрее (рис. 22). В обоих случаях выделяется равное количество теплоты, но в кислороде этот процесс протекает быстрее и выделяющаяся теплота не расходуется, как в случае с воздухом, на нагревание азота.
Температура при горении в чистом кислороде выше, чем в воздухе. Опуская тлеющую лучину в сосуд с чистым кислородом, можно увидеть, как она сразу загорается. А в воздухе тлеющая лучина может вскоре и потухнуть. Если эта лучина зажжена, то она продолжает гореть на воздухе, потому что выделяющееся при горении тепло требует большей температуры, чем температура воспламенения лучины.
Рис. 22. Горение магния в чистом кислороде
Рис. 23. Тушение пламени
Температура, необходимая для поджигания вещества на воздухе, называегся температурой воспламенения.
Значит, для обеспечения горения веществ, нужно нагревать их до температуры воспламенения и подавать кислород в достаточном количестве.
Для того чтобы потушить пламя, необходимо ликвидировать факторы, обеспечивающие его появление, т.е. охладить вещество до температуры ниже температуры возгорания и прекратить подачу кислорода (рис. 23).
Чтобы потушить горящую вещь, сначала следует понизить температуру, используя невоспламеняющиеся средства, затем накрыть источник возгорания одеялом или брезентом, чтобы прекратить подачу воздуха.
В непредвиденных ситуациях для тушения пожара необходимо использовать специальные средства, а если их нет, то применять указанный выше способ.
Вообще процесс горения имеет огромное значение в промышленности и в повседневной жизни.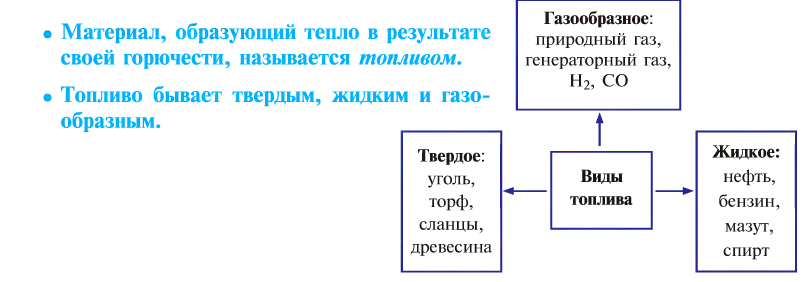
От твердого топлива остается минеральный осадок — пепел. Жидкое и газообразное топливо такого недостатка не имеет. Но любое топливо независимо от места добычи, промышленного объема, экономической эффективности имеет только свое место применения, и возможности по его взаимозамещению ограничены.
Неправильное сжигание топлива приносит вред народному хозяйству.
Топливо позволяет спокойно переносить холод, варить пищу, которая не употребляется в сыром виде, получать металлы из руд путем их выплавки, обеспечивать движение транспорта, получать другие виды энергии.
Горение и кислород
Рассмотренные в предыдущем параграфе реакции с участием кислорода сопровождаются одинаковыми внешними эффектами.
Химическую реакцию, во время которой выделяется теплота и появляется пламя, называют горением.
Пламя возникает вследствие свечения раскаленных частиц веществ, которые сгорают или образуются во время реакции.
Для того чтобы горючее вещество воспламенилось, необходимы такие условия:
- наличие кислорода (воздуха);
- нагревание вещества до температуры самовозгорания (для бензина она составляет 220 °С, сухой древесины — 250—300 °С, бумаги — 440 °С, угля — свыше 600 °С).
Кислород поддерживает горение веществ, но сам не горит.
Если не выполняется хотя бы одно из этих условий, то горение не происходит. Это учитывают во время работы с огнеопасными веществами, а также при тушении пожаров.
Погасить огонь можно, залив горящее вещество или предмет водой, засыпав его песком или землей, накрыв одеялом или направив на него струю углекислого газа (он не поддерживает горения и тяжелее воздуха) (рис. 63).
Рис. 63. Гашение пламени:
а — водой; б — песком; в — углекислым газом
В лабораториях, на предприятиях с этой целью используют огнетушители (рис. 64).
Рис. 64. Огнетушитель (а)и его использование (б)
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
- 2HgO →ot 2Hg O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Кислород
Кислород — газообразное вещество, содержащееся в воздухе в количестве 21% и обладающее окислительными свойствами. Является одним из обязательных компонентов горючей среды при пожаре и образовании взрывоопасных паро-, газо- и пылевоздушных смесей.
С увеличением концентрации кислорода в горючей среде скорость горения веществ и материалов увеличивается. Пожаротушение в таких средах затрудняется.
Предельную концентрацию кислорода в горючей среде, при которой прекращается распространение пламени, называют МВСК. Для большинства веществ и материалов минимальная взрывоопасная концентрация кислорода составляет 12 (об.), а для водорода,ацетилена, металлов и некоторых других веществ до 4 об. В обогащенных кислородом средах (свыше 21 об.) флегматизирующая концентрация ингибиторов существенно повышается, диапазон концентраций между НКПР и ВКВР расширяется, температура самовоспламенения и МЭЗ материала снижается.
Кислород хранят и транспортируют в сжатом состоянии в стальных баллонах или в сжиженном состоянии в изотермических ёмкостях отдельно от других веществ и материалов. Недопустимо попадание масла на арматуру баллона с кислородом из-за опасности взрыва. Жидкий кислород, смачивая пористыегорючие материалы (хлопок, целлюлоз ткани), образует пожаро- иливзрывоопасные смеси.
Лит.: Баратов А.Н. Горение – Пожар – Взрыв – Безопасность. М, 2003; Мальцев В.М., Мальцев В.И., Кашпроров Л.Я. Основные характеристики горения. М., 1977.
Кислород и воздух
Атмосферный воздух — это природная смесь многих газов. Помимо азота и кислорода, являющихся основной составной частью воздуха, в его состав входят в небольшом количестве инертные газы, углекислый газ, пары воды и водород (табл. 6). Кроме них, в воздухе встречаются, в зависимости от внешних условий, пыль, некоторые случайные примеси.
Один литр воздуха при 20°С и нормальном атмосферном давлении весит 1,293 г. При —192°С и давлении 101,33 кПа воздух превращается в бесцветную прозрачную жидкость. Из жидкого воздуха выделяются азот, кислород и инертные газы.
Углекислый газ и водяные пары воздуха выполняют функцию защитного экрана, препятствующего распространению во Вселенной тепла Земли, а озон не пропускает губительные для жизни на Земле коротковолновые ультрафиолетовые лучи, исходящие от Солнца и звезд.
К случайным примесям воздуха относятся сероводород и аммиак, образующиеся при гниении органических остатков, выбрасываемый промышленными предприятиями сернистый газ, образующиеся в результате электрических разрядов оксиды азота, которые периодически выводятся из состава воздуха дождем и снегом.
Воздух является необходимой составной частью жизни на Земле. Сохранение его чистоты имеет огромное значение для человечества. Для защиты воздуха от техногенных загрязнений необходимо использовать новые безотходные технологии, предупреждать уменьшение биомассы Земли, обеспечивать нормальную работу естественных механизмов очистки воздуха.
Классификация газов — окислители, инретные и нейтральные газы
Простейшая классификация газов такова:
- — окислители
— инертные
— горючие
Окислители: сами по себе газы не горючие, но отлично поддерживают горение в качестве окислителя. Жир или смазка в комбинации с сильными окислителями представляют собой самовоспламеняющуюся (взрывоопасную) комбинацию.
Наиболее распространенные окислители:
- Воздух
- Двуокись азота NO2
- Кислород
- Окись азота NO
- Фтор
- Хлор
Нейтральные газы: не поддерживают горение и не горят. Кроме того, они не вступают в реакцию с обычными материалами. Если в помещение подать некоторый объем нейтрального газа, то таким образом, за счет вытеснения кислорода, можно серьезно ограничить процесс горения. Отличная замена воде в системах пожаротушения для применений, где использование воды недопустимо ( например, установки под напряжением и т.д.).
Наиболее распространенные нейтральные газы :
- Азот
- Аргон
- Гелий
- Ксенон
- Неон
- Углекислый газ (CO2) — (не путать с СО = угарный газ)
Горючие газы: в смеси с воздухом или кислородом возгораются или взрываются при соответствующей концентрации смеси. Если смесь слишком богатая или бедная, то воспламенения не произойдет.
Наиболее распространенные горючие газы:
- Аммиак
- Арсин
- Ацетилен
- Бутан
- Водород
- Угарный газ (Моноксид углерода)
- Метан
- Пропан
- Пропилен
- Силан
- Холодильный агент R160, хлористый этил
- Холодильный агент R600a, изобутан;
- Холодильный агент R40, хлористый метил;
- Циклопропан (наркоз)
- Этан
- Этилен
Круговорот кислорода в природе
О том, что кислород в большом количестве находится в литосфере, гидросфере и атмосфере, мы говорили в предыдущих разделах учебника (табл. 5).
Круговорот кислорода на Земле несущественно отличается от его круговорота в атмосфере, литосфере и гидросфере. На Земле круговорот в основном протекает в процессе фотосинтеза и дыхания. В процессе фотосинтеза углекислый газ, взаимодействуя с водой, образует органические вещества и кислород. В результате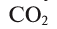
При дыхании, разложении умерших организмов и горении кислород из биосферы возвращается обратно в гидросферу и атмосферу:
В биомассе Земли кислород полностью меняется каждые 20—30 лет. В литосферу кислород переходит из атмосферы в виде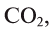
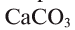
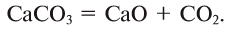
Эта реакция наблюдается в основном в зонах повышенной вулканической деятельности, тем самым постепенно обновляя углекислый газ в атмосфере.
Нахождение в природе

Накопление O
2
в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1
. (3,85—2,45 млрд лет назад) — O
2
не производился
2
. (2,45—1,85 млрд лет назад) O
2
производился, но поглощался океаном и породами морского дна
3
. (1,85—0,85 млрд лет назад) O
2
выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4
. (0,85—0,54 млрд лет назад) все горные породы на суше окислены, начинается накопление O
2
в атмосфере
5
. (0,54 млрд лет назад — по настоящее время) современный период, содержание O
2
в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад, в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы).
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2022 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Оксиды
Продуктами всех реакций, рассмотренных в параграфе, являются бинарные соединения элементов с Оксигеном.
Соединение, образованное двумя элементами, одним из которых является Оксиген, называют оксидом.
Общая формула оксидов — 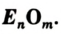
Таблица 4Формулы и названия некоторых оксидов
Выводы:
Кислород — химически активное вещество. Он взаимодействует с большинством простых веществ, а также со сложными веществами. Продуктами таких реакций являются соединения элементов с Оксигеном — оксиды.
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий
 Рис. 54.Получение кислорода нагреванием меркурий
Рис. 54.Получение кислорода нагреванием меркурий оксида
оксида
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
Небольшое количество катализатора — манган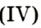
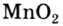
 Получение кислорода разложением гидроген пероксида
Получение кислорода разложением гидроген пероксида 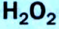 Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган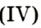
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 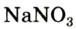

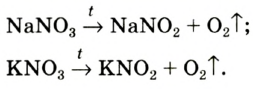
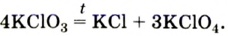
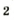 селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока: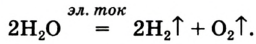
Применение кислорода в сварке
Сам по себе O2 является негорючим газом, но из-за свойства активно поддерживать горение и увеличения интенсивности (интенсификации) горения газов и жидкого топлива его используют в ракетных энергетических установках и во всех процессах газопламенной обработки.
В таких процессах газопламенной обработки, как газовая сварка, поверхностная закалка высокая температура пламени достигается путем сжигания горючих газов в O2, а при газовой резке благодаря ему происходит окисление и сгорание разрезаемого металла.
При полуавтоматической сварке (MIG/MAG) кислород O2 используют как компонент защитных газовых смесей с аргоном (Ar) или углекислым газом (CO2).
Кислород добавляют в аргон при полуавтоматической сварке легированных сталей для обеспечения устойчивости горения дуги и струйного переноса расплавленного металла в сварочную ванну. Дело в том, что как поверхностно активный элемент он уменьшает поверхностное натяжение жидкого металла, способствуя образованию на конце электрода более мелких капель.
При сварке низколегированных и низкоуглеродистых сталей полуавтоматом O2 добавляют в углекислый газ для обеспечения глубокого проплавления и хорошего формирования сварного шва, а также для уменьшения разбрызгивания.
Чаще всего кислород используют в газообразном виде, а в виде жидкости используют только при его хранении и транспортировке от завода-изготовителя до потребителей.
Применение кислорода в различных отраслях
Кислород используют в различных отраслях, причем в больших количествах (схема 9). В металлургии он ускоряет процесс выплавки стали и улучшает ее качество. Этот газ необходим в производстве многих химических соединений, используется в специальных устройствах для резки и сварки металлов (водородно-кислородные, ацетиленово-кислородные горелки).
Баллоны, наполненные кислородом (рис. 66) или его смесью с инертным газом гелием, используют космонавты, военные летчики, пожарники, водолазы. Кислородные подушки применяют при некоторых заболеваниях для облегчения дыхания. С помощью сжиженного кислорода создают необходимые условия для сгорания горючего в космических ракетах.

Схема 9.Применение кислорода
Широко используется и кислород, входящий в состав воздуха. При его участии сгорает топливо на теплоэлектростанциях, горючее в двигателях автомобилей, обжигают металлические руды на заводах цветной металлургии.
Рис. 66. Баллон с кислородомВо время сжигания топлива и горючего образуется и попадает в воздух значительное количество угарного (СО) и сернистого 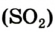
Пропан
Пропан технический — бесцветный горючий газ с резким запахом, состоящий из пропана С3Н8 или из пропана и пропилена С3Н8, суммарное содержание которых должно быть не менее 93%. Получают пропан при переработке нефтепродуктов.
При нормальных условиях пропан находится в газообразном состоянии, а при понижении температуры или повышении давления переходит в жидкое состояние. Так, при температуре 293 К пропан переходит в жидкое состояние при давлении 0,85 МПа. Испарение 1 кг жидкого пропана дает 0,53 м3 паров.
Пропан-бутановая смесь — бесцветный горючий газ с резким запахом, является побочным продуктом при переработке нефти.
Смесь легко превращается в жидкое состояние, например при температуре 233 К пропан-бутановая смесь сжижается при атмосферном давлении. Сжиженные газы хранят только в закрытых емкостях, так как испарение жидкости происходит даже при 273 К.
Плотность пропан-бутана больше плотности воздуха, поэтому необходимо тщательно следить за герметичностью аппаратуры и коммуникаций во избежание образования взрывоопасной смеси газа с воздухом внизу помещения. Заполнение емкостей пропаном и пропан-бутановой смесью, транспортирование их, а также слив газа должны выполняться в соответствии с «Правилами устройства и безопасной эксплуатации сосудов, работающих под давлением», утвержденными Госгортехнадзором.
Пропан-бутановые смеси широко применяются при резке сталей, сварке и пайке легкоплавких цветных металлов, закалке, газовой сварке пластмасс. К месту сварки смесь поставляют в стальных баллонах под давлением 1,6 МПа или по газопроводам через перепускную рампу. При испарении 1 кг пропана образуется 500 дм3 газа.
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 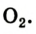
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 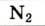 | 78,09 | 75,51 |
| Кислород | 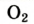 | 20,95 | 23,15 |
| Аргон | 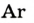 | 0,93 | 1,28 |
| углекислый газ | 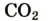 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой 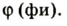
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52).
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 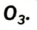 Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород:
Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород: 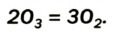
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Реакция с серой
Это химическое превращение осуществляет каждый, когда зажигает спичку; сера входит в состав ее головки. В лаборатории реакцию серы с кислородом проводят в вытяжном шкафу. Небольшое количество серы (светло-желтый порошок или кристаллы) нагревают в железной ложке. Вещество сначала плавится, потом загорается в результате взаимодействия с кислородом воздуха и горит едва заметным синим пламенем (рис. 56, б). Появляется резкий запах продукта реакции — сернистого газа (этот запах мы ощущаем в момент загорания спички). Химическая формула сернистого газа — 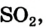
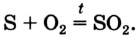
Рис. 56. Сера (а) и ее горение на воздухе (б) и в кислороде (в)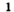
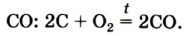
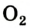
Рис. 57.Красный фосфор (а) и его горение на воздухе (б) и в кислороде (в)
Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 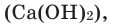
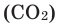
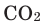
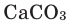
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ (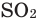
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (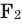
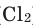
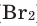
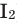
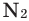
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (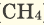
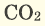
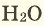
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода.
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Строение и физические свойства простых веществ
С простым веществом кислородом вы уже познакомились в курсе химии 7-го класса. Напомним, что простое вещество кислород в природе существует в виде двух аллотропных модификаций — обычного кислорода 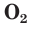 озона
озона 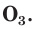
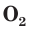
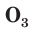
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Небольшие количества озона в воздухе оказывают целебное действие на людей. Однако сильное обогащение воздуха озоном может стать опасным для здоровья. Увеличение содержания озона в воздухе выше предельно допустимой концентрации приводит к появлению головных болей, раздражению дыхательных путей и глаз, а затем к ослаблению сердечной деятельности.
Источниками озона являются работающие приборы, в которых происходит высоковольтный электрический разряд — копировальные установки и лазерные принтеры, а также источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы, необходимо часто проветривать.
Озон сосредоточен в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от жесткого ультрафиолетового излучения Солнца. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов.
Кислород и озон в воде мало растворимы. При 20 °С в 100 объемах 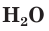
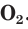
Физические свойства
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при 50 °C) и спирте (2,78 мл/100 г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Хорошо растворяется в перфторированных углеводородах (20-40 об/об %).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы. Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-O2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°.
- β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
- γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å.
Ещё три фазы образуются при высоких давлениях:
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона. Наиболее распространённая степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
- 4Li O2 → 2Li2O
- 2Sr O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO O2 → 2NO2↑
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6 15O2 → 12CO2 6H2O
- CH3CH2OH 3O2 → 2CO2 3H2O
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH O2 → CH3COOH H2O
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета.
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- 2Na O2 → Na2O2
- 2BaO O2 → 2BaO2
- H2 O2 → H2O2
- Na2O2 O2 → 2NaO2
- K O2 → KO2
- 3KOH 3O3 → 2KO3 KOH ∗ H2O 2O2↑
- PtF6 O2 → O2PtF6
В этой реакции, кислород проявляет восстановительные свойства.

