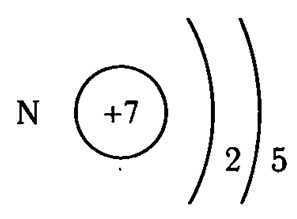
- Валентные возможности атома водорода
- Валентные возможности атома кислорода
- Валентные возможности атома серы
- Валентные возможности атома углерода
- Валентные возможности фосфора
- Найди валентность азота в его соединении с кислородом, формула соединения — n2o. ответ запиши римской цифрой. например: iv. ответ: валентность азота равна — знания.org
- Найди валентность азота в его соединении с кислородом, формула соединения — n2o. ответ…
- Найди валентность азота в его соединении с кислородом, формула соединения — no2. ответ запиши римской цифрой. например:
- Найди валентность азота в его соединении с кислородом, формула соединения — no2. ответ запиши римской цифрой. например: iv.
- Общие сведения о валентности кислорода
- Определите валентность азота в n2o, no, n2o3, no2, n2o5.
- Пример 1
- Степень окисления
- Таблица валентности химических элементов (1 часть):
- Таблица валентности химических элементов (2 часть):
- Таблица валентности химических элементов (3 часть):
- Таблица валентности химических элементов.
- Таблица характерных значений валентностей некоторых атомов химических соединений.
- Таблица элементов с постоянной валентностью.
- Электроотрицательность
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон.
Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных (
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s-орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Найди валентность азота в его соединении с кислородом, формула соединения — n2o. ответ запиши римской цифрой. например: iv. ответ: валентность азота равна — знания.org
Ответ:
|
Объяснение:
О при любых обстоятельствах имеет валентность ||,а я уравнении, у нас все коэффициенты должны быть равными, так что N — |.
Найди валентность азота в его соединении с кислородом, формула соединения — n2o. ответ…
Найди валентность азота в его соединении с кислородом, формула соединения — N2O.
Ответ запиши римской цифрой. Например: IV.
Ответ: валентность азота равна
Найди валентность азота в его соединении с кислородом, формула соединения — no2. ответ запиши римской цифрой. например:
Найди валентность азота в его соединении с кислородом, формула соединения — no2. ответ запиши римской цифрой. например: iv.
Общие сведения о валентности кислорода
Природный кислород состоит из трех стабильных изотопов 16O (99,76%), 17O (0,04%) и 18O (0,2%).
Наиболее устойчива двухатомная молекула кислорода O2. Она парамгнитна и слабо поляризуется. Температуры плавления (-218,9oС) и кипения (-183oС) кислорода очень низкие. Кислород плохо растворяется в воде. При нормальных условиях кислород представляет собой газ без цвета и запаха.
Жидкий и твердый кислород притягивается магнитом, т.к. его молекулы парамагнитны. Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
Кислород существует в виде двух аллотропных модификаций – кислорода O2 и озона O3.
Определите валентность азота в n2o, no, n2o3, no2, n2o5.
N2O – I, NO – II, N2O3 – III, NO2 – IV, N2O5 – V.
1. Определите валентность элементов по формулам: HgO, K2S, B2O3, ZnO, MnO2, NiO, Cu2O, SnO2, Ni2O3, SO3, As2O5, Cl2O7.
2. Даны химические символы элементов и указана их валентность. Составьте соответствующие химические формулы.
3. Пользуясь данными таблицы 3 (стр. 56 учебника), составьте химические формулы соединений с кислородом (оксидов) следующих химических элементов: Zn, B, Be, Co, Pb, Ni. Назовите эти соединения.
5. Составьте формулы оксидов (соединений с кислородом): меди (I), железа (III), вольфрама (VI), железа (II), углерода (IV), серы (VI), олова (IV), марганца (VII).
6. Составьте формулы соединений с хлором следующих элементов: K, Ca, Al, Ba.
7. Составьте формулы водородных соединений следующих элементов: S (II), P (III), F (I), C (IV).
Тестовые задания.
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной
реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны,
образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд » «, а другим «-«. Это связано с электроотрицательностью —
способностью атома притягивать к себе электроны. Знак » » означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное
понятие.
Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток —
получает знак » «.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2,
KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание
степеней окисления должно заменить даже самую развитую интуицию 😉
Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких
электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют
разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.
Таблица валентности химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Валентность | Примеры соединений | Примечание |
| 1 | Водород | H | I | HCl, H2O2 | |
| 2 | Гелий | He | отсутствует | ||
| 3 | Литий | Li | I | LiOH, Li2O | |
| 4 | Бериллий | Be | I, II | ||
| 5 | Бор | B | III | B2O3 | |
| 6 | Углерод | C | II, IV | ||
| 7 | Азот | N | I, II, III, IV |
| В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным |
| 8 | Кислород | O | II | (NO)F, CaO, O2, H2O2,Cl2O, H2O | |
| 9 | Фтор | F | I | HF, (NO)F | |
| 10 | Неон | Ne | отсутствует | ||
| 11 | Натрий | Na | I | Na2S, Na2O | |
| 12 | Магний | Mg | II | Mg(NO3)2 | |
| 13 | Алюминий | Al | III | Al2O3, Al2S3, AlCl3 | |
| 14 | Кремний | Si | II, IV | ||
| 15 | Фосфор | P | III, V |
| |
| 16 | Сера | S | II, IV, VI |
| |
| 17 | Хлор | Cl | I, III, IV, V, VI, VII |
| |
| 18 | Аргон | Ar | отсутствует | ||
| 19 | Калий | K | I | KOH, K2O, K2S | |
| 20 | Кальций | Ca | II | Ca(OH)2 | |
| 21 | Скандий | Sc | III | Sc2O3 | |
| 22 | Титан | Ti | II, III, IV | ||
| 23 | Ванадий | V | II, III, IV, V | ||
| 24 | Хром | Cr | II, III, VI | ||
| 25 | Марганец | Mn | II, III, IV, VI, VII |
| |
| 26 | Железо | Fe | II, III |
| |
| 27 | Кобальт | Co | II, III | ||
| 28 | Никель | Ni | II, III | ||
| 29 | Медь | Cu | I, II | ||
| 30 | Цинк | Zn | II | ZnSO4, ZnO, ZnS |
Таблица валентности химических элементов (2 часть):
| 31 | Галлий | Ga | I, II, III | ||
| 32 | Германий | Ge | II, IV | ||
| 33 | Мышьяк | As | III, V | ||
| 34 | Селен | Se | II, IV, VI | ||
| 35 | Бром | Br | I, III, V, VII | ||
| 36 | Криптон | Kr | отсутствует | ||
| 37 | Рубидий | Rb | I | RbOH | |
| 38 | Стронций | Sr | II | SrO | |
| 39 | Иттрий | Y | III | Y(NO3)3 | |
| 40 | Цирконий | Zr | II, III, IV | ||
| 41 | Ниобий | Nb | I, II, III, IV, V | ||
| 42 | Молибден | Mo | II, III, IV, V, VI |
| |
| 43 | Технеций | Tc | II, III, IV, V, VI, VII |
| |
| 44 | Рутений | Ru | II, III, IV, V, VI, VII, VIII |
| |
| 45 | Родий | Rh | II, III, IV, V, VI |
| |
| 46 | Палладий | Pd | II, IV | ||
| 47 | Серебро | Ag | I, II, III | ||
| 48 | Кадмий | Cd | I, II | ||
| 49 | Индий | In | I, II, III | ||
| 50 | Олово | Sn | II, IV | ||
| 51 | Сурьма | Sb | III, V | ||
| 52 | Теллур | Te | II, IV, VI | ||
| 53 | Йод | I | I, III, V, VII | ||
| 54 | Ксенон | Xe | отсутствует | ||
| 55 | Цезий | Cs | I | Cs2O | |
| 56 | Барий | Ba | II | Ba(OH)2 | |
| 57 | Лантан | La | III | La2(SO4)3 | |
| 58 | Церий | Ce | III, IV | ||
| 59 | Празеодим | Pr | II, III, IV | ||
| 60 | Неодим | Nd | II, III |
Таблица валентности химических элементов (3 часть):
| 61 | Прометий | Pm | III | PmBr3 | |
| 62 | Самарий | Sm | II, III | ||
| 63 | Европий | Eu | II, III | ||
| 64 | Гадолиний | Gd | II, III | ||
| 65 | Тербий | Tb | II, III, IV | ||
| 66 | Диспрозий | Dy | II, III | ||
| 67 | Гольмий | Ho | III | Ho2(SO4)3 | |
| 68 | Эрбий | Er | III | Er2O3 | |
| 69 | Тулий | Tm | II, III | ||
| 70 | Иттербий | Yb | II, III | ||
| 71 | Лютеций | Lu | III | LuBr3 | |
| 72 | Гафний | Hf | I, II, III, IV | ||
| 73 | Тантал | Ta | I, II, III, IV, V |
| |
| 74 | Вольфрам | W | II, III, IV, V, VI |
| |
| 75 | Рений | Re | I, II, III, IV, V, VI, VII |
| |
| 76 | Осмий | Os | I, II, III, IV, V, VI, VII, VIII |
| |
| 77 | Иридий | Ir | I, II, III, IV, V, VI |
| |
| 78 | Платина | Pt | II, III, IV, V, VI | ||
| 79 | Золото | Au | I, II, III, V | ||
| 80 | Ртуть | Hg | I, II | ||
| 81 | Таллий | Tl | I, II, III | ||
| 82 | Свинец | Pb | II, IV | ||
| 83 | Висмут | Bi | III, V | ||
| 84 | Полоний | Po | II, IV, VI | ||
| 85 | Астат | At | нет данных | ||
| 86 | Радон | Rn | отсутствует | ||
| 87 | Франций | Fr | I | FrOH | |
| 88 | Радий | Ra | II | Ra(OH)2 | |
| 89 | Актиний | Ac | III | Ac2O3 | |
| 90 | Торий | Th | II, III, IV | ||
| 91 | Протактиний | Pa | II, III, IV, V | ||
| 92 | Уран | U | III, IV, V, VI | ||
| 93 | Нептуний | Np | III, IV, V, VI, VII | ||
| 94 | Плутоний | Pu | III, IV, V, VI, VII | ||
| 95 | Америций | Am | II, III, IV, V, VI | ||
| 96 | Кюрий | Cm | II, III, IV | ||
| 97 | Берклий | Bk | III, IV | ||
| 98 | Калифорний | Cf | II, III, IV | ||
| 99 | Эйнштейний | Es | II, III | ||
| 100 | Фермий | Fm | II, III |
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента.
Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента.
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Коэффициент востребованности 5 707
Таблица валентности химических элементов.
Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число | Русское / Английское наименование | Химический символ | Валентность |
1 | Водород / Hydrogen | H | (-1), 1 |
2 | Гелий / Helium | He | 0 |
3 | Литий / Lithium | Li | 1 |
4 | Бериллий / Beryllium | Be | 2 |
5 | Бор / Boron | B | -3, 3 |
6 | Углерод / Carbon | C | ( 2), 4 |
7 | Азот / Nitrogen | N | -3, -2, -1, ( 1), 2, 3, 4, 5 |
8 | Кислород / Oxygen | O | -2 |
9 | Фтор / Fluorine | F | -1, ( 1) |
10 | Неон / Neon | Ne | 0 |
11 | Натрий / Sodium | Na | 1 |
12 | Магний / Magnesium | Mg | 2 |
13 | Алюминий / Aluminum | Al | 3 |
14 | Кремний / Silicon | Si | -4, ( 2), 4 |
15 | Фосфор / Phosphorus | P | -3, 1, 3, 5 |
16 | Сера / Sulfur | S | -2, 2, 4, 6 |
17 | Хлор / Chlorine | Cl | -1, 1, ( 2), 3, ( 4), 5, 7 |
18 | Аргон / Argon | Ar | 0 |
19 | Калий / Potassium | K | 1 |
20 | Кальций / Calcium | Ca | 2 |
21 | Скандий / Scandium | Sc | 3 |
22 | Титан / Titanium | Ti | 2, 3, 4 |
23 | Ванадий / Vanadium | V | 2, 3, 4, 5 |
24 | Хром / Chromium | Cr | 2, 3, 6 |
25 | Марганец / Manganese | Mn | 2, ( 3), 4, ( 6), 7 |
26 | Железо / Iron | Fe | 2, 3, ( 4), ( 6) |
27 | Кобальт / Cobalt | Co | 2, 3, ( 4) |
28 | Никель / Nickel | Ni | ( 1), 2, ( 3), ( 4) |
29 | Медь / Copper | Сu | 1, 2, ( 3) |
30 | Цинк / Zinc | Zn | 2 |
31 | Галлий / Gallium | Ga | ( 2). 3 |
32 | Германий / Germanium | Ge | -4, 2, 4 |
33 | Мышьяк / Arsenic | As | -3, ( 2), 3, 5 |
34 | Селен / Selenium | Se | -2, ( 2), 4, 6 |
35 | Бром / Bromine | Br | -1, 1, ( 3), ( 4), 5 |
36 | Криптон / Krypton | Kr | 0 |
37 | Рубидий / Rubidium | Rb | 1 |
38 | Стронций / Strontium | Sr | 2 |
39 | Иттрий / Yttrium | Y | 3 |
40 | Цирконий / Zirconium | Zr | ( 2), ( 3), 4 |
41 | Ниобий / Niobium | Nb | ( 2), 3, ( 4), 5 |
42 | Молибден / Molybdenum | Mo | ( 2), 3, ( 4), ( 5), 6 |
43 | Технеций / Technetium | Tc | 6 |
44 | Рутений / Ruthenium | Ru | ( 2), 3, 4, ( 6), ( 7), 8 |
45 | Родий / Rhodium | Rh | ( 2), ( 3), 4, ( 6) |
46 | Палладий / Palladium | Pd | 2, 4, ( 6) |
47 | Серебро / Silver | Ag | 1, ( 2), ( 3) |
48 | Кадмий / Cadmium | Cd | ( 1), 2 |
49 | Индий / Indium | In | ( 1), ( 2), 3 |
50 | Олово / Tin | Sn | 2, 4 |
51 | Сурьма / Antimony | Sb | -3, 3, ( 4), 5 |
52 | Теллур / Tellurium | Te | -2, ( 2), 4, 6 |
53 | Иод / Iodine | I | -1, 1, ( 3), ( 4), 5, 7 |
54 | Ксенон / Xenon | Xe | 0 |
55 | Цезий / Cesium | Cs | 1 |
56 | Барий / Barium | Ba | 2 |
57 | Лантан / Lanthanum | La | 3 |
58 | Церий / Cerium | Ce | 3, 4 |
59 | Празеодим / Praseodymium | Pr | 3 |
60 | Неодим / Neodymium | Nd | 3, 4 |
61 | Прометий / Promethium | Pm | 3 |
62 | Самарий / Samarium | Sm | ( 2), 3 |
63 | Европий / Europium | Eu | ( 2), 3 |
64 | Гадолиний / Gadolinium | Gd | 3 |
65 | Тербий / Terbium | Tb | 3, 4 |
66 | Диспрозий / Dysprosium | Dy | 3 |
67 | Гольмий / Holmium | Ho | 3 |
68 | Эрбий / Erbium | Er | 3 |
69 | Тулий / Thulium | Tm | ( 2), 3 |
70 | Иттербий / Ytterbium | Yb | ( 2), 3 |
71 | Лютеций / Lutetium | Lu | 3 |
72 | Гафний / Hafnium | Hf | 4 |
73 | Тантал / Tantalum | Ta | ( 3), ( 4), 5 |
74 | Вольфрам / Tungsten | W | ( 2), ( 3), ( 4), ( 5), 6 |
75 | Рений / Rhenium | Re | (-1), ( 1), 2, ( 3), 4, ( 5), 6, 7 |
76 | Осмий / Osmium | Os | ( 2), 3, 4, 6, 8 |
77 | Иридий / Iridium | Ir | ( 1), ( 2), 3, 4, 6 |
78 | Платина / Platinum | Pt | ( 1), 2, ( 3), 4, 6 |
79 | Золото / Gold | Au | 1, ( 2), 3 |
80 | Ртуть / Mercury | Hg | 1, 2 |
81 | Талий / Thallium | Tl | 1, ( 2), 3 |
82 | Свинец / Lead | Pb | 2, 4 |
83 | Висмут / Bismuth | Bi | (-3), ( 2), 3, ( 4), ( 5) |
84 | Полоний / Polonium | Po | (-2), 2, 4, ( 6) |
85 | Астат / Astatine | At | нет данных |
86 | Радон / Radon | Rn | 0 |
87 | Франций / Francium | Fr | нет данных |
88 | Радий / Radium | Ra | 2 |
89 | Актиний / Actinium | Ac | 3 |
90 | Торий / Thorium | Th | 4 |
91 | Проактиний / Protactinium | Pa | 5 |
92 | Уран / Uranium | U | ( 2), 3, 4, ( 5), 6 |
Чего не указано в таблице валентности, это то, что валентность элемента может быть постоянной и переменной.
Виды валентности | ||
Постоянная (у металлов главных подгрупп) | Переменная (у неметаллов и металлов побочных подгрупп) | |
Высшая (равна номеру группы) | Низшая (равна разности между числом 8 и номером группы) | |
Знание валентности элементов необходимы для правильного составления химических формул соединений.
Таблица характерных значений валентностей некоторых атомов химических соединений.
Элементы | Валентность | Примеры соединений |
H, F, Li, Na, K | I | H2, HF, Li2O, NaCl, KBr |
O, Mg, Ca, Sr, Ba, Zn | II | H2O, MgCl2, CaH2, SrBr2, BaO, ZnCl2 |
B, Al | III | BCl3, AlBr3 |
C, Si | IV | CO2, CH4, SiO2, SiCl4 |
Cu | I, II | Cu2O, CuO |
Fe | II, III | FeCl2, FeCl3 |
Cr | II, III, VI | CrCl2, CrCl3, CrO3 |
S | II, IV, VI | H2S, SO2, SO3 |
N | III, IV | NH3, NH4Cl, HNO3 |
P | III, V | PH3, P2O5, H3PO4 |
Sn, Pb | II, IV | SnCl2, SnCl4, PbO, PbO2 |
Cl, Br, I | I, III, V, VII | HCl, ClF3, BrF5, IF7 |
Таблица элементов с постоянной валентностью.
Валентности | Элементы |
I | H, Na, Li, K, Rb, Cs |
II | O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd |
III | B, Al, Ga, In |
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.