Контрольная работа по теме "неметаллы" | тест по химии (9 класс) по теме: | образовательная социальная сеть
9 класс
Контрольная работа по теме «Неметаллы»
Вариант 1
Часть 1
При выполнении заданий с выбором ответа (А1 — А8) запишите в тетрадь номер правильного ответа.
А1. Заряд ядра атома 17 имеют атомы химического элемента:
1) азота 2)кислорода 3)серы 4)хлора
А2. Число общих электронных пар в молекуле водорода:
- 1 2)2 3)3 4)4
А3. Ковалентная неполярная связь имеется в молекуле вещества, формула которого :
1) N2 2)CH4 3)HCI 4)Na2S
А4. Степень окисления фосфора в ряду веществ, формулы которых
Са3 Р2 — Р — Р2О3 — Р2О5
- повышается от 0 до 5
- повышается от -3 до 5
- понижается от 6 до -2
- повышается от -4 до 4
А5. Реактивом на карбонат-анион является катион:
- Н 2)NН4 3)К 4)Nа
А6.Химическая реакция возможна между веществами , формулы которых:
- SiO2 и Н2О 3) Р2О5 и NaОН
- SO2 и СO2 4) Н2SiO3 и Mg
А7. Оксид серы (IV) не образуется при взаимодействии веществ, формулы которых :
- S и O2 3) Hg и Н2SO4(конц)
- Н2SO4(конц) и Сu 4) СаСО3 и Н2SO4
А8. Массовая доля азота в сульфате аммония равна
- 12,3 % 2)21,2 % 3)43,1% 4) 48,5%
Часть 2
В 1. В ряду химических элементов Ge —► Si—► C
1) увеличивается радиус атомов
2) усиливаются неметаллические свойства соответствующих им простых веществ
3) ослабевает основный характер их высших оксидов
4) увеличивается чило электронов во внешнем слое
5) увеличивается заряд ядра атомов
Ответ:
В2. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества Продукты реакции
A) CuSO4 NaОН 1) Н2O CuSO4
Б) Сu(OH)2 Н2SO4 2) CuCI2 BaSO4
В) CuSO4 BaCI2 3) Na2SO4 Сu(OH)2
4) CuCI2 BaSO4
5) CuCI2 SO2 Н2О
Ответ:_
Часть 3
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С—► СO2—►Na2СO3 —► NaСI
С 2. К 27 г раствора с массовой долей хлорида меди 10% добавили избыток раствора сульфида натрия. Определите массу выпавшего осадка.
9 класс
Контрольная работа по теме «Неметаллы»
Вариант 2
Часть 1
При выполнении заданий с выбором ответа (А1 — А8) запишите в тетрадь номер правильного ответа.
А1. Заряд ядра атома 14 имеют атомы химического элемента:
1) азота 2) кислорода 3) кремния 4) углерода
А2. Число общих электронных пар в молекуле азота:
- 1 2)2 3)3 4)4
А3. Ковалентная полярная связь имеется в молекуле вещества, формула которого :
1) N2 2)O2 3) NaCI 4)H2S
А4. Степень окисления серы в ряду веществ, формулы которых
SO3 — SO2 — S — H2S
- повышается от 0 до 5
- понижается от 5 до 0
- повышается от -4 до 4
- понижается от 6 до -2
А5. Реактивом на сульфат -анион является катион:
- Н 2)NН4 3) Ba2 4)Nа
А6. Химическая реакция возможна между веществами , формулы которых:
- СO2 и NaОН 3) SO2 и N2О5
- Cu и Н2SO4(разб) 4) Р2О5 и HCI
А7. Оксид углерода (IV) образуется при взаимодействии веществ, формулы которых :
- Na2 CO3 и KСI 3) СO и Н2O4
- СаСО3 и HCI 4) СаСО3 и K2SO4
А8. Массовая доля кислорода в нитрате меди (II) равна
- 32,8 % 2)44,9 % 3)51,1% 4) 66,3%
Часть 2
В 1. В ряду химических элементов As —► P—► N
1) увеличивается электроотрицательность
2) возрастают радиусы атомов
3) усиливаются металические свойства
4) увеличивается чило электронов во внешнем слое
5)уменьшается радиус атомов элементов
Ответ:
В2. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества Продукты реакции
A) FeSO4 KОН 1) Fe(OH)2 K2SO4
Б) K2O Н2SO4 2)K2O Fe(OH)2
В) KОН SO2 3) K2SO4 H2 O
4) K2SO3 H2 O
5) K2SO4 H2
Часть 3
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СI2—► HСI—►NaСI —► AgСI
С 2. На 300 г. известняка, содержащего 75% карбоната кальция , подействовали избытком соляной кислоты. Вычислите объем (н.у) выделившегося газа.
Время выполнения работы 45 мин.
Система оценивания
Часть 1-8 баллов, часть 2 — 4 балла(2 2), часть 3 — 10 баллов (3 4). Итого: 19 баллов.
19-17 баллов- «5»
16-13 баллов- «4»
12-7 баллов- «3»
менее 7 баллов — «2»
Ответы:
Неметаллы
Видеофрагмент даёт представление об особенностях строения и свойствах атомов неметаллов, о положении их в Периодической системе, особенностях их физических и химических свойств, нахождении в природе и получении.
Как известно,
традиционное деление элементов на металлы и неметаллы исторически сложилось
из-за того, что металлы, как правило, находятся в твёрдом агрегатном состоянии,
имеют металлический блеск, тепло- и электропроводны, ковки и пластичны, а
неметаллы при обычных условиях этими свойствами не обладают.

К неметаллам
относятся 23 химических элемента, все неметаллы являются элементами главных
групп.

Условная граница
между металлами и неметаллами находится на линии в направлении от бора к астату. Таким образом,
элементы, расположенные начиная с третьей А группы и заканчивая восьмой А
группой, являются неметаллами. К неметаллам относится и водород, расположенный
в первой A группе.
Число элементов неметаллов
в группе увеличивается с номером группы.
В третьей Aгруппе находится только
один элемент неметалл – бор, а восьмая A группа полностью
состоит из неметаллов.
Для некоторых
неметаллов используют групповые названия. Элементы восьмой Aгруппы называются благородными,
или инэртными газами, элементы седьмой A группы называются
галогенами, элементы шестой Aгруппы – халькогенами.
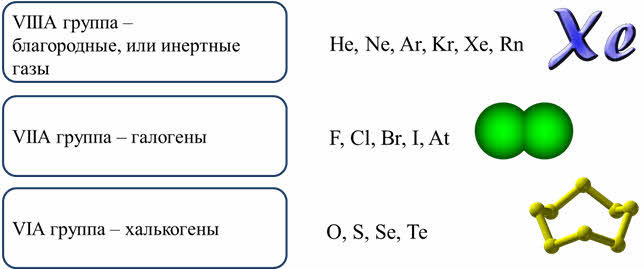
Наиболее типичными
неметаллами являются: водород, кислород, углерод, азот, фосфор,
сера, а также галогены – фтор, хлор, бром, йод.
Элементы,
расположенные вдоль условной разграничительной линии: бор, кремний, германий,
мышьяк, селен, тэллур, астат, являются неметаллам, но могут проявлять и металлические
свойства, поэтому их называют полуметаллами.
У атомов
большинства неметаллов, кроме водорода, гелия и бора, на внешнем энэргетическом
уровне от четырёх до восьми электронов. У атома водорода на внешнем уровне
содержится только один электрон, у гелия – два и его электронный слой полностью
заполнен, у бора на внешнем энергетическом уровне находится три электрона.
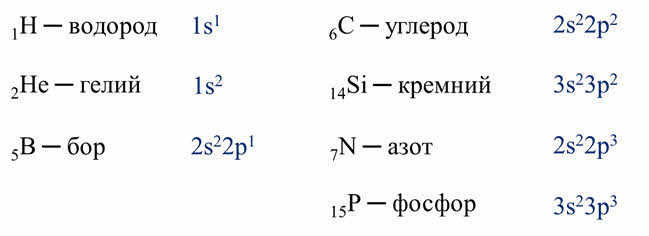
Число электронов
на внешнем уровне численно равно номеру группы. Так, углерод и кремний –
элементы четвёртой A группы содержат четыре электрона на
внешнем энэргетическом уровне, а азот и фосфор – элементы пятой A группы содержат
пять электронов на внешнем слое.
Атомы водорода и
гелия относятся к эс-элементам, а все остальные атомы неметаллов – к пэ-элементам.
Электроотрицательность неметаллов
гораздо выше, чем металлов.
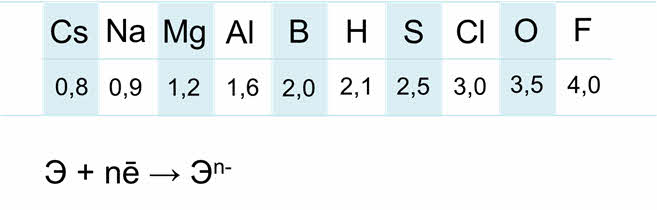
Электроны внешнего
энэргетического уровня прочно связаны с ядром, поэтому для атомов неметаллов
характерна способность присоединять электроны до завершения внешнего слоя.
Для атомов
неметаллов возможны различные степени окисления. Максимальная
положительная степень окисления, кроме кислорода и фтора, равна номеру
группы. Например, у углерода и кремния плюс четыре, у азота и фосфора — плюс пять, у хлора — плюс семь, у серы
— плюс шесть.
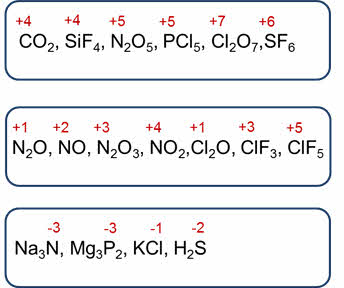
Некоторые
неметаллы проявляют несколько положительных степеней окисления. Например, азот
может кроме плюс пяти иметь такие степени окисления, как плюс один, плюс два,
плюс три, плюс четыре, а хлор, кроме степени окисления плюс семь, имеет степени
окисления плюс один, плюс три, плюс пять.
Минимальная
отрицательная степень окисления равна номер группы минус восемь. У азота
и фосфора минимальная отрицательная степень окисления равна минус трём, у
атомов галогенов — минус один, у
серы — минус два.
Таким образом,
атомы неметаллов в их соединениях с атомами металлов, водорода и других менее
электроотрицательных элементов проявляют отрицательные степени окисления,
а в соединениях с более электроотрицательными элементами для атомов неметаллов
характерны положительные степени окисления.
Благородные газа – ксенон и в
меньшей степени криптон – в своих соединениях со фтором и кислородом также
способны проявлять положительные степени окисления плюс два, плюс четыре, плюс
шесть и плюс восемь.
Исключение
составляет фтор, который в соединениях может проявлять только степень окисления
минус один.
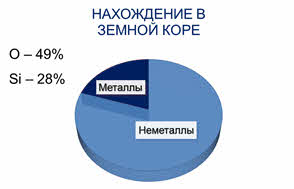
Массовая доля
неметаллов в земной коре составляет почти 80%, а во вселенной достигает
девяноста девяти процентов (в основном за счёт водорода и гелия). На долю
кислорода в земной коре приходится более 49%, на долю кремния – около 28%, а на
долю брома, йода, селена и тэллура – сотые доли процента.
Неметаллы входят и
в состав живых организмов. Эти элементы называются органогенными. К ним
относятся: углерод, кислород, водород, азот, фосфор, сера.
Несмотря на
незначительное содержание селена, брома, йода в живых организмах, эти элементы
относятся к жизненно необходимым.
В последние годы
учёные установили, что селен оберегает клетки от вредного воздействия
ультрафиолетового и радиоактивного облучения. Селен содержится в таких
грибах, как лисички, опята, маслята, но значительно больше этого элемента
содержится в ядовитых грибах: бледной поганке, мухоморе.

По мнению учёных,
большие концентрации селена в грибах способствуют их быстрому росту. Но следует
помнить, что употребление продуктов, содержащих селен в больших количествах,
больше пяти миллиграмм на один килограмм пищи, приводит к острому отравлению
организма человека.
В природе неметаллы
встречаются как в виде простых веществ, так и в виде сложных соединений.
Большая часть неметаллов входит в состав минералов и горных пород, в состав
органических соединений.

Молекулы
неметаллов могут быть одноатомными(благородные газы), двухатомными
(галогены, кислород, азот и водород), а также содержать большее число атомов (как
озон, фосфор и сера).
Атомы некоторых
неметаллов могут образовывать цепи, например, атомы углерода образуют цепи
неограниченной длины, а атомы кремния – недлинные цепи (до шести атомов).
Неметаллы образуют
вещества молекулярного строения (кислород, азот, сера, благородные газы) и
немолекулярного строения (углерод в виде алмаза и графита).
Для неметаллов
характерно разнообразие в физических свойствах. Как вы знаете, при обычных
условиях кислород, водород, азот, фтор, хлор – газы, как и элементы благородные,
или инэртные газы.
Единственной жидкостью
среди неметаллов является бром. Все остальные неметаллы – твёрдые вещества,
которые имеют атомную кристаллическую решётку, как у бора и кремния, так и
молекулярную, как у йода, фосфора, серы.
Многие неметаллы
обладают окраской: графит – серо-чёрной, бром – красно-бурой, сера – жёлтой,
хлор – жёлто-зелёной, йод – фиолетово-чёрной.

Очень различаются
и другие физические свойства неметаллов: так температура плавления графита
составляет 3850 градусов по Цэльсию, а у гелия —
минус 272 градуса по Цэльсию.
Плотность
газообразных неметаллов также различна: самая маленькая – у водорода, а самая
большая – у радона.
Твёрдые неметаллы
не обладают пластичностью.
В воде неметаллы
нерастворимы или малорастворимы. Некоторые из них, как галогены, сера лучше
растворяются в органических растворителях, а белый фосфор – в сероуглероде.
Различаются
неметаллы и по электропроводности. Большинство неметаллов – это изоляторы.
Графит – является
хорошим проводником электрического тока. Кремний, селен и тэллур обладают
полупроводниковыми свойствами.
Интересно, что
радиоактивный радон используется в медицине для лечения опорно-двигательного
аппарата, сердечных и нервных заболеваний. Но в тоже время в литературе часто
упоминается термин «радоновая проблема», который означает достаточно высокое
облучение, вызванное радоном, который выделяется через разломы в земной коре.
Для неметаллов
характерно явление аллотропии.
Аллотропия (от греч. аллотропия
– другое свойство) явление существования элементов в виде нескольких простых
веществ. Так, химический элемент кислород в природе существует в виде двух
простых веществ – кислорода и озона. Различный состав и строение молекул
определяют различие в их свойствах.
Кислород – газ без цвета и
запаха, озон – газ светло-голубого цвета с резким характерным
запахом. Они различаются также температурами плавления и кипения, реакционной
способностью.
В природе озон
образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Озон в
верхних слоях атмосферы образует озоновый слой, который защищает живые
организмы от ультрафиолетового излучения.
Небольшое
количество озона в воздухе оказывает целебное действие на людей с заболеванием
лёгких, но сильное обогащение воздуха озоном может стать опасным для здоровья.
Источником озона служат работающие ксероксы, лазерные принтеры, источники
ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых
находятся такие приборы необходимо часто проветривать.
Химический элемент
углерод также встречается в нескольких аллотропных модификациях: графит, алмаз,
карбин, фуллерен, но наиболее распространены алмаз и графит, которые отличаются
по своим свойствам. Графит – мягкое, серо-чёрное вещество, хорошо проводит
электрический ток, а алмаз – прозрачный кристалл, самое твёрдое природное
вещество, является изолятором.
Простые вещества
неметаллы различаются и по химической активности. Наиболее химически
активны галогены и кислород. Сера, фосфор, углерод и кремний вступают в
химические реакции, как правило, только при нагревании.
Для неметаллов
характерны и восстановительные, и окислительные свойства. Способность
неметаллов проявлять те или иные свойства определяется положением их в ряду электроотрицательности.
Электрооотрицательность уменьшается от фтора к водороду.
В качестве
окислителей неметаллы взаимодействуют с металлами. Например, при горении магния
в кислороде образуется оксид магния, кислород понижает свою степень окисления с
нуля до минус двух, поэтому он вступает в роли окислителя, при горении железа в
хлоре образуется хлорид железа три, хлор понижает степень окисления с нуля до
минус единицы, поэтому хлор является окислителем.
В реакции с
водородом неметаллы выступают в качестве окислителей, а водород – в качестве
восстановителя. Например, в реакции водорода с серой образуется сероводород. Сера
понижает свою степень окисления с нуля до минус двух, поэтому сера –
окислитель.
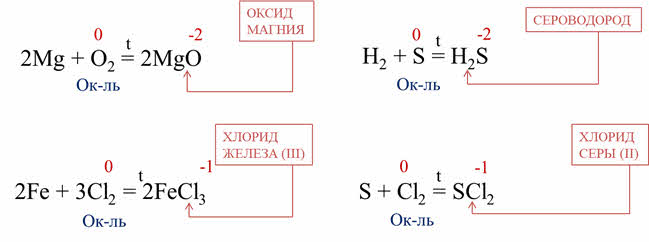
Неметаллы
выступают в роли окислителей при взаимодействии с другими неметаллами, имеющими
более низкую электроотрицательность. Так, в реакции серы с хлором образуется
хлорид серы два, хлор понижает свою степень окисления с нуля до минус единицы,
поэтому хлор – окислитель.
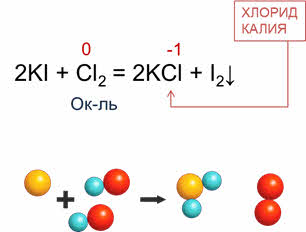
Неметаллы
реагируют и со сложными веществами: в реакции хлора с йодидом калия
образуется хлорид калия и йод. В этой реакции хлор понижает свою степень
окисления с нуля до минус единицы, поэтому в данной реакции хлор является
окислителем.
В качестве
восстановителей неметаллы выступают в реакциях с неметаллами, атомы которых
имеют более высокое значение электроотрицательности. Например, в реакции горения
серы образуется оксид серы четыре, в данной реакции сера повышает свою степень
окисления с нуля до плюс четырёх, поэтому в этой реакции сера – восстановитель.
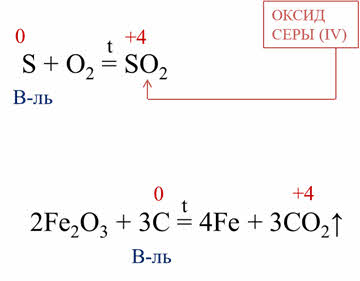
Восстановительные
свойства неметаллы проявляют и в реакциях со сложными веществами. Например, в
реакции углерода с оксидом железа три углерод повышает свою степень окисления с
нуля до плюс четырёх, выступая в роли восстановителя.
В реакциях диспропорционирования
один и тот же неметалл является одновременно и окислителем, и восстановителем.
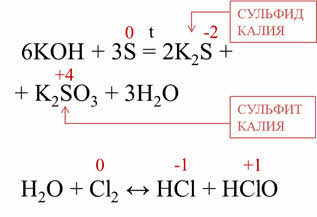
Например, в
реакции серы с гидроксидом калия образуется сульфид калия, сульфит калия и вода.
Сера, таким образом, изменила свою степень окисления с нуля до мину двух и плюс
четырёх. В реакции хлора с водой хлор также изменяет свою степень окисления с
нуля до минус единицы и плюс единицы.
Таким образом, все
неметаллы являются элементами главных групп. Атомы неметаллов могут проявлять
как отрицательные, так и положительные степени окисления. Простые вещества
неметаллы существенно различаются между собой физическими и химическими
свойствами. Для неметаллов характерно явление аллотропии. В химических реакциях
неметаллы могут проявлять окислительные и восстановительные свойства.
Сера, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Тренировочные задания
1. Водород при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кислородом и железом2) серой и хромом3) оксидом углерода (II) и соляной кислотой4) азотом и натрием
2. Верны ли следующие утверждения о водороде?
А. Перекись водорода можно получить сжиганием водорода в избытке кислорода.Б. Реакция между водородом и серой идёт без катализатора.
1) верно только А2) верно только Б3) верны оба суждения4) оба суждения неверны
3. Кислород при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) гелием и железом2) фосфором и цинком3) оксидом кремния (IV) и хлором4) хлоридом калия и серой
4. Верны ли следующие утверждения о кислороде?
А. Кислород не реагирует с хлором.Б. Реакция кислорода с серой даёт SO2.
1) верно только А2) верно только Б3) верны оба суждения4) оба суждения неверны
5. Фтор при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) гелием и железом2) аргоном и азотной кислотой3) оксидом углерода (IV) и неоном4) водой и натрием
6. Верны ли следующие утверждения о фторе?
А. Реакция избытка фтора с фосфором приводит к PF5.Б. Фтор реагирует с водой.
1) верно только А2) верно только Б3) верны оба суждения4) оба суждения неверны
7. Хлор при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кислородом и железом2) фосфором и серной кислотой3) оксидом кремния (IV) и неоном4) бромидом калия и серой
8. Верны ли следующие утверждения о хлоре?
А. Пары хлора легче воздуха.Б. В заимодействие хлора с кислородом приводит к оксиду хлора (V).
1) верно только А2) верно только Б3) верны оба суждения4) оба суждения неверны
9. Бром при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) фосфором и железом2) фосфором и серной кислотой3) оксидом кремния (IV) и хлором4) бромидом калия и серой
10. Верны ли следующие утверждения о броме?
А. Бром не вступает в реакцию с водородом.Б. Бром вытесняет хлор из хлоридов.
1) верно только А2) верно только Б3) верны оба суждения4) оба суждения неверны
11. Йод при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) гелием и железом2) фосфором и кальцием3) оксидом кремния (IV) и хлором4) хлоридом калия и серой
12. Верны ли следующие утверждения о йоде?
А. Раствор йода обладает бактерицидными свойствами.Б. Йод реагирует с хлоридом кальция.
1) верно только А2) верно только Б3) верны оба суждения4) оба суждения неверны
13. Сера при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) натрием и железом2) фосфором и оксидом цинком3) оксидом кремния (IV) и хлором4) хлоридом калия и бромидом натрия
14. Верны ли следующие утверждения о сере?
А. При сплавлении серы и кальция образуется CaS.Б. При реакции серы с кислородом образуется SO2.
1) верно только А2) верно только Б3) верны оба суждения4) оба суждения неверны
15. Азот при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) литием и хлоридом кальция2) хлором и оксидом кальция3) оксидом кремния (IV) и хлором4) литием и кальцием
16. Верны ли следующие утверждения об азоте?
А. В промышленности реакцию азота и водорода осуществляют под высоким давлением в присутствии катализатора.Б. При взаимодействии азота и натрия образуется Na3N.
1) верно только А2) верно только Б3) верны оба суждения4) оба суждения неверны
17. Фосфор при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) натрием и сульфидом кальция2) хлором и кислородом3) оксидом углерода (IV) и серой4) серой и оксидом цинка
18. Верны ли следующие утверждения о фосфоре?
А. Реакция фосфора с хлором идёт только в присутствии катализатора.Б. При реакции фосфора с избытком серы образуются только P2S3.
1) верно только А2) верно только Б3) верны оба суждения4) оба суждения неверны
19. Углерод при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кальцием и сульфатом бария2) хлором и неоном3) оксидом фосфора (V) и серой4) серой и гидроксидом цинка
20. Верны ли следующие утверждения об углероде?
А. При взаимодействии углерода с натрием образуется карбид состава Na2C2.Б. Углерод реагирует с оксидом кальция с образованием CaC2.
1) верно только А2) верно только Б3) верны оба суждения4) оба суждения неверны
21. Кремний при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кислородом и гидроксидом натрия2) хлором и неоном3) оксидом фосфора (V) и серой4) серой и гидроксидом цинка
22. Верны ли следующие утверждения о кремнии?
А. При взаимодействии кремния с углеродом образуется карбид состава SiC.Б. Кремний реагирует с магнием с образованием Mg2Si.
1) верно только А2) верно только Б3) верны оба суждения4) оба суждения неверны
23. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) H2 Ca →Б) H2 Na2SO4 →В) H2 CuO →
ПРОДУКТЫ РЕАКЦИИ1) Na2SO3 H2O2) Cu(OH)23) Cu H2O4) CaH25) Na2S H2O
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) H2 Fe3O4 →Б) H2 N2 →В) H2 Na →
ПРОДУКТЫ РЕАКЦИИ1) Fe(OH)22) NH33) N2H44) Fe H2O 5) NaH
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) O2 Li →Б) O2 Fe(OH)2 H2O →В) O2 (изб.) P →
ПРОДУКТЫ РЕАКЦИИ1) Li2O2) Li2O23) P2O54) Fe(OH)35) P2O3
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) O2 S →Б) O2 Cr(OH)2 H2O →В) O2 (изб.) C →
ПРОДУКТЫ РЕАКЦИИ1) CO2) CO23) SO34) SO25) Cr(OH)3
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) Cl2 Fe →Б) Cl2 Cr →В) Cl2 (изб.) P →
ПРОДУКТЫ РЕАКЦИИ1) PCl32) FeCl23) FeCl34) CrCl35) PCl5
28. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) Cl2 NaOH (охл.) →Б) Cl2 NaOH (нагр.) →В) Cl2 NaBr →
ПРОДУКТЫ РЕАКЦИИ1) NaClO3 NaCl H2O2) NaCl NaClO H2O3) NaClO3 NaCl4) NaCl Br25) NaClBr
29. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) Br2 NaI →Б) Br2 NaOH (нагр.) →В) Br2 NaOH (охл.) →
ПРОДУКТЫ РЕАКЦИИ1) NaClI2) NaBrO NaBr3) NaBrO3 NaBr H2O4) NaBrO NaBr H2O5) NaBr I2
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) Br2 NaOH (нагр.) →Б) Br2 I2 →В) Br2 SO2 H2O →
ПРОДУКТЫ РЕАКЦИИ1) NaBr NaBrO3 H2O2) NaBr NaBrO H2O3) I Br4) H2SO4 HBr5) HBr SO3
31. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) I2 SO2 H2O →Б) I2 H2S →В) I2 HNO3 (конц.) →
ПРОДУКТЫ РЕАКЦИИ1) HIO3 NO2 H2O2) HI S3) HIO NO H2O4) HIO NO25) HI H2SO4
32. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) I2 HNO3 (конц.) →Б) I2 NaOH (нагрев.) →В) I2 Br2 →
ПРОДУКТЫ РЕАКЦИИ1) NaI NaIO H2O2) HIO3 NO2 H2O3) IBr4) HIO NO H2O5) NaI NaIO3 H2O
33. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) S Na →Б) S HI →В) S NaOH →
ПРОДУКТЫ РЕАКЦИИ1) Na2SO3 H2O2) Na2S3) H2S I24) Na2S Na2SO3 H2O5) Na2S H2O
34. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) S Cl2 (недост.) →Б) S HNO3 (конц.) →В) S O2 →
ПРОДУКТЫ РЕАКЦИИ1) H2SO4 NO2 H2O2) SCl63) SO34) SO25) SCl2
35. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) N2 O2 →Б) N2 Na →В) N2 Ca →
ПРОДУКТЫ РЕАКЦИИ1) Ca3N22) NO23) N2O54) NO5) Na3N
36. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) N2 Li →Б) N2 Al →В) N2 H2 →
ПРОДУКТЫ РЕАКЦИИ1) NH32) Li3N3) N2H24) LiN35) AlN
37. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) P H2 →Б) P Cl2 (изб.) →В) P H2SO4 (конц.) →
ПРОДУКТЫ РЕАКЦИИ1) PCl32) H3PO4 SO2 H2O3) H2S PH3 H2O4) PH35) PCl5
38. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) P Br2 (недост.) →Б) P LiВ) P HNO3 (конц.) →
ПРОДУКТЫ РЕАКЦИИ1) H3PO4 NO2 H2O2) Li3P3) H3PO4 NH4NO34) PBr55) PBr3
39. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) C H2SO4 (конц.) →Б) C Ca →В) C Na2SO4 →
ПРОДУКТЫ РЕАКЦИИ1) CO2 SO2 H2O2) Na2SO3 CO3) CaC24) CaC5) Na2S CO2
40. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) C H2O →Б) C HNO3 →В) C S →
ПРОДУКТЫ РЕАКЦИИ1) CO2 NO2 H2O2) CO2 NH4NO33) CO H24) CO2 H25) CS2
41. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) Si O2 →Б) Si S →В) S i Mg →
ПРОДУКТЫ РЕАКЦИИ1) SiS22) Mg2S3) MgS4) SiO25) SiS
42. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВАА) Si Cl2 →Б) Si C →В) Si NaOH →
ПРОДУКТЫ РЕАКЦИИ1) SiC2) SiCl23) Na2SiO3 H24) Na2SiO3 H2O5) SiCl4
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
51. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
52. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
53. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
54. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.

