2.1. Общие сведения
Нейтрализацией называется реакция обмена между кислотой и основанием, при которой оба соединения теряют свои характерные свойства, и происходит образование солей.
Кислоты и основания в водном растворе диссоциируются, насыщая его катионами Н (кислоты) или анионами ОН– (основания). В результате водородный показатель уменьшается или увеличивается.
Причина диссоциации электролитов (кислот, щелочей и их солей) заключается в полярности молекул воды. Показателем, характеризующим способность электролитов к диссоциации в момент равновесия, когда интенсивности диссоциации и противоположного процесса ассоциации стали одинаковыми, характеризуются показателем a, отношением количества диссоциированных молекул к их первоначальному количеству. Электролиты считаются сильными, если a ![]() 0,5. Например, к сильным кислотам относятся: азотная, соляная (
0,5. Например, к сильным кислотам относятся: азотная, соляная (![]() 0,5. Например, к сильным кислотам относятся: азотная, соляная (
0,5. Например, к сильным кислотам относятся: азотная, соляная ( более 0,9), серная (
![]() = 0,58); к слабым – фтороводородная (
= 0,58); к слабым – фтороводородная (![]() = 0,58); к слабым – фтороводородная (
= 0,58); к слабым – фтороводородная ( = 0,15), уксусная (
![]() = 0,13), угольная (
= 0,13), угольная (![]() = 0,13), угольная (
= 0,13), угольная ( = 0,017); к сильным основаниям – едкий натр (
![]() = 0,84), гашеная известь (
= 0,84), гашеная известь (![]() = 0,84), гашеная известь (
= 0,84), гашеная известь ( = 0,90); к слабым раствор аммиака (
![]() = 0,013). Степень диссоциации можно определять по значению Кдис(константы диссоциации), соответствующей равновесному состоянию, и показателем pКдис = –lgКдис. Чем более полно диссоциируется электролит, тем больше значение Кдис и меньше pКдис. Значения этих показателей приводится в литературе [1].Соли сильных кислот и оснований хорошо диссоциируют (a
= 0,013). Степень диссоциации можно определять по значению Кдис(константы диссоциации), соответствующей равновесному состоянию, и показателем pКдис = –lgКдис. Чем более полно диссоциируется электролит, тем больше значение Кдис и меньше pКдис. Значения этих показателей приводится в литературе [1].Соли сильных кислот и оснований хорошо диссоциируют (a ![]() = 0,013). Степень диссоциации можно определять по значению Кдис(константы диссоциации), соответствующей равновесному состоянию, и показателем pКдис = –lgКдис. Чем более полно диссоциируется электролит, тем больше значение Кдис и меньше pКдис. Значения этих показателей приводится в литературе [1].Соли сильных кислот и оснований хорошо диссоциируют (a
= 0,013). Степень диссоциации можно определять по значению Кдис(константы диссоциации), соответствующей равновесному состоянию, и показателем pКдис = –lgКдис. Чем более полно диссоциируется электролит, тем больше значение Кдис и меньше pКдис. Значения этих показателей приводится в литературе [1].Соли сильных кислот и оснований хорошо диссоциируют (a 0,5) и при этом значение рН воды не меняется. Соли сильных кислот и слабых оснований или слабых кислот и сильных оснований способны гидролизоваться; при этом в первом случае выделяется катион водорода, и значение рН уменьшается, во втором – выделяется гидроксид–ион и значение рН возрастает.
Для уменьшения рН воды ее обрабатывают кислотами, для повышения – основаниями. Преимущественно используют сильные электролиты.
Между концентрацией кислоты и основания и значением рН воды существуют прямые связи; соответствующие формулы приведены в табл. 6.2 [2].
Таблица 6.2
Расчет концентрации ионов Н и ОН-,рНрастворов различных соединений
Раствор | Формула для расчета | Пример | |
1. Сильная кислота разбавленная (например, НCl) | [H ] = Ck; pH = –lgCk; | CHCl = 0,1; [H ] = 0,1 = 10–1; pH = 1; | |
2. Сильная щелочь разбавленная (например, NaOH) | [OH–] = C0; pOH = –lgC0; pH = 14 lgC0; | CNaOH = 0,1; [OH–] = 10–1; pOH = 1; pH = 14 – 1 = 13; | |
3. Слабая кислота (например, СН3СООН) | [H ] = pH = 0,5(pKк – lgCк); pH = 0,5(pKк pCк); |
[H ]= pH = 3 – lg 1,36 = 2,87; | |
4. Слабая щелочь (например, NH4OH) | [OH–] = pOH = 0,5(pKо – lgCо); pOH = 0,5(pKо pCо); |
[OH–]= pOH = 4 – 0,78 = 3,22; pH = 14 – 3,22 = 10,78; | |
5. Слабая кислота в присутствии ее соли (например, СН3СООН СН3СООNa) | [H ] = Kк(Ск/Со); pH = pKк – lg(Со/Ск); pH = pKк pСк – pСс; |
[H ]=1,8×10–5 pH = 5 – lg 3,6 = 4,44; | |
6. Слабая щелочь в присутствии ее соли (например, NH4OH NH4Cl) | [OH–] = Kо(Со/Сс); pOH = pKо – lg(Со/Сс); pOH = pKо pСо – pСс; |
[OH–]=1,8×10–5 pOH = 5 – lg 7,2 = 4,14; pH = 14 – 4,14 = 9,86; | |
7. Соль слабой кислоты и сильной щелочи (например, СН3СООNa) | [H ] = pH=7 0,5(pKк lgСc); pH=7 0,5(pKк – pСc); |
[H ]= = pH = 9 – lg 1,35 = 8,87; | |
Раствор | Формула для расчета | Пример | |
8. Соль слабого основания и сильной кислоты (например, NH4Cl) | [H ] = pH=7 – 0,5(pKк lgСc); pH=7 0,5(pСc –pKо); |
[H ]= pH = 6 – lg 7,4 = 5,13; | |
9. Соль слабой двухосновной кислоты (например, Na2CO3) | [H ] = pH=7 0,5(pK»к lgСc); pH=7 0,5(pK»к – pСc); |
[H ]= = pH = 12 – lg 2,4 = 11,62; | |
10. Кислая соль слабой двухосновной кислоты (например, NaHCO3) | [H ] = pH=0,5(pK’к pK»к); |
[H ]= = pH = 9 – lg 4,2 = 8,38; | |
Принятые обозначения: Ск, Со, Сс– молярные концентрации кислоты, основания, соли; Kк, Kо – константы диссоциации кислоты, основания; K’к, K»к – первая и вторая константы диссоциации слабой двухосновной кислоты; pKк, pKо – показатели (отрицательный логарифм) константы диссоциации кислоты, основания;
pСк, pСс – показатели отрицательных логарифмов концентрации кислоты, соли; pOH = 14 – pH.
Под молярной концентрацией вещества понимается количество его грамм-молекул в 1 л раствора. Связь между молярной концентрацией См и концентрацией С в г/л выражается зависимостью: С = СмМ, где М – молекулярная масса вещества.
Методика определения дозы реагента (кислоты или основания) иллюстрируется примером расчета.
Пример 6.1.Определить дозу серной кислоты, необходимую для снижения рН раствора до 4.
В соответствии с примером № 9 табл. 6.2 раствор получается путем обработки воды кальцинированной содой Na2СО3 и при рН = 11,62.
Решение.
При гидролизе Na2СО3, являющейся солью слабой угольной кислоты и сильного основания (едкого натра), образуется NаОН, за счет чего и увеличивается рН воды.
Определим содержание NаОН для рН = 11,62.
рОН = 14 – рН = 14 – 11,62 = 2,38;
lgСмосн = – рОН = –2,38;
Смосн = 0,00417 моль.
Молекулярная масса едкого натра М = 40,01.
С = 0,00417 × 40,01 = 166,84×10–3 г/л = 166,84 мг/л.
Определим “x”–дозу серной кислоты, необходимого для полной нейтрализации едкого натра. Молекулярная масса Н2SО4 равна 98,0.
Н2SО4 2NаОН = Nа2SО4 2Н2О;
x = 166,84 × 98/2 × 40,01 = 204,3 мг/л.
Определим содержание серной кислоты при рН = 4.
рН = –lgСмкисл; lgСмкисл = –4;
Смкисл = 0,0001 моль; С = 0,0001 × 98 = 9,8 × 10–3 г/л = 9,8 мг/л.
Общая доза серной кислоты: 204,3 9,8 = 214,1 мг/л.
Если ввести к расчетной дозе серной кислоты повышающий коэффициент 1,1, как это обычно рекомендуется, то доза составит около 230 мг/л, а рН=3,48 < 4,0.
Поэтому расчетные дозы считается ориентировочными и дозирование производится в соответствии с показаниями рН-метра.
График нейтрализации многоосновной кислоты (рассматривается нейтрализация трехосновной ортофосфорной кислоты) имеет ступенчатый характер со «скачками» в местах отделения катионов водорода и образования новых анионов.
Если нейтрализуемый раствор обладает буферностью, то до исчерпания буферного резерва увеличение дозы нейтрализующего реагента не вызывает изменения водородного показателя. Причина заключается в том, что вводимые для нейтрализации катионы водорода или гидроксид – ионы связываются компонентами буферных растворов в мало диссоциированные соединения.
Выбор нейтрализующих реагентов производится с учетом их эффективности (продолжительность и полнота процесса, удельные дозы реагента), количества и характера, образующихся при нейтрализации продуктов (газы, осадки, растворенные вещества), условий применения (хранение, подготовка к использованию, удобство дозирования, безопасность обслуживания реагентного хозяйства).
Наиболее часто применяют серную, реже – соляную кислоту, из щелочных реагентов – гашеную известь, кальцинированную соду, едкий натр, реже – известняк и доломит CaMg(CO3)2.
В табл. 6.3 приведены количества продуктов, образующихся при нейтрализации сильных кислот некоторыми щелочными реагентами. Как следует из таблицы, почти во всех рассмотренных случаях образуются хорошо растворимые соли.
Исключением является гипс CaSO4, перенасыщенный раствор которого может вызывать образование трудноудаляемых отложений в коммуникациях и в оборудовании.
Таблица 6.3
Количество продуктов, образующихся при нейтрализации сильных кислот, в расчете грамм на грамм кислоты
Кислоты | Продукты | Основания | ||||
Ca(OH)2 | CaCO3 | NaOH | HCO3– | CaMg(CO3)2 | ||
H2SO4 | CaSO4 | 1,39 | 1,39 | – | – | 0,695 |
Na2SO4 | – | – | 1,45 | – | – | |
MgSO4 | – | – | – | – | 0,612 | |
CO2 | – | 0,45 | – | 0,9 | 0,45 | |
HCl | CuCl2 | 1,53 | 1,53 | – | – | 0,775 |
NaCl | – | – | 1,63 | – | – | |
MgCl2 | – | – | – | – | 0,662 | |
CO2 | – | 0,61 | – | 1,22 | 0,61 | |
HNO3 | Cu(NO3)2 | 1,30 | 1,30 | – | – | 0,65 |
NaNO3 | – | – | 1,25 | – | – | |
Mg(NO3)2 | – | – | – | – | 0,588 | |
CO2 | – | 0,35 | – | 0,70 | 0,35 | |
Реагенты вводятся в виде порошков (известь, кальцинированная сода), водных растворов (едкий натр, гашеная известь и др.), газов, активных загрузок фильтров (дробленый мрамор, известняк, доломит); Если на промышленных предприятиях образуются кислые и щелочные стоки, представляется возможной их взаимная нейтрализация путем смешения в регулируемом режиме.
Химическая реакция нейтрализации проходит мгновенно, но условия, от которых зависит ее возможность, требуют контакта между нейтрализуемым веществом и реагентом в течение 5–10 мин. и более. Наибольшая продолжительность контакта требуется в случае, если реагент вводится в виде суспензии (известковое молоко) или порошков, а также при использовании активных загрузок фильтров (мутационная фильтрация).
Корректировка рН применяется с целью оптимизации многих технологических процессов очистки воды: коагуляции, удаления из воды ионов тяжелых металлов, подготовки к сорбции или к ионному обмену, деструкции загрязнений методами окисления и восстановления.
Рассмотрим некоторые случаи корректировки рН воды.
3.2.3. Окисление пероксидом водорода
Пероксид водорода Н2О2 имеет высокий окислительно-восстановительный потенциал, нормальное значение которого в реакции 2Н2О ↔ Н2О2 2Н 2е– равно 1,77 В. При разложении пероксида образуется кислород и выделяется тепло:
2Н2О2 = 2Н2О О2 98,8 кДж/моль.
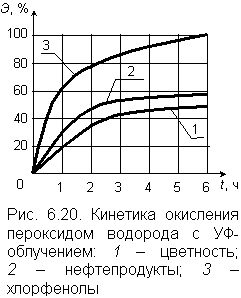 | В условиях химической или физической активации разложение пероксида сопровождается образованием свободных радикалов ОН· и О·, обладающих, как уже отмечалось, чрезвычайно высокой реакционной способностью. В роли катализаторов выступают металлы с переменной валентностью: марганец, медь, железо, кобальт. На рис. 6.20 приведен график, описывающий кинетику окисления фенола пероксидом водорода в присутствии катализатора – двухвалентного железа FeSO4. Окисление продолжается 10–20 минут. За несколько десятков минут в присутствии металлов–катализаторов и в кислой среде полностью (до состояния карбоновой кислоты) разрушаются нитриды, до цианатов – цианиды, органика бытовых сточных вод при рН = 5 на 60 % окисляется до углекислого газа. Сильнейшую активизацию процесса окисления вызывает фотолиз (ультрафиолетовое облучение) в интервале значений рН от 6,5 до 8,0. В этих условиях происходит разложение пероксида водорода и образование свободных радикалов НО·: |
Н2О2 ![]() 2НО·.
2НО·.
Свободные радикалы способны разрушить многие устойчивые соединения. Рассмотрим это на примере окисления предельных углеводородов.
Предельными углеводородами или алканами, к которым относятся метан, этан, пропан и другие, называются соединения, состоящие из атомов углерода и водорода.
Атомы имеют ковалентные связи С–С и С–Н. При разрушении молекулы алкана по связи С–Н образуется углеродный радикал RС и атом водорода.
Например, СН4 (метан) распадается на радикал СН3 (метил) и водород.
Окисление предельных углеводородов свободными радикалами НО· происходит согласно следующим уравнениям реакций:
RСH HO· ↔ RС H2O;
RС O2 ↔ RСOO·;
RСOO· RСH ↔ RСOOH RС;
2RСOOH ↔ RСН RСOO· и т.д.
По японским исследованиям сочетание пероксида водорода с фотолизом позволяет разрушить гуминовые кислоты до углекислого газа и воды, достичь глубокой деструкции СПАВ, нефтепродуктов, пестицидов и ряда других примесей техногенного происхождения.
Достигаемый при этом эффект очистки достаточно высок, как это видно из экспериментальных графиков на рис. 6.20. Исследования были выполнены для воды, содержащей 1,5 мг/л нефтепродуктов, 2,1 мг/л хлорфенола, имеющей цветность 90 градусов. После очистки в воде не содержалось токсичных продуктов окисления.
Применение перекиси водорода имеет то несомненное преимущество, что это наиболее чистый в экологическом отношении способ окисления. В [53] отмечается, что до 25 % производимого в мире пероксида водорода идет на цели охраны окружающей среды.
В табл. 6.5 приводятся некоторые данные о применении пероксида водорода для деструкции различных соединений.
Таблица 6.5
Примеры деструктивных процессов с участием пероксида водорода [53]
Соединение | Уравнение реакции | Удельная доза Н2О2, г/г | рН среды |
Серосодержащие | |||
Сероводород | H2S H2O2 → 2H2O S· | 1 | 6–8 |
Гидросульфиды | HS– H2O2 H → 2H2O S· | 1,03 | £ 8 |
Сульфиды | S2– 4H2O2 → SO42– 4H2O | 4,25 | > 8 |
Меркаптаны и другие тиолсодержащие соединения (RSH) | RSH 3H2O2 OH– → RSO3– 4H2O (2RSH H2O2 → RSSR 2H2O) | > 5 | 2–11 |
Сульфиты | SO32– H2O2 → SO42– H2O | 0,43 | > 8 |
Диалкилсульфиды (RSR) | RSR H2O2 → RSO H2O | > 2 | 2–4 |
Диалкилдисульфиды (RSSR) | RSSR 5H2O2 2OH– → 2RSO3 6H2O | > 5 | 2–11 |
Полисульфиды (SX2–) | S42– 13H2O2 6OH– → 4SO42– 16H2O S52– 16H2O2 8OH– → 5SO42– 20H2O | 3,45 3,4 | > 8 > 8 |
Дитиониты | S2O42– 3H2O2 2OH– → 2SO42– 4H2O | 0,8 | > 8 |
Тиосульфаты | S2O32– 4H2O2 2OH– → 2SO42– 5H2O | 1,21 | > 8 |
Диоксид серы | SO2 H2O2 → H2SO4 | 0,53 | < 6 |
Азот- и хлорсодержащие | |||
Цианиды простые | CN– H2O2 → CNO– H2O (окисление) CNO– H2O H → CO2 NH3 (гидролиз цианатов) | 1,31 | 8,5–10 |
Цианиды комплексные | 2[Cu(CN)3]2– 7H2O2 2OH– → → 2[Cu(OH)2]↓ 6CNO– 6H2O | 1,52 | 9–11 |
Нитриты | NO2– H2O2 → NO3– H2O | 0,74 | 2–5 |
Оксиды азота | NO NO2 2H2O2 → 2HNO3 H2O 2NO2 H2O2 → 2HNO3 | 0,89 0,37 | ³ 10 ³ 10 |
Хлор | Cl2 H2O2 → O2 2HCl | 0,48 | 7–9 |
Гипохлориты | OCl2 H2O2 → O2 Cl– H2O | 0,66 | 7–9 |
Содержащие тяжелые металлы | |||
Перманганаты | 2MnO4– 5H2O2 6H → → 2Mn2 5O2 8H2O | 0,71 | < 3,5 |
Хроматы | 2CrO42– 3H2O2 10H → → 2Cr3 3O2 8H2O | 0,44 | < 3,5 |
Соли железа | Fe2 H2O2 2H → Fe3 2H2O | 0,3 | < 3,5 |
Органосодержащие | |||
Формальдегид | CH2O 2H2O2 → CO2 3H2O | 2,27 | £ 9 |
Гидрохинон | C6H6O2 13H2O2 → 6CO2 16H2O | 4,02 | 4–6 |
Фенол | C6H6OH 14,5H2O2 → 6CO2 18H2O | 5,06 | 3–4 |
Примечание: R – радикал
Свободные радикалы образуются на промежуточных этапах многих реакций окисления с участием пероксида водорода. Это видно, например, из записи многоэтапной реакции окисления двухвалентного железа кислородом воздуха, на четвертом этапе которого образуется пероксид водорода, а на пятом он взаимодействует с катионом двухвалентного железа.
Реактив фентона, состоящий из Н2О2 и Fe2 , служит источником получения свободных радикалов и используется для этой цели при органическом синтезе. Разложение пероксида водорода с образованием свободного радикала происходит в присутствии ионов серебра.
Преимущества пероксида водорода сравнительно с другими окислителями заключается в большей стабильности, простоте аппаратуры, необходимой для обработки воды, избирательным действием по отношению к окисляющимся примесям воды, в пределах которого может применяться этот реагент. Однако, главным преимуществом пероксида водорода является экологическая чистота процесса, о чем упомянуто выше.
Заметим, что в ряде реакций пероксид водорода выступает в качестве восстановителя, а не окислителя. В табл. 6.5 приводятся характерные реакции с участием пероксида водорода при очистке окислением и восстановлением, стехиометрически рассчитанные дозы реагента, рекомендуемые значения рН.
Следует иметь в виду, что дозы должны определяться опытным путем, т.к. зависят от конкретных условий прохождения реакции. Окисление перксидом водорода интенсифицируется в присутствии металлов с переменной валентностью и их окислов (марганец, никель, медь и др.). Как будет показано ниже, пероксид водорода может применяться в сочетании с озонированием.
Как будет показано ниже, пероксид водорода может применяться в сочетании с озонированием.
Железо, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.


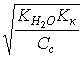 ;
;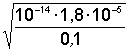 =
=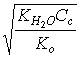 ;
;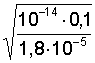 =7,4
=7,4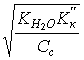 ;
;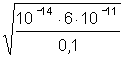 =
=