- История 1: treg-лимфоциты vs. th17-лимфоциты
- Кислородное голодание — симптомы болезни, профилактика и лечение кислородного голодания, причины заболевания и его диагностика на eurolab
- Классификация и стадии развития сердечной недостаточности
- Недостаточность левого желудочка сердца
- Недостаточность правого желудочка сердца
- Систолическая и дистолическая сердечная недостаточность
- Острая и хроническая сердечная недостаточность
- Стадии развития сердечной недостаточности
- Классификация хсн российского общества специалистов по сердечной недостаточности
- Классификация сердечной недостаточности нью-йоркской кардиологической ассоциации
- Лечение сердечной недостаточности
- Этапы оказания помощи пациенту с острой сердечной недостаточностью
- Цели терапии
- Нужна ли госпитализация при сердечной недостаточности
- Медикаментозное лечение
- Хирургические и механические методы лечения
- Питание и режим дня при сердечной недостаточности
- Некоторые современные сведения о факторах hif
- Причины гипоксии головного мозга
- Вместо заключения
История 1: treg-лимфоциты vs. th17-лимфоциты
Наивные CD4 T клетки в зависимости от микроокружения способны дифференцироваться в различные субпопуляции с весьма отличающимися друг от друга функциями: Th1, Th2, Tfh, Th17 и iTreg. Огромное внимание в вопросах аутоиммунных заболеваний и противоопухолевого иммунитета обращено к двум не так давно открытым популяциям T лимфоцитов — Th17 и iTreg [17].
Th17-клетки дифференцируются из наивных CD4 лимфоцитов под действием TGF-β и IL-6; критичным является активация транскрипционных факторов STAT3 и RORgt. Th17-лимфоциты обладают мощным бактерицидным и фунгицидным действием за счет секреции IL-17 и IL-22.
Индуцированные iTreg дифференцируются из наивных CD4 лимфоцитов под действием TGF-β и IL-2; критичным является активация транскрипционного фактора Foxp3. Treg вырабатывают IL-10, TGFβ, экспрессируют на своей поверхности много интересных молекул (типа рецептора к IL-2 СD25, ингибиторного корецептора CTLA-4), за счет которых проявляют свои иммуносупрессивные свойства.
Итого, мы имеем две субпопуляции лимфоцитов, обладающих диаметрально противоположными свойствами, не способными перепрограммироваться друг в друга и происходящие из единого предшественника — наивных CD4 лимфоцитов. Часто говорят о балансе Treg и Th17, сдвиге баланса либо в иммуносупрессивную, либо в провоспалительную сторону при разных заболеваниях, и подчеркивают первостепенную важность механизмов, определяющих дифференцировку по одному из двух путей. Кратко рассмотрим механизмы и попытаемся понять, в чем соль.
Первое, на что внимательный читатель обратит внимание, это общий для двух субпопуляций индуктор TGFβ. Известно, что сами по себе высокие концентрации TGFβ способны поддерживать активацию Foxp3 и коммитировать образование iTreg. Однако для Th17 также характерна активация Foxp3, которая в обязательном порядке должна быть подавлена.
Теперь о роли HIF-1. Для немиелоидных клеток показано, что активация STAT3 может приводить к негипоксической активации HIF-1. HIF-1, в свою очередь, способен ингибировать Foxp3, причем, вероятно, за счет механизма активации полиубиквитинирования с последующей протеасомной деградацией, т.е. механизма по которому HIF-1 разрушается сам.
Ингибируя Foxp3, HIF-1 способствует дифференцировке CD4 наивных лимфоцитов в Th17 направлении. Что интересно, данную STAT3-зависимую негипоксическую активацию HIF-1 с последующим ингибированием Foxp3 можно заменить циклами периодической гипоксии-нормоксии, которая приводит к стабилизации и накоплению HIF-1 (рис. 8).
Любопытно, что то же самое не случается в условиях длительной гипоксии. И виной здесь отрицательная обратная связь — длительная гипоксия повышает экспрессию HIF-зависимой микроРНК-210, которая способна подавлять трансляцию HIF-1α.
Приведенную выше концепцию особой роли HIF-1 в активации фактора RORgt (критичного для Th17) и ингибирования Foxp3 (критичного для Treg) подтверждает недавняя замечательная статья о роли фактора Deltex1 в поддержании стабильности Foxp3 за счет ингибирования его негативного регулятора HIF-1 [18].
Не так давно была открыта новая субпопуляция лимфоцитов — Tr1, обладающих иммуносупрессивными свойствами, при этом не экспрессирующих Foxp3 (маркер регуляторных T-лимфоцитов). Tr1 играют особую роль в супрессии воспаления в нервной системы и кишечнике [19].
Интересно, что гипоксия и повышенная концентрация внеклеточного АТФ — частые атрибуты воспаления — способны угнетать дифференцировку Tr1-лимфоцитов. Весьма красивым оказался механизм: критичным фактором для дифференцировки в Tr1 лимфоциты является фактор AHR, который при взаимодействии со своим ядерным переносчиком ARNT, переносится в ядро и активирует экспрессию IL-10, IL-21 и прочих факторов, определяющих иммуносупрессивные свойства Tr1-лимфоцитов.
Однако ARNT хорошо известен нам как HIF-1β, кислород независимая субъединица, с которой димеризуется HIF-1α. Между HIF-1α и AHR в указанных условиях происходит конкуренция за ARNT и HIF-1α в этой конкуренции побеждает. Впрочем, если условия позволяют, и в схватке побеждает ARNT, ему есть чем ответить — активируясь, он способствует деградации HIF-1α, предположительно за счет повышения экспрессии пролилгидроксилаз PHDs по кислород-зависимому механизму (рис. 9).
Хочется отметить также, что угнетающая роль HIF-1α на дифференцировку Tr1-лимфоцитов оказалась не столь уж однозначной — исследователи отмечают то, что активность HIF-1α важна на ранних стадиях дифференцировки, главным образом, за счет своей способности переключать метаболизм на гликолитический тип.
Кислородное голодание — симптомы болезни, профилактика и лечение кислородного голодания, причины заболевания и его диагностика на eurolab
Микроскопически может наблюдаться отек головного мозга. Ранним признаком гипоксии является нарушение микроциркуляторного русла – стазы, плазматическое пропитывание и некробиотические изменения сосудистых стенок с нарушением их проницаемости, выходом плазмы в перикапиллярное пространство. При тяжелой форме острой гипоксии рано выявляются различной степени поражения нейроцитов вплоть до необратимых. В клетках головного мозга обнаруживают вакуолизацию, хроматолиз, гиперхроматоз, кристаллические включения, пикноз, острое набухание, ишемическое и гомогенизирующее состояние нейронов, клетки-тени. Отмечаются грубые нарушения ультраструктуры ядра, его мембраны, деструкция митохондрий, осмиофилия части нервных клеток.
Выраженность изменений клеток зависит от тяжести гипоксии. В случаях тяжелой гипоксии может происходить углубление патологии клетки после устранения причины, вызвавшей гипоксию; в клетках, не имеющих признаков серьезных повреждений в течение нескольких часов, спустя 1-3 сут и позже можно обнаружить структурные изменения различной тяжести. В дальнейшем такие клетки подвергаются распаду и фагоцитозу, что приводит к образованию очагов размягчения; однако возможно и постепенное восстановление нормальной структуры клеток.
При хронической гипоксии морфологические изменения нервных клеток обычно менее выражены; глиальные клетки ЦНС при хронической гипоксии активизируются и усиленно пролиферируют.
При возникновении острой кислородной недостаточности часто развивается возбуждение нервной системы, сменяющееся торможением и нарастающим угнетением ее функций. Возбуждение сопровождается двигательным беспокойством, эйфорией, учащением сердцебиения и дыхания, бледностью кожных покровов, появлением холодного пота на лице и конечностях. Вслед за более или менее длительным периодом возбуждения (а нередко и без него) развиваются явления угнетения с возникновением потемнения в глазах (после предшествовавшего «мелькания» перед глазами), головокружения, сонливости, общей заторможенности, оглушенности, с постепенным угнетением сознания.
Растормаживание и индукционное усиление деятельности подкорковых образований сопровождаются беспорядочной двигательной активностью, судорожными сокращениями мышц, общими тоническими и клоническими судорогами. Этот период обычно бывает кратковременным. Дальнейшее распространение торможения сопровождается изменением безусловных рефлексов: выпадают сначала кожные рефлексы (брюшные, подошвенные, кремастерные), затем надкостничные (запястно-лучевые, надбровные) и, наконец, сухожильные, которые вначале резко усиливаются, а потом угасают, обычно сначала на верхних, а затем на нижних конечностях. Далее выпадают зрачковые и корнеальные рефлексы. Однако последовательность исчезновения рефлексов не всегда бывает одинаковой; отмечаются случаи длительного сохранения отдельных рефлексов при отсутствии остальных. Двигательные расстройства характеризуются развитием спастического паралича с повышением тонуса мышц, рефлексов, появлением патологических и защитных рефлексов, а затем тонус мышц снижается, рефлексы угасают. При быстром развитии глубокого кислородного голодания уже через несколько десятков секунд происходит потеря сознания, а спустя 1-2 мин развивается кома. Вследствие гипоксии мозга могут развиваться следующие неврологические синдромы.
• Коматозные состояния (в зависимости от распространенности угнетения функций мозга
и уровня регуляции сохранившихся функций):
а) состояние декортикации (подкорковая кома); б) переднестволовая (диэнцефально-мезэнцефальная), или «гиперактивная», кома;
в) заднестволовая, или «вялая», кома; г) терминальная (запредельная) кома.
• Состояния частичного нарушения сознания: а) сопор; б) оглушение; в) сомноленция.
• Синдромы диффузного органического поражения: а) тяжелая постгипоксическая
энцефалопатия (с мнестическими, зрительными, мозжечковыми, стриарными расстройствами);
б) умеренно выраженная постгипоксическая энцефалопатия.
• Астенические состояния (постгипоксическая астения с явлениями гипо- и гиперстении).
Перечисленные синдромы могут быть фазами проявления последствий гипоксии мозга.
В основе наиболее тяжелой степени коматозного состояния (запредельная кома) лежит угнетение функций центральной нервной системы, клинически проявляющееся арефлексией, гипотонией мышц, отсутствием электрической активности мозга («молчание»), расстройствами дыхания. Сохраняются деятельность сердца, автоматическая деятельность других органов за счет периферической вегетативной регуляции.
При восстановлении функций каудальных отделов ствола возобновляется самостоятельное дыхание (иногда отмечаются нарушения его ритма), вызываются корнеальные рефлексы — это «вялая», или заднестволовая, кома. Дальнейшее восстановление функций передних отделов ствола может проявляться мезэнцефальными и диэнцефальными симптомами в форме тонических судорог, вздрагиваний, выраженных вегетативных симптомов – гипертермии, мигрирующей гиперемии, гипергидроза, резких колебаний артериального давления. Такая кома определяется как «гиперактивная», или переднестволовая.
С частичным восстановлением функций подкорковых узлов связаны особенности подкорковой комы, или состояния декортикации. Клиническая картина ее характеризуется выраженными симптомами орального автоматизма (иногда сосательными и жевательными движениями), усилением деятельности подкорковых рефлекторных уровней – стволовых, спинальных, периферических, вегетативных. Сухожильные рефлексы повышены, кожные – угнетены, вызываются стопные и кистев ые патологические рефлексы. Явления раздражения проявляются хореиформными и атетоидными гиперкинезами, миоклоническими подергиваниями в отдельных мышечных группах. На ЭЭГ определяются диффузные медленные волны.
По мере восстановления сознания у больных возникает состояние оглушения. Более глубокое оглушение определяется как сопор, легкие степени оглушения постепенно сменяются сомноленцией, что соответствует восстановлению функций коры головного мозга. При этом признаки восстановления сочетаются с симптомами выпадения и раздражения. Особенности клиники в большей степени определяются состоянием лимбико-ретикулярного комплекса.
При сопорозных состояниях имеются лишь самые элементарные реакции на внешние раздражения. На ЭЭГ обычно доминируют медленные волны. Оглушение сопровождается затруднением понимания больным сложных фраз, ограничением способности произвольных движений, затруднением запоминания. Больные обычно лежат неподвижно. На фоне оглушения иногда возникают сноподобные (онейроидные) состояния. При сомнолентных состояниях больных можно легко вывести из дремотного состояния, они адекватно отвечают на вопросы, но крайне быстро устают. На фоне состояния оглушения выявляются мнестические, гностические, праксические нарушения, симптомы поражения мозжечка и экстрапирамидной системы, а также другие органические симптомы. Такие нарушения определяются как постгипоксическая энцефалопатия, которая характериз уется преи мущественно выраженными расстройствами сознания, памяти, агнозиями, апраксиями, речевыми нарушениями (в форме афазий, дизартрии или мутизма), мозжечковыми симптомами, стриарными гиперкинезами, диффузными очаговыми органическими симптомами. В дальнейшем при восстановлении функций (иногда далеко не полном) долго сохраняются неврастеноподобные симптомы, характерные для постгипоксической астении. В основе этих состояний лежит ослабление тормозного процесса с развитием раздражительной слабости, повышенной возбудимости, бессонницы, снижением внимания и памяти (гиперстеническая форма) либо ослабление и тормозного, и возбудительного процессов, сопровождающееся вялостью, сонливостью, обшей заторможенностью (гипостеническая форма).
Особое значение имеет поддержание деятельности сердечно-сосудистой системы, дыхания, водно-солевого баланса и кислотно-основного состояния. В лечении последствий циркуляторной гипоксии определенное значение имеют наркотические средства, нейролептики. общая и церебральная гипотермия, экстракорпоральное кровообращение, гипербарическая оксигенация. Для предупреждения нарушений микроциркуляции целесообразно применение антикоагулянтов, реополиглюкина. При отеке мозга, часто являющемся следствием гипоксии, применяются противоотечные средства. Однако следует учитывать, что отек мозга возникает иногда спустя многие часы после развития нарушений кровообращения и поэтому может совпасть во времени с феноменом «отдачи» (повышение осмотического давления вследствие ранее примененных дегидратирующих средств).
Противогипоксические средства весьма перспективны, но пока применяются главным образом в эксперименте. Большого внимания заслуживают попытки создания новых хинонов (на основе ортобензохинона). Защитными свойствами обладают препараты типа гутимина, оксибутирата натрия, а также средства из группы ноотропов.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу.
Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Eurolab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Классификация и стадии развития сердечной недостаточности
Выделяют следующие формы сердечной недостаточности:
- лево- и правостороняя;
- систолическая и диастолическая (сердечная недостаточность со сниженной и сохранной фракцией выброса);
- острая и хроническая.
Недостаточность левого желудочка сердца
Левосторонняя сердечная недостаточность бывает левожелудочковой и левопредсердной. Для неё свойственно снижение выброса левого желудочка и/или застой крови на пути к левым отделам сердца, то есть в венах малого круга кровообращения.
Левожелудочковая недостаточность обычно развивается при ишемической болезни сердца (ИБС), гипертензии, кардиомиопатии, врождённых пороках сердца, недостаточности сердечных клапанов, а левопредсердная — при сужении отверстия митрального клапана и в редких случаях при миксоме левого предсердия — доброкачественной опухи сердца [14].
Симптомы при левосторонней сердечной недостаточности (СН): слабость, головокружения, бледность кожи, одышка и быстрая утомляемость.
Недостаточность правого желудочка сердца
Для правожелудочковой недостаточности характерно снижение выброса правого желудочка и застой крови в венах большого круга кровообращения. Состояние обычно вызвано предшествующей недостаточностью левого желудочка или тяжёлыми заболеваниями лёгких [14].
Симптомы при правосторонней СН: периферические отёки, цианоз и скопление жидкости в брюшной полости.
Изолированная сердечная недостаточность встречается редко и кратковременно. В последующем нарушение затрагивает все камеры сердца и развиваются типичные симптомы болезни.
В некоторых источниках для описания сердечной недостаточности обоих желудочков применяют термин «глобальная сердечная недостаточность». Такая формулировка некорректна, и врачами не используется. В литературе для описания этого состояния встречается термин «тотальная сердечная недостаточность» [17].
Систолическая и дистолическая сердечная недостаточность
Нарушение насосной функции левого желудочка может быть вызвано систолической и диастолической дисфункцией. Систолическая дисфункция более распространена и связана со снижением сократимости миокарда — мышечной ткани сердца. В большинстве случаев причиной систолической хронической сердечной недостаточности становится ИБС, сочетаясь с артериальной гипертензией и сахарным диабетом.
Диастолическая дисфункция вызвана нарушением активного расслабления или повышением жёсткости миокарда. Пациенты с этой формой болезни реже страдают ИБС, чаще — от артериальной гипертонии и фибрилляции предсердий. Среди них больше пожилых людей, женщин и пациентов с ожирением [16].
Помимо привычных терминов “диастолическая сердечная недостаточность” и «систолическая сердечная недостаточность», используются названия “сердечная недостаточность с сохраненной фракцией выброса ЛЖ (СНСФВ)” и «сердечная недостаточность со сниженной фракцией выброса (СН СФВ)».
Речь идёт об одних и тех же состояниях, но применение терминов диастолической и систолической СН требует объективных доказательств, полученных с помощью эхокардиографии, магнитно-резонансной томографии и изотопного исследования сердца. В некоторых источниках эти термины используют как синонимы [14][18].
Симптомы при систолической и диастолической СН схожи [13]. Различить эти формы болезни можно только с помощью инструментальных методов диагностики. У многих пациентов наблюдаются одновременно оба вида дисфункции [17].
Острая и хроническая сердечная недостаточность
Симптомы при хронической и острой СН различаются лишь интенсивностью и сроками развития.
Стадии развития сердечной недостаточности
Современная классификация хронической сердечной недостаточности объединяет модифицированную классификацию Российской кардиологический школы по стадиям, которые могут только ухудшаться (В. Х. Василенко, М. Д. Стражеско, 1935 г.), и международную классификацию по функциональным классам, которые определяются способностью больного переносить физическую нагрузку (тест с 6-ти минутной ходьбой) и могут ухудшаться или улучшаться (Нью-Йоркская классификация кардиологов).[2]
Классификация хсн российского общества специалистов по сердечной недостаточности
| ФК | ФК ХСН (могут изменяться на фоне лечения) | НК | Стадии ХСН (не меняются на фоне лечения) |
|---|---|---|---|
| 1ФК | Ограничений физической активности нет; повышенная нагрузка сопровождается одышкой и/или медленным восстановлением | 1 ст | Скрытая сердечная недостаточность |
| 11ФК | Незначительное ограничение физической активности: утомляемость, одышка, сердцебиение | 11а ст | Умеренно выраженные нарушения гемодинамики в одном из кругов кровообращения |
| 111ФК | Заметное ограничение физической активности: по сравнению с привычными нагрузками сопровождается симптомами | 11б ст | Выраженные нарушения гемодинамики в обоих кругах кровообращения |
| 1У ФК | Симптомы СН присутствуют в покое и усиливаются при минимальной физической активности | 111 ст | Выраженные нарушения гемодинамики и необратимые структурные изменения в органах-мишенях. Финальная стадия поражения сердца и других органов |
Классификация сердечной недостаточности нью-йоркской кардиологической ассоциации
Класс I. Заболевание сердца не ограничивает физическую активность. Обычная нагрузка не вызывает усталость, сердцебиение и одышку.
Класс II. Болезнь незначительно ограничивает физическую активность. В покое симптомов нет. Обычная физическая нагрузка вызывает усталость, сердцебиение или одышку.
Класс III. Физическая активность значительно ограничена. В покое симптомов нет. Небольшая физическая активность вызывает усталость, сердцебиение или одышку.
Класс IV. Выраженное ограничение любой физической активности. Симптомы сердечной недостаточности появляются в покое и усиливаются при любой активности [15].
Лечение сердечной недостаточности
Этапы оказания помощи пациенту с острой сердечной недостаточностью
При сердечной недостаточности не стоит заниматься самолечением. Своевременное обращение к врачу поможет избежать негативных последствий.
Цели терапии
Правильно подобранная медикаментозная терапия способна улучшить качество жизни и значительно продлить её продолжительность у больных даже с тяжелыми формами хронической сердечной недостаточности (по данным литературы — до 10 лет).[4]
Стандарты диагностики и лечения сердечной недостаточности, которые утверждены Минздравом, предписывают определенные исследования и манипуляции для пациентов, обратившихся с симптомами, напоминающими сердечную недостаточность; там же есть список лекарственных средств, но без указания, кто и как должен это лечить. Терапевты в поликлиниках не имеют соответствующей подготовки и не могут грамотно оказывать помощь этим больным.
Нужна ли госпитализация при сердечной недостаточности
Причиной госпитализации является декомпенсация — выраженное нарастание отёков и одышки, тахикардия и нарушение сердечного ритма.
В России сегодня почти нет специализированных отделений, где принимали бы больных с этим заболеванием, проводили бы дифференциальную диагностику и подбирали лечение (в Западной Европе введена врачебная специальность «специалист по сердечной недостаточности»). Кто реально занимается индивидуальным подбором лекарственных препаратов для больного? Терапевт, который назначает преимущественно фуросемид (мочегонный препарат), выводящий калий, снижающий давление и ускоряющий наступление летального исхода?
Кардиологические отделения районных больниц, куда с огромным трудом можно госпитализировать тяжелого больного на очень короткий срок, где опять же назначат фуросемид и лишь выведут избыточно накопленную жидкость, а через 1-2 месяца опять наступит ухудшение (правило 4-х госпитализаций: время между каждой последующей госпитализацией сокращается, состояние ухудшается, после 4-й госпитализации больных не остается!) В то время как современные препараты в постепенно повышающихся дозах могут обеспечить гемодинамическую разгрузку сердца, улучшить состояние пациента, уменьшить потребность в госпитализациях, продлить жизнь больного.
При хронической сердечной недостаточности показано сохранять режим питания и нагрузок и непрерывно принимать лекарственные препараты. Одно-двухдневный пропуск может ухудшить состояние, симптомы могут вернуться, и станет неизбежной госпитализация. Хроническая сердечная недостаточность часто встречается у людей пожилого возраста и сочетается с энцефалопатией, и помощь близких может значительно повысить их приверженность к лечению. Нужно обучение правильному питанию, режиму дня, контролю за задержкой жидкости (за рубежом эти функции выполняет специально обученная медсестра, которая осуществляет патронаж больного).
Острая или тяжелая форма хронической сердечной недостаточности подразумевает постельный режим, полный психический и физический покой. В остальных случаях показаны умеренные нагрузки, которые не сказываются на самочувствии. Следует потреблять не более 500-600 мл жидкости в сутки, соли – 1-2 г. Назначается витаминизированное, легкоусвояемое диетическое питание, олигомерные питательные смеси.
Медикаментозное лечение
- Ингибиторы ангиотензинпревращающего фермента (ИАПФ) и блокаторы рецептора ангиотензина II (БРА): снижают нагрузку на сердце. В наше время неназначение ингибиторов АПФ/БРА больному с ХСН приравнивается к неоказанию медицинской помощи пациенту. Назначаются в минимально переносимых дозах, которые постоянно титруются на повышение под контролем АД и уровня креатинина. [12]
- Бета-блокаторы: уменьшают повреждающее воздействие адреналина на сердце, снижают число сердечных сокращений, удлиняя диастолу, улучшают коронарный кровоток. Дозы этих препаратов тоже постепенно увеличивают.
- Диуретики (мочегонные средства): позволяют вывести из организма задержанную жидкость, принимаются ежедневно (а не дважды в неделю, как было принято 10-15 лет назад). Современные диуретики не так значительно выводят калий, а в комбинации с калийсберегающими диуретиками это побочное действие значительно уменьшено. Они предотвращают развитие фиброза миокарда, остановливают прогрессирование ХСН.[8]
- Ингибиторы неприлизина: позволяют увеличить продолжительность жизни больных с ХСН.
- Блокаторы IF каналов: уменьшают частоту сердечных сокращений. ЧСС около 70 в 1 мин. при хронической сердечной недостаточности делают работу сердца наиболее эффективной.
- Сердечные гликозиды: усиливают работу сердца, урежают сердечный ритм.
- Антикоагулянты и антиагреганты: снижают риск тромбообразования, а это, с учетом заболеваний, которые вызывают хроническую сердечную недостаточность, является одной из главных задач в профилактике осложнений.
- Препараты омега-3 полиненасыщенных жирных кислот: улучшают свойства эндотелия сосудов, увеличивают сократимость миокарда, снижают риск жизнеопасных аритмий. В комплексе с основными препаратами дополнительно уменьшают риск смерти.
Если развивается приступ острой сердечной недостаточности левого желудочка (отёк легких), больной подлежит госпитализации, где ему оказывают неотложную помощь. Лечение заключается в введении диуретиков, нитроглицерина, препаратов, которые повышают сердечный выброс (добутамин, дофамин), проводятся ингаляции O2.
Если развивается асцит, показано проведение пункционного удаления жидкости из брюшной полости, при возникновении гидроторакса — плевральная пункция.
Поскольку сердечная недостаточность сопровождается выраженной гипоксией тканей, пациентам показана кислородная терапия. [10]
Хирургические и механические методы лечения
- Восстановление кровотока по коронарным артериям: стентирование коронарных артерий, аорто-коронарное шунтирование, маммаро-коронарное шунтирование (если сосуды сердца значительно поражены атеросклерозом).
- Хирургическая коррекция клапанных пороков сердца (если значительно выражен стеноз или недостаточность клапанов).
- Трансплантация (пересадка) сердца (при ХСН, не поддающейся медикаментозной терапии).
- Ресинхронизирующая терапия при ХСН с широкими комплексами QRS>130 мс., имплантация кардиостимулятора, регулирующего работу сердца.
- Имплантация кардиовертера-дефибрилятора, способного остановить приступ жизнеопасной аритмии.
- Лечение мерцательной аритмии — восстановление синусового ритма.
- Использование аппаратов вспомогательного кровообращения — искусственных желудочков сердца. Они полностью внедряются в организм, через поверхность кожи соединяются с аккумуляторными батареями на поясе у пациента. Искусственные желудочки перекачивают из полости левого желудочка в аорту до 6 л крови в минуту, в результате левый желудочек разгружается, и восстанавливается его сократительная способность.
Питание и режим дня при сердечной недостаточности
Пациенту с сердечной недостаточностью следует уменьшить употребление жидкости до одного литра в сутки. Также следует исключить солёности, пряности и копчёности.
При заболевании нужно больше двигаться и выполнять посильные нагрузки: чаще ходить пешком и заниматься лёгкой гимнастикой.
Некоторые современные сведения о факторах hif
Далее дорогой читатель будет вынужден простить мне несколько справочный раздел, суммирующий часть современных сведений о факторе HIF.
- Что есть гипоксия? Нормоксия — условие, при котором концентрация (напряжение) кислорода в окружающей организм/клетку среде «нормальное атмосферное», т.е. близко к 21%. Гипоксия, соответственно, это все, что ниже, гипероксия — все, что выше указанной цифры. На самом деле, понятия эти весьма условны. Классической нормоксии in vivo нет даже для дыхательного эпителия (~14,5%), а большинство тканей в норме прибывает в условиях так называемой физиологической гипоксии (2–9% в зависимости от ткани, обычно около 5%), которая для них и не гипоксия вовсе. Помимо этого, выделяют также умеренную гипоксию, собственно гипоксию и аноксию. Единой чёткой классификации гипоксий нет, но есть попытки (как в таблице 1).
- Как все начиналось. В самом начале протерозоя — 2,4 млрд. лет назад (или на 830 миллионов лет ранее, если верить совсем свежим данным [3]) — произошла так называемая кислородная катастрофа — довольно стремительное глобальное накопление кислорода в атмосфере Земли, что привело примерно 0,54 млрд. лет назад к формированию атмосферы, близкой к современной. Для многих организмов произошла смена восстановительного, анаэробного типа метаболизма на принципиально новый окислительный тип. Эволюционно возникла потребность в появлении кислород-чувствительного регулятора.
- Основные принципы работы кислород-чувствительных систем. Кислород-чувствительные системы прокариот и эукариот устроены сходным образом — в роли сенсора выступает фермент 2-оксоглутарат оксигеназа с двухвалентным железом в качестве кофактора [4]. Фермент в условиях нормоксии в присутствии 2-оксоглутара и молекулярного кислорода способен гидроксилировать остатки аминокислот (обычно пролина или аспарагина) в составе белка-регулятора транскрипции или трансляции, регулируя его функции (рис. 2).
Кислород-чувствительная система эукариот (PHD-HIF) претерпевала некоторую эволюцию. Уже довольно сходная с человеческой PHD-HIF система функционирует у Trichoplax adhaerens[5] — примитивного двухслойного животного, еще не обладающего билатеральной симметрией (рис. 3).
- Факторы HIFs и канонический кислород-зависимый путь регуляции их активности.У эукариот кислород-сенсорная система связана с функционированием важнейшего транскрипционного фактора HIF, регулирующего работу (по разным оценкам) 1–2% всех генов (что довольно приличная цифра). Факторы HIF представляет собой гетеродимерные белки, состоящие из конститутивно экспрессирующейся HIF-β субъединицы и одной из трех кислород-зависимых HIF-α субъединиц (HIF-1α, HIF-2α или HIF-3α), которые формируют при димеризации с β-субъединицами соответственно HIF-1, HIF-2 и HIF-3 (рис. 4). Лучше всего изучены факторы HIF-1 и HIF-2. Роль 2-оксоглутарат оксигеназы у эукариот выполняют пролилгидроксилазы (PHD 1-3), гидроксилирующие в условиях нормоксии остатки пролина в кислород-чувствительной α-субъединице, что приводит к ее деградации. В условиях гипоксии α- и β-субъединицы образуют гетеродимер, перемещаются в ядро и взаимодействуют с особыми последовательностями в промоторах генов HRE (hypoxia responsive elements), активируя экспрессию этих так называемых HIF-зависимых генов.
В условиях нормоксии транскрипционная активность HIF-1α и HIF-2α регулируется также за счет другого кислород-зависимого фермента — FIH-1 (factor inhibiting HIF-1), который, гидроксилируя остатки аспарагина, способен препятствовать взаимодействию HIFs с кофакторами [6]. - Неканонические пути регуляции активности факторов HIFs или та самая негипоксическая гипоксия. Помните пример с кобальтовой кардиомиопатией? Это был хороший пример так называемого неканонического пути активации HIF, когда он, по сути, активировался в условиях нормоксии. В данном случае Co2 выступает в качестве хелатора Fe2 (содержащегося в активном центре пролилгидроксилаз PHD), ингибирует их функцию и нарушает кислород-зависимое разрушение α-субъединицы. Это приводит к активации HIFs в условиях нормоксии. Так у любителей пива происходила постоянная активация HIFs и HIF-зависимого гена эритропоэтина — даже несмотря на то, что в их кровь была пересыщена гемоглобином, и никакой реальной гипоксии, разумеется, не наблюдалось. Воздействовать на Fe2 в составе пролилгидроксилаз PHD способны активные формы кислорода (АФК) [7], которые образуются в клетке в огромном количестве разнообразных процессов.
Позднее выяснилось, что активность HIF может регулироваться множеством других механизмов на уровне транскрипции, трансляции и посттрансляционных модификаций (фосфорилирование, ацетилирование/деацетилирование, убиквитинирование/деубиквитинирование, SUMO-илирование [8], S-нитрозилирование, NEDD-илирование). Механизмы эти могут быть как зависящими от кислорода, так и нет; как селективными, так и нет по отношению к HIF-1α и HIF-2α изоформам [9]. Но к этому мы вернемся несколько позже. - HIF-1 и HIF-2. В чем разница? А теперь еще один важный пункт — изоформоспецифические особенности фактора HIF. Напомню, что существуют главным образом две изоформы — HIF-1 и HIF-2; они обладают примерно 48%-идентичностью по аминокислотной последовательности, имеют один и тот же сайт для посадки — HRE — и, главным образом, один и тот же перечень контролируемых ими генов. Однако есть и особенности.
- Экспрессия первой изоформы повсеместна; экспрессия же HIF-2 тканеспецифична: это почечная ткань, кишечник, жировая ткань, эндотелий и другие.
- Существует специфика в активируемых изоформами генов: HIF-1 регулирует экспрессию ключевых ферментов гликолиза: 6-фосфофрукто-2-киназы/фруктозо-2,6-бифосфатазы 3, фосфоглицераткиназы, лактатдегидрогеназы А, карбангидразы-9; некоторых антиапоптотических факторов: BNIP3, BNIP3L; тогда как как HIF-2 (кстати, Семенза открыл именно фактор HIF-2) контролирует экспрессию «фактора стволовости» OCT-3/4 [10, 11], циклина D1, эритропоэтина и другие (рис. 5) [12].
- В настоящее время формируется парадигма кооперации двух факторов при гипоксии. Очень наглядно эта концепция продемонстрирована на модели динамики роста сосудов в ответ на ишемию и роста опухолевой массы (рис. 6). И в том, и в другом случае первоначально клетки находятся в состоянии выраженной гипоксии (аноксии) и активируются сразу оба фактора — HIF-1 и HIF-2, причем главным «игроком» является HIF-1. В это время происходят критические, быстрые события: стремительное переключение на гликолиз, защита от апоптоза, продукция ростовых факторов. Постепенно происходит переключение на изоформу HIF-2, которая активна при более умеренной гипоксии и более длительное время, экспрессируется другой спектр факторов, определяющих созревание сосудистой сети и дальнейший рост опухоли с метастазированием.
За переключение изоформ ответственна особая E3 лигаза, названная HAF — hypoxia-associated factor. В условиях продолжительной и незначительной гипоксии она способна связываться с С-концевым доменом HIF-2α, что приводит к его стабилизации и дополнительному повышению трансактивационных свойств HIF-2. В условиях острой, кратковременной гипоксии/аноксии активность ее подавлена. - Факторы HIF способны взаимодействовать с другими факторами, как связанными с регуляцией транскрипции (красивый пример — HIF-1 и HIF-2 по-разному взаимодействуют с участниками Notch-сигналинга и по-разному влияют на биологию стволовой клетки глиобластомы [13]), так и не связанными с транскрипцией (взаимодействие с g-секретазой при раке молочной железы [14]). Неканонические взаимодействия HIF-сигналинга, возможно, одна из самых интригующих и многообещающих областей.
- Случай из практики. В заключение данного раздела скажу, что явления негипоксической активации HIFs и различия в изоформной специфичности между HIF-1 и HIF-2 — это реальные вещи, с которыми я столкнулся лично. В своей дипломной работе я изучал экспрессию эндотелием различных хемокинов под действием ростовых факторов VEGF165 и HGF, по одиночке и в комбинации. Исследовалась закономерная активация киназ ERK-1/2, p38 и активация NF-kB. Экспрессия некоторых хемокинов и факторов адгезии (MCP-1, ICAM-1, VCAM-1) четко ложилась в нашу концепцию о «провоспалительном» действии VEGF165 и «противовоспалительном» действии HGF и согласовывалась с активностью провоспалительного фактора NFkB.
Однако экспрессия и продукция IL-8 (важнейшего провоспалительного хемокина) регулировалась загадочным и не совсем объяснимым образом. Позднее мы решили эту задачу и нашли, что в нашей системе фактор HGF способен стабилизировать и активировать HIF-2 в нормоксических условиях (скорее всего за счет прямого фосфорилирования HIF-2α и повышения стабильности) и, таким образом, повышать экспрессию и продукцию IL-8 (рис. 7), что и придавало загадочности в профиль его экспрессии [15].
Итак, дорогой читатель, я надеюсь, что вы не сильно утомились ознакомлением первой части рассказа. Скорее перейдем к его иммунологическому разделу!
Причины гипоксии головного мозга
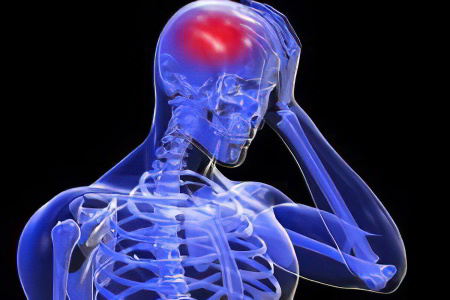
Примерно 20% от всего объема циркулирующей в организме крови поступает в головной мозг. Вместе с клетками крови к органу доставляется кислород и иные полезные вещества, которые необходимы для поддержания его работоспособности.
Различают эндогенную и экзогенную типы гипоксии. Причиной развития экзогенного кислородного голодания головного мозга становится снижение концентрации кислорода в окружающей среде, а именно, во вдыхаемом воздухе. Часто подобная ситуация наблюдается при подъеме в горы, поэтому такое состояние организма называют Высотной или Горной болезнью.
На эндогенное кислородное голодание указывают в том случае, когда уровень кислорода в воздухе понижен, а барометрическое давление остается в норме. Такая ситуация может случиться при нахождении человека в шахтах, а колодцах, в подводной лодке, либо во время операции при погрешностях в работе аппарата, отвечающего за подачу кислорода пациенту, находящемуся под наркозом.
Также гипоксия головного мозга может развиваться при патологических состояниях организма. В связи с этим, различают:
Гипоксия головного мозга, которая развивается на фоне нарушений в органах дыхательной системы.
Приводить к дыхательной гипоксии головного мозга способны следующие причины:
Альвеолярная гиповентиляция. Это может наблюдаться при нарушении проходимости дыхательных путей, например, на фоне воспалительного процесса в легких, при попадании в дыхательные пути инородного тела, по причине спазма дыхательных путей. Также к гипоксии головного мозга способны приводить: пневмония, отек легкого, пневмоторакс, скопление экссудата в плевральной полости. Причиной умеренной гипоксии головного мозга нередко становятся нарушения в подвижности грудной клетки, паралич дыхательной мускулатуры, а также ее спазм на фоне столбняка или миастении. Альвеолярная гиповентиляция может приводить к кислородному голоданию головного мозга при нарушении процессов регуляции дыхания, когда на дыхательный центр воздействуют патогенные факторы. К иным причинам относят: кровоизлияния в органы дыхания, наличие в них опухоли, травмирование продолговатого мозга, передозировка наркотическими или снотворными препаратами, сильные боли, которые возникают у человека во время выполнения дыхательных движений.
Сбой вентиляционно-перфузионных связей развивается по причине нарушения проходимости дыхательных путей на фоне бронхоспазма, эмфиземы легких, пневмосклероза.
Чрезмерное шунтирование венозной крови, что наблюдается при врожденных аномалиях развития сердца.
Затрудненная диффузия кислорода. Причиной становится эмфизема легкого, асбестоз, саркоидоз легкого, интерстициальный отек легкого.
Гипоксия, которая развивается на фоне тех или иных нарушений кровообращения, приводящих к недостаточному кровоснабжению тканей головного мозга. Причинами являются: массивная потеря крови, обезвоживание организма при ожогах или холере и пр. Сюда же относят нарушения в работе сердечной мышцы, например, инфаркт миокарда или кардиосклероз, тампонаду сердца, перегрузки сердца. Зачастую факторы могут встречаться в различных комбинациях. Циркуляторная гипоксия головного мозга развивается на фоне тяжелых инфекционных заболеваний, выраженных аллергических реакций, нарушениях электролитного баланса, при приеме глюкокортикоидов, при повышении вязкости крови, при острой и хронической сердечной недостаточности, при коллапсе и пр.
Сниженная кислородная емкость крови, приводящая к развитию гипоксии головного мозга, может стать следствием таких факторов, как: выраженная анемия с резким падением уровня гемоглобина в эритроцитах. Это часто наблюдается при таких заболеваниях, как туберкулез, язвенная болезнь желудка и кишечника, при отравлении гемолитическими ядами, при массивных ожогах, при малярии, при воздействии на организм ионизирующей радиации, на фоне нехватки витаминов и железа из пищи.
Тканевая гипоксия головного мозга развивается в том случае, когда ткани организма утрачивают способность поглощать кислород из крови. Подобная ситуация развивается на фоне отравления цианидами, при передозировке барбитуратами, антибиотиками, при воздействии на организм отравляющих веществ различного происхождения. Также спровоцировать тканевую гипоксию головного мозга способен дефицит тиамина, рибофлавина и иных витаминов.
Гипоксия головного мозга по смешанному типу развивается тогда, когда к ней приводят несколько факторов одновременно. Стоит отметить, что любая тяжелая гипоксия протекает по смешанному типу, например, при различных видах травматического шока или во время комы.
Вместо заключения
В настоящее время разработаны/разрабатываются методы селективного ингибирования HIF-1 и HIF-2; селективного ингибирования различных изоформ пролилгидроксилаз PHDs, за счет чего возможно активировать HIF-1 и HIF-2, причем также селективно; можно ингибировать фермент FIH-1и прочие участники пути регуляции кислород-зависимого пути деградации. При желании и достаточной фантазии можно пробовать воздействовать на кислород-независимые пути.
Все это, несомненно, должно найти и, я уверен, найдет применение в практической медицине. Но это потребует крайней обдуманности, многостадийного контроля и досконального изучения. Чем далеко ходить, лучше приведу пример.
Не так давно, в начале-середине 2000-х годов, наблюдался некоторый бум: для многих типов онкологических заболеваний была показана сверхэкспрессия HIF-1α, что вполне соответствовало понятиям об опухолевой биологии: быстрорастущая опухолевая масса в условиях жесткой гипоксии переходит на гликолитический анаэробный тип метаболизма [23], при этом активно секретируя вокруг себя многочисленные факторы роста сосудов, факторы инвазии и т.д. Что делать? Подавим экспрессию HIF-1α и дело в шляпе! Не тут-то было — реальность оказалась сложнее и запутанней.
Так, например, при применении siRNA против HIF-1α на культуре пигментного эпителия сетчатки и эндотелия сосудов, наблюдалось вполне закономерное снижение секреции таких ангиогенных факторов как VEGF, TGF-β (это очень хорошо), но росла секреция IL-8, мощного хемокина с ярко выраженными ангиогенными свойствами (это очень плохо)
[24]. Позднее, группой профессора Лобода был раскрыт механизм — дело в том, что HIF-1 подавляет экспрессию IL-8, а HIF-2 — активирует. Подавляя HIF-1 в клетках, исследователи добивались реципрокной активации HIF-2 и экспрессии IL-8 [25]. Такая неоднозначная выходила терапия.
Также нужно быть аккуратными с иммунной системой. Системное подавление HIF-1 при аутоиммунных заболеваниях, возможно, и приведет к снижению популяции Th17 и росту числа Treg, что теоретически способно облегчить течение заболевания, но также способно привести к искусственному комбинированному иммунодефициту за счет дисфункции M1-макрофагов, нейтрофилов, Th1, Th2, Th17 и СD8 T лимфоцитов.
Это, конечно, спекуляции, но все же.
- Alexander C.S. (1972). Cobalt-beer cardiomyopathy: a clinical and pathologic study of twenty-eight cases. Am. J. Med. 53 (4), 395–417;
- Gregg L. Semenza, M.D., Ph.D.Сайт The Johns Hopkins Hospital;
- Satkoski A.M., Beukes N.J., Li W., Beard B.L., Johnson C.M. (2022). A redox-stratified ocean 3.2 billion years ago. Earth Planet. Sci. Lett. 430, 43–53;
- Scotti J.S., Leung I.K., Ge W., Bentley M.A., Paps J., Kramer H.B. et al. (2022). Human oxygen sensing may have origins in prokaryotic elongation factor Tu prolyl-hydroxylation. Proc. Natl. Acad. Sci. USA.111 (37), 13331–13336;
- Loenarz C., Coleman M.L., Boleininger A., Schierwater B., Holland P. W., Ratcliffe P.J., Schofield C.J. (2022). The hypoxia‐inducible transcription factor pathway regulates oxygen sensing in the simplest animal, Trichoplax adhaerens. EMBO Rep. 12 (1), 63–70;
- Prabhakar N.R. and Semenza G.L. (2022). Oxygen sensing and homeostasis. Physiology. 30 (5), 340–348;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- SUMO: японская борьба или уникальная посттрансляционная модификация?;
- Agani F. and Jiang B.H. (2022). Oxygen-independent regulation of HIF-1: novel involvement of PI3K/AKT/mTOR pathway in cancer. Curr. Cancer. Drug Targets. 13 (3), 245–251;
- Была клетка простая, стала стволовая;
- Ствол и ветки: стволовые клетки;
- Koh M.Y. and Powis G. (2022). Passing the baton: the HIF switch. Trends Biochem. Sci. 37 (9), 364–372;
- Hu Y.Y., Fu L.A., Li S.Z., Chen Y., Li J.C., Han J. et al. (2022). Hif-1α and Hif-2α differentially regulate Notch signaling through competitive interaction with the intracellular domain of Notch receptors in glioma stem cells. Cancer Lett. 349 (1), 67–76;
- Villa J.C., Chiu D., Brandes A.H., Escorcia F.E., Villa C.H., Maguire W.F. et al. M. (2022). Nontranscriptional role of Hif-1α in activation of γ-secretase and notch signaling in breast cancer. Cell Rep. 8 (4), 1077–1092;
- Gluhanyuk E., Makarevich P., Gallinger J., Dergilev K., Beloglazova I., Parfyonova Ye. (2022). Diverse modulation of endothelial chemokine production by VEGF165 and HGF via NFkB and HIF-2. Материалы конференции Hypoxia: From Basic Mechanisms to Therapeutics;
- Palazon A., Goldrath A.W., Nizet V., Johnson R.S. (2022). HIF transcription factors, inflammation, and immunity. Immunity. 41 (4), 518–528;
- Phan A.T. and Goldrath A.W. (2022). Hypoxia-inducible factors regulate T cell metabolism and function. Mol. Immunol. doi: 10.1016/j.molimm.2022.08.004;
- Hsiao H.W., Hsu T.S., Liu W.H., Hsieh W.C., Chou T.F., Wu Y.J. et al. (2022). Deltex1 antagonizes HIF-1α and sustains the stability of regulatory T cells in vivo. Nat. Commun. 6, 6353;
- Yao Y., Vent-Schmidt J., McGeough M.D., Wong M., Hoffman H.M., Steiner T.S., Levings M.K. (2022). Tr1 cells, but not Foxp3 regulatory T cells, suppress NLRP3 inflammasome activation via an IL-10—dependent mechanism. J. Immunol. 195 (2), 488–497;
- Netea M.G., Latz E., Mills K.H., O’Neill L.A. (2022). Innate immune memory: a paradigm shift in understanding host defense. Nat. Immunol. 16 (7), 675–679;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Thomas A., Tambuwala M.M., McNicholas W.T., Roche H.M., Taylor C.T., Pepin J.L. et al. (2022). Chronic intermittent hypoxia contributes to pro-inflammatory macrophage alteration in visceral adipose tissue of lean and obese mice. Am. J. Respir. Crit. Care Med. 191, A2691;
- Страшней клешней на свете нет…;
- Forooghian F. and Das B. (2007). Anti-angiogenic effects of ribonucleic acid interference targeting vascular endothelial growth factor and hypoxia-inducible factor-1alpha. Am. J. Ophthalmol. 144 (5), 761–768;
- Loboda A., Jozkowicz A., Dulak J. (2022). HIF-1 versus HIF-2 — Is one more important than the other?Vascul. Pharmacol. 56 (5), 245–251..

