- А горит ли сам кислород?
- Взаимодействие металлов с серной кислотой
- Глава 11. типы окисления. антиоксидантные системы. биологическая химия
- История открытия
- Кислородное окисление, или дыхание
- Нахождение в природе
- Окислители и восстановители
- Окислительные свойства азотной кислоты
- Разложение кислородсодержащих веществ
- Разложение нитратов
- Сварка и резка металлов
- Схема восстановления перманганатов
- Физические свойства
- Фториды кислорода
- Химические свойства
А горит ли сам кислород?
Возьмите цилиндр и опрокиньте его вверх дном. Подведите под цилиндр трубку с водородом. Так как водород легче воздуха, он полностью заполнит цилиндр.
Зажгите водород около открытой части цилиндра и введите в него сквозь пламя стеклянную трубку, через которую вытекает газообразный кислород. Около конца трубки вспыхнет огонь, который будет спокойно гореть внутри цилиндра, наполненного водородом. Это горит не кислород, а водород в присутствии небольшого количества кислорода, выходящего из трубки.
Что же образуется в результате горения водорода? Какой при этом получается окисел?
Водород окисляется до воды. Действительно, на стенках цилиндра постепенно начинают осаждаться капельки конденсированных паров воды. На окисление 2 молекул водорода идет 1 молекула кислорода, и образуются 2 молекулы воды (2Н2 O2 → 2Н2O).
Если кислород вытекает из трубки медленно, он весь сгорает в атмосфере водорода, и опыт проходит спокойно.
Стоит только увеличить подачу кислорода настолько, что он не успеет сгореть полностью, часть его уйдет за пределы пламени, где образуются очаги смеси водорода с кислородом, появятся отдельные мелкие вспышки, похожие на взрывы.
Смесь кислорода с водородом — это гремучий газ. Если поджечь гремучий газ, произойдет сильный взрыв: при соединении кислорода с водородом получается вода и развивается высокая температура. Пары воды и окружающие газы сильно расширяются, создается большое давление, при котором может легко разорваться не только стеклянный цилиндр, но и более прочный сосуд. Поэтому работа с гремучей смесью требует особой осторожности.
Кислород обладает еще одним интересным свойством. Он вступает в соединение с некоторыми элементами, образуя перекисные соединения.
Приведем характерный пример. Водород, как известно, одновалентен, кислород двухвалентен: 2 атома водорода могут соединиться с 1 атомом кислорода. При этом получается вода. Строение молекулы воды обычно изображают Н — О — Н. Если к молекуле воды присоединить еще 1 атом кислорода, то образуется перекись водорода, формула которой Н2O2.
Куда же входит второй атом кислорода в этом соединении и какими связями он удерживается? Второй атом кислорода как бы разрывает связь первого с одним из атомов водорода и становится между ними, образуя при этом соединение Н—О—О—Н. Такое же строение имеет перекись натрия (Na—О—О—Na), перекись бария.
Характерным для перекисных соединений является наличие 2 атомов кислорода, связанных между собой одной валентностью. Поэтому 2 атома водорода, 2 атома натрия или 1 атом бария могут присоединить к себе не 1 атом кислорода с двумя валентностями (—О—), а 2 атома, у которых в результате связи между собой также остается только две свободные валентности (—О—О—).
Перекись водорода можно получить действием разбавленной серной кислоты на перекись натрия (Na2O2) или перекись бария (ВаO2). Удобнее пользоваться перекисью бария, так как при действии на нее серной кислотой образуется нерастворимый осадок сернокислого бария, от которого перекись водорода легко отделить путем фильтрования (ВаO2 H2SO4 → BaSO4 Н2O2).
Перекись водорода, как и озон, — соединение неустойчивое и разлагается на воду и атом кислорода который в момент выделения обладает большой окислительной способностью. При низких температурах и в темноте разложение перекиси водорода идет медленно. А при нагревании и на свету оно происходит значительно быстрее.
Песок, порошок двуокиси марганца, серебра или платины также ускоряют разложение перекиси водорода, а сами при этом остаются без изменения. Вещества, которые только влияют на скорость химической реакции, а сами остаются неизмененными, называются катализаторами.
Если налить немного перекиси водорода в склянку, на дне которой находится катализатор — порошок двуокиси марганца, разложение перекиси водорода пойдет с такой быстротой, что можно будет заметить выделение пузырьков кислорода.
Способностью окислять различные соединения обладает не только газообразный кислород, но и некоторые соединения, в состав которых он входит.
Хорошим окислителем является перекись водорода. Она обесцвечивает различные красители и поэтому применяется в технике для отбеливания шелка, меха и других изделий.
Способность перекиси водорода убивать различные микробы позволяет применять ее как дезинфицирующее средство. Перекись водорода употребляется для промывания ран, полоскания горла и в зубоврачебной практике.
Сильными окислительными свойствами обладает азотная кислота (HNO3). Если в азотную кислоту добавить каплю скипидара, образуется яркая вспышка: углерод и водород, входящие в состав скипидара, бурно окислятся с выделением большого количества тепла.
Бумага и ткани, смоченные азотной кислотой, быстро разрушаются. Органические вещества, из которых сделаны эти материалы, окисляются азотной кислотой и теряют свои свойства. Если смоченную азотной кислотой бумагу или ткань нагреть, процесс окисления ускорится настолько, что может произойти вспышка.
Азотная кислота окисляет не только органические соединения, но и некоторые металлы. Медь при действии на нее концентрированной азотной кислотой окисляется сначала до окиси меди, выделяя из азотной кислоты двуокись азота, а затем окись меди переходит в азотнокислую соль меди.
Не только азотная кислота, но и некоторые ее соли обладают сильными окислительными свойствами.
Азотнокислые соли калия, натрия, кальция и аммония, которые в технике получили название селитры, при нагревании разлагаются, выделяя кислород. При высокой температуре в расплавленной селитре тлеющий уголек сгорает так энергично, что появляется яркобелый свет.
Если же в пробирку с расплавленной селитрой вместе с тлеющим угольком бросить кусочек серы, горение пойдет с такой интенсивностью и температура повысится настолько, что стекло начнет плавиться. Эти свойства селитры давно были известны человеку; он воспользовался этими свойствами для приготовления пороха.
Черный, или дымный, порох приготовляется из селитры, угля и серы. В этой смеси уголь и сера являются горючими материалами. Сгорая, они переходят в газообразный углекислый газ (СO2) и твердый сернистый калий (K2S). Селитра, разлагаясь, выделяет большое количество кислорода и газообразный азот. Выделившийся кислород усиливает горение угля и серы.
В результате горения развивается такая высокая температура, что образовавшиеся газы могли бы расшириться до объема, который в 2000 раз больше объема взятого пороха. Но стенки замкнутого сосуда, где обычно производят сжигание пороха, не позволяют газам легко и свободно расширяться.
Так из калийной селитры, угля и серы образуется смесь, обладающая огромной разрушительной силой.
К соединениям с сильными окислительными свойствами относятся и соли кислородосодержащих кислот хлора. Бертолетова соль при нагревании распадается на хлористый калий и атомарный кислород.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H , которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальнойстепени окисления.
Например:
Fe H2SO4(разб) = FeSO4 H2
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) металл = соль металла продукт восстановления серы (SO2, S, H2S) вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S 4O2, молекулярная сера S либо сероводород H2S-2, в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1.Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2.Концентрированная серная кислотане взаимодействует сзолотом, платиной и палладием;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Например, медь окисляется концентрированной серной кислотой:
Cu0 2H2S 6O4(конц) = Cu 2SO4 S 4O2 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S2- (в зависимости от температуры, степени измельчения и активности металла).
Например, взаимодействие концентрированной серной кислоты с цинком:
8Na0 5H2S 6O4(конц) → 4Na2 SO4 H2S—2 4H2O
Глава 11. типы окисления. антиоксидантные системы. биологическая химия
Глава 11. Типы окисления. Антиоксидантные системы
Все реакции с участием кислорода, протекающие в живом организме, называются биологическим окислением. Почти во всех клетках около 90 % потребляемого кислорода восстанавливается в цепи тканевого дыхания с участием цитохромоксидазы (окисление, сопряженное с фосфорилированием АТФ, выполняет энергетическую функцию). Однако в некоторых тканях содержатся ферменты, катализирующие окислительно-восстановительные реакции, в которых атомы кислорода включаются непосредственно в молекулу субстрата (свободное окисление, выполняет пластическую функцию). Хотя в таких специализированных реакциях потребляется лишь небольшая часть кислорода, поглощаемого клетками, эти реакции очень важны для организма.
Выделяют четыре типа реакций с участием кислорода (табл 11.1.).
Таблица 11.1. Типы окисления
Тип окисления
Ферменты
Основные продукты реакции
оксидазный
Оксидазы
S Н2О
пероксидазный
ФАД-зависимые оксидазы
S Н2О2
диоксигеназный
Диоксигеназы
SO2
монооксигеназный
Монооксигеназы (гидроксилазы)
SOH H2O
Оксидазный тип окисления
Этот путь окисления осуществляется в процессе функционирования ЦТД. Терминальный фермент ЦТД, переносящий электроны непосредственно на кислород – цитохромоксидаза. Это основной путь потребления кислорода в организме. Он выполняет энергетическую функцию.
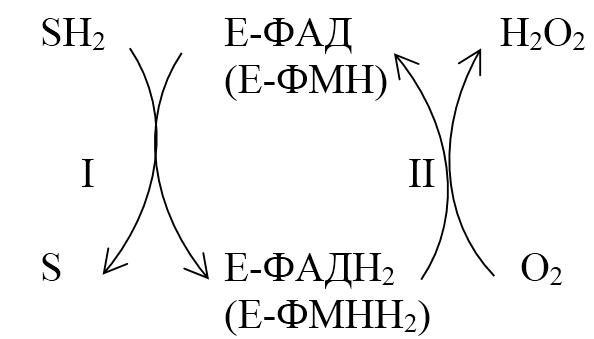
Пероксидазный тип окисления
Окисление субстрата путем дегидрирования. Два атома водорода переносятся на молекулу кислорода с образованием перекиси:
ФАД-зависимая оксидаза
SН2 О2 ? S Н2О2
В этой реакции энергия окисления выделяется в виде тепла. Реакции этого типа катализируют ФАД-зависимые оксидазы (аэробные дегидрогеназы), содержащие в качестве простетической группы ФАД или ФМН. В клетке около 80 % этих ферментов сосредоточено в пероксисомах. Пероксидазный путь окисления активно протекает в лейкоцитах, макрофагах и других фагоцитирующих клетках. Образующийся пероксид водорода Н2О2 – сильный окислитель, обезвреживающий патогенные бактерии (защитная функция).
Реакция пероксидазного окисления протекает в 2 стадии:
1. Анаэробная — происходит дегидрирование восстановленного субстрата SH2, при этом протоны и электроны переносятся на ФАД (ФАД 2Н ? ФАДН2).
2. Аэробная — происходит окисление фермента (ФАДН2 ? ФАД) кислородом (самопроизвольный процесс).
Биологическая роль оксидазного типа окисления:
1. защитная функция – в лейкоцитах и других фагоцитирующих клетках;
2. катаболизм биогенных аминов (фермент – моноаминооксидаза);
3. метаболизм аминокислот (ферменты – оксидазы D- и L-аминокислот);
4. катаболизм пуринов (фермент – ксантиноксидаза);
5. катаболизм глюкозы в растительных клетках (фермент – глюкозооксидаза).
Диоксигеназный тип окисления
В процессе диоксигеназного окисления в молекулу субстрата включаются оба атома кислорода:
Диоксигеназа
S O2 ? SO2
Диоксигеназы катализируют разрыв двойной связи в ароматическом кольце. Например: гомогентизатоксидаза катализирует расщепление ароматического кольца гомогентизиновой кислоты с образованием малеилацетоацетата.
Монооксигеназный тип окисления
Монооксигеназы (гидроксилазы) катализируют включение в субстрат одного атома молекулы кислорода. Другой атом кислорода восстанавливается до воды. Для работы монооксигеназной системы необходим кроме неполярного субстрата (SH) донор атомов водорода – косубстрат (НАДФН Н , ФАДН2, аскорбиновая кислота):
Гидроксил
SH НАДФН Н О2 ? SОН НАДФ Н2О
Монооксигеназные реакции необходимы для:
1. специфических превращений аминокислот, например, для синтеза тирозина из фенилаланина (фермент – фенилаланингидроксилаза);
2. синтеза холестерола, желчных кислот в печени; стероидных гормонов в коре надпочечников, яичниках, плаценте, семенниках; витамина D3 в почках;
3. обезвреживания чужеродных веществ (ксенобиотиков) в печени.
Ферменты монооксигеназного пути окисления локализованы в мембранах эндоплазматического ретикулума (при гомогенизации тканей эти мембраны превращаются в микросомы – мембранные пузырьки). Поэтому монооксигеназный путь окисления называют микросомальным окислением.
Микросомальное окисление представляет короткую электронтранспортную цепь, включающую НАДФ, ФАД, ФМН, цитохром Р450.

Микросомальная система включает два фермента: цитохром Р450 и НАДФН-цитохром-Р450-редуктазу.
НАДФН-цитохром Р450 – редуктаза – флавопротеин, в качестве простетической группы содержит два кофермента ФАД и ФМН.
Цитохром Р450 – гемопротеин, содержит простетическую группу гем и участки связывания для кислорода и субстрата. Восстановленный цитохром Р450 имеет максимум поглощения при 450 нм. Выполняет две функции: связывание окисляемого субстрата и активация молекулярного кислорода.
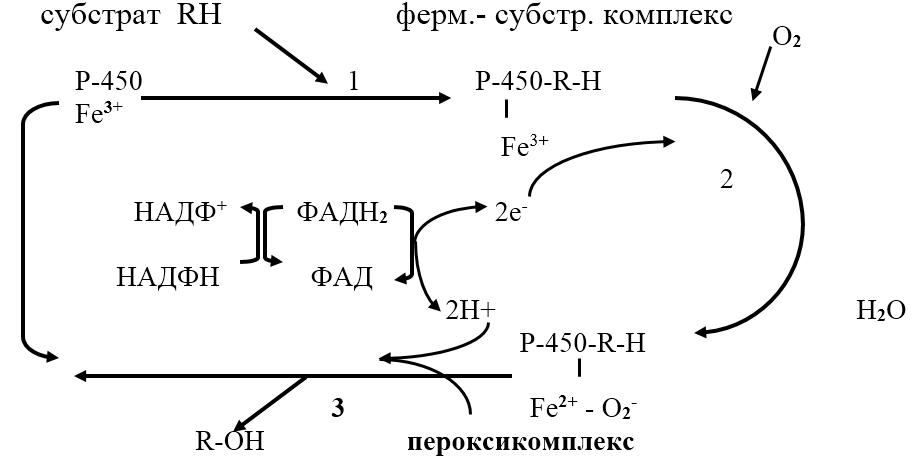
Рис. 11.1. Схема микросомального окисления
Микросомальное окисление протекает в несколько этапов:
1. связывание в активном центре цитохрома Р450 субстрата RН;
2. присоединение первого электрона и восстановление железа в геме до Fe2 ; изменение валентности железа увеличивает сродство комплекса Р450 – Fe2 ? RH к молекуле кислорода; присоединение второго электрона к молекуле кислорода и образование неустойчивого пероксикомплекса Р450–Fe2 ? О2—? RH;
3. Fe2 окисляется, при этом электрон присоединяется к молекуле кислорода; восстановленный атом кислорода (О2—) связывает два протона (донор протонов – НАДФН Н ) и образуется 1 молекула воды; второй атом кислорода участвует в гидроксилировании субстрата RH; гидроксилированный субстрат ROH отделяется от фермента.
В результате гидроксилирования гидрофобный субстрат становится более полярным, повышается его растворимость и возможность выведения из организма с мочой. Так окисляются многие ксенобиотики, лекарственные вещества.
В редких случаях в результате гидроксилирования токсичность соединения увеличивается. Например, при окислении нетоксичного бензпирена (содержится в табачном дыму, копченостях) образуется токсичный оксибензпирен, который является сильным концерогеном, индуцирующим злокачественное перерождение клеток.
В митохондриях содержится монооксигеназная система, которая выполняет биосинтетическую функцию: синтез холестерола; стероидных гормонов (кора надпочечников, яичники, плацента, семенники); желчных кислот (печень); образование витамина D3 (почки).
Активные формы кислорода (свободные радикалы)
В организме в результате окислительно-восстановительных реакций постоянно происходит генерация активных форм кислорода (АФК) при одноэлектронном восстановлении кислорода (молекула имеет неспаренный электрон на молекулярной или внешней атомной орбите).
Источники АФК:
1. цепь тканевого дыхания (утечка электронов с восстановленного убихинона KoQH2 на кислород);
2. реакции, катализируемые оксидазами, гемопротеинами, цитохромом Р450;
3. реакции окисления в лейкоцитах, макрофагах и пероксисомах;
4. радиолиз воды;
5. под воздействием ксенобиотиков, пестицидов;
6. реакции самопроизвольного (неферментативного) окисления ряда веществ.
Супероксид-анион – является одним из наиболее широко распространенных в организме свободных радикалов:
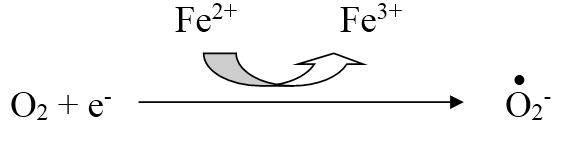
Он образуется в клетках болезнетворных бактерий и является повреждающим фактором для мембран клеток паренхиматозных органов человеческого организма. Для лейкоцитов и макрофагов супероксид-анион является фактором бактерицидности, с помощью которого клетки инактивируют патогенные микроорганизмы.
Другой путь образования свободных радикалов – взаимодействие кислорода с металлами переменной валентности. При этом образуется пероксидный радикал:
Fe2 O2 H ? Fe3 •HO2
•O2— Н ? •HO2
Взаимодействие супероксиданиона с пероксидным радикалом (1) или одноэлектронное восстановление супероксид-аниона (2) в водной среде приводят к образованию пероксида водорода
•O2— •НО2 Н ? Н2О2 О2 (1)
•О2— е— 2Н ? Н2О2 (2)
Гидроксильный радикал ОН образуется при взаимодействии пероксида водорода с супероксид-анионом (1) либо с металлами (2):
Н2О2 •О2— ? •ОН ОН— О2 (1)
Н2О2 Fe2 ? •ОН ОН— Fe3 (2)
Кислородные радикалы обладают высокой реакционной способностью и легко вступают в химические реакции с органическими молекулами для приобретения недостающего электрона. Кислородные радикалы оказывают воздействие на различные структурные компоненты клеток: ДНК (повреждение азотистых оснований); белки (окисление аминокислотных остатков, образование ковалентных «сшивок»); липиды; мембранные структуры.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, и инициируют тем самым цепные окислительные реакции. Если в реакцию с АФК вступают ненасыщенные жирные кислоты плазматических мембран, говорят о перекисном окислении липидов.
Данный текст является ознакомительным фрагментом.
История открытия
Официально считается[4][5], что кислород был открыт английским химиком Джозефом Пристли1 августа1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью большой линзы).
- 2HgO→t2Hg O2↑{displaystyle {ce {2HgO ->[t] 2Hg O2 ^}}}.
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела очень большое значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по изменению веса сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Кислородное окисление, или дыхание
Заключается в полном расщеплении пировиноградной кислоты, происходит в митохондриях и при обязательном присутствии кислорода.
Пировиноградная кислота транспортируется в митохондрии (строение и функции митохондрий — лекция №7). Здесь происходит дегидрирование (отщепление водорода) и декарбоксилирование (отщепление углекислого газа) ПВК с образованием двухуглеродной ацетильной группы, которая вступает в цикл реакций, получивших название реакций цикла Кребса.
Идет дальнейшее окисление, связанное с дегидрированием и декарбоксилированием. В результате на каждую разрушенную молекулу ПВК из митохондрии удаляется три молекулы СО2; образуется пять пар атомов водорода, связанных с переносчиками (4НАД·Н2, ФАД·Н2), а также одна молекула АТФ.
Суммарная реакция гликолиза и разрушения ПВК в митохондриях до водорода и углекислого газа выглядит следующим образом:
С6Н12О6 6Н2О → 6СО2 4АТФ 12Н2.
Две молекулы АТФ образуются в результате гликолиза, две — в цикле Кребса; две пары атомов водорода (2НАДЧН2) образовались в результате гликолиза, десять пар — в цикле Кребса.
Последним этапом является окисление пар атомов водорода с участием кислорода до воды с одновременным фосфорилированием АДФ до АТФ. Водород передается трем большим ферментным комплексам (флавопротеины, коферменты Q, цитохромы) дыхательной цепи, расположенным во внутренней мембране митохондрий. У водорода отбираются электроны, которые в матриксе митохондрий в конечном итоге соединяются с кислородом:
О2 e— → О2—.
Протоны закачиваются в межмембранное пространство митохондрий, в «протонный резервуар». Внутренняя мембрана непроницаема для ионов водорода, с одной стороны она заряжается отрицательно (за счет О2—), с другой — положительно (за счет Н ).
Когда разность потенциалов на внутренней мембране достигает 200 мВ, протоны проходят через канал фермента АТФ-синтетазы, образуется АТФ, а цитохромоксидаза катализирует восстановление кислорода до воды. Так в результате окисления двенадцати пар атомов водорода образуется 34 молекулы АТФ.
1 — наружная мембрана; 2 — межмембранное пространство, протонный резервуар; 3 — цитохромы; 4 — АТФ-синтетаза.
При перфорации внутренних митохондриальных мембран окисление НАД·Н2 продолжается, но АТФ-синтетаза не работает и образования АТФ в дыхательной цепи не происходит, энергия рассеивается в форме тепла (клетки «бурого жира» млекопитающих).
Суммарная реакция расщепления глюкозы до углекислого газа и воды выглядит следующим образом:
С6Н12О6 6О2 → 6СО2 6Н2О 38АТФ Qт,
где Qт — тепловая энергия.
Нахождение в природе

Накопление O
2
в
атмосфере
Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1
. (3,85—2,45 млрд лет назад) — O
2
не производился
2
. (2,45—1,85 млрд лет назад) — O
2
производился, но поглощался океаном и породами морского дна
3
. (1,85—0,85 млрд лет назад) — O
2
выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4
. (0,85—0,54 млрд лет назад) — все горные породы на суше окислены, начинается накопление O
2
в атмосфере
5
. (0,54 млрд лет назад — по настоящее время) — современный период, содержание O
2
в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе).
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн[7]). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад в атмосфере его практически не было.
Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита.
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими[10].
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму[11]. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время[12].
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов[13].
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере[14][нет в источнике].
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %[6].
В 2022 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад[16].
Окислители и восстановители
Окислители— это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN 5O3, HCl 7O4), соли (KN 5O3, KMn 7O4), оксиды (S 6O3, Cr 6O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4 , Fe3 , Au3 и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2 , Fe2 , Cr2 ), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S 4O3)2–, (НР 3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители:
перманганат калия (KMnO4);
дихромат калия (K2Cr2O7);
азотная кислота (HNO3);
концентрированная серная кислота (H2SO4);
пероксид водорода (H2O2);
оксиды марганца (IV) и свинца (IV) (MnO2, PbO2);
расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов .
К восстановителям, которые применяются влабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород, в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления 5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота металл = соль металла продукт восстановления азота H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N 4); оксид азота (II) NO (N 2); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3.
Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от 4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты.
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например, взаимодействие цинка с очень разбавленной азотной кислотой:
4Zn 10HNO3 = 4Zn(NO3)2 NH4NO3 3H2O
- концентрированная азотная кислота на холодепассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe. При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платинойPt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами и металлами средней активности азотная кислота восстанавливается до оксида азота (IV)NO2;
Например, окисление меди концентрированной азотной кислотой:
Cu 4HNO3 = Cu(NO3)2 2NO2 2H2O
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота(I) N2O;
Например, окисление натрия концентрированной азотной кислотой:
8Na 10HNO3 = 8NaNO3 N2O 5H2O
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%).
NO2; NO; N2O; N2; NH4NO3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например, взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
- 2KMnO4→tK2MnO4 MnO2 O2↑{displaystyle {ce {2KMnO4 ->[t] K2MnO4 MnO2 O2 ^}}}
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца(IV):
- 2H2O2→MnO22H2O O2↑{displaystyle {ce {2H2O2 ->[MnO2] 2H2O O2 ^}}}
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
- 2KClO3⟶2KCl 3O2↑{displaystyle {ce {2KClO3 -> 2KCl 3O2 ^}}}
Разложение оксида ртути(II) (при t = 100 °C) было первым методом синтеза кислорода:
- 2HgO→100°C2Hg O2↑{displaystyle {ce {2HgO ->[100{°}C] 2Hg O2 ^}}}
Разложение нитратов
Соли-нитраты содержат азот в степени окисления 5 — сильный окислитель. Такой азот может окислять кислород (О-2). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярногокислородаO2.
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления 3, и при разложении образуется соли-нитриты и молекулярный кислород.
Например:
2NaNO3 → 2NaNO2 O2.
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь), то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
2Zn(NO3)2 → 2ZnО 4NO2 O2.
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов, расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N 5, участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород.
Например, разложение нитрата серебра:
2AgNO3 → 2Ag 2NO2 O2.
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложениенитрата аммония:
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления 5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 оС образуется оксид азота (I)(«веселящий газ») и вода:
NH4NO3 → N2O 2H2O
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород:
2NH4NO3 → 2N2 O2 4H2O
При разложениинитрита аммонияNH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N 3 и восстановителя N-3
NH4NO2 → N2 2H2O
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Mn(NO3)2 = MnO2 2NO2
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления 3:
2Fe(NO3)2 → 2FeO 4NO2 O2 при 60°C 4Fe(NO3)2 → 2Fe2O3 8NO2 O2 при >60°C
Нитрат никеля (II) разлагается до нитрита при нагревании до 150оС под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Сварка и резка металлов
Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения.
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
Медицинский кислород хранится в металлических газовых баллонах высокого давления голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей.
Крупные медицинские учреждения могут использовать не сжатый кислород в баллонах, а сжиженный в сосуде Дьюара большой ёмкости. Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки.
Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха.
Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометруредуктора) умножают на величину ёмкости баллона в литрах. Например, в баллоне вместимостью 2 литра манометр показывает давление кислорода 100 атм.
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавкиE948[26], как пропеллент и упаковочный газ.
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), диоксид серы в триоксид серы, аммиака в оксиды азота в производстве азотной кислоты.
В тепличном хозяйстве для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганецв степени окисления 7. Соли марганца 7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn2 . Оксид марганца в степени окисления 2 проявляет основные свойства, поэтому в кислой средеобразуется соль.
Соли марганца 2 бесцветны. В нейтральном растворемарганец восстанавливается до степени окисления 4, с образованием амфотерного оксида MnO2 — коричневогоосадка, нерастворимого в кислотах и щелочах.
В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления 6. Соединения марганца 6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты. Манганаты придают раствору зеленую окраску.
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S0.
5 K2S 2 KMnO4 8 H2SO4 = 5 S 2 MnSO4 6 K2SO4 8 H2O,
3 K2S 2 KMnO4 4 H2O = 2 MnO2↓ 3 S↓ 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции.
K2S 2 KMnO4 –(KOH)= 2 K2MnO4 S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия.
Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно?
Перманганаты окисляют:
- неметаллыс отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения— фосфор, мышьяк — до 5;
- неметаллыс промежуточной степенью окисления до высшей степени окисления;
- активные металлыиз простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 неМе (низшая с.о.) = неМе0 другие продукты
KMnO4 неМе (промежуточная с.о.) = неМе(высшая с.о.) др. продукты
KMnO4 Ме0 = Ме (стабильная с.о.) др. продукты
KMnO4 P-3, As-3= P 5, As 5 др. продукты
Физические свойства
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его при нормальных условиях имеет массу 1,429 г., то есть немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C,2,09 мл/100 г при 50 °C) и спирте(2,78 мл/100 г при 25 °C).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы, концентрация диссоциированных атомов в смеси при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород кипит под давлением 101,325 кПа при температуре −182,98 °C и представляет собой бледно-голубую жидкость. Критическая температура кислорода 154,58 К (-118,57 °C), критическое давление 4,882 МПа[17].
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы.
Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейкиa=5,403 Å,b=3,429 Å,c=5,086 Å;β=132,53°[18].β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å,α=46,25°[18].γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å[18].
Ещё три фазы существуют при высоких давлениях:
Фториды кислорода
- 2F2 2NaOH⟶2NaF H2O OF2↑{displaystyle {ce {2F2 2NaOH -> 2NaF H2O OF2 ^}}}
- F2 O2⟶O2F2{displaystyle {ce {F2 O2 -> O2F2}}}
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 годуПьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3[23][24].
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона, фтора (с фтором кислород образует фторид кислорода, так как фтор более электроотрицателен, чем кислород).
- 4Li O2⟶2Li2O{displaystyle {ce {4Li O2 -> 2Li2O}}}
- 2Sr O2⟶2SrO{displaystyle {ce {2Sr O2 -> 2SrO}}}
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO O2⟶2NO2↑{displaystyle {ce {2NO O2 -> 2NO2 ^}}}
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6 15O2⟶12CO2 6H2O{displaystyle {ce {2C6H6 15O2 -> 12CO2 6H2O}}}
- CH3CH2OH 3O2⟶2CO2 3H2O{displaystyle {ce {CH3CH2OH 3O2 -> 2CO2 3H2O}}}
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH O2⟶CH3COOH H2O{displaystyle {ce {CH3CH2OH O2 -> CH3COOH H2O}}}
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета.
Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #Фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- 2Na O2⟶Na2O2{displaystyle {ce {2Na O2 -> Na2O2}}}
- 2BaO O2⟶2BaO2{displaystyle {ce {2BaO O2 -> 2BaO2}}}
- H2 O2⟶H2O2{displaystyle {ce {H2 O2 -> H2O2}}}
- Na2O2 O2⟶2NaO2{displaystyle {ce {Na2O2 O2 -> 2NaO2}}}
- K O2⟶KO2{displaystyle {ce {K O2 -> KO2}}}
- 3KOH 3O3⟶2KO3 KOH⋅H2O 2O2↑{displaystyle {ce {3KOH 3O3 -> 2KO3 KOH * H2O 2O2 ^}}}
- PtF6 O2⟶O2PtF6{displaystyle {ce {PtF6 O2 -> O2PtF6}}}
В этой реакции кислород проявляет восстановительные свойства.


![{displaystyle {ce {2HgO ->[t] 2Hg O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/804710fd51b4d0c4adca861caa5d341fb5921d84)
![{displaystyle {ce {2KMnO4 ->[t] K2MnO4 MnO2 O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fa985cedcb06a74333be1dbf055f4b95e5b416e4)
![{displaystyle {ce {2H2O2 ->[MnO2] 2H2O O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39356fdea2f393003bf49298522c43c2aa66e358)

![{displaystyle {ce {2HgO ->[100{°}C] 2Hg O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8ed83305529bb4aea427f4cd72a0f92c5fe51aef)














