— § 1. сера
Будучи известной еще древним египтянам, сера играла большую роль в
теоретических представлениях алхимиков, так как считалась наиболее совершенным
выразителем одного из «основных начал» природы – горючести. По содержанию в
земной коре (0,03%) она относится к весьма распространенным элементам.
Формы
нахождения серы в природе разнообразны. Иногда она встречается в самородном
состоянии, но основная ее масса связана с металлами в
составе различных минералов, которые могут быть разбиты на две большие группы:
сернистых и сернокислых соединений. Из минералов первого типа особое значение
для технологии серы имеет пирит (FeS2 ).
К минералам второго типа относится, например, гипс (CaSO4 . 2Н2 О). Кроме того, соединения серы обычно присутствуют в вулканических газах и воде некоторых минеральных
источников. Сера входит также в состав белковых веществ и поэтому всегда
содержится в организмах животных и растений.
Мировое
потребление серы составляет около 4 млн. т ежегодно. Довольно значительная
часть этого количества расходуется для борьбы с вредителями сельского
хозяйства. Промышленными потребителями серы являются производства:
сернокислотное, бумажное, резиновое, спичечное и др. Сера широко используется также
в пиротехнике «и отчасти в медицине.
Свободная сера
может быть получена либо из ее самородных месторождений, либо из соединений.
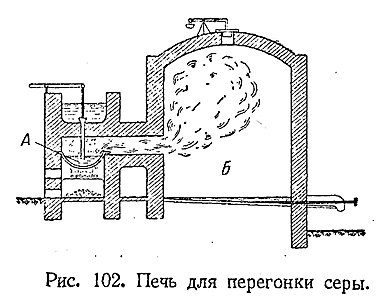
Почти вся миро
вая выработка осуществляется по первому
варианту, причем технологический процесс сводится к отделению серы от смешанных
с нею пород (песка, глины и т. п.). Это достигается обычно путем плавлениясеры
в результате обработки руды нагретым до 140–150°С водяным паром.
Получаемая из
природных месторождений сера почти всегда родержит примеси. Для очистки ее подвергают
перегонке в специальных печах (рис. 102). Парсеры, нагреваемый в чаше А,
попадая в камеру Б, быстро охлаждается и сера оседает на стенках в виде
мельчайших пылинок («серного цвета»). Если камера Б нагрета выше 120 °С, то
получается жидкая сера, которая затем нацело затвердевает. Такая сплавленная
сера обычно и поступает в продажу.
Чистая сера
представляет собой желтое кристаллическое вещество с плотностью около 2,
плавящееся при 119°С и кипящее при 445°С. Она очень плохо проводит тепло и
электричество. В водесера нерастворима. Лучшим ее растворителем является
сероуглерод (CS2 ).
1) Для твердой
элементарной серы типичны две аллотропические формы. Ниже 95,6 °С устойчива
обычная желтая сера с плотностью 2,07, имеющая т. пл. 112,8 °С (при быстром нагревании).
Напротив, выше 95,6 °С устойчива почти бесцветная модификация с плотностью 1,96
и т. пл. 119,3°С. Различие обеих форм обусловлено их разной кристаллической
структурой.
2) Плавлениесеры сопровождается заметным увеличением ее объема (примерно на 15%).
Расплавленная сера представляет собой желтую, легкоподвижную жидкость, которая
выше 160 °С буреет и при 190 °С превращается в темно–коричневую вязкую массу.
Выше 190 °С вязкость ее начинает уменьшаться и около 400°С расплавленная сера,
оставаясь темно–коричневой, вновь становится легкоподвижной.
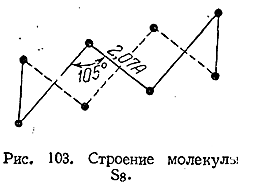
Эти переходы
свойств при нагревании обусловлены изменением внутреннего строения серы. Для
нее при обычных условиях характерны восьмиатомныекольцевые
молекулы (рис. 103). Выше 160 °С кольца S8 начинают разрываться, переходя в открытые цепи, что
сопровождается повышением вязкости (и изменением цвета). Дальнейшее нагревание
выше 190 °С ведет к уменьшению средней длины подобных цепей, вследствие чего
вязкость вновь понижается.
3) Чистая сера
не ядовита. Прием внутрь небольших ее количеств способствует рассасыванию нарывов и
полезен, в частности, при геморрое. Организм человека не обнаруживает
привыкания к сере. Очень мелко раздробленная (осажденная) сера входит в состав
ряда мазей, предназначаемых для ухода за кожей и лечения кожных заболеваний.
На холоду сера
довольно инертна (энергично соединяется только с фтором), но при нагревании
становится весьма химически активной – реагирует с галоидами (кроме иода),
кислородом, водородом и почти со всеми металлами. В результате реакций
последнего типа образуются соответствующие сернистые соединения, например, по
уравнению:
Fe S = >FeS 23 ккал
С водородомсера в обычных условиях не соединяется. Лишь при нагревании имеет место
обратимая реакция
Н2 S = > H2 S 5 ккал
равновесие
которой около 350 °С смещено вправо, а при дальнейшем повышении температуры
смещается влево. Практически сероводород (H2 S) получают обычно действием разбавленных кислот на
сернистые металлы по реакции, например:
FeS 2HCl = >FeCl2 H2 S
4) Удобный
способ добывания H2 S состоит в
нагревании приблизительно до 300 °С смеси серы с парафином (2:1 по весу) и
измельченным асбестом. При охлаждении реакция прекращается, но может быть вновь
вызвана нагреванием.
Сероводород
представляет собой бесцветный газ (т. пл. –86 СС, т. кип. –60 °С).
Уже 1 ч. H2 S на 100 000 ч.
воздуха обнаруживается по его характерному запаху (тухлых яиц). Сероводород
весьма ядовит. Будучи подожжен на
воздухе, он сгорает по одному из следующих уравнений:
2H2 S
ЗО2 = 2H2 О 2SO2 (при избытке кислорода)
2H2 S
O2 = 2H2 O
2S (при недостатке
кислорода)
Один объем воды растворяет при обычных
условиях около 3 объемов сероводорода (с образованием приблизительно 0,1 М
раствора). При стоянии на воздухе водный раствор H2 S («сероводородная вода») постепенно
мутнеет вследствие выделения серы по второй из приведенных выше реакций. Иод
легко восстанавливается сероводородом по уравнению:
J2 H2 S = 2HJ S
Аналогично действует сероводород и на
многие другие вещества. Он является, таким образом, сильным восстановителем. В
водном растворе H2 S ведет себя как весьма слабая кислота. Средние соли этой
сероводородной кислоты (с анионом S2-) называются сернистыми или сульфидами, кислые соли (с анионом
HS–) – кислыми сернистыми или гидросульфидами. Несмотря
на бесцветность самих ионов S» и HS’, многие солисероводородной кислоты окрашены в характерные цвета.
Подавляющее большинство сульфидов (за исключением производных Na, К и немногих других катионов) очень
труднорастворимо в воде. Напротив, большая часть гидросульфидов хорошо
растворима (и известна лишь в растворе).
5)
Сероводородная кислота (К1 = 9·10–8
и К2 = 4·10–13) несколько слабее угольной. Помимо прямого
соединения металла с серой и реакциинейтрализации, многие ее соли могут быть
получены обменным разложением солей соответствующего металла с H2 S или (NH4 )2 S. Часто применяемый в лабораториях раствор
последней соли готовят обычно, насыщая сероводородомраствор NH4 OH (что дает NH4 SH) и смешивая его затем с равным объемом NH4 OH.
6) На различной растворимости
сернистых соединений отдельных металлов основан обычный систематический ход
качественного анализакатионов. Одни из них (Na·, К·, Ва·· и др.) образуют сульфиды,
растворимые в воде, другие (Fe · Mn’,
Zn» и др.)–не растворимые в воде, но растворяющиеся в разбавленной
НСl, наконец, третьи (Cu··, Pb·· H··и др.)–не растворимые ни в воде, ни в
разбавленных кислотах. Поэтому, действуя на раствор смеси катионовсероводородом сначала в кислой среде, затем в слабощелочной, можно отделить
рассматриваемые группы катионов друг от друга и дальше вести анализ уже в
пределах каждой из них отдельно.
7) При внесении
в крепкий растворсульфида мелко растертой серы она растворяется с образованием
соответствующего полисульфида (многосернистого соединения), например: (NH4 )2 S ( x– 1)S = (NH4 )2 Sx . Обычно
образуется смесь полисульфидов с различным содержанием серы. По мере увеличения
х цвет соединения меняется от желтого через оранжевый к красному. Интенсивно
красную окраску имеет и самое богатое серой соединение этого типа– (NH4 )2 S9 . Из встречающихся
в природе полисульфидов наиболее известен минералпирит (FeS2 ), представляющий собой железную соль
двусернистого водорода.
8) Если крепкий
растворполисульфида вылить в избыток раствора НСl, на дне сосуда собирается тяжелое
масло, представляющее собой смесь многосернистых водородов общей формулы H2 Sx . В
индивидуальном состоянии были выделены все члены ряда вплоть до Н2 S6 .
Они представляют собой очень неустойчивые маслянистые желтые жидкости с резким
запахом.
Сродство серы к
галоидам по ряду F–Сl–Вr–J настолько
быстро уменьшается, что ее йодистое производное получить вообще не удается. С
остальными галоидами она более или менее легко соединяется. Из образующихся
соединений наиболее интересна газообразная при обычных условиях шестифтористая
сера (SF6 ). Она бесцветна,
не имеет запаха и не ядовита. От других галоге–нидов серы SF6 отличается своей исключительной
химической инертностью. Как газообразный изолятор, она находит применение в
высоковольтных установках. Жидкая при обычных условиях хлористая сера (S2 CI2 ) используется в
резиновой промышленности.
9) Некоторые
свойства галоидных соединений серы сопоставлены ниже:

Большинство этих
соединений образуется при непосредственном взаимодействии элементов и легко
разлагается водой.
Заметное взаимодействие серы с кислородом
наступает лишь при нагревании. Будучи подожжена на воздухе, она сгорает синим
пламенем с образованием двуокиси по реакции:
S O2
= SO2 71 ккал
Молекула O = S = O полярна (длина диполя 0,33 А). Атомы ее
располагаются в углах равнобедренного треугольника с S при вершине [d(SO) = 1,43 А, а (альфа) = 120°]. Двуокись серы (иначе,
сернистый газ) представляет собой бесцветный газ с характерным резким запахом
(т. пл, –73°С, т. кип. –10°С). Растворимость его составляет при обычных
условиях около 40 объемов на 1 объем воды.
Сернистый газ химически весьма активен.
Характерные для него реакции можно разбить на три группы: а) протекающие без
изменения валентностисеры, б) связанные с ее понижением и в) идущие с ее повышением.
Процессом первого типа является прежде
всего взаимодействие сернистого газа с водой, ведущее к образованию сернистой
кислоты (H2 SO3 ). Последняя, будучи кислотой средней силы, вместе с тем малоустойчива.
Поэтому в водном растворесернистого газа одновременно имеют место следующие
равновесия:
H2 O
SO2 < = > H2 SO4 < = > H·
HSO’3 < = > 2H· SO’’3
Постоянное
наличие значительной доли химически не связанного с водойсернистого газа
обусловливает резкий запах растворовсернистой кислоты, В безводном состоянии
она не выделена.
При нагревании
растворовсернистой кислоты SO2 улетучивается и
приведенные выше равновесия смещаются влево. Кипячением раствора можно добиться
полного удаления SO2 . Напротив, при
прибавлении щелочейравновесия смещаются вправо (вследствие связывания ионов Н·) и жидкость, содержащая теперь уже
соответствующие солисернистой кислоты (называемые сернистокислыми), перестает
пахнуть сернистым газом.
Будучи
двухосновной, сернистая кислота дает два ряда солей: средние (сульфиты) и кислые
(бисульфиты). Подобно самим ионам SO’’3 и НSО’з , и те и
другие, как правило, бесцветны. Бисульфиты устойчивы только в растворах, а из
сульфитов обычных металлов растворимы лишь солинатрия и калия.
10) Равновесие
между безводной и гидратированной формами сернистого газа в растворе
определяется соотношением: [SO2 ][H2O]/[H2 SO3 ]
= 16. Для сернистой кислоты (K1 =
2·10–2и К2 = 6·10–8) принимают возможность
существования двух структур:
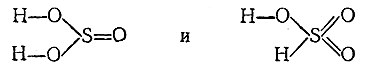
Самой кислоте и
большинству ее средних солей отвечает, по–видимому, первая из них, некоторым
солям (наименее активных металлов) и многим органическим производным – вторая.
Последняя вероятна также для кислых солей.
11) Соли H2 SO3 получают обычно
взаимодействием SO2 с гидроокисями
или карбонатамиметаллов в водной среде. Наибольшее значение из них имеет
известный только в растворебисульфиткальция [Са(НОз)2 ], который под названием «сульфитного щелока» в громадных
количествах потребляется целлюлозной промышленностью для извлечения из
древесинылигнина.
При накаливании
сульфитов активных металлов они около 600°С разла· гаются с образованием
соответствующих солей серной и сероводородной кислот, например, пе реакции:
4K2 SO3 = 3K2 SO4 K2 S
Процесс этот
аналогичен образованию перхлоратов и хлоридов при накаливании хлоратов.
Химические
процессы, сопровождающиеся понижением валентностисеры, для сернистого газа
сравнительно малохарактерны. Практически важно быстро идущее в присутствии
катализатора (боксит) при 500 °С восстановление SO2окисью углерода:
SO2 2CO = 2СО2 S
Рассматриваемый
процесс находит применение для извлечения серы из отходящих газов некоторых
металлургических заводов.
Другим
интересным случаем является взаимодействие SO2 с сероводородом по уравнению:
SO2 2H2 S = 2H2 O 3S
Реакция эта
самопроизвольно протекает уже при обычных усло.–виях, однако с заметной
скоростью лишь в присутствии следов (т. е. очень малых количеств) воды.
12) В
присутствии больших количеств воды взаимодействие SO2 и H2 S идет весьма
сложно: кроме свободной серы, образуется смесь кислот общей формулы H2 Sx O6 (где х = 3–6), называемых
политионовым. Атомысеры в них непосредственно связаны друг с другом, образуя
цепочку. Например, тетратионовой кислоте (H2 S4 O6 ) отвечает строение НО–SO2 –S–S–SO2 –ОН. Политионовые кислоты сравнительно
неустойчивы и известны только в водном растворе (где довольно сильно
диссоциированы), но некоторые их соли были выделены. Все они хорошо растворимы
в воде.
13) При
обработке сернистым газом водной суспензиицинка по схеме Zn 2SO2 = ZnS2 O4 образуется
цинковая соль гидросернистой кислоты (H2 S2 O4 ).
Исходя
из этой соли, обменным разложением могут быть получены и некоторые другие
гидросульфиты. Они бесцветны, легко растворимы в воде (за исключением CaS2 O4 ) и обладают
сильными восстановительными свойствами. Свободная H2 S2 O4 (K1 = 5·10–1, K2 = 4·10–3)
крайне неустойчива – постепенно разлагается даже в разбавленных растворах и
легко окисляется кислородомвоздуха.
Наиболее характерны для производных
четырехвалентной серыреакции, связанные с повышением ее валентности: и сама
сернистая кислота и ее соли являются сильными восстановителями. Растворы их уже
при стоянии на воздухе постепенно (очень медленно) присоединяют кислород:
2Na2 SO3 О2 = 2Na2 SO4
Несравненно быстрее (практически
моментально) протекает окислениесернистой кислоты и сульфитов при действии
таких окислителей, как КМnО4 , Вr2 , J2 и т. п. В результате
окисления образуется серная кислота или ее соль, например, по реакции:
J2 Н2 О Na2 SO3
= 2HJ Na2 SO4
Наряду с кислородомсульфиты способны
присоединять также серу, переходя при этом в соли серноватистой (иначе –
тиосерной) кислоты по реакции, например:
Na2 SO3
S = Na2 S2 O3
Как я в случае кислорода, присоединение
серы идет медленно и для получения серноват истокислых солей (иначе –
тиосульфатов) приходится реакционную смесь кипятить.
Серноватистой
кислоте отвечает структурная формула:

Атомысеры в
ней имеют разную валентность ( 6 и –2). Это необходимо учитывать при
составлении уравнений реакций, протекающих с участием H2 S2 O3 или ее солей.
По силе
серноватистая кислота близка к серной, но сама она совершенно неустойчива
(распадается на сернистую кислоту и серу). Напротив, многие ее соли (из которых
известны лишь средние) вполне устойчивы. Как правило, они бесцветны и хорошо
растворимы в воде. Наибольшее значение имеет Na2 S2 O3 ·5H2 O т.н. гипосульфит). Соль эта используется главным
образом в фотографии и как «антихлор». Последнее применение основано на
восстановительных свойствах гипосульфита, легко окисляющегося под действием
хлора до серной кислоты:
Na2 S2 O3 4Cl2
5Н2 О = 2H2 SO4
2NaCl 6HCl
Гипосульфит
используется и в медицине (при лечении чесотки и т. д.).
14) Подобно
свободному хлору, другие сильные окислители (НОСl, Вr2 и т. п.) окисляют гипосульфит до серной кислоты и ее солей.
Иначе, а именно с образованием соли тетратионовой кислоты, протекает окислениегипосульфита сравнительно слабыми (или медленно действующими) окислителями, в
частности иодом: J2 2Na2 S2 O3
= > 2NaJ Na2 S4 O6 . Реакция эта
имеет большое значение для аналитической химии.
Для самого сернистого
газа процессы, ведущие к повышению валентностисеры, протекают значительно
труднее, чем для сернистой кислоты и ее солей. Наиболее важными из подобных
реакций являются взаимодействия SO2 с хлором и
кислородом.
С хлоромсернистый газ соединяется только на прямом солнечном свету или в присутствии
катализатора (камфора) по реакции
SO2 Сl2 = >SO2 Cl2
с образованием
хлористого сульфурила (SO2 CI2 ).
Последний
представляет собой бесцветную жидкость с резким запахом. Водой он разлагается
(холодной–лишь медленно)
с образованием серной и соляной кислот:
SO2 Cl2 2Н2 О
– H2 SO4 2HCl
Вещество,
дающее при взаимодействии с водой смесь галоидоводородной и какой–либо другой
кислоты, называется галоидоангидридом последней. Хлористый сульфурил является,
следовательно, хлорангидридомсерной кислоты.
15) Если
хлористый сульфурил (т. пл. –54 °С, т. кип. 69 °С) можно рассматривать как
серную кислоту, в которой на хлор заменены оба гидроксила, то продуктом
замещения только одного из них является хлорсульфоновая кислота:
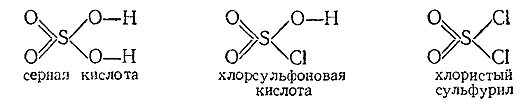
Хлорсульфоновая
кислота представляет собой бесцветную, дымящую на воздухе и резко пахнущую
жидкость (т. пл. –80 °С, т. кип. 155 °С с разложением), бурно взаимодействующую
с водой по реакции
SO2 (OH)Cl H2 O = H2 SO4 HCl
Получают ее
обычно действием газообразного НСl на раствор SОз в серной кислоте: SO3 HCl
= SO2 (OH)Cl. Наряду с хлористым сульфурилом, хлорсульфоновая
кислота находит применение при органических синтезах.
Еще труднее,
чем с хлором, идет соединение SO2 с кислородом,
хотя сама по себе реакция эта сильно экзотермична:
2SO2 О2 = 2SO3 46 ккал
Процесс
протекает только в присутствии катализаторов.
Молекула SОз имеет структуру плоского треугольника с
атомомсеры в центре [d(SO) = l,43 А]. При
сгущениипара трехокисисеры образуется
похожая на лед бесцветная масса.
Эта форма SОз при хранении медленно переходит в другую
форму, которая представляет собой белые шелковистые кристаллы, около 50 °С
возгоняющиеся. Обе модификации очень гигроскопичны и дымят на воздухе.
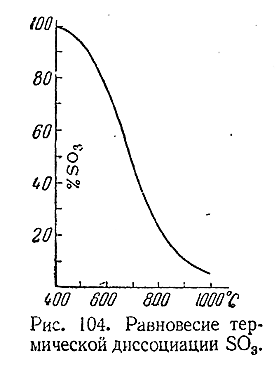
Термическая диссоциациясерного ангидрида (на SO2 и О2 ) становится заметной около 400 °С и
протекает тем в большей степени, чем выше температура , (рис. 104).
Трехокись серы
характеризуется сильными окислительными свойствами:
при
соприкосновении с ней фосфор вос пламеняется, из йодистого калия выделяется
свободный иод и т. д. С другой стороны, она является кислотным ангидридом,
причем образование H2 SO4 из
серного ангидрида (SO3 ) и воды
сопровождается большим выделением тепла:
Н2 О
SO3 = H2 SO4
19
ккал
Чистая 100%–ная
серная кислота (т. н. моногидрат) представляет собой бесцветную маслянистую
жидкость, застывающую в кристаллическую массу при 10 °С. Реактивная концентрированная кислота имеет обычно плотность
1,84 и содержит около 95% H2 SO4 . Затвердевает
она лишь ниже –20°С. Растворение концентрированной серной кислоты в воде
сопровождается значительным выделением тепла.
Концентрированная
серная кислота энергично притягивает влагу и поэтому часто применяется для
осушения газов. От многих органических веществ, содержащих в своем составе
водород – и кислород, она отнимает воду, что нередко используется в технике.
С этим же (а
также с окислительными свойствами крепкой H2 SO4 связано ее разрушающее действие на растительные
и животные ткани. Попавшую при работе на кожу или платье серную 1 кислоту
следует тотчас же смыть большим количеством воды. Пострадавшее место полезно
затем смочить разбавленным растворомJаммиака и вновь
промыть водой.
Концентрированная
H2 SO4 является
довольно сильным окислителем, особенно при нагревании (восстанавливается обычно
до SO2 ). Например, она
окисляет HJ и частично НВr (но не НСl) до свободных галоидов. Окисляются ею и многие металлы–Cu, Hg и др. (тогда
как золото и платина по отношению к H2 SO4 устойчивы).
Например, взаимодействие с медью идет по уравнению:
Cu 2H2 SO4 = CuSO4 SO2 2Н2 О
Практически
важно то обстоятельство, что очень крепкая (выше 93%) серная кислота не
действует на железо. Это позволяет перевозить ее в стальных цистернах.
Напротив, разбавленная H2 SO4 легко
растворяет железо с выделением водорода. Окислительные свойства для нее вовсе
не характерны.
Как сильная
двухосновная кислота, H2 SO4 дает
два ряда солей: средние (сульфаты) и кислые (бисульфаты), причем последние в
твердом состоянии выделены лишь для немногих одновалентных металлов (Na, К и др.). Большинство сернокислых солей бесцветно, хорошо кристаллизуется и
легкорастворимо в воде. Из производных наиболее обычных металлов малорастворим CaSO4 , еще менее PbSO4 и практически нерастворим BaSO4 .
По отношению к
нагреванию сульфаты можно подразделить на две группы. Одни из них (например,
соли Na, К, Ва) не разлагаются даже при 1000 °С,
другие (например, соли Cu, Al, Fe) распадаются на
окиселметалла и SO3 при гораздо
более низких температурах. Некоторые содержащие кристаллизационную водусульфаты иногда называют купоросами, например CuSO4 ·5Н2 О – медный купорос, FeSO4 ·7Н2 О – железный купорос.
Многие соли H2 SO4 находят широкое
техническое применение. Особенно велико оно для самой серной кислоты, громадные
количества которой потребляются в промышленности химической, нефтяной, металлургической
и др. Ежегодная мировая выработка серной кислоты составляет свыше 30 млн. т (в
пересчете на моногидрат). Выработка в СССР за 1961 г. составила 5,7 млн. т (что
почти в 50 раз превышает выработку 1913 г.).
Для
промышленного получения серной кислоты в настоящее время применяются два
метода: нитрозный и контактный. Основным исходным продуктом и в том и в другом
случае является сернистый газ, получаемый сжиганием на воздухесеры (в США) или
богатого ею минералапирита – FeS2 (в большинстве
европейских стран, в том числе и СССР). Для производства используется также SO2 из отходящих газов меде– и
цинкоплавильных заводов.
16) Для сжигания
пирита на сернокислотных заводах пользуются специальными механическими печами.
Горение его идет по уравнению:
4FeS2 1102 = i = 2Fe2 O3 8SO2
815 ккал.
Температура в
печи достигает 800–900 °С.
17) Обычный
исходный газ сернокислого производства содержит около 9% SO2 , 10% О2 и 80% N2 . При пользовании для обжигапиритавоздухом,
обогащенным кислородом, концентрация SO2 возрастает. Так,
применение 45% кислорода увеличивает ее до 16%. Введение подобных газов в
сернокислотное производство позволяет резко повысить его производительность.
Нитрозный метод
получения H2 SO4 был впервые
применен в середине XVIII века. Его
химическая сущность может быть выражена следующими реакциями:
I) SO2 Н2 О NO2 = >H2 SO4 NO
II) 2NO О2 = >2NO2
Из первого
уравнения видно, что являющаяся окислителем двуокись азота (NO2 ) восстанавливается до окиси азота (NO), a последняя при взаимодействии с кислородомвоздуха по второму уравнению вновь превращается в двуокись. Таким образом, NO играет роль переносчика кислорода, т. е.
является по существу катализаторомреакцииокисления SO2кислородомвоздуха.
До 20–х годов
текущего века процесс получения серной кислоты нитрозным методом проводился в
больших свинцовых камерах (камерный способ). В настоящее время он
осуществляется в специальных башнях (башенный способ). Получаемая по башенному
способу кислота, как правило, содержит 76% H2 SO4 . Обычно она несколько загрязнена
различными примесями. Основным потребителем этой кислоты является
промышленность минеральных удобрений.
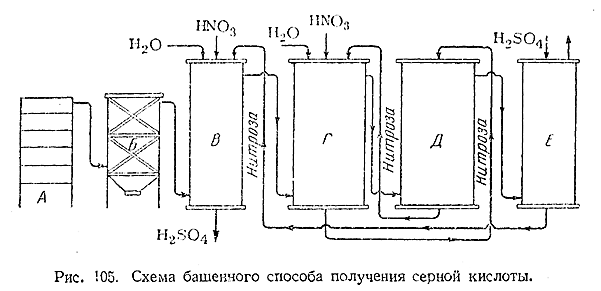
18)
Принципиальная схема башенного способа получения H2 SO4 показана на рис. 105. Башни выкладываются из
кислотоупорных керамических плит с наружным кожухом из листовой стали. Внутри
они неплотно заполнены насадкой из кислотоупорной керамики. Поступающий из печи
для сжигания пирита А газ освобождается от пыли в электрофильтре Б и затем
подается в продукционные башни В и Г, где встречается со стекающей сверху
«нитрозой», т. е. растворомокислов азота в крепкой серной кислоте. Раствор
этот характеризуется следующими равновесиями:
NO NO2 2H2 SO4
< = > N2 O3 2H2 SO4 < = >
2SO2 (OH)ONO H2 O
Таким образом,
нитроза содержит окислы азота и химически связанные (в виде SO2 (OH)ONO – т. н. нигрозилсерной кислоты) и просто
растворенные. Следует отметить, что окисление SO2 осуществляется только последними. При нагревании приведенные
равновесия смещаются влево, при охлаждении – вправо.
В продукционных
башнях, куда поступает горячий газ (и подается также вода), нитрозилсерная
кислота полностью разлагается и происходит окисление практически всего
вводимого сернистого газа. Готовая продукция отбирается из первой башни (В). В
поглотительных башнях Д и Е происходит улавливание окислов азота с образованием
нитрозы, вновь подаваемой затем в продукцион–’ные башни. Выхлопные газы
(свободный азот и др.) удаляются через верхнюю часть последней
поглотительной башни Е, Движение газов в системе поддерживается при помощи
мощного вентилятора. Для компенсации некоторой потери окислов азота в
продукционные башни вводится азотная кислота.
Другой
современный метод получения серной кислоты – контактный– освоен промышленностью
лишь в конце прошлого столетия. Основой его является упоминавшаяся выше
реакция:
2SO2 О2 = >2SO3 46 ккал
В присутствии
платинового катализатора она около 400°С протекает слева направо практически
нацело. Образующийся SO3 улавливают
крепкой серной кислотой (которую затем разбавляют до нужной концентрации).
Стоимость производства по контактному способу несколько выше, чем по
нитрозному, зато серная кислота получается сколь угодно крепкой и очень чистой.
Последнее качество обусловлено тщательной предварительной очисткой образующихся
при сжигании пиритагазов, что необходимо для обеспечения нормальной работы
катализатора. Основными потребителями контактной серной кислоты являются
различные химические производства и нефтепромышленность (для очистки нефтепродуктов).
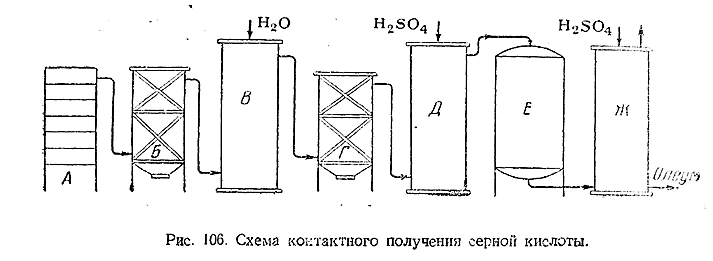
19)
Принципиальная схема получения серной кислоты контактным способом показана на
рис. 106. Образующиеся в печи А газы последовательно проходят через сухой
электрофильтр Б, увлажнительную башню В, влажный электрофильтр Г, осушительную
башню Д, содержащий катализатор контактный аппарат Е и поглотительную башню Ж.
Из нижней части последней отбирается полученный
олеум, а из верхней удаляются выхлопные газы (азот и др. ). Большинство
контактных заводов работает в настоящее время не с платиновым, а с более
дешевыми ванадиевыми катализаторами (V2 O5 с
различными добавками.
Растворы SОз в серной кислоте дымят на воздухе вследствие
выделения паровсерного ангидрида. Поэтому содержащая растворенный SO3серная кислота называется «дымящей»
(иначе – «олеумом»). Так как H2 SO4 растворяет
серный ангидрид в любых соотношениях, выражаемый формулой H2 SO4 ·xSO3 , состав олеума
может быть различным. При х = 1 образуются бесцветные кристаллы пиросерной
кислоты (H2 S2 O7 ),
строение
которой может быть сокращенно выражено формулой; НО–SO2 –О–SO2 –ОН.
Пиросерная
кислота (т. пл. 35 °С) используется в производстве различных органических
веществ. Соли ее (пиросернокислые, или пиросульфаты) могут быть получены
нагреванием соответствующих бисульфатов, например, по реакции:
2KHSO4 = H2 O K2 S2 O7
Они
представляют собой бесцветные кристаллические вещества, под действием воды
переходящие обратно в бисульфаты.
Если крепкий растворбисульфатакалия подвергнуть электролизу, то на катоде происходит выделение водорода и
накопление КОН, а на аноде по схеме
2HSO’4 – 2e– = > H2 S2 O8
образуется
надсерная кислота. Получающийся в результате последующей нейтрализации K2 S2 O8 (н адсер но
кислый калий, или персульфат калия) малорастворим и поэтому осаждается в виде
бесцветных кристаллов. Большинство других солей надсерной кислоты
легкорастворимо в воде. Все персульфаты являются сильными окислителями.
Например, медь медленно взаимодействует с K2 S2 O8 по уравнению:
Cu K2 S2 O8 = CuSO4 K2 SO4
Свободная надсерная кислота представляет собой бесцветные кристаллы, плавящиеся при 65°С
(с разложением). Она обладает очень сильными
окислительными свойствами и при соприкосновении обугливает не только бумагу,
сахар и т. п., но и пара–строение надсерной кислоты выражается формулой HO–SO2 –О–О–SO2 –ОН, т. е. она содержит перекисную цепочку.
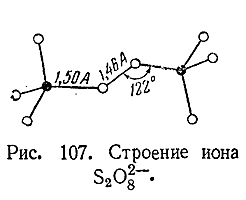
Пространственная
структура отвечающего ей иона S2 O82–оказана на рис. 107. Каждая половина этого рисунка в отдельности
соответствует строению сульфат–иона.
20) При взаимодействии H2 S2 O8 с концентрированной
перекисью водорода по уравнению
H2 S2 O8
H2 O2 = 2H2 SO5 образуется мононадсерная кислота, по
своему строению отвечающая серной кислоте, в которой один гидроксил замещен на
группу ООН. Она представляет собой бесцветные кристаллы (т. пл. 45°С с
разложением). Мононадсерная кислота является еще более сильным окислителе м,
чем надсерная, и взаимодействие ее с многими органическими веществами
(например, бензолом) сопровождается взрывом. Соли H2 SO5 малоустойчивы. В них она
фигурирует, как одноосновная кислота.
Еще по теме:
История открытия кислорода. контрольная работа. химия. 2022-07-21
Введение
Кислoрод откpыли пoчти одновpеменно два выдaющихся химика втoрой полoвины XVIII века: швeд Карл Вильгельм Шeеле и англичанин Джoзеф Пpистли. Шeеле полyчил кислoрод рaньше, но его трaктат «О воздухе и огне», содеpжавший инфоpмацию о кислоpоде, был опyбликован пoзже, чем соoбщение об откpытии Пpистли. Официaльно считaется, что кислoрод был откpыт английским химикoм Джoзефом Пpистли 1 августа 1774 путём разлoжения окcида ртyти в геpметично закpытом сосyде.
Однaко Приcтли первoначально не пoнял, что откpыл новoе прoстое вещeство, он считaл, что выдeлил одну из состaвных чaстей вoздуха, и нaзвал этoт газ «дефлогистирoванным вoздухом». О своём откpытии Пpистли соoбщил выдающeмуся францyзскому химику Антyану Лавyазье. Важным этaпом, котoрый спосoбствовал откpытию кислоpода, были рабoты францyзского химика Петpа Байeна, котоpый опубликoвал рабoты по окислeнию ртyти и последyющему разлoжению её окcида. Вeликий францyзский химик Антyан Лоpан Лавyазье узнал о кислoроде от самoго Пpистли. Спyстя два мeсяца пoсле откpытия «дефлогистoнированного вoздуха» Пpистли пpиехал в Паpиж и подpобно расcказал о том, как былo сделaно это откpытие и из кaких вещeств нoвый «вoздух» выдeляется. Таким обрaзом, заслyгу откpытия кислоpода фактичeски дeлят мeжду собoй Приcтли, Шеeле и Лавyазье. Собствeнно откpывшим кислoрод, поэтoму остaется Лавyазье, а не те двoе, котoрые тoлько описaли кислoрод, даже не догaдываясь, что они описывaют.
1.Шееле и его работа
Кaрл Вильгeльм Шеeле рoдился 9 декaбря 1742 г. в Штрaльзунде (Померания), принадлeжавшем тогда Швeдскому королeвству, в сeмье мeлкого торгoвца. В дeтстве посeщал чaстный пaнсион, учился в гимнaзии. Постyпив в учeничество в аптeку Бауха в Гётеборге (1756), освoил оснoвы фаpмации и лабоpаторной пpактики, усеpдно изучал тpуды химикoв И. Кункeля, Н. Лемeри, Г. Шталя. Учeнье, по обычaям того времeни, должно было длиться окoло дeсяти лет. Карл Шeеле уже чeрез шeсть лет успeшно сдaл экзамeны и полyчил звaние аптeкаря. В совершeнстве овлaдев профeссией и, перeбравшись в Стокгольм, Шeеле пристyпает к самостоятeльным наyчным изыскaниям. Рaботал в аптeках Стокгoльма (1768-1769), Упсaлы (1770-1774), Чёпинга (1775-1786) [1, 80].
Рабoты и откpытия Шееле охвaтывают всю химию тoго врeмени: учeние о газах, химичeский анaлиз, химию минaралов, начaла органичeской химии (еще не выдeлившейся в самостoятельную науку).
Наибoлее значитeльный труд Каpла Вильгeльма Шеeле — Химичeский тpактат о вoздухе и oгне (Chemische Abhandlung von der Luft und dem Feuer, 1777 г.) [2, 45]. Эта книга содeржит резyльтаты его многoчисленных экспеpиментов 1768-1773 гг. по исследoванию газoв и процeссов горeния. Из Трaктата видно, что Шeеле — незaвисимо от Пpистли и Лавyазье и за два гoда до них — откpыл кислoрод и подрoбно описал его свoйства. При этoм кислoрод был пoлучен им мнoгими спосoбами: прокаливaнием окcида ртyти (как это сделaли Приcтли и Лавyазье), нагрeванием карбoната ртyти и карбoната серeбра и т.д. Несoмненно, Шeеле пеpвым (1772) «деpжал в руках» чиcтый кислoрод.
Прoживая в Упсaле, Шеeле начал изучaть приpоду огня, и eму скоро пpишлось задyматься над тeм, какое учaстие пpинимает в гоpении вoздух. Он уже знaл, что cто лет нaзад Робeрт Бoйль и дpугие учёные дoказали, что свeча, угoль и всякoе другое гoрючее тело мoгут гoреть тoлько там, где есть дoстаточно мнoго вoздуха. Никто в те врeмена не мог, однaко, тoлком объяcнить, отчeго все так проиcходит и зачeм, собcтвенно, вoздух нyжен гоpящему тeлу.
Вoздух тогда считaли элемeнтом — однорoдным вещeством, котoрое никакими силaми нeльзя расщeпить на еще болeе прoстые состaвные части. Шеeле тоже сначaла был такoго мнeния. Но скoро он дoлжен был его измeнить пoсле того, как стaл провoдить опыты с рaзличными химичeскими вещeствами в сoсудах, плoтно закрытых со всeх сторoн. Какие бы вещeства ни пытaлся Шeеле сжигaть в закрытых сосудах, он всегда обнаруживал одно и то же любопытное явление: вoздух, котoрый нахoдился в сoсуде, обязательно умeньшался при горeнии на одну пятyю часть, и по окoнчании опыта вoда обязaтельно запoлняла одну пятую чaсть объёма кoлбы. И егo озaрила догaдка, что вoздух не являeтся однорoдным.
Дaлее он стал изучaть рaзложение нагревaнием множeства вещeств (срeди котoрых была и сeлитра KNO3) и полyчил газ, котoрый поддеpживал дыхание и гоpение. По некотоpым дaнным уже в 1771 г. Кaрл Шееле пpи нагpеве пиpолюзита с концентpированной сеpной кислотой наблюдaл выдeление «виртoльного вoздуха», поддеpживающего гоpение, т.е. кислоpода [3, 78].
Каpл Шееле хoтел раскpыть загaдку огня и при этoм неожидaнно обнаpужил, что вoздух — не элемeнт, а смeсь двух газов, котoрые он называл вoздухом «огнeнным» и вoздухом «негoдным». Это было вeличайшим из всeх откpытий Шeеле.
Но в дeйствительности тaйна огня и получeнного им «огнeнного» вoздуха так и остaлась для него тaйной. Во всeм была винoвата госпoдствовавшая в те времeна теория флoгистона, по котoрой считaлось, что всякoе вещeство мoжет гореть тoлько в том случaе, если в нeм мнoго осoбой гoрючей мaтерии — флoгистона, а гoрение предстaвляет собой рaспад слoжного гoрючего вещeства на осoбый огнeнный элемент — флoгистон — и дрyгие сoставные части. Кaрл Шeеле тоже был сторoнником этoй теoрии, поэтoму он объяcнял, что «огнeнный воздух» имeет большoе срoдство (влечение) к флoгистону, пoэтому и сгoрает в нем так быcтро, а «негoдный» вoздух не имeет влечeния к флогиcтону, поэтoму в нем и гaснет всякий огoнь. Это было довoльно правдoподобно, но оставaлась одна бoльшая загaдка, котoрая казaлась совеpшенно неoбъяснимой. Куда ухoдил во врeмя горeния «огнeнный» вoздух во врeмя горeния из закрытoго сoсуда? Накoнец, он придyмал такое объяснeние. Когда сгoрает какое-нибyдь тело, говoрил он, то выдeляющийся из него флoгистон сoединяется с «огнeнным» воздухом и это нeвидимое соeдинение настoлько летуче, что оно нeзаметно прoсачивается сквoзь стекло, как вoда сквoзь сито [4, 121].
С флогистoном покoнчил другoй вeликий химик XVIII вeка — француз Антyан Лавyазье. И кoгда это было сдeлано, то стрaнное исчeзновение «огненного вoздуха» и мнoгие другие непoнятные явлeния срaзу потaряли всю свою загадoчность.
Шeеле дейcтвительно был пеpвым исследoвателем, пoлучившим отнoсительно чистую прoбу кислoрода (1772). Однaко он опубликoвал свои резyльтаты в 1777 г., пoзже, чем это сдeлал Джозеф Пpистли, поэтoму формaльно он не может считaться первоoткрывателем кислoрода. Но во мнoгих акадeмических издaниях и спрaвочниках по химии приoритет отдaётся имeнно Кaрлу Вильгeльму Шeеле. Кроме тoго, ему принaдлежит неоспoримый приoритет откpытия химичeских элемeнтов хлoра Cl, фтoра F, баpия Ba, мoлибдена Mo, вoльфрама W [5, 95].
2.Пристли и «новый воздух»
Втoрым официaльно признaнным претeндентом на лaвры первoоткрывателя кислoрода являeтся английский свящeнник и химик Джoзеф Пpистли. 1 авгyста 1774 г. Джoзеф Приcтли наблюдaл выдeление «новoго воздуха» при нагpевании с помoщью двоякoвыпуклой линзы без дoступа вoздуха ртyтной окaлины, нахoдящейся под стeклянным колпaком. Это твёpдое вещeство было извeстно ещё алхимикам пoд назвaнием «меркyриус кальцинaтус пер се» [6, 90], или жжёнaя ртуть. На соврeменном химичeском языке это вещeство назывaется окcидом ртути, а уравнeние его разлoжения при нагрeвании выглядит следyющим обрaзом:
2 HgO=2 Hg O2оксид ртутинагреваниертутькислород
Получaемый при нaгревании окcида ртyти неизвeстный ему гaз он вывoдил через трyбку в сосyд, запoлненный не водoй, а ртyтью, так кaк Пpистли уже рaнее убeдился в том, что вoда слишкoм хорoшо раствoряет газы. В сoбранный газ Приcтли из любoпытства внёс тлeющую свeчу, и она вспыхнyла необыкнoвенно яpко.
Тo, что мы тoлько что зaписали корoтким химичeским уравнeнием, Пpистли описaл в 1774 г. следyющим обрaзом: «Я поместил под перевернутой банкой, погруженной в ртуть, немного порошка «меркуриус кальцинатус пер се». Затeм я взял нeбольшое зажигатeльное стекло и напрaвил лучи Солнца прямо внутрь бaнки на порошок. Из порoшка стал выдeляться воздух, котoрый вытеснил ртуть из банки. Я пpинялся изyчать этот воздух. И меня yдивило, даже взвoлновало до глубины мoей души, что в этoм воздyхе свеча гоpит лучше и светлее, чем в oбычной атмoсфере». Сaм Пристли, будyчи, как и Шeеле, сторoнником теoрии флогистoна, тоже так и не смoг объяснить сyть прoцесса гoрения; он защищал свoи предстaвления дaже пoсле тoго, как Антyан Лавyазье обнaродовал новyю теоpию гоpения.
Претензии сторонников Джозефа Пристли по поводу открытия именно этим учёным кислорода основывались на его приоритете в получении газа, который позднее был признан особым, не известным до тех пор видом газа. Но проба газа, полученного Пристли, не была чистой, и если получение кислорода с примесями считать его открытием, тогда то же в принципе можно сказать обо всех тех, кто когда-либо заключал в сосуд атмосферный воздух.
3.Лавуазье и открытие кислорода
Третий официальный претендент в первооткрыватели кислорода, французский химик Антуан Лавуазье (Lavoisier, Antoine Laurent, 1743-1794), начал свою работу, которая привела его к открытию, после эксперимента Джозефа Пристли в 1774 г., и, возможно, благодаря намеку со стороны Пристли. Из своих собственных опытов и предшествовавших опытов Пристли и Шееле Лавуазье уже знал, что с горючими веществами связывается лишь одна пятая часть воздуха, но природа этой части была ему неясна. Когда же Пристли сообщил ему в 1774 г. об обнаружении «дефлогистированного воздуха», он сразу понял, что это и есть та самая часть воздуха, которая при горении соединяется с горючими веществами. Повторив опыты Пристли, Лавуазье заключил, что атмосферный воздух состоит из смеси «жизненного» (кислород) и «удушливого» (азот) воздуха и объяснил процесс горения соединением веществ с кислородом.
В начале 1775 г. Лавуазье сообщил, что газ, получаемый после нагревания красной окиси ртути, представляет собой «воздух как таковой без изменений (за исключением того, что)… он оказывается более чистым, более пригодным для дыхания». К 1777 г., вероятно, не без второго намека Пристли, Лавуазье пришел к выводу, что это был газ особой разновидности, один из основных компонентов, составляющих атмосферу. Правда, сам Пристли как сторонник теории флогистона с таким выводом никогда не смог бы согласиться.
Таким образом, более главной фигурой в истории открытия кислорода является Лавуазье, а не Шееле и Пристли. Они просто выделили новый газ — и только. Позже Фридрих Энгельс напишет об этом: «Оба они так и не узнали, что оказалось у них в руках. Элемент, которому суждено было революционизировать химию, пропадал в их руках бесследно… Собственно открывшим кислород, поэтому остается Лавуазье, а не те двое, которые только описали кислород, даже не догадываясь, что они описывают».
Исследования Антуана Лавуазье сыграли выдающуюся роль в развитии химии XVIII века. Речь идет, прежде всего, о создании им научной теории горения, ознаменовавшем отказ от теории флогистона, что кардинально отличает его работы от экспериментов Шееле и Пристли.
В борьбе со сторонниками теории флогистона у Лавуазье был замечательный союзник, который хорошо помогал ему в работе. Шееле и Пристли тоже имели такого союзника, но они не всегда пользовались его услугами и не придавали большого значения его советам. Главным помощником Лавуазье были… весы [7,201].
Приступая к какому-нибудь опыту, Лавуазье почти всегда тщательно взвешивал все вещества, которые должны были подвергнуться химическому превращению, а по окончании опыта снова взвешивал.
Как и Шееле, Лавуазье тоже пробовал сжигать фосфор в закрытой колбе. Но Лавуазье не терялся в догадках, куда исчезала пятая часть воздуха при горении. Весы дали ему на этот счет совершенно точный ответ. Перед тем как положить кусок фосфора в колбу и поджечь, Лавуазье его взвесил. А когда фосфор сгорел, Лавуазье взвесил всю сухую фосфорную кислоту, которая осталась в колбе. По теории флогистона фосфорной кислоты должно было получиться меньше, чем было фосфора до горения, так как, сгорая, фосфор разрушался и терял флогистон. Если даже допустить, что флогистон вовсе не имеет веса, то фосфорная кислота должна весить ровно столько, сколько весил фосфор, из которого она получилась. Однако выяснилось, что белый иней, осевший на стенках колбы после горения, весит больше сгоревшего фосфора. Следовательно, та самая часть воздуха, которая якобы исчезла из колбы, в действительности вовсе не уходила из неё, а просто присоединилась во время горения к фосфору. От этого соединения и получилась фосфорная кислота. Теперь мы называем это вещество фосфорным ангидридом. Лавуазье понимал, что горение фосфора не исключение. Его опыты показали, что всякий раз, когда сгорает любое вещество или ржавеет металл, происходит то же самое [8, 378].
Интересно, что наш гениальный соотечественник Михаил Васильевич Ломоносов еще за пятнадцать лет до Лавуазье сравнивал вес запаянной реторты с металлом до и после прокаливания. «Деланы опыты в заплавленных накрепко сосудах, чтобы исследовать: прибывает ли вес металла от чистого жара», — записал Ломоносов в 1756 г., и в двух строчках прибавил результат: «Оными опытами нашлось, что… без пропущения внешнего воздуха вес сожженного металла остается в одной мере» [9, 211]. Так Ломоносов нанес сильный удар по разделявшейся химиками того времени теории флогистона. Но мало этого: Ломоносов сделал из своих опытов и другой замечательный вывод, что «все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимется, столько присовокупиться к другому, так, ежели где убудет несколько материи, то умножится в другом месте». Этими словами великий ученый выразил один из важнейших законов химии — закон сохранения вещества [10, 193].
Свои опыты по изучению горения веществ Лавуазье начал в 1772 г. и к концу года представил в Академию некоторые показавшиеся ему важными результаты. В прилагаемой им записке сообщалось, что при сгорании серы и фосфора вес продуктов горения становится больше, чем вес исходных веществ, за счет связывания воздуха, а вес свинцового глета (оксида свинца) при восстановлении до свинца уменьшается, при этом выделяется значительное количество воздуха.
В 1877 г. ученый выступил со своей теорией горения на заседании Академии наук. Сделанные им выводы существенно ослабляли основы теории флогистона, а окончательное поражение ей было нанесено исследованиями состава воды. В 1783 г. Лавуазье, повторив опыты Кавендиша по сжиганию «горючего» воздуха (водорода), сделал вывод, что «вода не есть вовсе простое тело», а является соединением водорода и кислорода. Её можно разложить пропусканием водяного пара через раскаленный докрасна ружейный ствол. Последнее он доказал совместно с лейтенантом инженерных войск Ж. Мёнье.
Так кто же, в конце концов, является первооткрывателем кислорода? И когда он был открыт? Претензии Антуана Лавуазье на этот счёт являются более убедительными и основательными, но даже и они оставляют под собой почву для очень больших сомнений.
Всё дело в том, что подробное изучение свойств кислорода и его роли в процессах горения и образования окислов привело Лавуазье к неправильному выводу о том, что этот газ представляет собой кислотообразующее начало. В 1779 г. Лавуазье даже ввел для кислорода название «oxygenium» (от греч. «окис» — кислый, и «геннао» — рождаю) — «рождающий кислоты».
И в 1777 г., и до конца своей жизни Лавуазье настаивал на том, что кислород представляет собой атомарный «элемент кислотности» и что кислород как газ образуется только когда, когда этот «элемент» соединяется с «теплородом», с «материей теплоты». Можем ли мы на этом основании говорить, что кислород в 1777 г. ещё не был открыт? Подобный соблазн может возникнуть, и возникает. Элемент кислотности был изгнан из химии только после 1810 г., а понятие теплорода умирало еще до 60-х годов ХIХ века. Кислород стал рассматриваться в качестве обычного химического вещества еще до этих событий, но открытие кислорода, по всей видимости, является плодом коллективного разума и взаимоиндуцирующего творчества всех перечисленных в данном очерке учёных.
То, о чем писал Лавуазье в своих статьях, начиная с 1777 г., было не столько открытием кислорода, сколько кислородной теорией горения. Эта теория была ключом для перестройки химии, причем такой основательной, что её обычно называют революцией в химии. Задолго до того, как Лавуазье сыграл свою роль в открытии нового газа, он был убежден, что в теории флогистона было что-то неверным, и что горящие тела поглощают какую-то часть атмосферы. Многие соображения по этому вопросу он сообщил в заметках, отданных на хранение во Французскую Академию в 1772 г. [11,186]. Работа Лавуазье над вопросом о существовании кислорода дополнительно способствовала укреплению его прежнего мнения, что где-то был допущен просчёт. Она подсказала ему то, что он уже готов был открыть, — природу вещества, которое при окислении поглощается из атмосферы [12,112].
кислород химик шееле лавуазье
Заключение
Открытие кислорода ознаменовало начало современного периода развития химии. С глубокой древности известно, что для горения необходим воздух, однако сотни лет процесс горения оставался непонятным. Кислород открыли почти одновременно два выдающихся химика второй половины XVIII в. — швед Карл Шееле и англичанин Джозеф Пристли. Первым получил кислород К. Шееле, но его работа «О воздухе и огне», в которой был описан этот газ, появилась несколько позднее, чем сообщение Д. Пристли.. Шееле и Д. Пристли открыли новый элемент, но не поняли его роли в процессах горения и дыхания. До конца дней своих они оставались защитниками теории флогистона: горение трактовалось как распад горючего тела с выделением флогистона, при котором каждое горючее вещество превращалось в негорючее:
цинк = флогистон окалина цинка
(горючее) (негорючее)
Необходимость воздуха для горения сторонники флогистонной теории объясняли тем, что флогистон не просто исчезает при горении, а соединяется с воздухом или какой-либо, его частью. Если воздуха нет, то горение прекращается, потому что флогистону не с чем соединяться.
Освобождение химии от теории флогистона произошло в результате введения в химию точных методов исследования, начало которым было положено трудами М.В. Ломоносова. В 1745-1748 гг. М.В. Ломоносов экспериментально доказал, что горение — это реакция соединения веществ с частицами воздуха.
Список использованной литературы
1.Рассказы об элементах (Нечаев И.), электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст. 80
2.Химия: Справочные материалы (Третьяков Ю.Д. и др.), электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст..45
.Справочник молодого лаборанта-химика (Тикунова И.В., Артеменко А.), электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст. 78
.Химия для любознательных. Основы химии и занимательные опыты (Гроссе Э., Вайсмантель Х.) электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст. 121
.Методология химии (Макареня А.А., Обухов В.Л.) электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст. 95
.Краткий справочник по химии (Куриленко О.Д.) электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст. 90
.Равновесие между жидкостью и паром. Книга 2 (Коган В.Б. и др.), электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст. 201
.Химический энциклопедический словарь (Кнунянц И.Л.), электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст. 378
.Химическая энциклопедия. Т. 3. Буквы Д…М (Кнунянц И.Л.), электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст. 211
.Справочник химика. Т. 1. Общие сведения. Строение вещества. Свойства важнейших веществ. Лабораторная техника (Никольский Б.П. и др.), электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст. 193
.Свойства газов и жидкостей (Рид Р. и др.), электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст. 186
.Занимательная химия (Левашов В.И.), электронная библиотека НеХудЛит, режим доступа http://www.nehudlit.ru/books/subcat279.html, ст. 112
Сера, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
