- Контрольная работа по химии 11 класс. неметаллы | материал по химии (11 класс) на тему: | образовательная социальная сеть
- Общая характеристика р-элементов viа-группы. халькогены.
- Радиусы атомов, их периодические изменения в системе химических элементов
- Закономерности изменения химических свойств элементов и их соединений по периодам и группам
- Шпаргалки
Контрольная работа по химии 11 класс. неметаллы | материал по химии (11 класс) на тему: | образовательная социальная сеть
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа № 15 п. Березайка»
Бологовского района Тверской области
Контрольная работа
по теме «Неметаллы»
11 класс
Составил: учитель химии
Гарипов В. Р.
2022 год
Вариант I
Часть А Тестовые задания с выбором ответа
1. Элементу неметаллу 4-го периода ПСХЭ соответствует электронная формула:
а) 1s22s22p63s23p63d104s1 в) 1s22s22p63s23p63d104s2 4p3
б) 1s22s22p63s23p64s1 г) 1s22s22p63s1
2. Электронная формула иона серы S-2:
а) 1s22s22p63s23p6 б) 1s22s22p6 в) 1s22s22p63s1 г) 1s22s22p5
3. Постоянную степень окисления в соединениях проявляет:
а) сера б) фтор в) углерод г) азот
4. Простое вещество – азот – может являться:
а) только восстановителем в) только окислителем
б) окислителем и восстановителем
5. Схема превращений S 4→S 6→S0 представляет собой процессы:
а) восстановления в) окисления
б) окисления (1), восстановления (2) г) восстановления(1), окисления(2)
6. Восстановительные свойства в ряду химических элементов: O – N – C – B:
а ) изменяются периодически б) не изменяются в) ослабевают г) усиливаются
7. Формула вещества Х в уравнении реакции: Cu 2H2SO4=CuSO4 X 2H2O:
а) H2 б) SO2 в) H2S г) SO3
8. Продуктом гидролиза сахарозы являются:
а) глюкоза и фруктоза в) вода и углекислый газ
б) глюкоза и этанол г) вода, этанол и углекислый газ
9. Азот взаимодействует с каждым веществом группы:
а) водород, кислород, кальций
б) кислород, уксусная кислота, вода
в) оксид углерода (IV), гидроксид калия, бром
г) сера, этанол, соляная кислота
10. Кислотные свойства оксидов усиливаются в ряду:
а) SO2-SeO3-A2O5-B2O3 в) Br2O7-SO2-P2O5-SiO2
б) Li2O-BeO-B2O3-CO2 г) CO2 –B2O3-BeO-Li2O
Часть Б Задания со свободным ответом
11. Составьте формулы высшего оксида и гидроксида (кислоты) элемента, в ядре которого содержится 15 электронов. Назовите эти вещества, укажите их характер.
12. Составьте уравнения реакций следующих превращений: S → X → SO3 → H2SO4 → X →S
13. Дополните фразу: «В периоде с уменьшением заряда ядра атома от щелочного металла к галогену радиус атомов …».
14. Сравните число атомов в 32 г серы и 2,8 г кремния.
15. Рассчитайте объем, количество вещества и массу газа, полученного при взаимодействии 28 г азота с водородом, взятом в избытке.
Вариант II
Часть А Тестовые задания с выбором ответа
1. Элементу неметаллу 4-го периода ПСХЭ соответствует электронная формула:
а) 1s22s22p63s23p63d104s1 в) 1s22s22p63s23p63d104s2 4p6
б) 1s22s22p63s23p1 г) 1s22s22p63s23p5
2. Электронная формула иона фосфора P 5 :
а) 1s22s22p63s2 б) 1s22s22p6 в) 1s22s22p6 г) 1s22s22p5
3.Только отрицательную степень окисления в соединениях проявляет:
а) йод б) бром в) хлор г) фтор
4. Простое вещество – фтор – может являться:
а) только восстановителем в) только окислителем
б) окислителем и восстановителем
5. Схема превращений C0→C 2→C 4 представляет собой процессы:
а) восстановления в) окисления
б) окисления (1), восстановления (2) г) восстановления(1), окисления(2)
6. Окислительные свойства в ряду химических элементов: Sb –Te –I –Br:
а ) изменяются периодически б) не изменяются в) ослабевают г) усиливаются
7. Формула вещества Х в уравнении реакции: 2Fe 6H2SO4=Fe 2(SO4) 3 X 6H2O:
а) H2 б) SO2 в) H2S г) SO3
8. Продуктами гидролиза хлорэтана являются:
а) этанол и вода в) этанол и хлороводород
б) хлороводород и этан г) этанол, хлор, вода
9. Углерод взаимодействует с каждым веществом группы:
а) водород, оксид меди (II), вода
б) кальций, оксид серы, серная кислота
в) кислород, водород, оксид железа(II)
г) азот, сероводород, этанол,
10. Основные свойства оксидов ослабевают в ряду:
а) Na2O-Li2O-BeO-B2O3 в) N2O5-P2O5-SiO2-Al2O3
б) A2O3-SiO2 -GeO2-Ga2O3 г) CO2-B2O3 –A2O3-MgO
Часть Б Задания со свободным ответом
11. Составьте формулы высшего оксида и гидроксида (кислоты) элемента, в ядре которого содержится 15 электронов. Назовите эти вещества, укажите их характер.
12. Составьте уравнения реакций следующих превращений: Si → X → Na2SiO3→ H2SiO3 →X → Si
13. Дополните фразу: «В группе с увеличением заряда ядра атома от кислорода к теллуру радиус атомов …».
14. Сравните число атомов в 1,2 г углерода и 62 г фосфора.
15. Рассчитайте объем, количество вещества и массу газа, полученного при взаимодействии 128 г карбида кальция с водой, взятой в избытке.
Общая характеристика р-элементов viа-группы. халькогены.
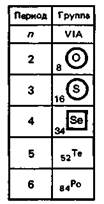 В VIА-группу периодической системы элементов Д.И. Менделеева входят кислород, сера, селен, теллур, полоний. Первые четыре из них имеют неметаллический характер. Общее название элементов этой группы халькогены, что в переводе с греч. означает «образующие руды», указывая на их нахождение в природе.
В VIА-группу периодической системы элементов Д.И. Менделеева входят кислород, сера, селен, теллур, полоний. Первые четыре из них имеют неметаллический характер. Общее название элементов этой группы халькогены, что в переводе с греч. означает «образующие руды», указывая на их нахождение в природе.
 Электронная формула валентной оболочки атомов элементов VIА-группы.
Электронная формула валентной оболочки атомов элементов VIА-группы.
Атомы этих элементов имеют по 6 валентных электронов на s- и р-орбиталях внешнего энергетического уровня. Из них две р-орбитали заполнены наполовину.
Атом кислорода отличается от атомов других халькогенов отсутствием низколежащего d-подуровня. Поэтому кислород, как правило, способен образовывать только две связи с атомами других элементов. Однако в некоторых случаях наличие неподеленных пар электронов на внешнем энергетическом уровне позволяет атому кислорода образовывать дополнительные связи по донорно-акцепторному механизму.
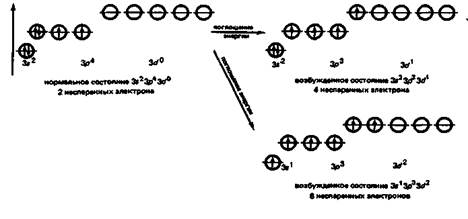 У атомов остальных халькогенов при поступлении энергии извне число неспаренных электронов может увеличиваться в результате перехода s- и р-электронов на d-подуровень. Поэтому атомы серы и других халькогенов способны образовывать не только 2, но также и 4, и 6 связей с атомами других элементов. Например, у атома серы в возбужденном состоянии электроны внешнего энергетического уровня могут приобретать электронную конфигурацию 3s23р33d1 и 3s13р33d2:
У атомов остальных халькогенов при поступлении энергии извне число неспаренных электронов может увеличиваться в результате перехода s- и р-электронов на d-подуровень. Поэтому атомы серы и других халькогенов способны образовывать не только 2, но также и 4, и 6 связей с атомами других элементов. Например, у атома серы в возбужденном состоянии электроны внешнего энергетического уровня могут приобретать электронную конфигурацию 3s23р33d1 и 3s13р33d2:
В зависимости от состояния электронной оболочки проявляются разные степени окисления (СО). В соединениях с металлами и водородом элементы этой группы проявляют СО = —2. В соединениях же с кислородом и неметаллами сера, селен и теллур могут иметь СО = 4 и СО = 6. В некоторых соединениях они проявляют СО = 2.
Кислород уступает по электроотрицательности только фтору. Во фтороксиде F2О степень окисления кислорода положительна и равна 2. С остальными элементами кислород проявляет обычно в соединениях степень окисления -2, за исключением пероксида водорода Н2О2 и его производных, в которых кислород имеет степень окисления —1. В живых организмах кислород, сера и селен входят в состав биомолекул в степени окисления —2.
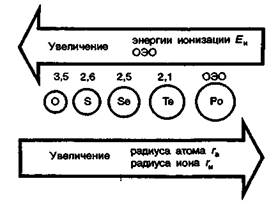 В ряду О — S — Sе—Те — Ро увеличиваются радиусы атомов и ионов. Соответственно в этом же направлении закономерно понижается энергия ионизации и относительная электроотрицательность.
В ряду О — S — Sе—Те — Ро увеличиваются радиусы атомов и ионов. Соответственно в этом же направлении закономерно понижается энергия ионизации и относительная электроотрицательность.
С увеличением порядкового номера элементов VIА-группы окислительная активность нейтральных атомов понижается и увеличивается восстановительная активность отрицательных ионов. Все это приводит к ослаблению неметаллических свойств халькогенов при переходе от кислорода к теллуру.
С увеличением порядкового номера халькогенов возрастают характерные координационные числа. Это связано с тем, что при переходе от р-элементов четвертого периода к р-элементам пятого и шестого периодов в образовании σ- и π-связей все большую роль начинают играть d— и даже f-орбитали. Так, если для серы и селена наиболее характерны координационные числа 3 и 4, то для теллура — 6 и даже 8.
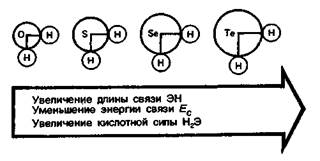 В нормальных условиях водородные соединения H2Э элементов VIА-группы, за исключением воды, — газы с очень неприятным запахом. Термодинамическая стабильность этих соединений уменьшается от воды к водородтеллуриду Н2Те. В водных растворах они проявляют слабокислотные свойства. В ряду H2О—H2S—H2Sе— H2Те сила кислот возрастает.
В нормальных условиях водородные соединения H2Э элементов VIА-группы, за исключением воды, — газы с очень неприятным запахом. Термодинамическая стабильность этих соединений уменьшается от воды к водородтеллуриду Н2Те. В водных растворах они проявляют слабокислотные свойства. В ряду H2О—H2S—H2Sе— H2Те сила кислот возрастает.
 Это объясняется увеличением радиусов ионов Э2- и соответствующим ослаблением связей Э—Н. В том же направлении растет восстановительная способность H2Э.
Это объясняется увеличением радиусов ионов Э2- и соответствующим ослаблением связей Э—Н. В том же направлении растет восстановительная способность H2Э.
Сера, селен, теллур образуют два ряда кислотных оксидов: ЭO2 и ЭО3. Им соответствуют кислотные гидроксиды состава H2ЭО3 и H2ЭО4. Кислоты H2ЭО3 в свободном состоянии неустойчивы. Соли этих кислот и сами кислоты проявляют окислительно-восстановительную двойственность, так как элементы S, Sе и Те имеют в этих соединениях промежуточную степень окисления 4.
Кислоты состава Н2ЭО4 более устойчивы и в реакциях ведут себя как окислители (высшая степень окисления элемента 6).
Химические свойства соединений кислорода.Кислород — самый распространенный элемент в земной коре (49,4%). Высокое содержание и большая химическая активность кислорода определяют преобладающую форму существования большинства элементов Земли в виде кислородсодержащих соединений. Кислород входит в состав всех жизненно важных органических веществ — белков, жиров, углеводов.
Без кислорода невозможны многочисленные чрезвычайно важные жизненные процессы, например дыхание, окисление аминокислот, жиров, углеводов. Только немногие растения, называемые анаэробными, могут обходиться без кислорода.
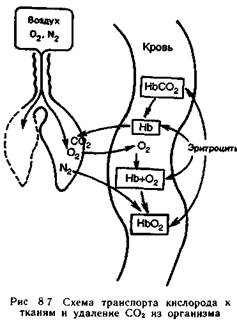
У высших животных (рис. 8.7) кислород проникает в кровь, соединяется с гемоглобином, образуя легко диссоциирующее соединение оксигемоглобин. С потоком крови это соединение поступает в капилляры различных органов. Здесь кислород отщепляется от гемоглобина и через стенки капилляров диффундирует в ткани. Связь между гемоглобином и кислородом непрочная и осуществляется за счет донорно-акцепторного взаимодействия с ионом Fе2 .
В состоянии покоя человек вдыхает примерно 0,5м3 воздуха в час. Но лишь 1/5 ч. вдыхаемого с воздухом кислорода удерживается в организме. Однако избыток кислорода (4/5) необходим для создания высокой его концентрации в крови. Это в соответствии с законом Фика обеспечивает достаточную скорость диффузии кислорода через стенки капилляров. Таким образом, за сутки человек фактически использует около 0,1м3 кислорода.
В тканях кислород расходуется. на окисление различных веществ. Эти реакции в конечном счете приводят к образованию углерода диоксида, воды и созданию запаса энергии.
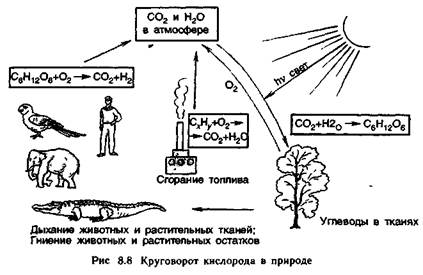
Кислород расходуется не только в процессе дыхания, но и в процессе гниения растительных и животных остатков. В результате процесса гниения сложных органических веществ образуются их продукты окисления: СО2, Н2О и др. Регенерация кислорода совершается в растениях.
Таким образом, в результате круговорота кислорода в природе поддерживается его постоянное содержание в атмосфере. Естественно, что круговорот кислорода в природе тесно связан с круговоротом углерода (рис. 8.8).
Элемент кислород существует в виде двух простых веществ (аллотропные модификации): дикислорода (кислорода) О2 и трикислорода (озона) О3. В атмосфере практически весь кислород содержится в виде кислорода О2, содержание же озона очень мало. Максимальная объемная доля озона на высоте 22км составляет всего лишь 10-6%.
 Молекула кислорода О2 в отсутствие других веществ очень стабильна. Наличие в молекуле двух неспаренных электронов обусловливает ее высокую реакционную способность. Кислород — один из самых активных неметаллов. С большинством простых веществ он реагирует непосредственно, образуя оксиды ЭxOy Степень окисления кислорода в них равна —2. В соответствии с изменением структуры электронных оболочек атомов характер химической связи, а следовательно, структура и свойства оксидов в периодах и группах системы элементов изменяются закономерно. Так, в ряду оксидов элементов второго периода Li2О—ВеО—B2О3—СО2—N2O5 полярность химической связи Э—О от I к V группе постепенно уменьшается. В соответствии с этим ослабляются основные и усиливаются кислотные свойства: Li2О — типичный основной оксид, ВеО — амфотерный, а B2О3, СО2 и N2O5 — кислотные оксиды. Аналогично изменяются кислотно-основные свойства и в других периодах.
Молекула кислорода О2 в отсутствие других веществ очень стабильна. Наличие в молекуле двух неспаренных электронов обусловливает ее высокую реакционную способность. Кислород — один из самых активных неметаллов. С большинством простых веществ он реагирует непосредственно, образуя оксиды ЭxOy Степень окисления кислорода в них равна —2. В соответствии с изменением структуры электронных оболочек атомов характер химической связи, а следовательно, структура и свойства оксидов в периодах и группах системы элементов изменяются закономерно. Так, в ряду оксидов элементов второго периода Li2О—ВеО—B2О3—СО2—N2O5 полярность химической связи Э—О от I к V группе постепенно уменьшается. В соответствии с этим ослабляются основные и усиливаются кислотные свойства: Li2О — типичный основной оксид, ВеО — амфотерный, а B2О3, СО2 и N2O5 — кислотные оксиды. Аналогично изменяются кислотно-основные свойства и в других периодах.
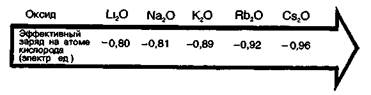 В главных подгруппах (А-группах) с увеличением порядкового номера элемента ионность связи Э—О в оксидах обычно увеличивается.
В главных подгруппах (А-группах) с увеличением порядкового номера элемента ионность связи Э—О в оксидах обычно увеличивается.
Соответственно основные свойства оксидов в группе Li—Nа—К—Rb—Сs и других А-группах возрастают.
Свойства оксидов, обусловленные изменением характера химической связи, представляют собой периодическую функцию заряда ядра атома элемента. Об этом свидетельствует, например, изменение по периодам и группам температур плавления, энтальпий образования оксидов в зависимости от заряда ядра.
Полярность связи Э—ОН в гидроксидах Э(ОН)n, а следовательно, и свойства гидроксидов закономерно изменяются по группам и периодам системы элементов.
Например, в IА-, IIА- и IIIА-группах сверху вниз с увеличением радиусов ионов полярность связи Э—ОН возрастает. В результате в воде легче идет ионизация Э—ОН → Э ОН—. Соответственно усиливаются основные свойства гидроксидов. Так, в группе IА основные свойства гидроксидов щелочных металлов усиливаются в ряду Li—Nа—К—Rb—Сs.
В периодах слева направо с уменьшением ионных радиусов и увеличением заряда иона полярность связи Э—ОН уменьшается. В результате в воде легче идет ионизация ЭОН ⇄ ЭО— Н . Соответственно в этом направлении усиливаются кислотные свойства. Так, в пятом периоде гидроксиды RbОН и Sr(ОН)2 являются основаниями, In(ОН)3 и Sn(ОН)4 — амфотерными соединениями, а Н[Sb(ОН)6] и Н6ТеО6 — кислотами.
Наиболее распространенный на земле оксид — водород оксид или вода. Достаточно сказать, что она составляет 50—99% массы любого живого существа. В организме человека содержится 70—80% воды. За 70 лет жизни человек выпивает около 25 000 кг воды.
Благодаря своей структуре вода обладает уникальными свойствами. В живом организме она является растворителем органических и неорганических соединений, участвует в процессах ионизации молекул растворенных веществ. Вода является не только средой, в которой протекают биохимические реакции, но и сама интенсивно участвует в гидролитических процессах.
Жизненно важна способность кислорода к образованию оксигенильных комплексов с различными веществами. Ранее рассмотрены примеры оксигенильных комплексов О2 с ионами металлов — переносчиков кислорода в живых организмах — оксигемоглобин и оксигемоцианин:
НbFе2 О2 → НbFе2 ∙О2
НсСu2 О2 → НсСu2 ∙О2
где Нb — гемоглобин, Нc — гемоцианин.
Имея две неподеленные пары электронов, кислород выступает в качестве донора в этих координационных соединениях с ионами металлов. В других соединениях кислород образует различные водородные связи.
В настоящее время большое внимание уделяется получению оксигенильных комплексов переходных металлов, которые могли бы выполнять функции, сходные с функциями соответствующих бионеорганических комплексных соединений. Состав внутренней координационной сферы этих комплексов аналогичен природным активным центрам. В частности, перспективными по способности обратимо присоединять и отдавать элементный кислород являются комплексы кобальта с аминокислотами и некоторыми другими лигандами. Эти соединения в известной степени можно рассматривать как заменители гемоглобина.
Одной из аллотропных модификаций кислорода является озонО3. По своим свойствам озон сильно отличается от кислорода О2 — имеет более высокие температуры плавления и кипения, обладает резким запахом (отсюда его название).
Образование озона из кислорода сопровождается поглощением энергии:
3О2 ⇄2О3,
Озон получают при действии электрического разряда в кислороде. Образуется озон из О2 и под действием ультрафиолетового излучения. Поэтому при работе бактерицидных и физиотерапевтических ультрафиолетовых ламп чувствуется запах озона.
Озон — сильнейший окислитель. Окисляет металлы, бурно реагирует с органическими веществами, при низкой температуре окисляет соединения, с которыми кислород не реагирует:
О3 2Аg = Аg2О О2
РbS 4О3 = РbSО4 4O2
Широко известна качественная реакция:
2КI О3 Н2О = I2 2КОН О2
Окислительное действие озона на органические вещества связано с образованием радикалов:
RН О3 → RО2∙ ОН∙
 Радикалы инициируют радикально-цепные реакции с биоорганическими молекулами — липидами, белками, ДНК. Такие реакции приводят к повреждению и гибели клеток. В частности, озон убивает микроорганизмы, содержащиеся в воздухе и воде. На этом основано применение озона для стерилизации питьевой воды и воды плавательных бассейнов.
Радикалы инициируют радикально-цепные реакции с биоорганическими молекулами — липидами, белками, ДНК. Такие реакции приводят к повреждению и гибели клеток. В частности, озон убивает микроорганизмы, содержащиеся в воздухе и воде. На этом основано применение озона для стерилизации питьевой воды и воды плавательных бассейнов.
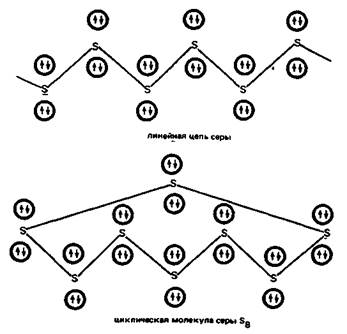
Химические свойства соединений серы.По своим свойствам сера близка к кислороду. Но в отличие от него она проявляет в соединениях не только степень окисления —2, но и положительные степени окисления 2, 4 и 6. Для серы, как и для кислорода, характерна аллотропия — существование нескольких элементных веществ — ромбической, моноклинной, пластической серы. Вследствие меньшей электроотрицательности по сравнению с кислородом способность к образованию водородных связей у серы выражена слабее. Для серы характерно образование устойчивых полимерных гомоцепей, имеющих зигзагообразную форму.
Образование гомоцепей из атомов серы характерно и для ее соединений, выполняющих существенную биологическую роль в процессах жизнедеятельности. Так, в молекулах аминокислоты — цистина имеется дисульфидный мостик —S—S—:
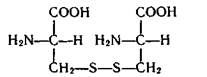
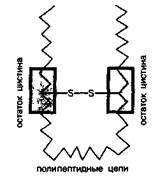
Эта аминокислота играет важную роль в формировании белков и пептидов. Благодаря дисульфидной связи S—S полипептидные цепи оказываются скрепленными между собой (дисульфидный мостик).
 Характерно для серы и образование водородсульфидной (сульфгидрильной) тиоловой группы —SН, которая присутствует в аминокислоте цистеине, белках, ферментах.
Характерно для серы и образование водородсульфидной (сульфгидрильной) тиоловой группы —SН, которая присутствует в аминокислоте цистеине, белках, ферментах.
Очень важной в биологическом отношении является аминокислота метионин.
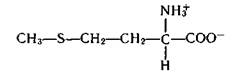
Донором метильных групп в живых организмах служит S-аденозилметионин Аd—S—СН3 — активированная форма метионина, в которой метильная группа соединена через S с аденином Аd. Метильная группа метионина в процессах биосинтеза переносится на различные акцепторы метильных групп RН:
Аd—S—СН3 RН → Аd—SН R—СН3
Сера довольно широко распространена на Земле (0,03%). В природе присутствует в виде сульфидных (ZnS, НgS, РbS и др.) и сульфатных (Nа2SО4∙10Н2О, СаSО4∙2Н2О и др.) минералов, а также в самородном состоянии. Порошок «серы осажденной» применяют наружно в виде мазей (5—10—20%) и присыпок при лечении кожных заболеваний (себореи, псориаза). В организме образуются продукты окисления серы — политионовые кислоты с общей формулой H2SxO6 (х = 3—6)
S O2 → H2SxO6
Эти продукты обладают противомикробной и противопаразитарной активностью. Таков же механизм действия серы очищенной, применяемой в качестве противоглистного средства.
Сера — довольно активный неметалл. Даже при небольшом нагревании она окисляет многие простые вещества, однако и сама легко окисляется кислородом и галогенами (окислительно-восстановительная двойственность).
Степень окисления —2 сера проявляет в сероводороде и его производных — сульфидах.
Сероводород (диводородсульфид) часто встречается в природе. Содержится в так называемых серных минеральных водах. Это бесцветный газ с неприятным запахом. Образуется при гниении растительных и, в особенности, животных остатков под действием микроорганизмов. Некоторые фотосинтезирующие бактерии, например зеленые серные бактерии, в качестве донора водорода используют диводородсульфид. Эти бактерии вместо кислорода О2 выделяют элементную серу — продукт окисления Н2S.
Диводородсульфид — весьма токсичное вещество, так как является ингибитором фермента цитохромоксидазы — переносчика электронов в дыхательной цепи. Он блокирует перенос электронов с цитохромоксидазы на кислород О2.
Водные растворы Н2S дают слабокислую реакцию по лакмусу. Происходит ионизация по двум ступеням:
Н2S ⇄ Н НS— (I ступень)
НS— ⇄ Н S2- (II ступень)
Сероводородная кислота очень слабая. Поэтому ионизация по второй ступени протекает только в очень разбавленных растворах.
Соли сероводородной кислоты называются сульфидами. В воде растворимы сульфиды только щелочных, щелочноземельных металлов и аммония. Кислые соли — гидросульфиды Э НS и Э2 (НS)2 — известны только для щелочных и щелочноземельных металлов
Являясь солями слабой кислоты, сульфиды подвергаются гидролизу. Гидролиз сульфидов многозарядных катионов металлов (Аl3 , Сr3 и др.) часто доходит до конца, он практически необратим.
Сульфиды, в особенности сероводород, являются сильными восстановителями. В зависимости от условий они могут окисляться до S, SО2 или Н2SО4:
2Н2S 3О2 = 2SО2 2Н2О (на воздухе)
2Н2S О2 = 2Н2О 2S (на воздухе)
3Н2S 4НСlO3 = 3Н2SО4 4НСl (в растворе)
Некоторые белки, содержащие цистеин НSСН2СН(NН2)СООН и важный метаболит кофермент А, имеющие водородсульфидные (тиоловые) группы —SН, в ряде реакций ведут себя как бионеорганические производные диводородсульфида. Белки, содержащие цистеин, так же, как и диводородсульфид, можно окислить иодом. При помощи дисульфидного мостика, образующегося при окислении тиоловых групп, цистеиновые остатки полипептидных цепей соединяют эти цепи поперечной связью (образуется сшивка).
 Многие серосодержащие ферменты Е—SН необратимо отравляются ионами тяжелых металлов, такими, как Сu2 или Аg . Эти ионы блокируют тиольные группы с образованием меркаптанов, бионеорганических аналогов сульфидов:
Многие серосодержащие ферменты Е—SН необратимо отравляются ионами тяжелых металлов, такими, как Сu2 или Аg . Эти ионы блокируют тиольные группы с образованием меркаптанов, бионеорганических аналогов сульфидов:
Е—SН Аg → Е—S—Аg Н
В результате фермент теряет активность. Сродство ионов Аg к тиольным группам настолько велико, что АgNО3 можно использовать для количественного определения —SН-групп методом титрования.
Оксид серы (IV) SO2 является кислотным оксидом. Его получают сжиганием элементной серы в кислороде или обжигом пирита FеS2:
S О2 = SО2
4FеS2 11О2 = 2Fе2О3 8SО2
SО2 — газ с удушливым запахом; весьма ядовит. При растворении SО2 в воде образуется сернистая кислота Н2SО3. Эта кислота средней силы. Сернистая кислота, будучи двухосновной, образует соли двух типов: средние — сульфиты (Nа2SО3, К2SО3 и др.) и кислые — гидросульфиты (NаНSО3, КНSО3 и др.). В воде растворимы лишь соли щелочных металлов и гидросульфиты типа Э2 (НSО3)2, где Э — элементы различных групп.
Для оксида SО2, кислоты Н2SОз и ее солей характерна окислительно-восстановительная двойственность, так как сера имеет в этих соединениях промежуточную степень окисления 4:
2Nа2SО3 О2 = 2Nа2SО4
SО2 2Н2S = 3S° 2Н2O
Однако восстановительные свойства у соединений серы (IV) преобладают. Так, сульфиты в растворах окисляются даже дикислородом воздуха при комнатной температуре.
На высших животных оксид SO2 действует прежде всего как раздражитель слизистой оболочки дыхательных путей. Токсичен этот газ и для растений. В промышленных районах, где сжигается много угля, содержащего небольшое количество соединений серы, в атмосферу выделяется сера диоксид. Растворяясь во влаге, находящейся на листьях, SО2 образует раствор сернистой кислоты, который, в свою очередь, окисляется до серной кислоты Н2SО4:
SО2 Н2О = Н2SО3
2Н2SО3 О2 = 2Н2SО4
Атмосферная влага с растворенными SО2 и Н2SО4 выпадает нередко в виде кислотных дождей, приводящих к гибели растительности.
При нагревании раствора Nа2SО3 с порошком серы образуется натрий тиосульфат:
Nа2SО3 S = Nа2S2О3
Из раствора выделяется кристаллогидрат Nа2S2О3∙5Н2О. Натрий тиосульфат — соль тиосерной кислоты Н2S2О3.
Тиосерная кислота очень неустойчива и разлагается на Н2О, SО2 и S. Натрий тиосульфат Nа2S2О3∙5Н2О применяют в медицинской практике как противотоксическое, противовоспалительное и десенсибилизирующее средство. Как противотоксическое средство, натрий тиосульфат используют при отравлениях соединениями ртути, свинца, синильной кислотой и ее солями. Механизм действия препарата, очевидно, связан с окислением тиосульфат-иона до сульфит-иона и элементной серы:
S2О32- → SО32- S°
Ионы свинца и ртути, попадающие в организм с пищей или воздухом, образуют плохо растворимые нетоксичные сульфиты:
Рb2 SO32- = РbSO3
Цианид-ионы взаимодействуют с элементной серой, образуя менее ядовитые тиоцианаты:
СN— S° = NСS—
Применяют натрий тиосульфат и для лечения чесотки. После втирания в кожу раствора делают повторные втирания 6%-ного раствора НСl. В результате реакции с НСl натрий тиосульфат распадается на серу и диоксид серы:
Nа2S2О3 2НСl = 2NaСl SО2 S Н2О
которые и оказывают губительное действие на чесоточных клещей.
Оксид серы (VI) SО3 — летучая жидкость. При взаимодействии с водой SО3 образует серную кислоту:
серы (VI) SО3 — летучая жидкость. При взаимодействии с водой SО3 образует серную кислоту:
SО3 Н2О = Н2SО4
Структура молекул серной кислоты соответствует сере в sр3—гибридном состоянии.
Серная кислота — сильная двухосновная кислота. По первой ступени она ионизирована практически полностью:
Н2SО4 ⇄ Н НSО4—,
Ионизация по второй ступени протекает в меньшей степени:
НSО4— ⇄ Н SО42-,
Концентрированная серная кислота — сильный окислитель. Она окисляет металлы и неметаллы. Обычно продуктом ее восстановления является SО2, хотя в зависимости от условий проведения реакции (активности металла, температуры, концентрации кислоты) могут получаться и другие продукты (S, Н2S).
Будучи двухосновной кислотой, Н2SО4 образует два типа солей: средние — сульфаты (Na2SO4 и др.) и кислые — гидросульфаты (NаНSО4, КНSО4 и др.). Большинство сульфатов хорошо растворимы в воде Многие сульфаты выделяются из растворов в виде кристаллогидратов: FеSО4∙7Н2О, СuSО4∙5Н2О. К практически нерастворимым относятся сульфаты ВаSО4, SrSО4 и РbSО4. Малорастворим кальций сульфат СаSО4. Барий сульфат нерастворим не только в воде, но и в разбавленных кислотах.
В медицинской практике сульфаты многих металлов применяют в качестве лекарственных средств Na2SO4∙10Н2О — как слабительное, MgSО4∙7Н2О — при гипертонии, как слабительное и как желчегонное средство, медный купорос СuSО4∙5Н2О и ZnSО4∙7Н2О — как антисептические, вяжущие, рвотные средства, барий сульфат ВаSО4 — как контрастное вещество при рентгенологическом исследовании пищевода и желудка
Соединения селена и теллура.По химическим свойствам теллур и в особенности селен похожи на серу. Однако усиление металлических свойств у Sе и Те повышает их склонность к образованию более прочных ионных связей. Сходство физико-химических характеристик: радиусов ионов Э2-, координационных чисел (3, 4) — обусловливает взаимозамещаемость селена и серы в соединениях. Так, селен может замещать серу в активных центрах ферментов. Замена водородсульфидной группы —SН на водородселенидную группу —SеН изменяет течение биохимических процессов в организме. Селен может выступать как синергистом, так и антагонистом серы.
С водородом Sе и Те образуют аналогичные Н2S очень ядовитые газы Н2Sе и Н2Те. Диводородселенид и диводородтеллурид являются сильными восстановителями. В ряду Н2S—Н2Sе—Н2Те восстановительная активность растет.
Для Н2Sе выделены как средние соли — селениды (Nа2Sе и др.), так и кислые соли — гидроселениды (NaНSе и др.). Для Н2Те известны только средние соли — теллуриды.
Соединения Sе (IV) и Те (IV) с кислородом в отличие от SО2 — твердые кристаллические вещества SеО2 и ТеО2.
Селенистая кислота Н2SеО3 и ее соли селениты, например Nа2SеО3, — окислители средней силы. Так, в водных растворах они восстанавливаются до селена такими восстановителями, как SО2, Н2S, НI и др.:
Н2SеО3 2SО2 Н2О = Sе 2Н2SО4
Очевидно, что легкость восстановления селенитов до элементного состояния обусловливает образование в организме биологически активных селенсодержащих соединений, например селеноцистеина.
SеО3 и ТеО3 — кислотные оксиды. Кислородные кислоты Sе (VI) и Те (VI) — селеновая Н2SеО4 и теллуровая Н6ТеО6 — кристаллические вещества с сильными окислительными свойствами. Соли этих кислот называются соответственно селенатами и теллуратами.
В живых организмах селенаты и сульфаты — антагонисты. Так, введение сульфатов приводит к выведению из организма избыточных селенсодержащих соединений.
§
Кислород.По содержанию в организме человека (мас. доля 62%) кислород относится к макроэлементам. Он незаменим и принадлежит к числу важнейших элементов, составляющих основу живых систем, т.е. является органогеном. Кислород входит в состав огромного числа молекул, начиная от простейших и кончая биополимерами. Исключительно велика роль кислорода в процессах жизнедеятельности, так как окисление кислородом питательных веществ — углеводов, белков, жиров — служит источником энергии, необходимой для работы органов и тканей живых организмов. Большинство окислительно-восстановительных реакций в организме протекает при участии кислорода и его активных форм.
Фагоцитарные (защитные) функции организма также связаны с наличием кислорода, и уменьшение содержания кислорода в организме понижает его защитные свойства.
В фагоцитах (клетках, способных захватывать и переваривать посторонние тела) кислород О2 восстанавливается до супероксид-иона О2—. Ион О2— — радикал, инициирующий радикальноцепные процессы окисления инородных органических веществ RН, захваченных фагоцитами.
При недостатке кислорода эти процессы замедляются, и в результате сопротивляемость организма к инфекциям снижается.
В медицинской практике кислород применяют для вдыхания при болезненных состояниях, сопровождающихся кислородной недостаточностью (гипоксией), заболеваниях дыхательных путей, сердечно-сосудистой системы, отравлениях оксидом углерода (II) СО, синильной кислотой НСN, а также при заболеваниях с нарушениями функций дыхания.
Широко используется в клинической практике гипербарическая оксигена-ция — применение кислорода под повышенным давлением. Установлено, что гипербарическая оксигенация значительно улучшает кислородное насыщение тканей, гемодинамику, защищает головной мозг от гипоксии. Этот метод лечения с высокой эффективностью применяют в кардиологии, реанимации, неврологии, хирургии и других областях медицины. Для общего улучшения обменных процессов при лечении сердечно-сосудистых заболеваний в желудок вводят кислородную пену в виде так называемого кислородного коктейля.
Аллотропную модификацию кислорода — озон О3 как очень сильный окислитель используют для дезинфекции помещений, обеззараживания воздуха и очистки питьевой воды. Небольшая примесь озона в воздухе создает ощущение приятной свежести и благотворно действует на состояние человека, особенно легочных больных.
При использовании кислорода О2 и озона О3 следует учитывать их токсичность, обусловленную интенсификацией процессов окисления в организме.
Сера.По содержанию в организме человека (мас. доля 0,16%) сера относится к макроэлементам. Как и кислород, она жизненно необходима. Суточная потребность взрослого человека в сере около 4—5г. Сера входит в состав многих биомолекул — белков, аминокислот (цистина, цистеина, метионина и др.). гормонов (инсулина), витаминов (витамин В12). Много серы содержится в каротине волос, костях, нервной ткани.
Аминокислоты, содержащие серу, характеризуются наличием водородсульфидных (тиоловых) —SН-групп (например, цистеин) или наличием дисульфидных связей —S—S— (например, цистин). При окислении тиоловых групп образуются дисульфидные связи и, наоборот, при восстановлении связей —S—S— образуются SН-группы, т.е. эти переходы обратимы:
R1—S—S—R2 ⇄ R1SН R2SН
В некоторой степени этот обратимый переход защищает организм от радиационных поражений. Под влиянием ионизирующего облучения в результате радиолиза воды в организме образуются свободные радикалы, в том числе весьма активные Н• и ОН• , инициирующие процессы окисления. Водородсульфидные группы вступают в реакции со свободными радикалами:
RSН ОН• → RS• Н2O
Радикалы RS• малоактивны. Тем самым предотвращается воздействие активных радикалов на нуклеиновые кислоты и другие биомолекулы.
 В живых организмах сера, входящая в состав аминокислот, окисляется. Конечными продуктами этого процесса преимущественно являются сульфаты. Кроме того, образуются тиосульфаты, элементная сера и политионовые кислоты:
В живых организмах сера, входящая в состав аминокислот, окисляется. Конечными продуктами этого процесса преимущественно являются сульфаты. Кроме того, образуются тиосульфаты, элементная сера и политионовые кислоты:
Образующаяся в организме эндогенная серная кислота участвует в обезвреживании ядовитых соединений — фенола, крезола, индола, вырабатываемых в кишечнике из аминокислот микробами. Кроме того, серная кислота связывает многие чужеродные для организма соединения (ксенобиотики) —лекарственные препараты и их метаболиты. Со всеми этими соединениями серная кислота образует относительно безвредные вещества — конъюгаты, в виде которых они и выводятся из организма. Например, с мочой человека выделяется конъюгат — калиевая соль сернокислого эфира фенола:
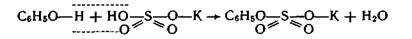
В медицинской практике широко применяют как саму серу, так и многие ее соединения: сера осажденная, натрий тиосульфат, сульфаты натрия, меди, цинка и др.
Селен.По содержанию в организме (мас доля 10-5—10-7%) селен относится к микроэлементам. Некоторые исследователи относят его к жизненно необходимым элементам.
Селен поступает с пищей — 55—110мг в год. Селен в основном концентрируется в печени и почках. Концентрация селена в крови составляет 0,001—0,004 ммоль/л.
Несомненна связь селена с серой в живых организмах. При больших дозах селен в первую очередь накапливается в ногтях и волосах, основу которых составляют серосодержащие аминокислоты. Очевидно, селен как аналог серы замещает ее в различных соединениях:
R—S—S—R → R—Sе—Sе—R
Токсическое действие селенитов и селенатов на сельскохозяйственных животных давно известно Связанные с селеном заболевания скота наблюдались в местах, где в почве в повышенных количествах присутствуют эти соли. Тем неожиданнее оказались результаты опытов, в которых было обнаружено, что селен, правда, в значительно меньших количествах должен содержаться в пище крыс, цыплят, телят, ягнят и кроликов.
Установлено, что недостаток селена ведет к уменьшению концентрации фермента глутатионпероксидазы, что, в свою очередь, приводит к окислению линидов и серосодержащих аминокислот.
Проведенные в последние годы исследования показали, что селен в комплексе с какой-либо кислотой входит в состав активных центров нескольких ферментов: формиатдегидрогеназы, глутатионредуктазы и глутатионпероксидазы. В частности, в активном центре глутатионпероксидазы содержится остаток необычной аминокислоты — селеноиистеина:
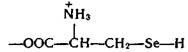
Этот фермент вместе с белком глутатионом и защищает клетки от разрушающего действия органических пероксйдов RООН и пероксида водорода. Возможно, что водородселенидная группа —SеН остатка селеноцистеина обладает какими-то преимуществами по сравнению с водородсульфидной группой —SН в механизме действия этого и других селенсодержащих ферментов.
Следует отметить, что компенсация недостатка селена в организме путем добавления в рацион крыс натрия селенита Nа2SеО3 способствовала предохранению от некроза тканей. Это еще раз подчеркивает физиологическую роль селена в процессе жизнедеятельности.
Хорошо известна и способность селена предохранять организм от отравления ртутью Нg и кадмием Сd. Оказалось, что селен способствует связыванию этих токсичных металлов с другими активными центрами — с теми, на которые их токсическое действие не влияет. Интересным является и факт взаимосвязи между высоким содержанием селена в .рационе и низкой смертностью от рака.
В больших дозах, как уже отмечалось, селен токсичен. Распад соединений селена в организме животных приводит к выделению высокотоксичного диметилселена СН3—Sе—СН3, имеющего чесночный запах. Установлен механизм этой реакции. При взаимодействии селенистой кислоты H2SеО3 с глутатионом образуются соединения, содержащие группу —S—Sе—S—
Н2SеО3 4GSН → GSSeSG GSSG 3Н2О
Под действием ферментов соединения, содержащие группу —S—Sе—S—, восстанавливаются до диводородселенида:
GSSeSG → H2Sе
который затем присоединяет метильные группы, образуя диметилселен.
Теллур и полоний. Теллур обнаружен в живых организмах. Норма его содержания в тканях и органах не установлена. Не выяснен и вопрос, играет ли он какую-нибудь биологическую роль в живых организмах. Известно только, что введение в организм в избытке соединений теллура ведет, как и в случае селена, к замещению серы в тиоловых группах, что приводит к ингибированию ферментов.
Данные о влиянии полония на живые организмы отсутствуют.
Таким образом, среди элементов VIА-группы жизненно необходимыми являются макроэлементы кислород и сера. Селен физиологически активен, а биологическое действие теллура и полония не выявлено. В живых организмах кислород, сера и селен входят в состав биомолекул в степени окисления —2, причем вследствие близости физико-химических характеристик их атомов сера, селен и теллур могут замещать друг друга в соединениях Наблюдаются как случаи синергизма, так и антагонизма этих элементов.
§
 Элементы фтор F, хлор Сl, бром Вr, иод I, астат Аt, входящие в VIIА-группу, называются галогенами (общее обозначение Г). В переводе с греч. галогены означают «солепорождающие». В эту группу часто включают также водород Н, однако свойства его существенно отличаются от свойств галогенов, и поэтому химические свойства водорода целесообразно рассматривать отдельно.
Элементы фтор F, хлор Сl, бром Вr, иод I, астат Аt, входящие в VIIА-группу, называются галогенами (общее обозначение Г). В переводе с греч. галогены означают «солепорождающие». В эту группу часто включают также водород Н, однако свойства его существенно отличаются от свойств галогенов, и поэтому химические свойства водорода целесообразно рассматривать отдельно.
 На валентных орбиталях атомов галогенов находится по семь электронов — два на s- и пять на p-орбиталях. Электронная формула валентной оболочки пs2пр5, где п — номер периода.
На валентных орбиталях атомов галогенов находится по семь электронов — два на s- и пять на p-орбиталях. Электронная формула валентной оболочки пs2пр5, где п — номер периода.
До завершения оболочки благородных газов недостает одного электрона. Поэтому галогены обладают большим сродством к электрону и являются сильными окислителями. Атомы галогенов, присоединяя электрон, образуют однозарядные галогенид-ионы с электронной структурой соответствующего благородного газа (пs2пр6).
 Такая склонность к присоединению электронов характеризует галогены как типичные неметаллы. Галогенид-ионы, особенно Сl—, устойчивы в биосредах.
Такая склонность к присоединению электронов характеризует галогены как типичные неметаллы. Галогенид-ионы, особенно Сl—, устойчивы в биосредах.
Одинаковое строение внешнего электронного слоя атомов галогенов обусловливает большое сходство в химических свойствах простых и сложных веществ, образуемых галогенами.
Однако сопоставление свойств однотипных соединений галогенов показывает, что между ними имеются и существенные различия. Последние связаны с изменением атомных радиусов и различным строением внутренних электронных оболочек. Так, например, у хлора валентным электронам предшествует 8-электронная оболочка, а у брома и иода — более рыхлая, склонная к деформации 18-электронная оболочка. Поэтому можно ожидать, что свойства соединений хлора будут отличаться от свойств соединений брома и иода, особенно в тех случаях, когда в образовании химических связей принимают участие предвнешние атомные орбитали.
С повышением заряда ядра в группе от F к Аt: увеличиваются радиусы атомов. Это находит отражение в уменьшении в ряду F—Аt энергии ионизации и сродства к электрону, электроотрицательности, стандартного потенциала восстановления.
 Уменьшение энергии ионизации помимо возрастания атомного радиуса объясняется усиливающимся (по мере заполнения электронных оболочек) экранированием заряда ядра электронами внутренних слоев. Также закономерно происходит в ряду Сl—Аt уменьшение энергии сродства к электрону. Это связано с ослаблением притяжения свободного электрона к ядру вследствие увеличения радиуса атома и экранирования. В результате, как и в других группах р-элементов, с увеличением числа заполняемых электронных оболочек неметаллические свойства ослабевают.
Уменьшение энергии ионизации помимо возрастания атомного радиуса объясняется усиливающимся (по мере заполнения электронных оболочек) экранированием заряда ядра электронами внутренних слоев. Также закономерно происходит в ряду Сl—Аt уменьшение энергии сродства к электрону. Это связано с ослаблением притяжения свободного электрона к ядру вследствие увеличения радиуса атома и экранирования. В результате, как и в других группах р-элементов, с увеличением числа заполняемых электронных оболочек неметаллические свойства ослабевают.
Меньшее сродство к электрону у фтора (328 кДж/моль), чем у хлора (349 кДж/моль), объясняется значительным межэлектронным отталкиванием. Увеличение отталкивания свободного электрона атомом фтора обусловлено меньшим размером атома. Так как в ряду F—Сl—Вr—I—Аt энергия сродства вцелом уменьшается, окислительная активность в этом ряду также снижается.
Необходимо отметить, что хотя сродство к электрону у фтора меньше, чем у хлора, элементный фтор тем не менее является наиболее сильным окислителем среди галогенов. Это можно объяснить следующим образом Энергия, необходимая для восстановления газообразного фтора и хлора до отрицательно заряженных ионов слагается из энергии разрыва связи между атомами галогенов Г и сродства к электрону.
 Так как химическая связь в молекуле хлора значительно прочнее, энергия разрыва связи в молекуле фтора существенно меньше, чем в молекуле хлора. Незначительный выигрыш в сродстве к электрону атома хлора не компенсирует большую затрату энергии на разрыв химической связи в молекуле хлора. В результате фтор оказывается более сильным окислителем.
Так как химическая связь в молекуле хлора значительно прочнее, энергия разрыва связи в молекуле фтора существенно меньше, чем в молекуле хлора. Незначительный выигрыш в сродстве к электрону атома хлора не компенсирует большую затрату энергии на разрыв химической связи в молекуле хлора. В результате фтор оказывается более сильным окислителем.
 Для галогенов характерно многообразие химических соединений. Элементные галогены (нулевая степень окисления) представляют собой двухатомные неполярные молекулы Г2. Появление нечетных положительных степеней окисления 1, 3, 5, 7 атомов Сl, Вr, I, Аt связано с переходом электронов на d-орбитали. Например, атом хлора имеет один неспаренный электрон в нормальном состоянии и 5 свободных d-орбиталей с низкой энергией.
Для галогенов характерно многообразие химических соединений. Элементные галогены (нулевая степень окисления) представляют собой двухатомные неполярные молекулы Г2. Появление нечетных положительных степеней окисления 1, 3, 5, 7 атомов Сl, Вr, I, Аt связано с переходом электронов на d-орбитали. Например, атом хлора имеет один неспаренный электрон в нормальном состоянии и 5 свободных d-орбиталей с низкой энергией.
Такой атом может быть переведен в зависимости от поглощаемой энергии в возбужденное состояние с тремя, пятью или семью неспаренными электронами.
Исключение составляет фтор. Отсутствие низколежащих d-подуровней у его атома приводит к тому, что процесс возбуждения оказывается невыгодным. Переход электрона на высоколежащий 3d-подуровень требует очень большой затраты энергии. Поэтому для фтора характерна постоянная валентность, равная единице.
Все галогены проявляют степень окисления —1 в водородгалогенидах НГ (например, НF, НСl) и в солях-галогенидах ЭГ (NаF, NаСl и др.).
Водородгалогениды (НГ) — газы, хорошо растворимые в воде. Водные растворы НГ ведут себя как кислоты. Сила кислот НГ растет с уменьшением электроотрицательности галогенов сверху вниз по группе. Такой характер изменения силы кислот НГ объясняется уменьшением прочности связи Н—Г в ряду НF—НСl—НВr—НI и уменьшением энергии гидратации ионов Г—.
Кислородные соединения галогенов (оксиды, кислоты) термически нестабильны. Устойчивость кислородных соединений галогенов в ряду F—Аt в целом возрастает.
Галогены и галогениды.Элементные галогены — вещества общей формулы Г2, т.е. состоят из двухатомных молекул: F2, Cl2, Вr2, I2, Аt2. Связь Г—Г образуется за счет одной σ-связывающей молекулярной орбитали, полученной при перекрывании атомных nр-орбиталей. Остальным связывающим молекулярным орбиталям (π-орбиталям) соответствуют разрыхляющие, заполненные электронами:
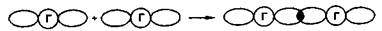
Образование двухатомных молекул галогенов из нейтральных атомов сопровождается выделением значительной энергии. В ряду Сl2 — Вr2 —I2 — Аt2 с увеличением межъядерного расстояния прочность связи между атомами уменьшается. Соответственно уменьшаются в этом ряду энтальпии диссоциации молекул Г2. Причиной уменьшения прочности связи в ряду является снижение степени перекрывания связывающих nр-орбиталей. Меньшую прочность связи Г—Г в молекулах фтора по сравнению с другими галогенами можно объяснить тем, что в образовании связи Г—Г не принимают участия d-орбитали.
Элементные галогены Г2, как неполярные соединения, плохорастворимы в воде. При 20°С растворимость Сl2 — 0,091 моль/л, Вr2 — 0,22 моль/л, I2 — 0,001 моль/л. Однако равновесие Г2 (г) ⇄ Г2 (р) сдвигается вправо вследствие реакций галогенов с водой (принцип Ле Шателье).
Фтор энергично реагирует с водой:
2F2 2Н2О = 4НF О2.
При взаимодействии других галогенов с водой помимо соответствующего водородгалогенида образуется кислородсодержащая кислота. Например, хлор реагирует следующим образом:
Сl2 Н2О ⇄ Н Сl— НСlO
Здесь происходит окисление — восстановление хлора (диспропорционирование). Эта реакция протекает при хлорировании воды.
Значительно лучше, чем в воде, бром и иод растворяются в органических растворителях: этаноле, бензоле, диэтиловом эфире. Это их свойство используют для извлечения брома и иода из водных растворов.
В медицинской практике в качестве обеззараживающего средства используются водно-спиртовые (w(I2) = 5%) и спиртовые (w(I2) = 10%) растворы иода.
Для элементных галогенов характерны окислительно-восстановительные реакции. Эти реакции сопровождаются разрывом связи Г—Г с присоединением электронов к атомам галогена и образованием галогенид-ионов.
Элементные галогены являются сильными окислителями и вступают во взаимодействие почти со всеми простыми веществами — металлами и неметаллами, образуя галогениды. С кислородом и азотом галогены непосредственно не взаимодействуют. Наиболее быстро с выделением большого количества теплоты протекает реакция галогенов с металлами. Так, например, металлический натрий, помещенный в атмосферу хлора, сгорает с образованием натрия хлорида:
2Nа (т) Сl2 (г) = 2NаСl (т)
Хлор непосредственно взаимодействует со многими неметаллами (фосфором, мышьяком, сурьмой и кремнием) даже при низкой температуре. Так, белый фосфор загорается в атмосфере хлора при комнатной температуре:
2Р 5Сl2 = 2РСl5
Аналогичным образом бром и иод вступают в реакции с металлами и неметаллами. Однако химическая активность брома и иода ниже, чем хлора
Особенно высокую химическую активность проявляет фтор. Так, щелочные металлы, железо, свинец, а также неметаллы S, Р уже при комнатной температуре загораются в атмосфере фтора. При нагревании со фтором реагируют даже благородные газы ксенон и криптон:
Хе 2F2 = ХеF4
Являясь наиболее электроотрицательным элементом, фтор образует соединения с элементами IIА-группы, устойчивость которых уменьшается в ряду ВеF2 — МgF2— СаF2— SrF2—ВаF2. Во многих биохимических процессах фтор выступает ингибитором, блокируя активные центры ферментов, содержащих Мg2 , Са2 и ионы других металлов.
Сопоставление свойств элементных галогенов показывает, что их химическая активность убывает в ряду F2 — Сl2 — Вr2 — I2—Аt2. Например, фтор реагирует с водородом со взрывом даже в темноте. Хлор без освещения не реагирует с водородом, но при нагревании или при ярком свете реакция протекает со взрывом (по цепному механизму). Бром с водородом взаимодействует только при нагревании, а иод — только при сильном нагревании, да и то не полностью, так как начинает идти обратная реакция разложения водородиодида.
Различная окислительная способность галогенов проявляется и в их действии на биоорганические вещества и ткани живых организмов. Так, газообразный Сl2, являющийся сильным окислителем, представляет собой отравляющее вещество, вызывающее раздражение слизистых оболочек глаза, носа, гортани, тяжелое поражение легких. В отличие от хлора, иод — мягкий окислитель, обладающий антисептическим действием. Но при больших концентрациях иода и длительном применении возможны явления иодизма (насморк, крапивница, сыпь на коже и т.д.).
 Водородгалогениды. Среди соединений галогенов, в которых они проявляют степень окисления —1, одними из наиболее важных в практическом и теоретическом отношении являются водородгалогениды. Химическая связь в газообразных НГ — полярная ковалентная. Электронная пара, осуществляющая связь, сильно смещена к более электроотрицательному элементу — галогену.
Водородгалогениды. Среди соединений галогенов, в которых они проявляют степень окисления —1, одними из наиболее важных в практическом и теоретическом отношении являются водородгалогениды. Химическая связь в газообразных НГ — полярная ковалентная. Электронная пара, осуществляющая связь, сильно смещена к более электроотрицательному элементу — галогену.
С точки зрения метода ВС химическая связь в НГ имеет одинаковый характер.
 Так как электронная структура всех водородгалогенидов одинакова, с ростом ионного радиуса галогена свойства НГ в ряду F — I монотонно изменяются (исключение составляет НF). Снижение прочности химической связи в молекулах НГ в ряду НF — НСl — НВr — НI находит отражение в уменьшении энтальпий диссоциации молекул НГ на атомы и в увеличении энтальпии и энергии Гиббса образования молекул НГ.
Так как электронная структура всех водородгалогенидов одинакова, с ростом ионного радиуса галогена свойства НГ в ряду F — I монотонно изменяются (исключение составляет НF). Снижение прочности химической связи в молекулах НГ в ряду НF — НСl — НВr — НI находит отражение в уменьшении энтальпий диссоциации молекул НГ на атомы и в увеличении энтальпии и энергии Гиббса образования молекул НГ.
 Как и в случае свободных галогенов, причиной падения прочности связи в ряду НF—НСl—НВr—НI является понижение степени перекрывания орбиталей атомов водорода и галогенов.
Как и в случае свободных галогенов, причиной падения прочности связи в ряду НF—НСl—НВr—НI является понижение степени перекрывания орбиталей атомов водорода и галогенов.
Дипольный момент, характеризующий полярность связи в ряду НF—НСl—НВr—НI, уменьшается от 6,4 до 1,3. Исходя из максимальной полярности НF, можно предположить: 1) растворимость водородгало-генидов в воде в этом ряду должна уменьшаться; 2) сила образующихся галогеноводородных кислот: НF (фтороводородная — плавиковая), НСl (хлороводородная — соляная), НВr (бромоводородная), НI (иодоводородная) также должна падать.
Однако из экспериментальных данных следует, что степень ионизации, соответственно и сила кислот Н—Г в ряду от F к I, наоборот, возрастают. Растворимость от НF к НСl падает, но от НСl к НI растет.
Причиной наблюдаемого изменения растворимости и силы водородгалогенных кислот является увеличение радиуса Г—-ионов от F— к I— и уменьшение их гидратации.
 При растворении газообразного НГ в воде происходит гидратация При этом наблюдается разрыв полярной связи Н—Г и образование гидратированных ионов. Гидратированные протоны Н и анионы I— оказываются изолированными друг от друга Их взаимодействие становится чисто электростатическим. Но так как ионные радиусы в ряду F— — Сl— — Вr— — I— увеличиваются, то кулоновское взаимодействие между ионом гидроксония Н3О и галогенид-ионами в этом ряду уменьшается, что и приводит к увеличению степени ионизации галогеноводородных кислот в ряду НF—НСl—НВr—НI. Исходя из тех же соображений, можно объяснить и изменение растворимости НГ в этом ряду.
При растворении газообразного НГ в воде происходит гидратация При этом наблюдается разрыв полярной связи Н—Г и образование гидратированных ионов. Гидратированные протоны Н и анионы I— оказываются изолированными друг от друга Их взаимодействие становится чисто электростатическим. Но так как ионные радиусы в ряду F— — Сl— — Вr— — I— увеличиваются, то кулоновское взаимодействие между ионом гидроксония Н3О и галогенид-ионами в этом ряду уменьшается, что и приводит к увеличению степени ионизации галогеноводородных кислот в ряду НF—НСl—НВr—НI. Исходя из тех же соображений, можно объяснить и изменение растворимости НГ в этом ряду.
Рассмотренный пример показывает, что правильный теоретический прогноз физико-химических свойств растворенных веществ возможен лишь при учете не только характеристик молекул этих веществ, но и их взаимодействия с растворителем.
По мере увеличения межъядерного расстояния в ряду НF—НСl—НВr—НI увеличивается восстановительная активность водородгалогенидов и галогеноводородных кислот.
Так, O2 восстанавливается иодоводородной кислотой уже при обычной температуре:
О2 4Н 4I— = 2Н2О 2I2.
Бромоводородная кислота взаимодействует с дикислородом медленнее, а соляная кислота вообще не окисляется дикислородом. Индифферентность аниона Сl— в кислой среде весьма существенна с точки зрения физиологии и медицины.
Используя индифферентность хлорид-иона, его вводят в состав многих лечебных препаратов. Вводные растворы натрия хлорида — изотонический (мас. доля 0,9%) и гипертонические (мас. доля 3—5—10%) широко применяют в медицинской практике. Использование гипертонических растворов основано на законах осмоса.
Хлорид-ион присутствует в организме в макроколичествах. В форме соляной кислоты является необходимым компонентом желудочного сока. Соляная кислота играет важную роль в процессе пищеварения.
Желудочный сок (рН от 1 до 3) содержит катион Н и анионы Сl—, Н2РО4—, НSО4—. Однако концентрация хлорид-ионов Сl— значительно превышает концентрацию других анионов. Поэтому говорят, что соляная кислота содержится в желудочном соке и ее массовая доля составляет около 0,3%.
Для выработки соляной кислоты в желудке необходим NаСl — поваренная соль. Вы деление соляной кис лоты из клеток слизистой оболочки (рис 8.10) желудка можно описать следующим уравнением:
Н2СО3(кровь) Сl— = НСO3—(кровь) НСl(желудок)
Соляная кислота желудочного сока не обходима для перехода фермента пепсина в активную форму. Пепсин обеспечивает переваривание белков путем гидролитического расщепления пептидных связей (отсюда название фермента).
Кислородные кислоты хлора и их соли.Среди кислородных соединений галогенов наибольшее значение для практического применения имеют кислородные кислоты хлора и их соли. Кислородные кислоты хлора значительно менее устойчивы, чем их соли.
Кислота состава НСlО, где атомы хлора проявляют степень окисления 1. в свободном состоянии не выделена. Она называется гипохлористой (хлорноватистой), а соли ее — гипохлоритами. Гипохлористая кислота получается при взаимодействии хлора с водой:
Сl2 Н2О ⇄ Сl— НСlO Н .
При этом один из атомов молекулы хлора присоединяет электрон от другого атома и восстанавливается, а другой атом хлора, отдавая электрон, окисляется:
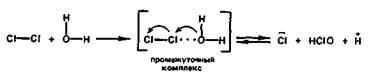
Реакция гидролиза хлора является обратимой и сильно смещена влево.
Кислота НСlО настолько слабая, что даже угольной кислотой вытесняется из растворов гипохлоритов:
NаСlO Н2О СО2 = NаНСО3 НСlO
Степень гидролиза хлора зависит от разбавления. Изменение общей концентрации хлора от 100 до 20 ммоль/л приводит к увеличению степени гидролиза от 0,33 до 0,73. Таким образом, хлорная вода всегда содержит наряду с молекулами Сl2 значительное количество НСlO.
Гипохлористая кислота нестойка и даже в водном растворе распадается под действием света. Механизм распада можно представить в виде двух стадий:
НСlO hν = НСl [О]
2О → О2,
где [О] — монокислород, активная форма кислорода.
Гипохлористая кислота является очень сильным окислителем, именно ее образованием объясняется бактерицидное и отбеливающее действие хлорной воды. Выделяющийся при распаде НСlO монокислород обесцвечивает красители и убивает микроорганизмы.
Гипохлористая кислота способна реагировать с органическими соединениями RН (R — органический радикал) по следующим схемам:
RН НСlО= RОН НСl
RН НСlO = RСl Н2O
т.е. и как окислитель, и как хлорирующее вещество.
Например, НСlO разрушает (денатурирует) белки, из которых состоят микроорганизмы. При этом хлор замещает атомы водорода пептидных связей белка:
R—СО—NН—R1 НСlO → R—СО—NСl—R1 Н2О
В результате нарушается вторичная структура белков, что приводит к гибели микроорганизмов. Поэтому с целью обеззараживания воды можно применять ее хлорирование. Отсюда следует, что бактерицидное действие водных растворов хлора связано как с образованием монокислорода, так и с хлорирующим действием гипохлористой кислоты. Образующееся в хлорированной воде небольшое количество соляной кислоты безвредно, и такая вода пригодна для употребления.
Гипохлористая кислота более сильный окислитель, чем газообразный Сl2. Это можно доказать экспериментально: сухой хлор менее эффективно отбеливает ткани, чем «сырой», содержащий НСlO.
Бром и иод, проявляя степень окисления 1, образуют также кислородные кислоты НВrО (гипобромистая) и НIO (гипоиодистая).
Сила кислородсодержащих кислот в ряду Сl—Вr—I уменьшается вследствие роста ковалентного радиуса атомов галогенов в этом ряду, что сопровождается ослаблением ковалентной связи О—Г.
 Окислительные свойства НГО в ряду от Сl к I так же уменьшаются, а относительная устойчивость возрастает. Так, при нагревании НГО или действии на них света
Окислительные свойства НГО в ряду от Сl к I так же уменьшаются, а относительная устойчивость возрастает. Так, при нагревании НГО или действии на них света
2НГО(р) = 2НГ(р) О2(г).
Химизм антисептического и дезинфицирующего действия иода во многом аналогичен действию хлора. Так, иод, подобно хлору, замещает водородные атомы у атомов азота в молекулах белков микроорганизмов, что приводит к их гибели:
R—СО—NН—R1 НIO → R—СО—NI—R1 Н2О
В медицинской практике, в быту и промышленности находят применение соли гипохлористой кислоты, а также препараты хлора и иода, отщепляющие активные формы галогенов.
Если к хлорной воде добавить щелочь, то равновесие гидролиза хлора сместится вправо (принцип Ле Шателье) вследствие нейтрализации гипохлористой и соляной кислот:
НСl НСlO 2КОН = КСl КСlO 2Н2О
или в ионном виде:
НСlO ОН— = ОСl— Н2О
Полученный таким способом раствор калия хлорида и гипохлорита называется жавелевой водой. Она применяется для отбеливания тканей. Ее отбеливающие свойства обусловлены тем, что калий гипохлорит взаимодействует с оксидом углерода(IV) воздуха в присутствии воды:
КСlO Н2О СО2 = НСlO КНСО3
или в ионном виде:
СlО— Н2О СО2 = НСlO НСО3—
т.е. образуется гипохлористая кислота, которая разрушает красящие вещества.
Действуя хлором на гидроксид кальция (II), получают смесь, называемую белильной или хлорной известью:
2Са(ОН)2 2Сl2 = Cа(СlО)2 2Н2О СаСl2
 Ее можно рассматривать как смешанную соль соляной и гипохлористой кислот, которой отвечает следующая формула строения:
Ее можно рассматривать как смешанную соль соляной и гипохлористой кислот, которой отвечает следующая формула строения:
Хлорная известь — белый порошок с резким запахом, является сильным окислителем и применяется как дезинфицирующее, отбеливающее и дегазирующее средство.
Во влажном воздухе СаОСl2 взаимодействует с оксидом углерода (IV), постепенно выделяя гипохлористую кислоту, которая, как рассматривалось ранее, разлагается с образованием монокислорода. НСlО выделяется также в результате гидролиза:
Са(ОСl)Сl Н2О ⇄ СаОН НСlO Сl—
При действии на хлорную известь соляной кислотой происходит выделение свободного хлора:
Са(ОСl)Сl 2НСl = СаСl2 Сl2 Н2О
Кислородсодержащая кислота НСlО2, в которой хлор проявляет степень окисления 3, называется хлористой, аее соли — хлориты. Обычно эту кислоту получают действием серной кислоты на хлорит бария:
Ва(СlO2)2 Н2SО4 = 2НСlО2 ВаSО4
При нагревании гипохлористой кислоты легко протекает ее разложение с образованием хлорноватой кислоты НСlO3:
3НОСl = 2НСl НСlО3
В молекуле хлорноватой кислоты атом хлора проявляет степень окисления 5.Соли хлорноватой кислоты называются хлоратами. Если не на холоду, а через горячий раствор щелочи, например КОН, пропускать хлор, то вместо КСlО образуется КСlO3:
3Сl2 6КОН = 5КСl КСlO3 3Н2О
Продуктами реакции являются калий хлорид и калий хлорат — КСlO3 (бертолетова соль). Хлорноватая кислота в свободном состоянии не выделена, но в отличие от НСlО и НСlО2 известны ее концентрированные растворы (до 40%). Хлорноватая кислота является сильной кислотой). По окислительной активности НСlO3 уступает НСlО2.
В больших количествах хлораты токсичны.
Перхлорная (хлорная) кислота НСlО4 (атом хлора имеет степень окисления 7) — бесцветная жидкость, способная взрываться, но ее водные растворы вполне устойчивы. Перхлорная кислота — самая сильная из всех известных кислот.
Окислительная активность НСlО4 меньше, чем у НСlO3, а кислотные свойства выражены сильнее. Соли хлорной кислоты — перхлораты в сухом состоянии являются мощными окислителями и используются для минерализации различных биоматериалов при определении содержащихся в них неорганических компонентов.
Сравнивая свойства кислородных кислот хлора, можно сделать следующие выводы:  по мере увеличения степени окисления хлора в ряду НСlО—НСlО2—НСlO3—НСlО4 сила кислот увеличивается.
по мере увеличения степени окисления хлора в ряду НСlО—НСlО2—НСlO3—НСlО4 сила кислот увеличивается.
Такой характер изменения кислотных свойств объясняется тем, что по мере увеличения числа атомов кислорода в ряду НО—Сl, НО—СlO, НО—СlO2, НО—СlО3 прочность связи О—Н ослабевает. Резкое возрастание силы кислот с увеличением числа атомов кислорода (увеличение числа связей Сl—О) можно объяснить оттягиванием электронной плотности от связи Н—О на связь Сl—О.
Сравнение окислительных свойств кислородных кислот хлора показывает, что в ряду анионов СlО— — СlО2— —СlО3— — СlO4— уменьшается окислительная способность. Такой характер изменения окислительной активности можно объяснить повышением устойчивости в указанном ряду анионов, обусловленной увеличением числа электронов, принимающих участие в образовании σ- и π-связей.
Комплексные соединения галогенов.Галогены входят в состав комплексных соединений как в качестве лигандов, так и комплексообразователей. Более склонны элементы VIIА-группы к комплексообразованию в качестве лигандов с ионами металлов. Обычно устойчивость галогенидных комплексов уменьшается в ряду F>Сl>Вr>I, но для некоторых ионов металлов наблюдается обратный порядок.
Образование комплексных галогенидов имеет место и в живых организмах. Так, токсическое действие избытка фторид-ионов на организм связано с образованием фторидных комплексов с катионами металлов, входящих в активные центры ферментов Е:
Е—Мn F— → [Е—М—F]n-1
В результате блокирования свободной орбитали металла подавляется активность ферментов.
Важными комплексными соединениями галогенов, применяемых в медицине, являются противоопухолевые препараты (химиотерапия). Активными считаются цис-диаминдихлороплатина (II) [Рt(NН3)2Сl2] и цис-диаминтетрахлороплатина (IV) [Рt(NН3)2Сl4].
Известны комплексы, где комплексообразователем является галогенид-ион, а лигандами — молекулы галогенов. Такие комплексы состава [Г∙(Г2)x]— называются полигалогенидами. Так, увеличение растворимости молекулярного иода в воде в присутствии калия иодида связано с образованием комплексного иона:
I— I2 ⇄ [I(I2)]—
Диссоциация комплекса (реакция обратимая) обеспечивает присутствие в растворе полииодида элементного иода, обладающего бактерицидными свойствами. Поэтому в медицинской практике используют раствор иода с добавлением КI.
§
По содержанию в организме человека хлор (0,15%) относится к макроэлементам, в то время как остальные элементы этой группы являются микроэлементами (содержание ~10-5%). Галогены в виде различных соединений входят в состав тканей человека и животных. Хлор и иод относятся к незаменимым элементам, а остальные являются постоянными составными частями тканей.
В организме все галогены находятся в степени окисления —1, хлор и бром — в виде гидратированных ионов Сl— и Вr—, а фтор и иод — главным образом в связанной форме в составе некоторых биоорганических соединений. Вследствие уменьшения электроотрицательности в ряду F— — Сl— — Вr— — I— связь углерода с иодом наименее полярная. Поэтому иод находится в живых организмах в виде элементорганических соединений (со связью С—I).
 Фтор.Масса фтора в организме человека составляет около 7 мг (~10-5%). Соединения фтора концентрируются в костной ткани, ногтях, зубах. В состав зубов входит около 0,01% фтора, причем большая часть приходится на эмаль, что связано с присутствием в ней труднорастворимого фторапатита Са5(РО4)3F. Недостаток фтора в организме приводит к кариесу зубов.
Фтор.Масса фтора в организме человека составляет около 7 мг (~10-5%). Соединения фтора концентрируются в костной ткани, ногтях, зубах. В состав зубов входит около 0,01% фтора, причем большая часть приходится на эмаль, что связано с присутствием в ней труднорастворимого фторапатита Са5(РО4)3F. Недостаток фтора в организме приводит к кариесу зубов.
Интерес к биологическому действию фтора связан прежде всего с проблемой зубных болезней, так как фтор предохраняет зубы от кариеса. Минеральную основу зубных тканей — дентина составляют гидроксилапатит Са5(РО4)3(ОН), хлорпатит Са5(РО4)3Сl и фторапатит Са5(РО4)3F. Фторид-ион легко замещает гидроксид-ион в гидроксилапатите, образуя защитный эмалевый слой более твердого фторапатита:
Са5(РО4)3ОН F— ⇄ Са5(РО4)3F ОН—
Кроме того, фторид-ионы способствуют осаждению кальция фосфата, тем самым ускоряя процесс реминерализации (образования кристаллов):
10Са2 6РО43- 2F— = 3Са3(РО4)2∙СаF2
Кариес зубов начинается с образования на поверхности зуба поврежденного участка эмали в виде пятна. Под действием кислот, вырабатываемых бактериями, происходит растворение гидроксилапатитной компоненты эмали:
Са5(РО4)3ОН 7Н = 5Са2 3Н2РО4— Н2О
 Очень часто разрушению подвергается не внешняя поверхность зуба, покрытая слоем эмали, а внутренние участки дентина, обнаженные при повреждении эмали. Имеются предположения, что пока эмаль повреждена незначительно, введение натрия фторида способствует образованию фторапатита, облегчая реминерализацию начавшегося повреждения (рис. 8.11).
Очень часто разрушению подвергается не внешняя поверхность зуба, покрытая слоем эмали, а внутренние участки дентина, обнаженные при повреждении эмали. Имеются предположения, что пока эмаль повреждена незначительно, введение натрия фторида способствует образованию фторапатита, облегчая реминерализацию начавшегося повреждения (рис. 8.11).
Обогащение питьевой воды фтором, т.е. фторирования воды с целью доведения содержания в ней фтора до нормы (1мг/л), приводит к значительному снижению заболеваемости населения кариесом зубов. Фторирование питьевой воды осуществляется добавлением к ней определенного количества натрия фторида.
Натрий фторид NaF употребляют в медицинской практике в качестве местно действующего наружного средства. Применение NаF основано на образовании фторапатита:
NаF Са5(РО4)3ОН ⇄ NаОН Са5(РО4)3F
паста зубная ткань
При этом происходит одновременно и подщелачивание среды ротовой полости, что способствует, по-видимому, нейтрализации кислот, вырабатываемых бактериями.
Вреден не только недостаток, но и избыток фтора. При содержании фтора в питьевой воде выше предельно допустимой нормы (1,2мг/л) зубная эмаль становится хрупкой, легко разрушается и появляются другие симптомы хронического отравления фтором — повышение хрупкости костей, костные деформации и общее истощение организма. Возникающее в этом случае заболевание называется флуорозом (фторозом).
Хлор.В организме человека содержится примерно 100г (2790 ммоль) хлора (мас. доля 0,15%). Хлорид-ионы играют важную биологическую роль. Они активируют некоторые ферменты, создают благоприятную среду для действия протолитических ферментов желудочного сока, обеспечивают ионные потоки через клеточные мембраны, участвуют в поддержании осмотического равновесия.
Хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании определенного осмотического давления и регуляции водносолевого обмена. Суточная потребность натрия хлорида составляет 5—10г. Как уже рассматривалось, NаСl необходим для выработки соляной кислоты в желудке. Помимо важной роли соляной кислоты в процессе пищеварения, она уничтожает различные болезнетворные бактерии (холеры, тифа).
Если в желудок с большим количеством воды попадают бактерии, то вследствие разбавления НСl не оказывает антибактериального действия, и бактерии выживают. Это приводит к заболеванию организма. Поэтому во время эпидемий особенно опасна сырая вода. При недостаточном количестве соляной кислоты в желудке повышается рН и нарушается нормальное пищеварение, что тяжело отражается на здоровье человека. При пониженной кислотности желудочного сока в медицинской практике используют разбавленный раствор соляной кислоты.
При воспалении желудка (гастрите), язвенной болезни секреция желудочного сока увеличивается, повышается его кислотность. Это заболевание требует специального лечения и обязательного уменьшения количества поваренной соли, потребляемой с пищей.
Жизненно необходимые хлорид-ионы не обладают токсическим действием, в то время как элементный хлор — высокотоксичный газ, применявшийся в первую мировую войну в качестве отравляющего вещества. Предельно допустимая концентрация газообразного хлора в воздухе 0, 001 мг/л.
Бром.Масса брома в организме человека составляет около 7 мг (~10-5%). Он локализуется преимущественно в железах внутренней секреции, в первую очередь в гипофизе. Биологическая роль соединений брома в нормальной жизнедеятельности организма еще недостаточно выяснена.
Имеются данные, что соединения брома угнетают функцию щитовидной железы и усиливают активность коры надпочечников. При введении в организм бромид-ионов наиболее чувствительной оказывается центральная нервная система. Бромид-ионы равномерно накапливаются в различных отделах мозга и действуют успокаивающе при повышенной возбудимости. Иначе говоря, они способствуют восстановлению нарушенного равновесия между процессами возбуждения и торможения.
По ионному радиусу, электроотрицательности и другим физико-химическим характеристикам бром занимает промежуточное положение между хлором и иодом. Поэтому бромид-ионы могут замещать ионы Сl— и I— в организме. Примером такого взаимозамещения является замещение иода бромом при избытке брома в организме в гормонах щитовидной железы, что приводит к гипертиреоидизму.
В связи с тем, что в организме существует определенная динамическая связь между содержанием в нем бромид- и хлорид-ионов, повышенная концентрация бромид-ионов в крови нарушает равновесие и способствует быстрому выделению почками хлорид-ионов и наоборот (принцип Ле Шателье).
Бромид-ионы Вг— легко всасываются в желудочно-кишечном тракте. Токсичность бромид-ионов невысока. Однако вследствие медленного выведения из организма — в течение 30—60 суток — они могут накапливаться (кумулировать), что приводит к развитию хронического отравления, которое называется «бромизмом».
При проявлении признаков хронического отравления бромом немедленно прекращают прием бромидных препаратов. Кроме того, вводят большое количество натрия хлорида (до 25 г в сутки), чтобы увеличить скорость выделения бромид-ионов (принцип Ле Шателье), и назначают обильное питье. В связи с различной индивидуальной чувствительностью дозировка препаратов брома меняется в пределах от 0,05 до 2,0г.
Иодотносится к числу незаменимых биогенных элементов, и его соединения играют важную роль в процессах обмена веществ. Имеются данные, что иод влияет на синтез некоторых белков, жиров, гормонов. В организме человека содержится около 25 мг (4∙10-5%) иода. Из общего количества иода в организме больше половины находится в щитовидной железе. Почти весь иод, содержащийся в этой железе, находится в связанном состоянии — в виде гормонов — и только около 1% его находится в виде иодид-иона. Щитовидная железа способна концентрировать I— в 25 раз по сравнению с содержанием его в плазме. Щитовидная железа секретирует гормоны тироксин и трииодти-ронин.
Пониженная активность щитовидной железы (гипотиреоз) может быть связана с уменьшением ее способности накапливать иодид-ионы, а также с недостатком в пище иода (эндемический зоб).
При эндемическом зобе назначают препараты иода: калий иодид КI или натрий иодид NаI в дозах, соответствующих суточной потребности человека в иоде (0,001 г калия иодида). В районах, где имеется дефицит иода, для профилактики эндемического зоба добавляют к поваренной соли NаI или КI (1 — 2,5 г на 100 кг).
При повышенной активности щитовидной железы (гипертиреоз) вследствие избыточного синтеза тиреоидных гормонов наблюдается ненормально увеличенная скорость метаболических процессов
Представляется парадоксальным, что КI применяют и при гипотиреозе (эндемический зоб), и при гипертиреозе. При эндемическом зобе иодид-ион используют для синтеза гормонов, в то время как при гипертиреозе иодид-ион тормозит иодирование тирозина иодом.
При неэффективности указанных препаратов для лечения гипертиреоза применяют препарат радиактивного иода 131I, излучение которого разрушает фолликулы щитовидной железы и уменьшает тем самым избыточный синтез гормонов.
NaI и КI используют также как отхаркивающие средства при воспалительных заболеваниях дыхательных путей.
Таким образом, все р-элементы VIIА-группы физиологически активны, а хлор и иод незаменимы для жизнедеятельности организма. Очевидно, что фтор также можно считать элементом, необходимым для нормального функционирования живых организмов.
В организме галогены взаимозамещаемы, при этом наблюдаются как случаи синергизма, так и антагонизма.
Радиусы атомов, их периодические изменения в системе химических элементов
Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т. к. притяжение ядром электронных оболочек усиливается. Происходит своеобразное их «сжатие». От лития к неону заряд ядра постепенно увели-чивается (от 3 до 10), что обуславливает возрастание сил притяжения электронов к ядру, размеры атомов уменьшаются. Поэтому в начале периода расположены элементы с небольшим числом электронов на внешнем электронном слое и большим радиусом атома. Электроны, находящиеся дальше от ядра, легко от него отрываются, что характерно для элементов-металлов.
В одной и той же группе с увеличением номера периода атомные радиусы возрастают, т. к. увеличение заряда атома оказывает противоположный эффект. С точки зрения теории строения атомов принадлежность элементов к металлам или неметаллам определяется способностью их атомов отдавать или присоединять электроны. Атомы металлов сравнительно легко отдают электроны и не могут их присоединять для достраивания своего внешнего электронного слоя.
Закономерности изменения химических свойств элементов и их соединений по периодам и группам
Д. И. Менделеев в 1869 г. сформулировал периодический закон, который звучит так: свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов. Систематизируя химические элементы на основе их относительных атомных масс, Менделеев уделял большое внимание также свойствам элементов и образованных ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы — группы. В соответствии с современными представлениями о строении атома, основой классификации химических элементов являются заряды их атомных ядер, и современная формулировка периодического закона такова: свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер. Периодичность в изменении свойств элементов объясняется периодической повторяемостью в строении внешних энергетических уровней их атомов. Именно число энергетических уровней, общее число расположенных на них электронов и число электронов на внешнем уровне отражают принятую в периодической системе символику.
- При перемещении СПРАВА НАЛЕВО вдоль ПЕРИОДА МЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении — возрастают неметаллические. Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях.
- Например, углерод — более выраженный неметалл, чем его сосед по периоду бор, а азот обладает еще более яркими неметаллическими свойствами, чем углерод. Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача. Наоборот, s-элементы в левой части таблицы имеют мало электронов на внешней оболочке и меньший заряд ядра, что способствует образованию именно металлической связи. За понятным исключением водорода и гелия (их оболочки близки к завершению или завершены!), все s-элементы являются металлами; p-элементы могут быть как металлами, так и неметаллами, в зависимости от того — в левой или правой части таблицы они находятся.
- У d- и f-элементов, как мы знаем, есть «резервные» электроны из «предпоследних» оболочек, которые усложняют простую картину, характерную для s- и p-элементов. В целом d- и f-элементы гораздо охотнее проявляют металлические свойства.
- Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы. Некоторые элементы в связи с тем, что они могут проявлять лишь слабые металлические свойства, относят к полуметаллам. Что такое полуметаллы? Если выбрать из Периодической таблицы p-элементы и записать их в отдельный «блок» (это сделано в “длинной” форме таблицы), то обнаружится закономерность, показанная на Левая нижняя часть блока содержит типичные металлы, правая верхняя — типичные неметаллы. Элементы, занимающие места на границе между металлами и неметаллами, называются полуметаллами.
- Полуметаллы расположены примерно вдоль диагонали, проходящей по p-элементам от левого верхнего к правому нижнему углу Периодической таблицы
- Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной «октетной» ковалентной связи (как в боре), либо они не удерживаются достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер. Некоторые полуметаллы (кремний, германий) являются полупроводниками. Полупроводниковые свойства этих элементов объясняются многими сложными причинами, но одна из них — существенно меньшая (хотя и не нулевая) электропроводность, объясняемая слабой металлической связью. Роль полупроводников в электронной технике чрезвычайно важна.
- При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой «шубой» из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
б)Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов.
- Перечисленные выше причины объясняют, почему СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ — ВОССТАНОВИТЕЛЬНЫЕ свойства элементов.
- Последняя закономерность распространяется даже на такие необычные элементы, как инертные газы. У «тяжелых» благородных газов криптона и ксенона, которые находятся в нижней части группы, удается «отобрать» электроны и получить их соединения с сильными окислителями (фтором и кислородом), а для «легких» гелия, неона и аргона это осуществить не удается.
- В правом верхнем углу таблицы находится самый активный неметалл-окислитель фтор (F), а в левом нижнем углу — самый активный металл-восстановитель цезий (Cs). Элемент франций (Fr) должен быть еще более активным восстановителем, но его химические свойства изучать крайне трудно из-за быстрого радиоактивного распада.
- По той же причине, что и окислительные свойства элементов, их ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету.
- При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
- в) Закономерности, связанные с размерами атомов.
- Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ. Электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке (например, у фтора по сравнению с кислородом) не приводит к увеличению размеров атома. Наоборот, размеры атома фтора меньше, чем атома кислорода.
- При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
г) Закономерности, связанные с валентностью элементов.
- Элементы одной и той же ПОДГРУППЫ имеют аналогичную конфигурацию внешних электронных оболочек и, следовательно, одинаковую валентность в соединениях с другими элементами.
- s-Элементы имеют валентности, совпадающие с номером их группы.
- p-Элементы имеют наибольшую возможную для них валентность, равную номеру группы. Кроме того, они могут иметь валентность, равную разности между числом 8 (октет) и номером их группы (число электронов на внешней оболочке).
- d-Элементы обнаруживают много разных валентностей, которые нельзя точно предсказать по номеру группы.
- Не только элементы, но и многие их соединения — оксиды, гидриды, соединения с галогенами — обнаруживают периодичность. Для каждой ГРУППЫ элементов можно записать формулы соединений, которые периодически «повторяются» (то есть могут быть записаны в виде обобщенной формулы).
Итак, подытожим закономерности изменения свойств, проявляемые в пределах периодов:
Изменение некоторых характеристик элементов в периодах слева направо:
- заряд ядер атомов увеличивается;
- радиус атомов уменьшается;
- электроотрицательность элементов увеличивается;
- количество валентных электронов увеличивается от 1 до 8 (равно номеру группы);
- высшая степень окисления увеличивается (равна номеру группы);
- число электронных слоев атомов не изменяется;
- металлические свойства уменьшается;
- неметаллические свойства элементов увеличивается.
Изменение некоторых характеристик элементов в группе сверху вниз:
- заряд ядер атомов увеличивается;
- радиус атомов увеличивается;
- число энергетических уровней (электронных слоев) атомов увеличивается (равно номеру периода);
- число электронов на внешнем слое атомов одинаково (равно номеру группы);
- прочность связи электронов внешнего слоя с ядром уменьшается;
- электроотрицательность уменьшается;
- металличность элементов увеличивается;
- неметалличность элементов уменьшается.

