- Аммиак
- Валентные возможности атома углерода
- Высшая и низшая валентности химических элементов
- Общие сведения:
- Оксиды азота
- Подгруппа кислорода
- Степень окисления
- Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
- Таблица валентности химических элементов (1 часть):
- Таблица валентности химических элементов (2 часть):
- Таблица валентности химических элементов (3 часть):
- Физические свойства бериллия:
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
6NH3 8KClO3 6NaOH = 6NaNO3 8KCl 12H2O
10NH3 6KMnO4 9H2SO4 = 5N2 6MnSO4 3K2SO4 24H2O
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
NH3 HCl = NH4Cl
NH3 H2SO4 = NH4HSO4
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
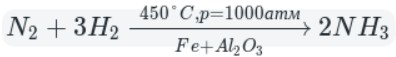
Лабораторный способ:
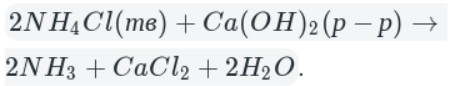
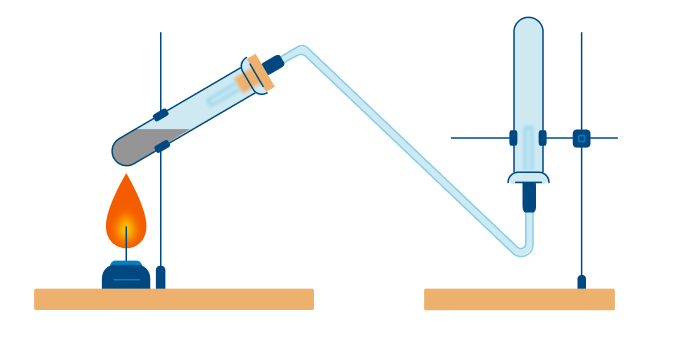
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных (
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Высшая и низшая валентности химических элементов
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Существуют элементы с т.н. постоянной валентностью (металлы IA и IIA групп, алюминий водород, фтор, кислород), которые в своих соединениях проявляют единственную степень окисления, которая чаще всего совпадает с номером группы Периодической таблицы Д.И. Менделеева, где они расположены).
Элементы, для которых характерны несколько значений валентности (причем не всегда это высшая и низшая валентность) называются переменновалентными. Например, для серы характерны валентности II, IV и VI.
Для того, чтобы легче было запомнить сколько и какие валентности характерны для конкретного химического элемента используют таблицы валентности химических элементов, которые выглядят следующим образом:
Порядковый номер | Русское / англ. название | Химический символ | Валентность |
1 | Водород / Hydrogen | H | I |
2 | Гелий / Helium | He | 0 |
3 | Литий / Lithium | Li | I |
4 | Бериллий / Beryllium | Be | II |
5 | Бор / Boron | B | III |
6 | Углерод / Carbon | C | II, IV |
7 | Азот / Nitrogen | N | I, II, III, IV, V |
… | |||
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Бериллий |
| 102 | Прежнее название | |
| 103 | Латинское название | Beryllium |
| 104 | Английское название | Beryllium |
| 105 | Символ | Be |
| 106 | Атомный номер (номер в таблице) | 4 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, щёлочноземельный металл |
| 109 | Открыт | Луи-Николя Воклен, Франция, 1798 г. |
| 110 | Год открытия | 1798 г. |
| 111 | Внешний вид и пр. | Относительно твёрдый, хрупкий металл светло-серого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации бериллия: — α-бериллий с гексагональной плотноупакованной кристаллической решёткой, — β-бериллий с кубической объёмно-центрированной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | — α-бериллий существует при температуре ниже 1250 °C и иных стандартных условиях, — β-бериллий существует при температуре выше 1250 °C и иных стандартных условиях |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00019 % |
| 120 | Содержание в морях и океанах (по массе) | 6,0·10-11 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10-8 % |
| 123 | Содержание в метеоритах (по массе) | 2,9·10-6 % |
| 124 | Содержание в организме человека (по массе) | 4,0·10-8 % |
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Подгруппа кислорода
Элементы 6-й группы главной подгруппы. Очень часто употребляемое название — ХАЛЬКОГЕНЫ — «руду рождающие». Думаю, этим названием они в большей степени обязаны сере, чем кислороду 🙂
В формате подготовки к ЕГЭ мы рассмотрим физические и химические свойства двух элементов — кислорода O и серы S.
Электронное строение
nS2 np4
Но тут не все так просто.
К кислороду претензий нет — у него электронное строение соответствует общей формуле, а вот у серы и остальных элементов есть и другие варианты… Если детально рассмотреть строение p-элементов по периодам, то нужно обратить внимание, что с 3-го периода у p- элементов появляется свободная d-орбиталь, на которую могут переходить электроны.
Именно поэтому степень окисления серы может быть не только -2.
Итак, выводы:
- Валентность элементов:
- валентность кислорода = 2,
- валентность серы — 2,4,6
- Степени окисления:
- степень окисления кислорода = -2 — типичный неметалл, сильный окислитель;
- степень окисления серы = -2(минимальная степень окисления), 2 (редко), 4, 6 (максимальная степень окисления) в минимальной с.о. S будет проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства
 Кислород — O2 (O=O, O::O) -газ без цвета, без запаха. Аллотропная модификация — озон O3 — бесцветный газ со специфическим запахом (запах «после грозы»)
Кислород — O2 (O=O, O::O) -газ без цвета, без запаха. Аллотропная модификация — озон O3 — бесцветный газ со специфическим запахом (запах «после грозы»)
Сера — S — твердое вещество, хотя мы пишем формулу этого вещества как S , но обычно образуются кристаллы состава S4 и S8. Обычно сера — пластичное вещество коричневого или желтого цвета.
На воздухе сера горит: S O2 = SO2 (бесцветный газ с резким запахом)
Химические свойства
Свойства кислорода
| Окислительные свойства | Восстановительные свойства |
| Кислород может проявлять восстановительные свойства только к элементу, у которого больше электроотрицательность, т.е., он должен стоять в периодической системе элементов правее кислорода. Это КОРОЛЬ НЕМЕТАЛЛОВ — F:
|
Свойства серы:
Cернистая кислота — H2SO3 (степень окисления серы= 4). Соли — сульфитыСерная кислота — H2SO4 (cтепень окисления серы= 6). Соли — сульфатыИх свойства мы рассмотрим отдельно.[TESTME 32]
Категории:
|
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной
реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны,
образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд » «, а другим «-«. Это связано с электроотрицательностью —
способностью атома притягивать к себе электроны. Знак » » означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное
понятие.
Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток —
получает знак » «.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2,
KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание
степеней окисления должно заменить даже самую развитую интуицию 😉
Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких
электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют
разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.
Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов.
Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.
Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..
|
Таблица валентности химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Валентность | Примеры соединений | Примечание |
| 1 | Водород | H | I | HCl, H2O2 | |
| 2 | Гелий | He | отсутствует | ||
| 3 | Литий | Li | I | LiOH, Li2O | |
| 4 | Бериллий | Be | I, II | ||
| 5 | Бор | B | III | B2O3 | |
| 6 | Углерод | C | II, IV | ||
| 7 | Азот | N | I, II, III, IV |
| В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным |
| 8 | Кислород | O | II | (NO)F, CaO, O2, H2O2,Cl2O, H2O | |
| 9 | Фтор | F | I | HF, (NO)F | |
| 10 | Неон | Ne | отсутствует | ||
| 11 | Натрий | Na | I | Na2S, Na2O | |
| 12 | Магний | Mg | II | Mg(NO3)2 | |
| 13 | Алюминий | Al | III | Al2O3, Al2S3, AlCl3 | |
| 14 | Кремний | Si | II, IV | ||
| 15 | Фосфор | P | III, V |
| |
| 16 | Сера | S | II, IV, VI |
| |
| 17 | Хлор | Cl | I, III, IV, V, VI, VII |
| |
| 18 | Аргон | Ar | отсутствует | ||
| 19 | Калий | K | I | KOH, K2O, K2S | |
| 20 | Кальций | Ca | II | Ca(OH)2 | |
| 21 | Скандий | Sc | III | Sc2O3 | |
| 22 | Титан | Ti | II, III, IV | ||
| 23 | Ванадий | V | II, III, IV, V | ||
| 24 | Хром | Cr | II, III, VI | ||
| 25 | Марганец | Mn | II, III, IV, VI, VII |
| |
| 26 | Железо | Fe | II, III |
| |
| 27 | Кобальт | Co | II, III | ||
| 28 | Никель | Ni | II, III | ||
| 29 | Медь | Cu | I, II | ||
| 30 | Цинк | Zn | II | ZnSO4, ZnO, ZnS |
Таблица валентности химических элементов (2 часть):
| 31 | Галлий | Ga | I, II, III | ||
| 32 | Германий | Ge | II, IV | ||
| 33 | Мышьяк | As | III, V | ||
| 34 | Селен | Se | II, IV, VI | ||
| 35 | Бром | Br | I, III, V, VII | ||
| 36 | Криптон | Kr | отсутствует | ||
| 37 | Рубидий | Rb | I | RbOH | |
| 38 | Стронций | Sr | II | SrO | |
| 39 | Иттрий | Y | III | Y(NO3)3 | |
| 40 | Цирконий | Zr | II, III, IV | ||
| 41 | Ниобий | Nb | I, II, III, IV, V | ||
| 42 | Молибден | Mo | II, III, IV, V, VI |
| |
| 43 | Технеций | Tc | II, III, IV, V, VI, VII |
| |
| 44 | Рутений | Ru | II, III, IV, V, VI, VII, VIII |
| |
| 45 | Родий | Rh | II, III, IV, V, VI |
| |
| 46 | Палладий | Pd | II, IV | ||
| 47 | Серебро | Ag | I, II, III | ||
| 48 | Кадмий | Cd | I, II | ||
| 49 | Индий | In | I, II, III | ||
| 50 | Олово | Sn | II, IV | ||
| 51 | Сурьма | Sb | III, V | ||
| 52 | Теллур | Te | II, IV, VI | ||
| 53 | Йод | I | I, III, V, VII | ||
| 54 | Ксенон | Xe | отсутствует | ||
| 55 | Цезий | Cs | I | Cs2O | |
| 56 | Барий | Ba | II | Ba(OH)2 | |
| 57 | Лантан | La | III | La2(SO4)3 | |
| 58 | Церий | Ce | III, IV | ||
| 59 | Празеодим | Pr | II, III, IV | ||
| 60 | Неодим | Nd | II, III |
Таблица валентности химических элементов (3 часть):
| 61 | Прометий | Pm | III | PmBr3 | |
| 62 | Самарий | Sm | II, III | ||
| 63 | Европий | Eu | II, III | ||
| 64 | Гадолиний | Gd | II, III | ||
| 65 | Тербий | Tb | II, III, IV | ||
| 66 | Диспрозий | Dy | II, III | ||
| 67 | Гольмий | Ho | III | Ho2(SO4)3 | |
| 68 | Эрбий | Er | III | Er2O3 | |
| 69 | Тулий | Tm | II, III | ||
| 70 | Иттербий | Yb | II, III | ||
| 71 | Лютеций | Lu | III | LuBr3 | |
| 72 | Гафний | Hf | I, II, III, IV | ||
| 73 | Тантал | Ta | I, II, III, IV, V |
| |
| 74 | Вольфрам | W | II, III, IV, V, VI |
| |
| 75 | Рений | Re | I, II, III, IV, V, VI, VII |
| |
| 76 | Осмий | Os | I, II, III, IV, V, VI, VII, VIII |
| |
| 77 | Иридий | Ir | I, II, III, IV, V, VI |
| |
| 78 | Платина | Pt | II, III, IV, V, VI | ||
| 79 | Золото | Au | I, II, III, V | ||
| 80 | Ртуть | Hg | I, II | ||
| 81 | Таллий | Tl | I, II, III | ||
| 82 | Свинец | Pb | II, IV | ||
| 83 | Висмут | Bi | III, V | ||
| 84 | Полоний | Po | II, IV, VI | ||
| 85 | Астат | At | нет данных | ||
| 86 | Радон | Rn | отсутствует | ||
| 87 | Франций | Fr | I | FrOH | |
| 88 | Радий | Ra | II | Ra(OH)2 | |
| 89 | Актиний | Ac | III | Ac2O3 | |
| 90 | Торий | Th | II, III, IV | ||
| 91 | Протактиний | Pa | II, III, IV, V | ||
| 92 | Уран | U | III, IV, V, VI | ||
| 93 | Нептуний | Np | III, IV, V, VI, VII | ||
| 94 | Плутоний | Pu | III, IV, V, VI, VII | ||
| 95 | Америций | Am | II, III, IV, V, VI | ||
| 96 | Кюрий | Cm | II, III, IV | ||
| 97 | Берклий | Bk | III, IV | ||
| 98 | Калифорний | Cf | II, III, IV | ||
| 99 | Эйнштейний | Es | II, III | ||
| 100 | Фермий | Fm | II, III |
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента.
Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента.
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Коэффициент востребованности 5 633
Физические свойства бериллия:
| 400 | Физические свойства | |
| 401 | Плотность* | 1,85 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – кристаллы, твердое тело), 1,690 г/см3 (при температуре плавления 1287 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1287 °C (1560 K, 2348,6 °F) |
| 403 | Температура кипения* | 2742 K (2469 °C, 4476 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 12,2 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 292 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 1,56 Дж/г·K (при -23 °C), 1,98 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 16,443 Дж/(K·моль) |
| 411 | Молярный объём | 4,8767 см³/моль |
| 412 | Теплопроводность | 200 Вт/(м·К) (при стандартных условиях), 201 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 11,3 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | 4931,85 °C (5205 K, 8909,33 °F) – предположительно |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | 0,001 мм.рт.ст. (при 1091 °C), 0,1 мм.рт.ст. (при 1361 °C), 1 мм.рт.ст. (при 1548 °C), 10 мм.рт.ст. (при 1785 °C), 100 мм.рт.ст. (при 2097 °C) |
| 420 | Давление паров (Па) | 1 Па (при 1462 K), 10 Па (при 1608 K), 100 Па (при 1791 K), 1 кПа (при 2023 K), 10 кПа (при 2327 K), 100 кПа (при 2742 K) |
| 421 | Стандартная энтальпия образования ΔH | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) |
| 422 | Стандартная энергия Гиббса образования ΔG | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) |
| 423 | Стандартная энтропия вещества S | 9,54 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело) |
| 424 | Стандартная мольная теплоемкость Cp | 16,4 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело) |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | Диамагнитный материал |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | -2,328·10-5 |
| 430 | Удельная магнитная восприимчивость | -1,26·10—8 |
| 431 | Молярная магнитная восприимчивость | -9,0·10-6 см3/моль (при 298 K) |
| 432 | Электрический тип | Проводник |
| 433 | Электропроводность в твердой фазе | 25,0·106 См/м (при 20 °C) |
| 434 | Удельное электрическое сопротивление | 36,0 нОм·м (при 20 °C) |
| 435 | Сверхпроводимость при температуре | 0,0237 К |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | 5,5 |
| 440 | Твёрдость по Бринеллю | 600 МПа |
| 441 | Твёрдость по Виккерсу | 1670 МПа |
| 442 | Скорость звука | 12,890 м/с (при 20 °C) (в тонком стержне) |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | 200-550 МПа, до 400-800 МПа – после обработки давлением |
| 447 | Предел текучести | 250-600 МПа – после обработки давлением |
| 448 | Предел удлинения | 0,2-2 %, до 4-12% – после обработки давлением |
| 449 | Модуль Юнга | 287 ГПа |
| 450 | Модуль сдвига | 132 ГПа |
| 451 | Объемный модуль упругости | 130 ГПа |
| 452 | Коэффициент Пуассона | 0,032 |
| 453 | Коэффициент преломления |

