Общая характеристика подгруппы кислорода
В подгруппу кислорода входят пять элементов: кислород, сера, селен, теллур и полоний (полоний — радиоактивный элемент). Это р-элементы VI группы периодической системы Д. И. Менделеева. Они имеют групповое название — халькогены, что означает «образующие руды».
У атомов халькогенов одинаковое строение внешнего энергетического уровня — ns2np4 (п. 2, табл. 9.1). Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления 
Таблица 9.1. Свойства элементов подгруппы кислорода
Для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Он проявляет степень окисления обычно  p-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления —2 и 2 (например, в Н2O и OF2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3s-электроны (показано стрелками). Число неспаренных электронов, а следовательно, и валентность в первом случае равны четырем (например, в SO2), а во втором — шести (например, в SO3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы—селену, теллуру и полонию, а их степени окисления могут быть равны
p-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления —2 и 2 (например, в Н2O и OF2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3s-электроны (показано стрелками). Число неспаренных электронов, а следовательно, и валентность в первом случае равны четырем (например, в SO2), а во втором — шести (например, в SO3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы—селену, теллуру и полонию, а их степени окисления могут быть равны 
Водородные соединения элементов подгруппы кислорода отвечают формуле H2R (R — символ элемента): Н2O, H2S, H2Se, Н2Те. Они называются хальководородами. При растворении их в воде образуются кислоты (формулы те же).
Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RO2 и RO3. Им соответствуют кислоты типа H2RO3 и H2RO4. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа H2RO3 также и восстановительные.
Закономерно изменяются свойства простых веществ: с увеличением заряда ядра ослабевают неметаллические и возрастают металлические свойства. Так, кислород и теллур — неметаллы, но последний обладает металлическим блеском и проводит электричество.
Онлайн урок: кислород по предмету химия 8 класс |
Кислород – самый распространенный на Земле химический элемент:
земная кора содержит 47% кислорода
мировой океан состоит из кислорода на 85%
Кроме этого, кислород – основной участник обмена веществ в живых организмах – дыхания и фотосинтеза.
В таблице приведены основные сведения о кислороде.
Химический элемент | Простое вещество |
Название «Oxygenium» произошло от двух слов, в переводе «рождающий кислоты» Химический знак – О Атомный номер – 8 Расположение в периодической системе – 2 период, VI группа Типичный неметалл (сильный окислитель) Атомная масса – 16 а. е. м. Валентность – 2 Степени окисления – –2; 0; 1; 2 | Химическая формула – O2 Молекулярная масса – 32 а. е. м. Бесцветный газ без запаха; светло-голубая жидкость; синие кристаллы Температура кипения – –183 °С Температура плавления – –218 °С |
В жидком состоянии кислород имеет голубой цвет, поэтому на всех формулах мы его будем обозначать голубым!

Изучением кислорода занимались несколько учёных примерно в одно и то же время.
Официально первооткрывателем кислорода считается англичанин Джозеф Пристли (1774 год).
Однако установлен факт, что в свое время Леонардо да Винчи изучал химию кислорода, не подозревая тогда, что он является элементом.
Название «кислород» в русский язык ввёл Михаил Ломоносов, который также ввёл в употребление термин «кислота», который в те времена обозначал оксид – соединение элемента с кислородом.
Поэтому истинное значение названия «кислород» переводится как «рождающий оксиды». Некоторое время в России кислород называли «кислотвор».
Химический элемент кислород образует два простых вещества: кислород (O2) и озон (O3).
Кислород активно участвует в обмене веществ, именно ему обязана наша планета возникновением на ней жизни.
Атмосфера содержит 21 % кислорода.
Считается, что несколько сотен миллионов лет назад концентрация кислорода в атмосфере была почти в 2 раза выше – около 40%.
Количество кислорода в воздухе ниже 8% является угрозой для жизни человека.
В отличие от кислорода, озон даже в газообразном состоянии имеет голубой цвет, в жидком – насыщенный фиолетовый, в твёрдом – почти чёрный.
Озон (O3) образуется из кислорода при воздействии ионизирующих излучений: радиации или жестких ультрафиолетовых лучей (это свойство кислорода было открыто в 1899 году учеными Пьером и Марией Кюри).
Он образуется в атмосфере под воздействием разрядов молнии, а также при работе бытовой техники, например, лазерных принтеров.
При этом вы можете чувствовать характерный запах – это и есть запах озона.
Слово «озон» с греческого языка так и переводится: «пахну».
Озон также способен в некоторой степени задерживать ультрафиолетовые лучи. Это его свойство является одним из факторов существования жизни на Земле.
Кислород и озон являются парамагнетиками – это значит, что они притягиваются к магниту.
Это заметно при проведении опытов с жидкими кислородом и озоном.
Промышленное производство серной кислоты
Какие катализаторы используются при производстве серной кислоты?
Серная кислота — одно из важнейших неорганических соединений в химической промышленности. Сырьем для промышленного производства серной кислоты служат: чистая сера S, железный колчедан (пирит) 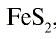
Процессы промышленного производства серной кислоты, начиная с подготовки сырья и кончая получением готового продукта, подразделяются на несколько этапов.
1. Получение оксида серы (IV). 2. Очистка оксида серы (IV). 3. Окисление оксида серы (IV) и получение оксида серы (VI).
1. Получение оксида серы (IV).
Для получения оксида серы (IV) из имеющегося сырья необходимо осуществить следующие химические реакции:
В промышленности для производства 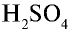
1) реакции обжига проводить при участии чистого кислорода вместо воздуха. Это позволяет увеличить концентрацию одного из реагирующих веществ — кислорода, а следовательно, и скорость реакции;
2) измельчать частицы пирита, при этом увеличивается поверхность столкновения частиц пирита с кислородом, в результате чего реакция ускоряется. Однако чрезмерное измельчение пирита замедляет реакцию, так как пирит спекается и кислород не может проникнуть в уплотненные слои. Но использование чрезмерно измельченного пирита по принципу противотока также дает хорошие результаты. Пирит засыпается в печь для обжига колчедана (окисление 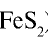 Очистка оксида серы (IV). Процесс получения оксида серы (IV) является каталитическим, в качестве катализатора используется оксид ванадия (V)—
Очистка оксида серы (IV). Процесс получения оксида серы (IV) является каталитическим, в качестве катализатора используется оксид ванадия (V)—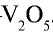
3. Окисление оксида серы (IV) и получение оксида серы (VI).
Для получения оксида серы (VI) из оксида серы (IV) последний окисляется в присутствии катализатора:
Реакция является экзотермической, и при 400°С выход оксида серы (VI) составляет 99,2%. С повышением температуры выход продукта уменьшается, например, при 600°С он составляет лишь 73%.
Теплота, выделяющаяся в ходе реакции, расходуется на нагревание 
Для выбора оптимальных условий окисления оксида серы (IV) необходимо подобрать факторы, позволяющие сдвинуть равновесие обратимой реакции вправо.
1. Температура. Для увеличения выхода оксида серы (VI) температуру реакции следует постепенно понижать с 600°С до 400—450°С .
2. Катализатор. Катализатором могут служить оксиды железа, платины и ванадия. К катализаторам предъявляются следующие требования: а) низкая цена; б) устойчивость к каталитическим донорам; в) долговечность. В настоящее время в качестве катализатора используется оксид ванадия (V).
3. Оксид серы (IV), поступающий в контактный аппарат, должен быть осушен от водяных паров и очищен от различных твердых частиц и пыли, повреждающих катализатор. Оксид серы (IV), осушенный от водяного пара и очищенный от пыли и различных примесей, в смеси с воздухом поступает в теплообменник, где он нагревается до определенной температуры, а оттуда в контактный аппарат, где он окисляется до 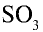
Образовавшийся в контактном аппарате и охлажденный в теплообменнике оксид серы (VI) подается в поглотительную башню.
Гидратация оксида серы (VI), то есть получение серной кислоты.
В поглотительной башне из оксида серы (VI) получается серная кислота, для чего 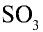
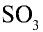
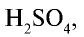
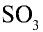
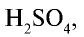
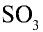
Процесс промышленного производства серной кислоты является непрерывным (рис. 25).
Элементы знаний, умений и навыков: сырье, обжиг пирита, кипящий слой, контактный аппарат, теплообменник, олеум.
Пример:
Во сколько раз увеличится скорость реакции, если коэффициент скорости равен 3, а температура повышена с 50°С до 70°С? При первоначальной температуре (50°С) реакция завершается за 2 мин 15 с, за какое время она завершится при 70°С?
Решение:
1) увеличение скорости реакции (при переходе от 50°С к 70°С) найдем согласно правилу Вант-Гоффа:
Скорость химической реакции увеличится в 9 раз;
2) при начальной температуре 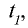
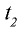
Ответ. 15 с.
Серная кислота
На какие металлы не воздействует концентрированная серная кислота?
Молекулярная формула серной кислоты 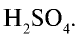
Получение серной кислоты осуществляется с помощью химических реакций, протекающих по следующей схеме:
Физические свойства: Серная кислота — тяжелая бесцветная маслянистая жидкость без запаха. Плотность 96% -ной концентрированной кислоты равна 1,84 г/см3. При растворении в воде она выделяет большое количество теплоты, поэтому при ее разбавлении следует соблюдать осторожность, приливая серную кислоту к воде небольшими частями.
1. Взаимодействует со всеми металлами, стоящими в ряду активности перед водородом, при этом образуются соли и вытесняется водород:
2. Взаимодействует с основными и амфотерными оксидами и образует соли и воду:
3. Взаимодействует с основаниями и образует соли и воду:
4. Взаимодействует с солями слабых и летучих кислот и образует новые соли и новые кислоты:
Концентрированная серная кислота является очень сильным окислителем, поэтому она реагирует почти со всеми металлами, кроме серебра Ag, золота Аu и платины Pt, а также железа Fe при 100% -ной концентрации.
При этом в зависимости от активности металлов, концентрации серной кислоты и условий реакции выделяются газы 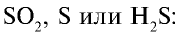
При кипячении концентрированная серная кислота взаимодействует также с неметаллами:
Концентрированная серная кислота обугливает такие вещества, как сахар, бумага, дерево и ткани, вытягивая воду из содержащейся в них целлюлозы:
Для определения серной кислоты и сульфатов на них воздействуют растворимой солью бария (хлорид бария). В результате реакции выпадает осадок белого цвета, не растворимый ни в воде, ни в азотной кислоте:
Сульфаты. Сульфат натрия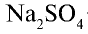
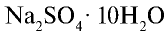 Сульфат кальция
Сульфат кальция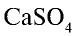
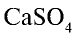
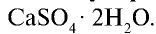
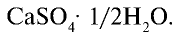
Алебастр — важный строительный материал, часто используемый при строительстве объектов. В медицине гипс используется для наложения всевозможных гипсовых повязок.
Сульфат меди(Н)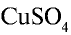
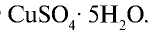 Железный купорос
Железный купорос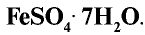
Соли серной кислоты
Серная кислота, будучи двухосновной, образует два ряда солей: средние, называемые сульфатами, и кислые, называемые гидросульфатами. Сульфаты образуются при полной нейтрализации кислоты щелочью (на один моль кислоты приходится два моля щелочи), а гидросульфаты — при недостатке щелочи (на один моль кислоты — один моль щелочи):
Многие соли серной кислоты имеют большое практическое значение.
Качественная реакция на сульфат-ион. Большинство солей серной кислоты растворимо в воде. Соли CaSO4 и PbSO4 мало растворимы в воде, a BaSO4 практически нерастворима как в воде, так и в кислотах. Это свойство позволяет использовать любую растворимую соль бария, например ВаСl2, как реагент на серную кислоту и ее соли (точнее, на ион 
или в ионной форме:
При этом выпадает белый нерастворимый в воде и кислотах осадок сульфата бария.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Факторы, влияющие на скорость химической реакции
1. Влияние концентрации реагирующих веществ на скорость химических реакций.
При изучении химических свойств кислорода в курсе химии 7 класса вы узнали, что на воздухе сера горит очень медленно, а в присутствии чистого кислорода быстро сгорает ярким пламенем.
При горении серы в присутствии чистого кислорода количество молекул кислорода, ударяющихся о поверхность серы, намного больше, чем в воздухе. Это связано с тем, что кислород занимает 21% объема воздуха.
Скорость химических реакций равна произведению концентраций веществ, участвующих в реакции. Например, для реакции А В=С v = к [А] • [В], где [А] и [В] — молярные концентрации веществ А и В, к — коэффициент пропорциональности.
2. Влияние температуры на скорость химических реакций.
При повышении температуры скорость реакции увеличивается в 2—4 раза:
где 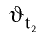
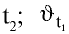
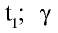
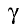
3. Влияние природы веществ на скорость химической реакции.
4. Для твердых веществ скорость реакции прямо пропорциональна поверхности веществ, вступающих в реакцию.
Рассмотрим эту зависимость на примере реакции соединения железа с серой.
Реакция Fe S = FeS протекает быстрее до строго определенной степени измельчения частиц железа. При увеличении степени измельчения частиц до порошкообразного состояния скорость реакции ослабевает, так как происходит спекание, которое снижает взаимное столкновение молекул.
5. Влияние катализатора на скорость химической реакции.
Реакция расщепления пероксида водорода ускоряется в присутствии
МпОг Процесс получения оксида серы (VI) ускоряется в присутствии катализатора оксида ванадия (V).
— Вещества, которые ускоряют химические реакции, но сами остаются без изменений, называются катализаторами.
Ингибиторы — это вещества, которые снижают возможность веществ вступать в химическую реакцию.
Элементы знаний, умений и навыков: скорость химической реакции, концентрация, температура, температурный коэффициент скорости, столкновение молекул, катализатор, ингибитор.
Химические свойства оксида серы (iv)
Оксид серы (IV) – это типичный кислотныйоксид. За счет серы в степени окисления 4 проявляет свойства окислителяи восстановителя.
1. Как кислотный оксид, сернистый газ реагирует с щелочамии оксидами щелочных и щелочноземельных металлов.
Например, оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2 2NaOH(изб) → Na2SO3 H2O
SO2(изб) NaOH → NaHSO3
Еще пример: оксид серы (IV) реагирует с основным оксидом натрия:
SO2 Na2O → Na2SO3
2. При взаимодействии с водой SO2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
SO2 H2O ↔ H2SO3
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например, оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
2SO2 O2 ↔ 2SO3
Сернистый ангидрид обесцвечивает бромную воду:
SO2 Br2 2H2O → H2SO4 2HBr
Азотная кислота очень легко окисляет сернистый газ:
SO2 2HNO3 → H2SO4 2NO2
Озон также окисляет оксид серы (IV):
SO2 O3 → SO3 O2
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
5SO2 2H2O 2KMnO4 → 2H2SO4 2MnSO4 K2SO4
Оксид свинца (IV) также окисляет сернистый газ:
SO2 PbO2 → PbSO4
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например, при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
SO2 2Н2S → 3S 2H2O
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 2CO → 2СО2 S
SO2 С → S СO2
Химическое равновесие
Почему реакция расщепления известняка считается необратимой?
Химические реакции подразделяются на обратимые и необратимые. Необратимые реакции протекают только в сторону образования продуктов реакции. Например,
В обратимых же реакциях химический процесс протекает в противоположные стороны. То есть сначала образуются продукты реакции, которые одновременно могут превращаться в исходные вещества. Например, оксид серы (IV), взаимодействуя с водой, образует сернистую кислоту: 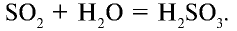
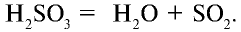
В обратимых химических реакциях по мере расходования исходных веществ их концентрации в растворе уменьшаются. В результате снижается скорость прямой реакции. И наоборот, за счет увеличения концентрации продуктов, образующихся в течение реакции, увеличивается скорость обратной реакции.
Химическое равновесие может быть нарушено при изменении давления, температуры и концентрации веществ. Катализатор не только не сдвигает химическое равновесие, а наоборот, способствует его быстрейшему установлению. Повышение температуры ускоряет реакции, протекающие с поглощением тепла.
Реакция окисления оксида серы (IV) является обратимой экзотермической реакцией: 
Повышение температуры этой реакции ускоряет обратную реакцию, а понижение температуры ускоряет прямую реакцию.
Увеличение давления сдвигает химическое равновесие в сторону реакции, приводящей к уменьшению объема продукта:
Из расчетов, выполненных на основе уравнения реакции, видно, что в прямой реакции происходит уменьшение объема. Значит, увеличение давления ускоряет прямую реакцию.
Увеличение концентрации одного из веществ в реакции, находящейся в состоянии химического равновесия, приводит к сдвигу химического равновесия в сторону расходования этого вещества. Например, в реакционной среде 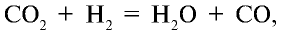
Элементы знаний, умений и навыков: обратимая реакция, прямая реакция, обратная реакция, химическое равновесие, сдвиг равновесия, факторы, обусловливающие сдвиг равновесия.
