(10 мин)
1. Перманганат калия (КMnO4) поместите в
сухую пробирку. У отверстия пробирки положите
рыхлый комочек ваты.2. Закройте пробирку пробкой с газоотводной
трубкой, проверьте на герметичность (рис. 1).
(Пояснения учителя, как проверить
прибор на герметичность.) Укрепите прибор в лапке
штатива.
3. Газоотводную трубку опустите в стакан, не
касаясь дна, на расстоянии 2–3 мм (рис. 2).
4. Подогрейте вещество в пробирке.
(Помните правила техники безопасности.)5. Проверьте наличие газа тлеющей лучинкой
(угольком). Что наблюдаете? Почему кислород можно
собирать методом вытеснения воздуха?6. Соберите полученный кислород в две колбы для
проведения следующих опытов. Колбы закройте
пробками.7. Оформите отчет, пользуясь табл. 1, которую
разместите на развороте тетради.
(5 мин)
1. Прикрепите к одному концу стальной проволоки
кусочек спички. Зажгите спичку. Проволоку с
горящей спичкой опустите в колбу с кислородом.
Что наблюдаете? Дайте объяснение (рис. 5).
2. Оформите отчет о работе в табл. 1.
Таблица 1
| Выполняемые операции (что делали) | Рисунки с обозначениями исходных и полученных веществ | Наблюдения. Условия проведения реакций. Уравнения реакций | Объяснения наблюдений. Выводы |
|---|---|---|---|
| Сборка прибора для получения кислорода. Проверка прибора на герметичность | |||
| Получение кислорода из KMnО4 при нагревании | |||
| Доказательство получения кислорода c помощью тлеющей лучинки | |||
| Характеристика физических свойств О2. Собирание О2 двумя методами: вытеснением воздуха, вытеснением воды | |||
| Характеристика химических свойств О2. Взаимодействие с простыми веществами: горение угля, горение железа (стальная проволока, скрепка) |
![]() ВЫВОД. Один из способов получения
ВЫВОД. Один из способов получения
кислорода в лаборатории – разложение КMnO4.
Кислород – газ без цвета и запаха, тяжелее
воздуха в 1,103 раза (Mr(O2) = 32, Mr(возд.)
= 29, из чего следует 32/29 ![]()
![]()
![]()
![]()
Задача. Определите, какое из соединений
железа – Fe2О3 или Fe3О4 –
богаче железом?
Решение
![]() n•Ar(X)/Mr,
n•Ar(X)/Mr,
где n – число атомов элемента Х в формуле
вещества.
Mr(Fe2O3) = 56•2 16•3 = 160,
![]()
![]() Mr (Fe3O4) = 56•3 16•4 = 232,
Mr (Fe3O4) = 56•3 16•4 = 232,![]() ‘(Fe)
‘(Fe)
= 56•3/232 = 0,724,![]() ‘(Fe) = 72,4%.
‘(Fe) = 72,4%.
Ответ. Fe3O4 богаче железом, чем Fe2O3.
Учитель во время практической работы наблюдает
за правильностью выполнения приемов и операций
учащимися и отмечает в карточке учета умений
(табл. 2).
Таблица 2
§ 17. получение и хранение кислорода
Разложение оксидов
Методы получения кислорода можно разделить на промышленные и лабораторные. В лаборатории кислород удобнее получать из тех его соединений, которые при нагревании легко разлагаются с выделением кислорода. Чаще всего для этого используют калий перманганат KMnO4, калий хлорат KClO3 (бертолетову соль), калий нитрат KNO3 (индийскую селитру), гидроген пероксид Н2O2.
Впервые кислород был получен нагреванием меркурий(II) оксида HgO сфокусированными солнечными лучами. При этом образуется жидкая ртуть и газообразный кислород (рис. 90):
Рис. 90. При прокаливании красного меркурий(II) оксида образуется жидкая серебристая ртуть и газообразный кислород
Таким же образом могут разлагаться соединения и других неактивных металлических элементов с Оксигеном.
Но обычно такие реакции происходят при очень высоких температурах, поэтому использовать их для получения кислорода в лаборатории не очень удобно.
Разложение бертолетовой соли. Катализаторы
Поместим в чистую сухую пробирку несколько кристаллов бертолетовой соли и нагреем ее в пламени спиртовки. Сначала соль начинает плавиться (357 °С), а потом расплав закипает (400 °С) — начинается разложение с выделением бесцветного газа в соответствии с уравнением:
Чтобы доказать, что выделяющийся газ является кислородом, в пробирку внесем тлеющую лучину (рис. 91). Лучина ярко вспыхивает. Это означает, что полученный газ — кислород, так как он поддерживает горение.
Чтобы ускорить реакцию, к бертолетовой соли можно добавить небольшое количество порошка манган(ІV) оксида MnO2. В его присутствии кислород начинает выделяться при более низкой температуре (200 °С), даже ниже, чем температура плавления. Сам по себе манган(ІV) оксид в этой реакции не расходуется, он только ускоряет ее. Такие вещества называют катализаторами, а увеличение скорости реакции под действием катализатора — катализом.
Катализаторы — это вещества, которые изменяют скорость химической реакции, но сами в ней не расходуются.
Способность некоторых веществ ускорять химические реакции известна уже более 200 лет, но первые научные объяснения этого явления, а также приведенное определение катализаторов было введено выдающимся химиком В. Оствальдом.
Рис. 91. Доказательство наличия кислорода в пробирке: тлеющая лучина при внесении в кислород вспыхивает
Вильгельм-Фридрих Оствальд (1853-1932)
Выдающийся немецкий физико-химик, лауреат Нобелевской премии 1909 г. Родился в Риге, где учился и в 28 лет начал работать профессором. В возрасте 35 лет переехал в Лейпциг, где возглавил Физикохимический институт. Вильгельм Оствальд изучал законы химического равновесия, электрические свойства растворов, открыл закон разбавления, названный его именем, разработал основы теории кислотно-основного катализа, занимался историей химии.
Разложение калий перманганата
Кислород в лаборатории удобно получать из калий перманганата KMnO4. Калий перманганат представляет собой черно-фиолетовые кристаллы со специфическим блеском (рис. 92). Небольшое количество порошка калий перманганата поместим в пробирку. Во избежание разбрасывания порошка, в пробирку необходимо поместить ватный тампон (рис. 93).
Для того чтобы началась реакция, пробирку необходимо нагреть приблизительно до 230 °С. Порошок постепенно нагревается и начинает растрескиваться — происходит реакция:
Если к пробирке присоединить газоотводную трубку, то выделяющийся кислород можно собрать в какую-нибудь емкость.
Рис. 92. Калий перманганат используют для получения кислорода в лаборатории
Рис. 93. Приспособление для получения кислорода разложением калий перманганата
Рис. 94. Приспособление для собирания кислорода: а — методом вытеснения воздуха; б — методом вытеснения воды
Как можно собрать полученный кислород?
Кислород тяжелее воздуха и малорастворим в воде, поэтому его можно собирать двумя способами: вытеснением воздуха и вытеснением воды. В первом случае (рис. 94а) кислород, который поступает в емкость по стеклянной трубке, постепенно вытесняет воздух. Во избежание смешивания кислорода с атмосферным воздухом, отверстие емкости неплотно закрывают куском ваты или листом фильтровальной бумаги.
При собирании кислорода над водой (рис. 94б) выделяющийся газ постепенно вытесняет воду из пробирки, заранее заполненной водой. Когда газ полностью вытеснит воду из пробирки, ее отверстие закрывают стеклом и только потом вынимают из воды и переворачивают.
Получение кислорода из гидроген пероксида
Часто для получения кислорода в лаборатории используют гидроген пероксид Н2O2. Гидроген пероксид при обычных условиях разлагается, но очень медленно, даже если его подогреть на горелке. Но если в раствор гидроген пероксида добавить щепотку манган(ІV) оксида, то жидкость сильно вспенивается, почти «закипает» — это выделяется кислород:
По окончании реакции в пробирке остается смесь воды и манган(ІV) оксида. Эту смесь легко разделить фильтрованием. В данной реакции манган(ІV) оксид выступает в роли катализатора. В этом легко убедиться, если отфильтрованный манган(ІV) оксид снова добавить к гидроген пероксиду для разложения новой порции.
Поскольку катализаторы в процессе химической реакции не расходуются, то их добавляют к реагентам очень малыми дозами. Существует даже выражение «добавить реагент в каталитическом количестве», что означает «очень мало».
Реакции разложения
Если внимательно проанализировать приведенные уравнения реакций получения кислорода, то можно заметить общий признак: в левой части данных уравнений записана формула одного вещества, а в правой — нескольких. Такие реакции называются реакциями разложения.
Реакции, в которых из одного сложного вещества образуется несколько других веществ, называются реакциями разложения.
В общем виде уравнения реакции разложения можно записать следующим образом:
Получение кислорода в промышленности. Хранение кислорода
Приведенные выше методы получения кислорода могут быть использованы только в лабораторных условиях. Для промышленного получения больших объемов кислорода они не используются из-за высокой стоимости исходных веществ. Большие количества кислорода получают из жидкого воздуха разделением (ректификацией).
Полученный жидкий кислород хранят в специальных емкостях — сосудах Дьюара (рис. 95), которые по строению напоминают обычный термос. Сосуд Дьюара имеет две стенки, из пространства между которыми откачан воздух. Благодаря этому сосуд почти не пропускает тепло, и в нем длительное время при низкой температуре может храниться сжиженный газ.
Рис. 95. Сосуд Дьюара для хранения сжиженных газов (а) и его строение (б)
Часто в промышленности кислород получают из воды. Под действием электрического тока вода разлагается на два простых вещества — кислород и водород. Этот процесс называют электролизом (рис. 96).
Электролиз воды происходит довольно медленно и требует значительных затрат электричества, но полученный кислород довольно чистый, поэтому в некоторых случаях этот метод является целесообразным.
Полученный газообразный кислород хранят в специальных стальных баллонах под высоким давлением, чтобы он занимал меньше места. Баллоны с кислородом окрашивают в синий цвет, чтобы не перепутать их с баллонами, наполненными другими газами (рис. 97, с. 127).
Рис. 96. Приспособление для получения кислорода электролизом воды
Рис. 97. Баллоны для хранения чистого кислорода под высоким давлением
Рис. 98. Газометр для хранения и использования газов в лаборатории: а — наполнение газометра кислородом методом вытеснения воды (краны 1 и 2 закрыты, кран 3 открыт); б — использование собранного кислорода (краны 1 и 2 открыты, кран 3 закрыт)
Для хранения и удобного пользования кислородом в лаборатории используют другое устройство — газометр (рис. 98). Это большой стеклянный баллон с большой воронкой, заполненной водой. Сначала газометр заполняют кислородом методом вытеснения воды (рис. 98а). Когда газометр заполнен, открывают кран 2 и вода из воронки вытесняет собранный газ через кран 1 (рис. 98б).
Выводы:
1. В лаборатории кислород получают разложением сложных веществ: бертолетовой соли, калий перманганата или гидроген пероксида. Полученный кислород можно выявить, используя тлеющую лучину, а собирают его методом вытеснения воды или воздуха.
2. Реакции получения кислорода являются реакциями разложения, в которых из одного вещества образуется несколько. Часто они происходят при участии катализаторов — веществ, которые ускоряют химические реакции, но сами при этом не расходуются.
3. В промышленности кислород получают либо разделением (ректификацией) воздуха, либо реакцией разложения воды электролизом.
Контрольные вопросы
1. Какие условия протекания реакций являются общими для описанных лабораторных методов получения кислорода?
2. Выберите вещества, разложением которых можно получить кислород: а) калий перманганат KMnO4; б) углекислый газ СO2; в) вода Н2O; г) манган(IV) оксид MnO2.
3. Какие реакции называют реакциями разложения?
4. Как получают кислород в промышленности?
5. Какие вещества называются катализаторами? Почему катализаторы добавляют в небольших количествах?
6. Чем принципиально отличаются лабораторные и промышленные способы получения кислорода?
7. Каким способом можно доказать наличие чистого кислорода в сосуде? На каком свойстве кислорода он основан?
8. Назовите способы собирания кислорода. На каких свойствах кислорода они основаны?
9. В каких сосудах хранят газообразный и жидкий кислород?
10. Как отличить баллон, в котором хранится кислород? Почему нельзя смазывать вентили кислородных баллонов машинным маслом?
Задания для усвоения материала
1. Назовите лабораторные методы получения кислорода. Запишите соответствующие уравнения реакций.
2. Составьте формулы соединений Оксигена с Гидрогеном, Калием, Магнием, Алюминием, Карбоном(IV), Фосфором(V) и Сульфуром(VI).
3. В каком соединении содержание Оксигена больше (по массовой доле) — в калий перманганате или бертолетовой соли?
4. Как изменится положение весов, если в пустой стакан, уравновешенный на весах, через трубочку добавить кислород?
5. В химический стакан налили раствор гидроген пероксида массой 400 г и добавили щепотку манган(IV) оксида. По завершении выделения пузырьков газа в стакане осталась вода массой 375 г. Вычислите массу выделенного кислорода.
6. Для получения кислорода в пробирку поместили калий перманганат массой 20 г. После прокаливания в пробирке остался твердый остаток массой 18 г. Вычислите массу полученного кислорода. Какой объем занимает этот кислород? (Для расчетов используйте данные из § 15 или Приложения 1.)
7*. Как вы считаете, на чем основано действие катализаторов? Почему катализаторы не расходуются в реакциях?
8*. Объясните, почему сосуд Дьюара, заполненный сжиженным газом, нельзя плотно закрывать крышкой.
Источник
11 как получить, собрать и распознать: а) водород: б) кислород: в) углекислый газ: г) аммиак; д) этилен?
№11. а). Водород получают взаимодействием металлов с кислотами (кроме HNO3). Чаще всего используют Zn и HCl.
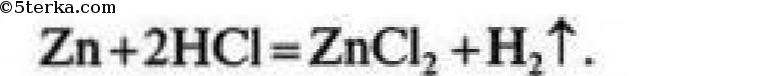
Собирают водород методом вытеснения воздуха в перевернутый вверх дном сосуд, так как водород легче воздуха. Для распознавания водорода его поджигают и по характеру звука, с которым он сгорает, определяют наличие данного газа.
б). Кислород получают разложением перманганата калия или пероксида водорода.

Собирают кислород вытеснением воздуха (он тяжелее воздуха, поэтому сосуд располагают вниз дном) или вытеснением воды (он малорастворим в воде).
Для того чтобы доказать наличие кислорода, необходимо в сосуд внести тлеющую лучинку: если она разгорится — значит, в сосуде был кислород.
в). Углекислый газ получают действием кислоты на карбонаты, обычно берут HCl и CaCO3
Собирают CO2 вытеснением воздуха в сосуд, расположенный вниз дном, так как он тяжелее воздуха.
Вытеснением воды углекислый газ нельзя собрать, так как он хорошо растворим.
Распознают углекислый газ с помощью раствора Ca(OH)2 (известковой воды), который мутнеет в присутствии CO2.

Карточка учета умений
| Операции практической работы | Фамилии учащихся | |||||
|---|---|---|---|---|---|---|
| А | Б | В | Г | Д | Е | |
| Сборка прибора для получения кислорода | ||||||
| Проверка прибора на герметичность | ||||||
| Укрепление пробирки в лапке штатива | ||||||
| Обращение со спиртовкой | ||||||
| Нагревание пробирки с KМnО4 | ||||||
| Проверка выделения О2 | ||||||
| Собирание О2 в сосуд двумя методами: вытеснением воздуха, вытеснением воды | ||||||
| Сжигание угля | ||||||
| Сжигание Fe (стальной проволоки) | ||||||
| Kультура выполнения опытов | ||||||
| Оформление работы в тетради | ||||||
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза.
Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарноеуравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение и свойствакислорода
ПРАКТИЧЕСКАЯ РАБОТА (1 ч) ![]()
Работа проводится учащимися
самостоятельно под контролем учителя.Предлагаю результат моей многолетней работы по
подготовке и проведению практических работ в
общеобразовательной школе на уроках химии в 8–9-х
классах:
- «Получение и свойства
кислорода», - «Приготовление
растворов солей с определенной массовой долей
растворенного вещества», - «Обобщение сведений о
важнейших классах неорганических соединений», - «Электролитическая
диссоциация», - «Подгруппа кислорода»
(см. след. номера газеты «Химия»).
Все они апробированы мною на занятиях. Их
можно использовать при изучении школьного курса
химии как по новой программе О.С.Габриеляна, так и
по программе Г.Е.Рудзитиса, Ф.Г.Фельдмана.Ученический эксперимент – это вид
самостоятельной работы.
Эксперимент не только
обогащает учащихся новыми понятиями, умениями,
навыками, но и является способом проверки
истинности приобретенных ими знаний,
способствует более глубокому пониманию
материала, усвоению знаний. Он позволяет более
полно осуществлять принцип вариативности
восприятия окружающего мира, т. к. главная
сущность этого принципа – связь с жизнью, с
будущей практической деятельностью учащихся.
Цели. Уметь получать кислород в
лаборатории и собирать его двумя методами:
вытеснением воздуха и вытеснением воды;
подтвердить опытным путем свойства кислорода;
знать правила техники безопасности.Оборудование.
Металлический штатив с
лапкой, спиртовка, спички, пробирка с
газоотводной трубкой, пробирка, комочек ваты,
пипетка, химический стакан, лучинка,
препаровальная игла (или проволока),
кристаллизатор с водой, две конические колбы с
пробками.
Правила техники безопасности.Осторожно обращайтесь с химическим
оборудованием!Помните! Пробирку прогревают, держа ее в
наклонном положении, по всей длине двумя-тремя
движениями в пламени спиртовки. При нагревании
направляйте отверстие пробирки в сторону от себя
и соседей.
Предварительно учащиеся получают
домашнее задание, связанное с изучением
содержания предстоящей работы по инструкции,
одновременно используя материалы учебников 8-го
класса авторов О.С.Габриеляна (§ 14, 40) или
Г.Е.Рудзитиса, Ф.Г.
ХОД УРОКА
Один опыт я ставлю выше,чем тысячу мнений, рожденных только воображением.
М.В.Ломоносов
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):
Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.
При этом протекает следующая химическая реакция:
Урок 17. получение кислорода
В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.
Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород. Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать.

