- Основные реакции сталеплавильных процессов
- Поведение составляющих чугуна при продувке
- При окислении 300 г чугуна в токе кислорода образовалось 33,6 л оксида углерода.определить массовую долю железа в чугуне — знания.site
- При окислении 300 г чугуна в токе кислорода образовалось 33,6 л (н. у.) оксида углерода. определите массовую долю (в процентах) железа чугуне.
- При окислении 300г чугуна в токе кислорода образовалось 33, 6 л? — химия
- При окислении 300г чугуна в токе кислорода образовалось 33,6 л. оксида углерода(4). определите массовую долю железа в чугуне — знания.org
- При окислении 300г чугуна в токе кислорода образовалось 33.6л оксида углерода(iv). определите массовую долю( в процентах) железа в чугуне. пожалуйста, решите кто нибудь! ничего не получается:( *для справки: оксид углерода(iv)-со2 —
Основные реакции сталеплавильных процессов
Поскольку сталь получают обычно из чугуна и лома в результате окисления и удаления содержащихся в них примесей (кремния, марганца, фосфора и др.), особое значение в сталеплавильной практике имеют реакции окисления. Кислород для протекания этих реакций поступает или из атмосферы, или из железной руды, или из других окислителей, или при продувке ванны газообразным кислородом.
Поведение составляющих чугуна при продувке
Все примеси в процессе продувки кислородам окисляются одновременно, но скорости их окисления различны: с наибольшей скоростью протекают реакции, максимально удаленные от равновесия. Мерой отклонения реакции от равновесия в общем случае является нестандартное изменение изобарно-изотермического потенциала 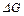 , которое тем больше, чем выше химическое сродство элемента к кислороду в стандартных условиях. В начальный момент рафинирования с наибольшей скоростью окисляются примеси, имеющие максимальное химическое сродство к кислороду в стандартных условиях. Другие примеси окисляются одновременно, но с меньшими различными скоростями, в соответствии с химическим сродством к кислороду.
, которое тем больше, чем выше химическое сродство элемента к кислороду в стандартных условиях. В начальный момент рафинирования с наибольшей скоростью окисляются примеси, имеющие максимальное химическое сродство к кислороду в стандартных условиях. Другие примеси окисляются одновременно, но с меньшими различными скоростями, в соответствии с химическим сродством к кислороду.
По ходу рафинирования концентрация в металле примеси, которая имеет максимальное химическое сродство к кислороду (например, кремний), быстро снижается, что приводит к уменьшению 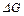 , снижению скорости окисления и, наконец, полному прекращению реакции. В дальнейшем поступающий в ванну кислород на эту реакцию больше не расходуется, а расходуется на другие реакции, одна из которых начинает играть ведущую роль.
, снижению скорости окисления и, наконец, полному прекращению реакции. В дальнейшем поступающий в ванну кислород на эту реакцию больше не расходуется, а расходуется на другие реакции, одна из которых начинает играть ведущую роль.
Реакции окисления. В течение продувки за счет подаваемого в конвертер кислорода окисляется избыточный углерод, а также кремний, большая часть марганца и некоторое количество железа. Окисление примесей жидкого чугуна — углерода, кремния и марганца можно представить следующими итоговыми реакциями:
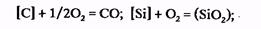
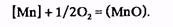
За счет непосредственного взаимодействия с газообразным кислородом окисляется лишь незначительная часть примесей. Окисление большей части примесей протекает по более сложной схеме:
— первоначально в зоне контакта кислородной струи с металлом окисляется железо 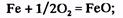 его окисление объясняется тем, что концентрация железа в несколько десятков раз больше концентрации других элементов, и поэтому с вдуваемым кислородом прежде всего контактируют атомы железа. Образующийся оксид FеО растворяется частично в металле
его окисление объясняется тем, что концентрация железа в несколько десятков раз больше концентрации других элементов, и поэтому с вдуваемым кислородом прежде всего контактируют атомы железа. Образующийся оксид FеО растворяется частично в металле  и частично в шлаке
и частично в шлаке  .
.
— за счет этого растворенного в металле и шлаке кислорода окисляются прочие составляющие жидкого чугуна.
Таким образом, при продувке в конвертере характерно прямое окисление железа в зоне контакта кислородной струи с металлом (в первичной реакционной зоне) и окисление прочих составляющих металла за счет вторичных реакций на границе с первичной реакционной зоной и в остальном объеме ванны.
Окисление кремния и марганца, так же как и углерода, начинается с момента подачи кислорода, причем весь кремний и большая часть марганца выгорают в первые минуты продувки. Более быстрое их окисление по сравнению c углеродом объясняется различием в химическом сродстве разных элементов к кислороду при различных температурах.
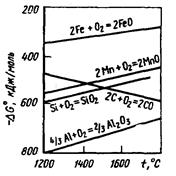 На рис. 7.7 приведена зависимость химического сродства ряда элементов к кислороду от температуры; при этом величина химического сродства тем больше, чем больше по абсолютной величине отрицательное значение ΔG. Из рис. 7.7 следует, что при температурах ниже 1450-1500 °С кремний и марганец обладают более высоким сродством к кислороду, чем углерод; при более же высоких температурах сродство углерода к кислороду превышает сродство марганца и кремния. В соответствии с этим марганец и кремний окисляются в начале продувки, когда температура в конвертере сравнительно невысока.
На рис. 7.7 приведена зависимость химического сродства ряда элементов к кислороду от температуры; при этом величина химического сродства тем больше, чем больше по абсолютной величине отрицательное значение ΔG. Из рис. 7.7 следует, что при температурах ниже 1450-1500 °С кремний и марганец обладают более высоким сродством к кислороду, чем углерод; при более же высоких температурах сродство углерода к кислороду превышает сродство марганца и кремния. В соответствии с этим марганец и кремний окисляются в начале продувки, когда температура в конвертере сравнительно невысока.
Рис. 7.7. Химическое сродство элементов к кислороду при различных температурах
Окисление кремния заканчивается в первые 3—5 мин продувки и в дальнейшем по ходу плавки жидкий металл кремния не содержит. Реакция окисления кремния протекает до его полного израсходования и является необратимой, поскольку продукт окисления — кислотный оксид SiO2, связывается в основном шлаке в прочное соединение 2СаО•SiO2.
Интенсивное окисление марганца наблюдается в начале продувки, когда при низких температурах его химическое сродство к кислороду велико; к 3—5 мин продувки окисляется около 70% марганца, содержащегося в чугуне.
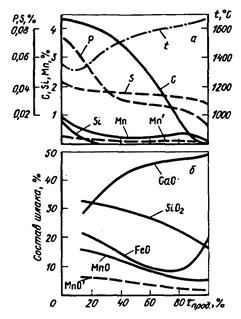
Рис. 7.8. Изменение состава металла (а) и шлака (б) по ходу продувки в кислородном конвертере
Марганец восстанавливается из шлака; в конце продувки, когда вследствие усиливающегося окисления железа содержание оксидов железа в шлаке возрастает. Конечное содержание обычно находится в пределах от 0,2—0,3 до 0,03—0,05 %, нижний предел— при переработке маломарганцовистых чугунов.
Окисление углеродав кислородном конвертере происходит преимущественно до СО; до СО2 окисляется около 10% углерода, содержащегося в чугуне. В начале продувки скорость окисления углерода невелика (0,1—0,15 %/мин), поскольку много кислорода расходуется на окисление кремния и марганца, имеющих высокое химическое сродство к кислороду при низких температурах. В дальнейшем, вследствие повышения сродства углерода к кислороду при росте температуры и уменьшения расхода кислорода на окисление марганца и кремния, скорость окисления углерода возрастает и затем остается в течение длительного времени почти постоянной. В этот период весь вдуваемый кислород идет на окисление углерода, и достигаемая скорость (до 0,5 %/мин) обезуглероживания определяется интенсивностью подачи кислорода. В конце продувки скорость обезуглероживания вновь снижается потому, что в металле остается мало углерода.
Роль реакции обезуглероживания велика: окисление углерода дает большую часть тепла для нагрева ванны; длительность окисления углерода определяет длительность продувки; выделяющиеся пузыри СО обеспечивают6
— перемешивание ванны, благодаря чему выравниваются состав и температура;
-ускоряется нагрев металла;
— вследствие перемешивания металла и шлака ускоряются дефосфорация и десульфурация;
— с пузырями СО удаляются растворенные в металле вредные газы — водород и азот;
— пузыри СО вспенивают ванну, благодаря чему могут возникать выбросы.
Дефосфорация.Основными источниками попадания фосфора в конвертер являются жидкий чугун, а также стальной лом. Для успешного протекания экзотермической реакции удаления из металла в шлак фосфора:
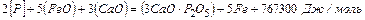
необходимы повышенные основность и окисленность шлака и невысокая температура.
В конвертере с верхней продувкой создаются благоприятные условия для удаления фосфора:
быстрое формирование основных шлаков с высокой окислен-ностью (высоким содержанием оксидов железа) и неплохое перемешивание металла со шлаком.
Поскольку реакция удаления фосфора сопровождается выделением тепла, дефосфорация наиболее интенсивно протекает в первой половине продувки при сравнительно низкой температуре.
Конечное содержание фосфора в металле зависит от количества шлака и полноты протекания реакции дефосфорации, которую обычно характеризуют величиной коэффициента распределения фосфора между шлаком и металлом (Р2О5)/[Р]. Эта величина в условиях кислородно-конвертерного процесса изменяется от 40 до 100—120 и в этих пределах обычно тем выше, чем выше основность и окисленность шлака и чем ниже температура металла в конце продувки. Кроме того, повышению значения (Р2О5)/[Р] способствует улучшение перемешивания металла со шлаком, что достигается при снижении вязкости шлака и при более раннем шлакообразовании, поскольку в этом случае увеличивается продолжительность контакта металла со шлаком. Целесообразно также увеличение количества шлака, поскольку при одной и той же достигнутой величине коэффициента распределения количество фосфора, перешедшего в шлак, будет тем больше, чем больше масса шлака.
Обычно при содержании фосфора в чугуне менее 0,15— 0,20 % металл в конце продувки содержит 0,02—0,04 % фосфора; степень дефосфорации достигает 75—90 %.
Десульфурация. Сера поступает в кислородный конвертер с жидким чугуном, стальным ломом, шлаком из заливочного ковша с известью. Чугун может содержать до 0,035—0,5 % S.
В процессе продувки немного серы (5—10 %) окисляется кислородом дутья и удаляется в виде SO2 c отходящими газами. Остальная сера распределяется между шлаком и металлом. Для успешного удаления серы необходимы высокая основность шлака и низкое содержание в нем окислов железа. Конвертерный шлак содержит значительное количество FеО (8—20 % и более), поэтому десульфурация получает ограниченное развитие. Степень десульфурации обычно не превышает 30 %, а коэффициент распределения серы между шлаком и металлом невелик (от 2 до 6).
В реальных условиях конвертерной плавки десульфурацию стали проводят на установках внепечной обработки стали путем вдувания порошкообразных десульфураторов в ковш после выпуска в него металла из конвертера.
Шлаковый режим. Основные источники шлакообразования служат:
— загружаемая в конвертер известь (СаО);
— продукты окисления составляющих чугуна (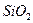 , МпО, FеО, Fе2О3, Р2О5);
, МпО, FеО, Fе2О3, Р2О5);
— оксиды растворяющейся футеровки (СаО, МgО);
— миксерный шлак (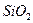 , СаО, МпО, МgО, FеО, А12О3, S);
, СаО, МпО, МgО, FеО, А12О3, S);
— оксиды железа из ржавчины стального лома и составляющие флюсов.
Флюсом служит:
— плавиковый шпат или флюоритовые руды (СаF2), вносящие СаF2 и немного 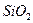 ;
;
— боксит (А12О3, 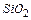 , Fе2О3);
, Fе2О3);
— железная руда или агломерат или окатыши, вносящие оксиды железа и немного 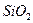 и А12О3;
и А12О3;
— различные отходы производств.
Формирование основного шлака сводится к растворению загружаемой в конвертер кусковой извести в образующейся с первых секунд продувки жидкой шлаковой фазе — продуктах окисления составляющих чугуна (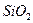 , МпО, FеО). Известь тугоплавка (температура плавления СаО составляет 2570 °С), поэтому для ее растворения необходимо взаимодействие СаО с окислами окружающей шлаковой фазы с образованием легкоплавких химических соединений, которые расплавлялись бы при температурах конвертерной ванны.
, МпО, FеО). Известь тугоплавка (температура плавления СаО составляет 2570 °С), поэтому для ее растворения необходимо взаимодействие СаО с окислами окружающей шлаковой фазы с образованием легкоплавких химических соединений, которые расплавлялись бы при температурах конвертерной ванны.
Практика показала, что без принятия специальных мер растворение извести происходит медленно. Это объясняется тем, что в образующейся в первые секунды продувки шлаковой фазе содержится большое количество 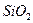 и, реагируя с этим оксидом, куски извести покрываются тугоплавкой оболочкой из двухкалышевого силиката 2СаО •
и, реагируя с этим оксидом, куски извести покрываются тугоплавкой оболочкой из двухкалышевого силиката 2СаО • 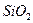 (температура плавления 2130 °С), препятствующей дальнейшему растворению. Поэтому необходимо добавлять компоненты, понижающие температуру плавления этого силиката, а также самой извести.
(температура плавления 2130 °С), препятствующей дальнейшему растворению. Поэтому необходимо добавлять компоненты, понижающие температуру плавления этого силиката, а также самой извести.
Наиболее эффективны в этом отношении СаF2 и оксиды железа, в несколько меньшей степени МпО. С учетом изложеного в конвертер в начале продувки обычно присаживают плавиковый шпат (СаF2), а обогащение шлака окислами железа достигают, начиная продувку при повышенном положении фурмы, и иногда за счет присадок железной руды, агломерата, окатышей, боксита.
Общий расход извести составляет 6-8% от массы плавки; его определяют расчетом так, чтобы обеспечивалась требуемая основность шлака (СаО/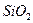 = 2,7-3,6). Расход плавикового шпата составляет 0,15—0,3 % и иногда более.
= 2,7-3,6). Расход плавикового шпата составляет 0,15—0,3 % и иногда более.
В результате растворения извести содержание СаО в шлаке возрастает, а содержание 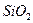 , МпО и FеО снижается. Заметно уменьшается содержание FеО в период наиболее интенсивного окисления углерода (середина продувки), когда сильное развитие получает реакция окисления углерода за счет окислов железа шлака. В конце продувки, когда углерода в металле мало, начинает окисляться железо и содержание FеО в шлаках возрастает, причем тем значительнее, чем до более низкого содержания углерода в металле ведут продувку.
, МпО и FеО снижается. Заметно уменьшается содержание FеО в период наиболее интенсивного окисления углерода (середина продувки), когда сильное развитие получает реакция окисления углерода за счет окислов железа шлака. В конце продувки, когда углерода в металле мало, начинает окисляться железо и содержание FеО в шлаках возрастает, причем тем значительнее, чем до более низкого содержания углерода в металле ведут продувку.
Состав конечного шлака следующий: 43-52 % СаО; 14-22 % 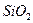 ; 8-25% FеО; 2-6% Fе2О3; 3-12% МпО; 3-7% А12О3; 1,5-4% МgО; 0,5-4,0% Р2O5; < 3 % СаF2; < 1 % СаS. Соотношение между содержанием СаО и
; 8-25% FеО; 2-6% Fе2О3; 3-12% МпО; 3-7% А12О3; 1,5-4% МgО; 0,5-4,0% Р2O5; < 3 % СаF2; < 1 % СаS. Соотношение между содержанием СаО и 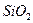 определяется основностью шлака, которой задаются и которую регулируют, изменяя расход извести. Количество оксидов железа, как отмечалось, будет тем выше, чем ниже содержание углерода в металле в конце продувки.
определяется основностью шлака, которой задаются и которую регулируют, изменяя расход извести. Количество оксидов железа, как отмечалось, будет тем выше, чем ниже содержание углерода в металле в конце продувки.
При окислении 300 г чугуна в токе кислорода образовалось 33,6 л оксида углерода.определить массовую долю железа в чугуне — знания.site
при окислении 300 г чугуна в токе кислорода образовалось 33,6 л оксида углерода.определить массовую долю железа в чугуне
При окислении 300 г чугуна в токе кислорода образовалось 33,6 л (н. у.) оксида углерода. определите массовую долю (в процентах) железа чугуне.
Если образовалось 33,6 л, то найдем количество CO2.
n (CO2) = 33,6 л/22,4 л/моль=1,5 моль
Над CO2 поставим 1,5 моль внизу — 1. Над C — внизу поставим 1 а вверху — x. Составим и решим пропорцию
x/1=1,5 моль/1
n (C) = 1,5 моль.
m (С) = 1,5 моль*12 г/моль=18 г
m (Fe) = 300 г — 18 г=282
массовая доля Fe=282/300=0,94=94%
Проверь вычисления
При окислении 300г чугуна в токе кислорода образовалось 33, 6 л? — химия
Вопрос При окислении 300г чугуна в токе кислорода образовалось 33, 6 л?, расположенный на этой странице сайта, относится к
категории Химия и соответствует программе для 5 — 9 классов. Если
ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска
похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему.
Для этого ключевые фразы введите в строку поиска, нажав на кнопку,
расположенную вверху страницы. Воспользуйтесь также подсказками посетителей,
оставившими комментарии под вопросом.
При окислении 300г чугуна в токе кислорода образовалось 33,6 л. оксида углерода(4). определите массовую долю железа в чугуне — знания.org
C O2->CO2, n(CO2)=v/Vмоль=33,6.22б4=1,5моль=n(C), m(C)=n*M=1,5*12=18г, m(Fe)=m(сплава)-m(C)=300-18=282г, w(Fe)=m(Fe)*100%/m(сплава)=282*100/300=94%. Ответ: w(Fe)=94%.
При окислении 300г чугуна в токе кислорода образовалось 33.6л оксида углерода(iv). определите массовую долю( в процентах) железа в чугуне. пожалуйста, решите кто нибудь! ничего не получается:( *для справки: оксид углерода(iv)-со2 —
Да, твоя справка очень помогла!!!
Чугун как правило состоит из железа и углерода. (грубо говоря, потому что там еще должны быть легирующие металлы, постоянные примеси Si, S…)
В токе кислорода пойдет две реакции:
4Fe 3O2=2Fe2O3
C O2=CO2
Для решения задачи понадобится только второе уравнение.
V(CO2)=33.6 л
n(CO2)=V/Vм=33.6/22.4= 1.5 моль
n(CO2)/1=n(C)/1
m(C)=n*M=1.5*12=18 г
w(C)=m(C)/m(сплава)
w(C)=18/300= 0,06=6% — массовая доля углерода в чугуне.
w(Fe)=100%-6%=94%
Ответ: 94%
Хотя вообще по идее в чугуне углерода должно быть процента 2… Хотя в задачах все возможно)
