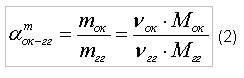Расчеты горения
Расчеты горения ведут по химическим уравнениям реакций, используя законы газового состояния: Бойля – Мариотта 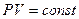 , Гей-Люссака
, Гей-Люссака 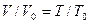 , Шарля
, Шарля 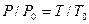 и Клапейрона – Менделеева
и Клапейрона – Менделеева 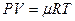 . Используется также закон Авогадро, согласно которому один грамм-моль любого газа при нормальных условиях (Т = 273 К, Р = 760 мм рт. ст.) занимает одинаковый объём – 22,4 дм3. Соответственно один кг-моль – 22,4 м3.
. Используется также закон Авогадро, согласно которому один грамм-моль любого газа при нормальных условиях (Т = 273 К, Р = 760 мм рт. ст.) занимает одинаковый объём – 22,4 дм3. Соответственно один кг-моль – 22,4 м3.
Рассмотрим реакцию горения водорода в кислороде: 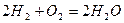 . Из уравнения следует, что при нормальных условиях для полного сгорания 2 × 22,4 = 44,8 м3 водорода требуется 22,4 м3 кислорода. Обычно для простоты и удобства расчеты ведут на один кубометр сжигаемого газа, т.е. для сгорания 1 м3 водорода требуется 0,5 м3 кислорода.
. Из уравнения следует, что при нормальных условиях для полного сгорания 2 × 22,4 = 44,8 м3 водорода требуется 22,4 м3 кислорода. Обычно для простоты и удобства расчеты ведут на один кубометр сжигаемого газа, т.е. для сгорания 1 м3 водорода требуется 0,5 м3 кислорода.
Рассмотрим реакцию горения метана в кислороде: 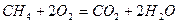 . Из уравнения следует, что для полного сгорания 22,4 м3 метана требуется 2 × 22,4 = 44,8 м3 кислорода. Следовательно, для сгорания 1 м3 метана необходимо 2 м3 кислорода.
. Из уравнения следует, что для полного сгорания 22,4 м3 метана требуется 2 × 22,4 = 44,8 м3 кислорода. Следовательно, для сгорания 1 м3 метана необходимо 2 м3 кислорода.
В практических условиях сжигание газа осуществляется в воздухе. Примем состав сухого воздуха: О2 – 21 %, N2 – 79%. Следовательно, 1 м3 кислорода содержится в 100/21 = 4,76 м3 воздуха. Или на 1 м3 кислорода приходится 3,76 м3 азота. Отсюда условная формула воздуха: (О2 3,76N2).
Запишем реакцию горения водорода в воздухе:
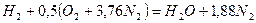 .
.
Из уравнения следует, что при нормальных условиях для полного сгорания 1 м3 водорода требуется 0,5 × 4,76 = 2,38 м3 воздуха. Таким образом, для сгорания 1 м3 водорода требуется 2,38 м3 воздуха. В результате образуются продукты сгорания: 1 м3 воды в виде пара и 1,88 м3 азота.
Запишем реакцию горения метана в воздухе:
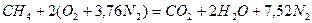 .
.
Из уравнения следует, что для полного сгорания 1 м3 метана необходимо 2 × 4,76 = 9,52 м3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м3 метана требуется 9,52 м3 сухого воздуха. Продукты сгорания содержат 1 м3 диоксида углерода, 2 м3 паров воды и 7,52 м3 азота.
Запишем реакцию горения пропана в воздухе:
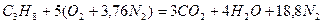 .
.
Из уравнения видно, что для полного сгорания 1 м3 пропана необходимо 5 × 4,76 = 23,8 м3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м3 пропана требуется 23,8 м3 сухого воздуха.
Приведенные расчеты выполнены для стехиометрических уравнений и полученные соотношения воздуха и газа называются стехиометрическими. Например, для горения метана в воздухе стехиометрическое соотношение – 9,52. В реальных условиях воздуха может не хватать для полного сгорания газа или, напротив, воздух подается в избыточном количестве. Для характеристики реальных соотношений воздуха и газа в процессе горения введена безразмерная величина: коэффициент избытка воздуха (окислителя) – коэффициент α. Для стехиометрического соотношения α = 1. Если имеет место недостаток воздуха, то α < 1, а при избытке воздуха α > 1. Например, в процессе горения израсходовано 23 м3 воздуха и 2 м3 метана. Подсчитываем коэффициент α. Реальное соотношение воздуха и газа 23/2 = 11,5. Отсюда α = 11,5/9,52 = 1,2.
Выше показано, как можно подсчитывать необходимое количество воздуха для сгорания и определять объем продуктов сгорания для индивидуальных газов. Но обычно используемый газ – смесь различных газов. В этом случае расчет теоретически необходимого объема воздуха (воздуха сухого) ведется по формуле:
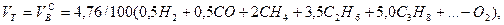 нм3/нм3, (10.4)
нм3/нм3, (10.4)
где 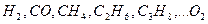 – соответственно объемное процентное содержание данных газов в исходной смеси.
– соответственно объемное процентное содержание данных газов в исходной смеси.
Используемый для сжигания атмосферный воздух содержит влагу, поэтому расчет объема влажного воздуха производят по формуле:
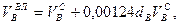 нм3/нм3, (10.5)
нм3/нм3, (10.5)
где 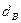 – влагосодержание воздуха, г/нм3;
– влагосодержание воздуха, г/нм3;
0,00124 – объем 1 г водяного пара.
И, наконец, определяется объем воздуха действительный с учетом величины коэффициента α по формуле:
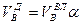 . (10.6)
. (10.6)
Пример. Имеется газ состава СН4 – 95%, С3Н8 – 5%. Определить объем воздуха действительного для сжигания данного газа при α = 1,1 и 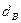 = 10 г/м3.
= 10 г/м3.
Производим расчеты:
 , нм3/нм3,
, нм3/нм3,
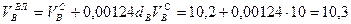 , нм3/нм3,
, нм3/нм3,
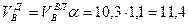 , нм3/нм3.
, нм3/нм3.
Объем продуктов сгорания газовой смеси определяется по следующим формулам.
Объем диоксида углерода
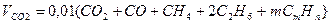 , нм3/нм3. (10.7)
, нм3/нм3. (10.7)
Объем водяных паров
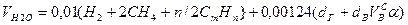 , нм3/нм3. (10.8)
, нм3/нм3. (10.8)
Объем азота
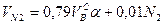 , нм3/нм3. (10.9)
, нм3/нм3. (10.9)
где N2 – процентное содержание азота в газовой смеси.
Объем кислорода
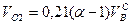 , нм3/нм3. (10.10)
, нм3/нм3. (10.10)
Суммарный объем продуктов сгорания
 , нм3/нм3. (10.11)
, нм3/нм3. (10.11)
§
Химические уравнения реакций горения газов, рассмотренные выше, не вскрывают механизм реакций, а являются лишь уравнениями итогового баланса. Процесс горения сложный физико-химический процесс, скорость которого определяется интенсивностью физических и химических явлений и особенностями их взаимодействия. Горение – многофакторный процесс, включающий химическую кинетику, термодинамику, тепломассоперенос, газо- и гидродинамику течений. Основной вклад в создании современных представлений о механизме реакций горения внесли академик Н.Н. Семёнов и его школа. За разработку теории цепных реакций Н.Н. Семёнову и английскому учёному С.Н. Хиншелвуду была присуждена Нобелевская премия.
Согласно теории цепных реакций горение протекает в виде разветвлённых и неразветвлённых цепей, состоящих из элементарных актов превращений. В цепной реакции участвуют радикалы, атомы и другие неустойчивые промежуточные соединения. Цепь начинается с активного центра, который в конце каждого звена регенерируется (восстанавливается). В качестве активных центров выступают радикалы. Радикал – атом, молекула или осколок молекулы, имеющие на внешней электронной оболочке неспаренные электрон или электроны (ненасыщенные валентности). Обозначение радикалов: водорода – Н, кислорода – О, гидроксил – ОН, метил – СН3, метилен – СН2, метин – СН, формин – НСО и т.д. Радикалы чрезвычайно химически активны и очень быстро вступают во взаимодействие.
Наиболее изученным является механизм горения водорода в кислороде. Зарождение цепи начинается с эндотермического процесса образования активных центров – радикалов водорода:
Н2 М = Н Н М.
Элемент М следует понимать как источник энергии активации. Это может быть открытое пламя, раскаленное тело, электрическая искра и т.п.
Звено превращений состоит из следующих элементарных актов:
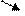 Н О2 → ОН Н2 → → Н
Н О2 → ОН Н2 → → Н
 Н2О
Н2О
 О Н2 → → → Н
О Н2 → → → Н
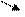 ОН Н2 → Н
ОН Н2 → Н
Н2О
Итогом единичного звена является реакция:
Н 3Н2 О2 = 2Н2О 3Н.
Радикал водорода приводит к образованию двух молекул воды и трех новых радикалов. Каждый из них может привести к развитию цепи превращений. Такая цепная реакция называется разветвленной. Однако в процессе горения могут быть как, благоприятные реакции (соударения), так и неблагоприятные. Например, Н Н = Н2 . Практика показывает, что число благоприятных реакций превышает число неблагоприятных. Поэтому воспламенение ГВС приводит к быстрому распространению горения на весь объем, что в итоге приводит к взрыву смеси.
Механизм горения метана представляет собой довольно сложную совокупность цепных реакций с образованием на отдельных стадиях стабильных и нестабильных промежуточных продуктов. Предполагаемый механизм цепного горения метана в кислороде при стехиометрическом соотношении следующий:
1. Н О2 → ОН О
СН4 ОН → СН3 Н2О
СН4 О → СН3 ОН→ СН2 Н2О
2. СН3 О2 → НСНО ОН
СН2 О2 → НСНО О
3. НСНО ОН → НСО Н2О
НСО О2 → СО О ОН
НСНО О → СО Н2О
4. СО О2 → СО2
СО ОН → СО2 Н
Итог звена реакции горения метана в кислороде:
Н 2СН4 4О2 = 2СО2 4Н2О Н.
Ещё более сложный механизм горения метана в воздухе, особенно при отклонении от стехиометрического соотношения.
§
Различают следующие температуры горения газов: калориметрическая, теоретическая и действительная.
Калориметрическая температура– это температура продуктов сгорания горючих газов в адиабатических условиях с действительным значением коэффициентом α с действительной температурой газа и воздуха. Калориметрическая температура может быть рассчитана по формуле:
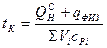 , (10.12)
, (10.12)
где  – низшая теплота сгорания газа;
– низшая теплота сгорания газа;
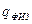 – теплосодержание воздуха и газа;
– теплосодержание воздуха и газа;
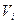 – объем i-го компонента продуктов сгорания газов;
– объем i-го компонента продуктов сгорания газов;
 – теплоемкость i-го компонента продуктов сгорания газов.
– теплоемкость i-го компонента продуктов сгорания газов.
Теплосодержание (энтальпия) воздуха и газа вычисляются по формуле:
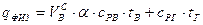 ,
,
где 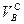 – объем воздуха сухого, необходимый для полного сжигания газа;
– объем воздуха сухого, необходимый для полного сжигания газа;
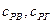 – теплоемкость воздуха и газа;
– теплоемкость воздуха и газа;
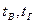 – температура воздуха и газа.
– температура воздуха и газа.
Знаменатель формулы 10.12 в развернутом виде
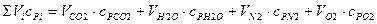 .
.
Теплоемкость продуктов сгорания величина не постоянная и увеличивается с повышением температуры, поэтому калориметрическая температура рассчитывается методом итераций (последовательных приближений). Примерные значения калориметрической температуры некоторых газов при сжигании в сухом воздухе при нормальных условиях и коэффициенте α = 1 приведены в таблице 10.2.
Таблица 10.2. Калориметрическая температура горения газов
| Наименование газа | Температура, °С |
| Водород | |
| Метан | |
| Пропан | |
| Ацетилен | |
| Природный газ | |
| Доменный газ | |
| Сжиженный газ |
С увеличением влажности воздуха температура снижается на 25 – 20 градусов на каждый весовой процент влаги. К снижению температуры приводит уменьшение и увеличение коэффициент α относительно α = 1.
Теоретическая температура– это температура продуктов сгорания горючих газов в адиабатических условиях с действительным значением коэффициентом α с действительной температурой газа и воздуха с учетом химической неполноты сгорания и реакций диссоциации. Реакции диссоциации – распад молекул продуктов сгорания под воздействием высокой температуры. Например:
Н2О ↔ Н2 0,5О2 – 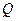 ;
;
СО2 ↔ СО 0,5О2 – 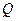 .
.
При протекании реакций диссоциации теплота поглощается и в результате температура горения снижается. Теоретическая температура рассчитывается по формуле:
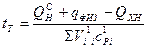 , (10.13)
, (10.13)
где 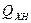 – химическая неполнота сгорания, включая потери теплоты на
– химическая неполнота сгорания, включая потери теплоты на
диссоциацию продуктов сгорания;
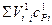 – сумма произведений объемов и средних теплоемкостей с учетом диссоциации на 1 м3 газа.
– сумма произведений объемов и средних теплоемкостей с учетом диссоциации на 1 м3 газа.
Степень диссоциации определяется по константам диссоциации для каждой реакции. До температуры 1500°С диссоциацию можно не учитывать.
Действительная температура– это температура продуктов сгорания горючих газов в действительных условиях с действительным значением коэффициентом α с действительной температурой газа и воздуха с учетом химической неполноты сгорания и реакций диссоциации. Действительные условия отличаются от адиабатических условий, т.к. всегда есть потери теплоты в окружающую среду.
Действительная температура находится по формуле:
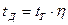 , (10.14)
, (10.14)
где 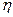 – пирометрический коэффициент.
– пирометрический коэффициент.
Величина пирометрического коэффициента зависит от печей и их тепловой изоляции. Принимается в пределах от 0,5 до 0,85.
§
Процесс возбуждения горения называется воспламенением. Под температурой воспламенения (самовоспламенения) понимается минимальная температура, до которой должна быть нагрета газовоздушная смесь, чтобы начался самопроизвольный процесс горения не требующий больше внешнего подводы теплоты. Тепловое воспламенение носит цепной характер и может заканчиваться взрывом. Температура воспламенения определяется экспериментально. Величина температуры воспламенения зависит от природы газа, от содержания газа в газовоздушной смеси, от давления и других факторов. Температура воспламенения горючих газов в смеси с кислородом всегда меньше, чем в смеси с воздухом. Введение в смесь негорючих (балластных) газов (N2, CO2 и т.п.) приводит к повышению температуры воспламенения. Минимальные значения температуры воспламенения газовоздушных смесей приведены в таблице 1.3.
Таблица 10.3. Минимальная температура воспламенения газовоздушных смесей
| Газ | Температура воспламенения, °С | Газ | Температура воспламенения, °С |
| Водород | Бутан | ||
| Метан | Оксид углерода | ||
| Пропан | Природный газ |
В действительности воспламенение газовоздушной смеси производится зажиганием (вынужденное зажигание). Зажигание или поджигание характеризуется тем, что холодная газовоздушная смесь воспламеняется в одном месте (пламенем спички, раскаленным телом, искрой) и возникшее пламя распространяется по всему объему газовоздушной смеси. Таким образом, зажигание смеси отличается от теплового воспламенения тем, что смесь доводится до температуры воспламенения не во всем объеме одновременно, а только в малой части объема, откуда горение распространяется на весь объем холодной смеси.