- Почему некоторые газы называют благородными.
- — благородные газы — химическая энциклопедия
- Активные
- Благородные (инертные) газы, подготовка к егэ по химии
- Газовые смеси
- Инертные
- Инертные газы
- Историческая справка
- Получение
- Применение
- Примечания
- Распространённость в природе.
- Свойства
- Соединения
- Физические свойства
- Химические свойства
Почему некоторые газы называют благородными.
— благородные газы — химическая энциклопедия
БЛАГОРОДНЫЕ ГАЗЫ (инертные газы, редкие газы), хим. элементы
VIII гр. периодич. системы: гелий (Не), неон (Ne), аргон
(Аr),
криптон (Кr), ксенон (Хе), радон (Rn). В природе образуются
в результате разл. ядерных процессов. Воздух содержит 5,24*10-4%
по объему Не, 1,82*10-3% Ne, 0,934% Аr, 1,14-10-4%
Кг, 8,6*10-6% Хе, 6*10-20% Rn. Космос более богат
благородными газами, чем атмосфера Земли. Благородные газы содержатся также в прир. газах и нек-рых
минералах.
Атомы благородных газов имеют полностью заполненные внеш. электронные оболочки (s2
для Не и s2p6 для всех остальных), что обусловливает
их низкую реакционную способность. Благородные газы — одноатомные газы без цвета и
запаха (нек-рые их характеристики приведены в таблице; см. также статьи
об отдельных представителях). Они относительно трудно сжижаются, но тем
легче, чем больше их атомная масса. Кристаллизуются в кубич. гранецентрированной
решетке; пространств, группа Рт3т. Значения Сp° не зависят
от т-ры до 6000 К и выше. Благородные газы адсорбируются на активном угле и цеолитах
при низких т-рах; энтальпияадсорбции на угле (кДж/моль): Ne 4,72 (91 К),
Аr 16,43 (168 К), Кr 22,24 (223 К), Хе 36,53 (248 К), Не 2,26 (ниже 50
К). Это св-во используется для разделения благородных газов и их очистки. Благородные газы-хорошие
диэлектрики (р 1018*1020 Ом*см). Они диамагнитны.
Степень сжимаемости для Не и Ne больше 1, для Аr, Кr, Хе — меньше 1 (273
К; 0,1-30 МПа). Относительно хорошо раств. в воде (р-римость быстро возрастает
от Не к Rn), лучше-во многих орг. р-рителях (бензин, толуол, спирт, бензол
и др.). Жидкий Не — единств. в-во, затвердевающее только под давлением
выше 2,5 МПа. Он обладает уникальным свойством — образует квантовую жидкость,
т.е. жидкость, в которой в макроскопическом объеме проявляются квантовые
свойства составляющих ее атомов.
Благородные газы (кроме Не) образуют неустойчивые соед. включения (клатраты) с
водой и орг. р-рителями. Степень заполнения атомами благородных газов полостей кристаллич.
решеток соответствующих соединений определяет состав образующегося клатрата,
напр. Аr*4У, Кr*5,6У, Хе*3У (У = С6Н5ОН). Получены
гидраты типа Х*5,75Н2О, У*2Х*17Н2О, где Х — атом
благородного газа (кроме Не), У-СН3СОСН3, СНС13, СН3СООН,
СС14 и др. С фенолом и гидрохиноном выше 313 К образуются клатраты,
близкие по составу к Х*3У [X = Аr, Кr, Хе; У = = С6Н4(ОН)2].
Разработан метод получения клатратов при невысоких давленияхгаза — изоморфное
соосаждение благородных газов с его аналогами в кристаллохим. отношении — H2S,
НВr, СО2, НС1, SO2, CH4. Таким путем получены
Х*6Н2О (X = Ne, Ar, Rn), X*2С6Н5СН3
(X = Хе, Rn), Rn -3C1C6H4OH и др. Различная способность
благородных газов к образованию клатратов м.б. использована для их разделения и выделения
из смесей.
ХАРАКТЕРИСТИКА БЛАГОРОДНЫХ ГАЗОВ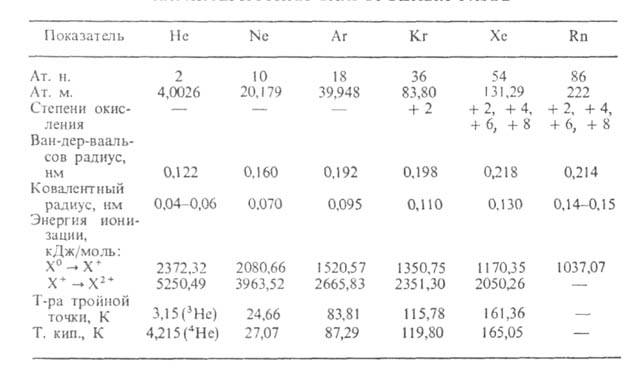
К соед. включения относятся также т. наз. криптонаты, образующиеся при
бомбардировке ряда твердых в-в (металлов, стекол, каучуков, пластиков,
белков и др.) ионизованными атомами благородных газов при высоких т-pax и давлениях;
атомы благородных газов диффундируют в твердое в-во на глубину 102-103
нм.
Способность благородных газов к образованию хим. соед. понижается от Хе к Аг (самым
активным должен быть Rn, однако из-за высокой радиоактивности его св-ва
изучены мало; известны лишь фториды). наиб. число соед. получено для Хе
(фториды, хлориды, оксиды, оксофториды, фосфаты, перхлораты, фторсульфонаты,
ксенаты, перксенаты и др.) В присут. катализаторов (к-т Льюиса) Хе энергично
взаимод. уже при нормальных условиях с F2. Криптон реагирует
только с элементарным фтором при низких т-рах. Различная реакционная способность
благородных газов по отношению к F2 и нек-рым фторсодержащим окислителям
м. б. использована для их разделения, утилизации радиоактивных изотопов
и очистки. Напр., Хе с SbO2F6 взаимод. с образованием
твердого нелетучего соед. XeF2*2SbF5, а Кr такого
в-ва не образует. Аналогичную р-цию с Rn предложено использовать для очистки
атмосферы урановых рудников. Газы Rn и Хе окисляются также с помощью К2
[NiF6], Cs2 [CoF6], К3 [CuF6]
и др. Для улавливания радиоактивных изотопов благородных газов, в основном
133Хе
и 85Кr — продуктов деления U в ядерных реакторах, наряду с наиб.
эффективными методами криогенной дистилляции и адсорбции на активном угле
перспективны также избирательное поглощение хладонами, диффузионные методы,
образование клатратов и других химических соединений.
Благородные газы образуют эксимеры под действием пучка электронов, УФ-излучения
или электрич. разряда на их смеси с галогенами, О2, фторсодержащими
соед. Молекулыэксимеров существуют только в электронно-возбужденном состоянии.
Переход из возбужденного состояния в несвязанное сопровождается когерентным
излучением в широкой области спектра (100-600 нм), что используется для
генерации лазерного излучения. Лазерное действие получено для KrF* (248
нм), Kr2F* (420 нм), ХеС1* (308 нм), KrCl* (222 нм) и др.
Благородные газы (кроме Не) получают как побочные продукты при произ-ве N2
и О2 из воздуха. Гелий выделяют из подземных гелионосных газов.
Используют благородные газы в кач-ве инертной среды в металлургии, атомной и ракетной
технике, в произ-ве полупроводниковых материалов и др., как наполнитель
в электронике, электротехнике и др., рабочее в-во в лазерной технике.
При повышенных давлениях благородные газы оказывают вредное действие на нервную
систему (усиливающееся с увеличением атомной массы элемента), к-рое быстро
проходит при вдыхании чистого воздуха.
===
Исп. литература для статьи «БЛАГОРОДНЫЕ ГАЗЫ»: Фастовский В. Г., Ровинский А. Е., Петровски и Ю. В., Инертные
газы, 2 изд., М., 1972; Нейдинг А. Б., Соколов В. Б., «Успехи химии«, 1974,
т. 43, № 12, с. 2146-94; Легасов В. А., «Вестник АН СССР», 1976, в. 12,
с. 3-16; Елецкий А. В., «Успехи физических наук», 1978, т. 125, в. 2, с.
279-314; Смирнов Б. М., «Успехи физических наук», 1983, т. 139, а 1, с.
53-81; Bartlett N., Sladky F. О., The chemistry of krypton, xenon and radon,
в кн.: Comprehensive inorganic chemistry, v. 1, Oxf.-[a.o.], 1973. В.Б.
Соколов.
Страница «БЛАГОРОДНЫЕ ГАЗЫ» подготовлена по материалам химической энциклопедии.
Активные
Защищают зону сварки от воздуха, но сами растворяются в жидком металле либо вступают с ним в химическое взаимодействие
Кислород (О2) — газ без цвета, запаха и вкуса. Негорючий, но активно поддерживающий горение. Технический газообразный кислород (ГОСТ5583-78) выпускается трех сортов: 1-й сорт — 99,7% кислорода; 2-й — 99,5%; 3-й — 99,2%. Применяется только как добавка к инертным и активным газам.
Углекислый газ (СО2) — бесцветный, со слабым запахом, с резко выраженными окислительными свойствами, хорошо растворяется в воде. Тяжелее воздуха в 1,5 раза, может скапливаться в плохо проветриваемых помещениях, в колодцах, приямках.
Выпускается (ГОСТ 8050-85) трех сортов: высший-99,8% СО2, 1-й-99,5% и 2-й-98,8%. Двуокись углерода 2-го сорта применять не рекомендуется. Для снижения влажности СО2 рекомендуется установить баллон вентилем вниз и через 1-2 ч открыть вентиль на 8-10 с для удаления воды.
В углекислом газе сваривают чугун, низко- и среднеуглеродистые, низколегированные конструкционные коррозионностойкие стали.
Благородные (инертные) газы, подготовка к егэ по химии
К благородным (инертным) газам относятся элементы VIIIa группы: гелий, неон, аргон, криптон, ксенон.
На их внешнем энергетическом уровне содержится 8 электронов.
Они бесцветны, не имеют запаха, вкуса и обладают низкой химической активностью — инертны. Используются в лампочках для
того, чтобы препятствовать окислению вольфрамовой нити.
При прохождении электрического тока гелий светится ярко-желтым, неон — огненно-красным, аргон — сине-голубым,
криптон — синевато-белым, ксенон — белым цветом.
Аргон составляет 1% воздуха. Гелий является самым распространенным элементом в космосе после водорода.
В чистом виде инертные газы получают методом сжижения воздуха.
Сами по себе инертные газы не ядовиты, однако их утечка способна приводить к потере сознания.
Газовые смеси
Сварочные смеси служат для улучшения процесса сварки и качества сварного шва
Смесь аргона и гелия. Оптимальный состав: 50% 50% или 40% аргона и 60% гелия. Пригоден для сварки алюминиевых и титановых сплавов.
Смесь аргона и кислорода при содержании кислорода 1-5% стабилизирует процесс сварки, увеличивает жидко текучесть сварочной ванны, перенос электродного металла становится мелкокапельным. Смесь рекомендуется для сварки углеродистых и нержавеющих сталей.
Смесь аргона и углекислого газа. Рациональное соотношение — 75-80% аргона и 20-25% углекислого газа. При этом обеспечиваются минимальное разбрызгивание, качественное формирование шва, увеличение производительности, хорошие свойства сварного соединения. Используется при сварке низкоуглеродистых и низколегированных конструкционных сталей.
Смесь углекислого газа и кислорода. Оптимальный состав: 60-80% углекислого газа и 20-40% кислорода. Повышает окислительные свойства защитной среды и температуру жидкого металла. При этой смеси используют электродные проволоки с повышенным содержанием раскислителей, например Св-08Г2СЦ.
Смесь аргона, углекислого газа и кислорода — трехкомпонентная смесь обеспечивает высокую стабильность процесса и позволяет избежать пористости швов. Оптимальный состав: 75% аргона, 20% углекислого газа и 5% кислорода. Применяется при сварке углеродистых, нержавеющих и высоколегированных конструкционных сталей.
Инертные
Не вступают в химическое взаимодействие с металлами и практически не растворяются в металлах
Аргон (Ar) — бесцветный, без запаха, негорючий, неядовитый газ, почти в 1,5 раза тяжелее воздуха. В металлах нерастворим как в жидком, так и в твердом состояниях. Выпускается (ГОСТ 10157-79) двух сортов: высшего и первого.
В газе высшего сорта содержится 99,993 % аргона, не более 0,006 % азота и не более 0,0007 % кислорода. Рекомендуется для сварки ответственных металлоконструкций из активных и редких металлов и сплавов, цветных металлов.
В газе первого сорта содержится 99,98 % аргона, до 0,01 % азота и не более 0,002 % кислорода. Рекомендуется для сварки стали и чистого алюминия.
Гелий (Не) — бесцветный газ, без запаха, неядовитый, значительно легче воздуха и аргона. Выпускается (ГОСТ 20461-75) двух сортов: высокой чистоты (до 99,985 %) и технический (99,8%).
Используется реже, чем аргон, из-за его дефицитности и высокой стоимости. Однако при одном и том же значении тока дуга в гелии выделяет в 1,5 — 2 раза больше энергии, чем в аргоне. Это способствует более глубокому проплавлению металла и значительному увеличению скорости сварки.
Гелий применяют при сварке химически чистых и активных материалов, а также сплавов на основе алюминия и магния.
Азот (N2) — газ без цвета, запаха п вкуса, неядовитый. Используется только для сварки меди и ее сплавов, по отношению к которым азот является инертным газом. Выпускается (ГОСТ 9293-74) четырех сортов: высшего — 99,9% азота; 1-го — 99,5%; 2-го — 99,0%; 3-го — 97,0%.
Инертные газы
Эти газы объединяет низкая реакционная активность. Под словом инертность как раз и понимается малоактивность. Поэтому об их существовании долгое время даже не догадывались. Определить их с помощью реакций нельзя. Обнаружили их в воздухе (отсюда и название аэрогены), удалив из него кислород и прочие «побочные газы», чтобы получить азот, и экспериментально установили, что полученный таким образом азот имеет примеси. Примесями этими и оказались инертные газы.
Чтобы понять, с чем связана низкая реакционная активность этих газов нужно построить их электронные диаграммы:
Мы можем видеть, что нет неспаренных электронов, орбитали заполнены. Это очень выгодное состояние электронной оболочки. Поэтому и все остальные элементы, образуя соединения, стремятся приобрести электронную конфигурацию благородных газов (вспомните правило октета), потому что она энергетически выгодная, а атомы, как и люди, выгоду любят.
Из-за малоактивности атомы благородных газов даже не соединяются в двухатомные молекулы (как это делают остальные газы: O2, Cl2, N2 и т.д.).
Благородные газы существуют в виде одноатомных молекул.
Говорить, что благородные газы абсолютно инертны нельзя. У некоторых аэрогенов есть свободные орбитали в пределах одного энергетического уровня, а это значит, что возможен процесс возбуждения электронов. В настоящее время в чрезвычайно экстремальных условиях получены некоторые соединения этих «ленивых» с точки зрения химической активности элементов. Но в школьной программе, а тем более в ЕГЭ, это не рассматривается.
Физические свойства
- гелий и неон легче воздуха, остальные благородные газы, которые находятся ниже – тяжелее, что обусловлено возрастанием атомной массы.
- из-за химической инертности, вкусовые и обонятельные рецепторы не могут обнаружить присутствие благородных газов в воздухе, поэтому они не имеют ни вкуса, ни запаха.
Практическая значимость благородных газов.
Гелий – всем хорошо известный газ, для заполнения воздушных шариков, который делает голос смешным. Гелием заполняют дирижабли (этот газ, в отличие от водорода, не взрывоопасен).
Благородные газы используют для создания инертной (химически не активной) атмосферы. Некоторые аэрогены входят в состав дыхательных смесей, разбавляя собой кислород (кислород – сильный окислитель и дышать им в чистом виде нельзя).
При пропускании через благородные газы разряда тока, они имеют свойство ярко светиться. Что обеспечивает аэрогенам применение для осветительной аппаратуры. Выглядит довольно зрелищно.
Историческая справка
К. получили в 1774 независимо К. Шееле (путём прокаливания нитратов калия KNO3 и натрия NaNO3, диоксида марганца MnO2 и др. веществ) и Дж. Пристли (при нагревании тетраоксида свинца Pb3О4 и оксида ртути HgО). Позднее, когда было установлено, что К. входит в состав кислот, А. Лавуазье предложил назв. oxygène (от греч. ὀχύς – кислый и γεννάω – рождаю, отсюда и рус. назв. «К.»).
Получение
В пром. масштабах К. производят путём сжижения и фракционной перегонки воздуха (см. в ст. Воздуха разделение), а также электролизом воды. В лабораторных условиях К. получают разложением при нагревании пероксида водорода (2Н2О2= 2Н2О О2), оксидов металлов (напр., оксида ртути: 2HgO=2Hg O2), солей кислородсодержащих кислот-окислителей (напр., хлората калия: 2KClO3=2KCl 3O2, перманганата калия: 2KMnO4=K2MnO4 MnO2 O2), электролизом водного раствора NaOH. Газообразный К. хранят и транспортируют в стальных баллонах, окрашенных в голубой цвет, при давлении 15 и 42 МПа, жидкий К. – в металлич. сосудах Дьюара или в спец. цистернах-танках.
Применение
Лёгкие инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. Жидкий гелий, который кипит при 4,2 К(−268,95 °C), используется для получения сверхпроводимости — в частности, для охлаждения сверхпроводящих обмоток электромагнитов, применяемых, например, для магнитно-резонансной томографии и других приложений ядерного магнитного резонанса.
Жидкий неон, хотя его температура кипения (–246,03 °C) и не достигает таких низких значений как у жидкого гелия, также находит применение в криогенике, потому что его охлаждающие свойства (удельная теплота испарения) более чем в 40 раз лучше, чем у жидкого гелия, и более чем в три раза лучше, чем у жидкого водорода.
Гелий, благодаря его пониженной растворимости в жидкостях, особенно в липидах, используется вместо азота как компонент дыхательных смесей для дыхания под давлением (например, при подводном плавании). Растворимость газов в крови и биологических тканях растёт под давлением.
Благодаря меньшей растворимости в липидах, атомы гелия задерживаются клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине.
Кроме того, пониженная растворимость гелия в жидкостях тела позволяет избежать кессонной болезни при быстром всплытии с глубины. Уменьшение остатка растворённого газа в теле означает, что во время всплытия образуется меньшее количество газовых пузырьков; это уменьшает риск газовой эмболии.
Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму[10][неавторитетный источник?] для подводного плавания.
Аргон, наиболее дешёвый среди инертных газов (его содержание в атмосфере составляет около 1 %), широко используется при сварке в защитных газах, резке и других приложениях для изоляции от воздуха металлов, реагирующих при нагреве с кислородом (и азотом), а также для обработки жидкой стали.
После крушения дирижабля«Гинденбург» в 1937 году огнеопасный водород был заменен негорючим гелием в качестве заполняющего газа в дирижаблях и воздушных шарах, несмотря на снижение плавучести на 8,6 % по сравнению с водородом.
Несмотря на замену, катастрофа оказала непропорционально большое влияние на всю область герметичных летательных аппаратов легче воздуха и подорвала планы по расширению этой области авиации более чем на полвека. Они стали популярнее только в последнее время, с развитием нановолоконных тканей и альтернативной энергетики.
Примечания
- ↑Atomic weights of the elements 2022 (IUPAC Technical Report) (англ.) — IUPAC, 1960. — ISSN 0033-4545; 1365-3075; 0074-3925 — doi:10.1515/PAC-2022-0305
- ↑Инертные газы // Казахстан. Национальная энциклопедия (рус.). — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2. (CC BY-SA 3.0)
- ↑[www.xumuk.ru/encyklopedia/588.html Благородные газы] — статья из Химической энциклопедии
- ↑Flerov laboratory of nuclear reactions (неопр.). JINR. Дата обращения: 8 августа 2009.Архивировано 6 октября 2022 года.
- ↑Nash, Clinton S. Atomic and Molecular Properties of Elements 112, 114, and 118 (англ.) // J. Phys. Chem. A : journal. — 2005. — Vol. 109, no. 15. — P. 3493—3500. — doi:10.1021/jp050736o. — PMID 16833687.
- ↑Wieser M. E. Atomic weights of the elements 2005 (IUPAC Technical Report) (англ.) // Pure Appl. Chem. : journal. — 2006. — Vol. 78, no. 11. — P. 2051—2066. — doi:10.1351/pac200678112051.
- ↑Опасности при работе с азотом и аргоном (неопр.). Дата обращения: 31 марта 2022.Архивировано 16 октября 2022 года.
- ↑Инструкция по эксплуатации баллонов с аргоном, используемых в спектральной лаборатории (неопр.) (недоступная ссылка). Дата обращения: 31 марта 2022.Архивировано 25 июля 2022 года.
- ↑Павлов Б. Н.Проблема защиты человека в экстремальных условиях гипербарической среды обитания (рус.). www.argonavt.com (15 мая 2007). Дата обращения: 22 мая 2022.Архивировано 22 августа 2022 года.
- ↑en:Dry_suit (англ.)
Распространённость в природе.
К. – самый распространённый химич. элемент на Земле: содержание химически связанного К. в гидросфере составляет 85,82% (гл. обр. в виде воды), в земной коре – 49% по массе. Известно более 1400 минералов, в состав которых входит К. Среди них преобладают минералы, образованные солями кислородсодержащих кислот (важнейшие классы – карбонаты природные, силикаты природные, сульфаты природные, фосфаты природные), и горные породы на их основе (напр., известняк, мрамор), а также разл. оксиды природные, гидроксиды природные и горные породы (напр., базальт). Молекулярный К. составляет 20,95% по объёму (23,10% по массе) земной атмосферы. К. атмосферы имеет биологич. происхождение и образуется в зелёных растениях, содержащих хлорофилл, из воды и диоксида углерода при фотосинтезе. Количество К., выделяемое растениями, компенсирует количество К., расходуемое в процессах гниения, горения, дыхания. К. – биогенный элемент – входит в состав важнейших классов природных органич. соединений (белков, жиров, нуклеиновых кислот, углеводов и др.) и в состав неорганич. соединений скелета.
Свойства
Строение внешней электронной оболочки атома К. 2s22p4; в соединениях проявляет степени окисления –2, –1, редко 1, 2; электроотрицательность по Полингу 3,44 (наиболее электроотрицательный элемент после фтора); атомный радиус 60 пм; радиус иона О2– 121 пм (координац. число 2). В газообразном, жидком и твёрдом состояниях К. существует в виде двухатомных молекул О2. Молекулы О2 парамагнитны. Существует также аллотропная модификация К. – озон, состоящая из трёхатомных молекул О3.
В осн. состоянии атом К. имеет чётное число валентных электронов, два из которых не спарены. Поэтому К., не имеющий низкой по энергии вакантной d-орбитали, в большинстве химич. соединений двухвалентен. В зависимости от характера химич. связи и типа кристаллич. структуры соединения координац. число К. может быть разным: 0 (атомарный К.), 1 (напр., О2, СО2), 2 (напр., Н2О, Н2О2), 3 (напр., Н3О ), 4 (напр., оксоацетаты Ве и Zn), 6 (напр., MgO, CdO), 8 (напр., Na2O, Cs2O). За счёт небольшого радиуса атома К. способен образовывать прочные π-связи с др. атомами, напр. с атомами К. (О2, О3), углерода, азота, серы, фосфора. Поэтому для К. одна двойная связь (494 кДж/моль) энергетически более выгодна, чем две простые (146 кДж/моль).
Парамагнетизм молекул О2 объясняется наличием двух неспаренных электронов с параллельными спинами на дважды вырожденных разрыхляющих π*-орбиталях. Поскольку на связывающих орбиталях молекулы находится на четыре электрона больше, чем на разрыхляющих, порядок связи в О2 равен 2, т. е. связь между атомами К. двойная. Если при фотохимич. или химич. воздействии на одной π*-орбитали оказываются два электрона с противоположными спинами, возникает первое возбуждённое состояние, по энергии расположенное на 92 кДж/моль выше основного. Если при возбуждении атома К. два электрона занимают две разные π*-орбитали и имеют противоположные спины, возникает второе возбуждённое состояние, энергия которого на 155 кДж/моль больше, чем основного. Возбуждение сопровождается увеличением межатомных расстояний О–О: от 120,74 пм в осн. состоянии до 121,55 пм для первого и до 122,77 пм для второго возбуждённого состояния, что, в свою очередь, приводит к ослаблению связи О–О и к усилению химич. активности К. Оба возбуждённых состояния молекулы О2 играют важную роль в реакциях окисления в газовой фазе.
К. – газ без цвета, запаха и вкуса; tпл –218,3 °C, tкип –182,9 °C, плотность газообразного К. 1428,97 кг/дм3 (при 0 °C и нормальном давлении). Жидкий К. – бледно-голубая жидкость, твёрдый К. – синее кристаллич. вещество. При 0 °C теплопроводность 24,65·10—3 Вт/(м·К), молярная теплоёмкость при постоянном давлении 29,27 Дж/(моль·К), диэлектрич. проницаемость газообразного К. 1,000547, жидкого 1,491. К. плохо растворим в воде (3,1% К. по объёму при 20 °C), хорошо растворим в некоторых фторорганич. растворителях, напр. перфтордекалине (4500% К. по объёму при 0 °C). Значит. количество К. растворяют благородные металлы: серебро, золото и платина. Растворимость газа в расплавленном серебре (2200% по объёму при 962 °C) резко понижается с уменьшением темп-ры, поэтому при охлаждении на воздухе расплав серебра «закипает» и разбрызгивается вследствие интенсивного выделения растворённого кислорода.
К. обладает высокой реакционной способностью, сильный окислитель: взаимодействует с большинством простых веществ при нормальных условиях, в осн. с образованием соответствующих оксидов (мн. реакции, протекающие медленно при комнатной и более низких темп-рах, при нагревании сопровождаются взрывом и выделением большого количества теплоты). К. взаимодействует при нормальных условиях с водородом (образуется вода Н2О; смеси К. с водородом взрывоопасны – см. Гремучий газ), при нагревании – с серой (серы диоксид SO2 и серы триоксид SO3), углеродом (углерода оксид СО, углерода диоксид СО2), фосфором (фосфора оксиды), мн. металлами (оксиды металлов), особенно легко со щелочными и щёлочноземельными (в осн. пероксиды и надпероксиды металлов, напр. пероксид бария BaO2, надпероксид калия KO2). С азотом К. взаимодействует при темп-ре выше 1200 °C или при воздействии электрич. разряда (образуется монооксид азота NO). Соединения К. с ксеноном, криптоном, галогенами, золотом и платиной получают косвенным путём. К. не образует химич. соединений с гелием, неоном и аргоном. Жидкий К. также является сильным окислителем: пропитанная им вата при поджигании мгновенно сгорает, некоторые летучие органич. вещества способны самовоспламеняться, когда находятся на расстоянии нескольких метров от открытого сосуда с жидким кислородом.
К. образует три ионные формы, каждая из которых определяет свойства отд. класса химич. соединений: $ce{O2^-}$– супероксидов (формальная степень окисления атома К. –0,5), $ce{O2^2^-}$ – пероксидных соединений (степень окисления атома К. –1, напр. водорода пероксид Н2О2), О2– – оксидов (степень окисления атома К. –2). Положительные степени окисления 1 и 2 К. проявляет во фторидах O2F2 и ОF2 соответственно. Фториды К. неустойчивы, являются сильными окислителями и фторирующими реагентами.
Молекулярный К. является слабым лигандом и присоединяется к некоторым комплексам Fe, Co, Mn, Cu. Среди таких комплексов наиболее важен железопорфирин, входящий в состав гемоглобина – белка, который осуществляет перенос К. в организме теплокровных.
Соединения
Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором).
Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления ( 1, 2, 4, 6, 8).
Оганесон, несмотря на его принадлежность к 18-й группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов, влияющих на движение электронов вблизи его ядра с высоким зарядом, он будет находиться в твёрдом состоянии[6].
Физические свойства
Инертные газы бесцветны, прозрачны и не имеют запаха и вкуса. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов и планет земной группы.
Гелий является вторым (после водорода) по распространённости элементом во Вселенной, однако для Земли он является редким газом, который улетучился в космос во время образования планеты. Почти весь добываемый гелий является радиогенным продуктом происходящего в течение миллиардов лет в недрах Земли альфа-распада урана, тория и их дочерних элементов; лишь малая часть земного гелия сохранилась от эпохи образования Солнечной системы.
При нормальных условиях все элементы 18-й группы (кроме, возможно, оганесона) являются одноатомными газами. Их плотность растёт с увеличением номера периода. Плотность гелия при нормальных условиях примерно в 7 раз меньше плотности воздуха, тогда как радон почти в восемь раз тяжелее воздуха.
При нормальном давлении температуры плавления и кипения у любого благородного газа отличаются менее чем на 10 °C; таким образом, они остаются жидкими лишь в малом температурном интервале. Температуры сжижения и кристаллизации растут с ростом номера периода. Гелий под атмосферным давлением вообще не становится твёрдым даже при абсолютном нуле — единственный из всех веществ.
Химические свойства
Благородные газы не поддерживают горения и не возгораются при нормальных условиях.
| № | Элемент | № электронов/электронной оболочки |
|---|---|---|
| 2 | гелий | 2 |
| 10 | неон | 2, 8 |
| 18 | аргон | 2, 8, 8 |
| 36 | криптон | 2, 8, 18, 8 |
| 54 | ксенон | 2, 8, 18, 18, 8 |
| 86 | радон | 2, 8, 18, 32, 18, 8 |
| 118 | оганесон | 2, 8, 18, 32, 32, 18, 8 |

