— сера — большая советская энциклопедия
Сера (лат. Sulfur) S, химический элемент VI группы периодической системы Менделеева; атомный номер 16, атомная масса 32,06. Природная сера состоит из четырёх стабильных изотопов: 32S (95,02%), 33S (0,75%), 34S (4,21%), 36S (0,02%). Получены также искусственные радиоактивные изотопы31S (T1/2 = 2,4 сек), 35S (T1/2 = 87,1 cym), 37S (T1/2 = 5,04 мин).
Историческая справка. Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. Она упоминается в Библии, поэмах Гомера и др. Сера входила в состав «священных» курений при религиозных обрядах; считалось, что запах горящей серы отгоняет злых духов. Сера давно стала необходимым компонентом зажигательных смесей для военных целей, например «греческого огня» (10 в. н. э.). Около 8 в. в Китае стали использовать серу в пиротехнических целях. Издавна серой и её соединениями лечили кожные заболевания. В период арабской алхимии возникла гипотеза, согласно которой серу (начало горючести) и ртуть (начало металличности) считали составными частями всех металлов. Элементарную природу серы установил А. Л. Лавуазье и включил её в список неметаллических простых тел (1789). В 1822 Э. Мичерлих обнаружил аллотропию серы.
Распространение в природе. Сера относится к весьма распространённым химическим элементам (кларк 4,7·10-2); встречается в свободном состоянии (сера самородная) и в виде соединений — сульфидов, полисульфидов, сульфатов (см. Сульфиды природные, Сульфаты природные, Сульфидные руды). Вода морей и океанов содержит сульфаты натрия, магния, кальция. Известно более 200 минераловсеры, образующихся при эндогенных процессах. В биосфере образуется свыше 150 минераловсеры (преимущественно сульфатов); широко распространены процессы окислениясульфидов до сульфатов, которые в свою очередь восстанавливаются до вторичного H2S и сульфидов. Эти реакции происходят при участии микроорганизмов. Многие процессы биосферы приводят к концентрациисеры — она накапливается в гумусе почв, углях, нефти, морях и океанах (8,9·10-2%), подземных водах, в озёрах и солончаках. В глинах и сланцахсеры в 6 раз больше, чем в земной коре в целом, в гипсе — в 200 раз, в подземных сульфатных водах — в десятки раз. В биосфере происходит круговорот серы: она приносится на материки с атмосферными осадками и возвращается в океан со стоком. Источником серы в геологическом прошлом Земли служили главным образом продукты извержения вулканов, содержащие SO2 и H2S. Хозяйственная деятельность человека ускорила миграцию серы; интенсифицировалось окислениесульфидов.
Физические и химические свойства. Сера — твёрдое кристаллическое вещество, устойчивое в виде двух аллотропических модификаций. Ромбическая a-S лимонно-жёлтого цвета, плотность 2,07 г/см3, tпл 112,8 °С, устойчива ниже 95,6°С; моноклинная b-S медово-жёлтого цвета, плотность 1,96 г/см3, tпл 119,3 °С, устойчива между 95,6 °С и температуройплавления. Обе эти формы образованы восьмичленными циклическими молекулами S8 с энергией связи S — S 225,7 кдж/моль.
При плавлениисера превращается в подвижную жёлтую жидкость, которая выше 160 °С буреет, а около 190 °С становится вязкой тёмно-коричневой массой. Выше 190°С вязкость уменьшается, а при 300 °С сера вновь становится жидкотекучей. Это обусловлено изменением строения молекул: при 160 °С кольца S8 начинают разрываться, переходя в открытые цепи; дальнейшее нагревание выше 190 °С уменьшает среднюю длину таких цепей.
Если расплавленную серу, нагретую до 250—300 °С, влить тонкой струей в холодную воду, то получается коричнево-жёлтая упругая масса (пластическая сера). Она лишь частично растворяется в сероуглероде, в осадке остаётся рыхлый порошок. Растворимая в CS2 модификация называется l-S, а нерастворимая — m-S. При комнатной температуре обе эти модификации превращаются в устойчивую хрупкую a-S. tkипсеры 444,6 °С (одна из стандартных точек международной температурной шкалы). В парах при температурекипения, кроме молекул S8, существуют также S6, S4 и S2. При дальнейшем нагревании крупные молекулы распадаются, и при 900°С остаются лишь S2, которые приблизительно при 1500°С заметно диссоциируют на атомы. При замораживании жидким азотом сильно нагретых паровсеры получается устойчивая ниже — 80°С пурпурная модификация, образованная молекулами S2.
Сера — плохой проводник тепла и электричества. В воде она практически нерастворима, хорошо растворяется в безводном аммиаке, сероуглероде и в ряде органических растворителей (фенол, бензол, дихлорэтан и др.).
Конфигурация внешних электроноватома S 3s23p 4. В соединениях сера проявляет степени окисления -2, 4, 6.
Сера химически активна и особенно легко при нагревании соединяется почти со всеми элементами, за исключением N2, I2, Au, Pt и инертных газов. СO2 на воздухе выше 300 °С образует окислы: SO2 — сернистый ангидрид и SO3 — серный ангидрид, из которых получают соответственно сернистую кислоту и серную кислоту, а также их солисульфиты и сульфаты (см. также Тиокислоты и Тиосульфаты). Уже на холоду S энергично соединяется с F2, при нагревании реагирует с Cl2 (см. Серы фториды, Серы хлориды); с бромомсера образует только S2Br2, иодидысеры неустойчивы. При нагревании (150 — 200 °С) наступает обратимая реакция с H2 с получением сернистого водорода. Сера образует также многосернистые водороды общей формулы H2Sx, т. н. сульфаны. Известны многочисленные сераорганические соединения.
При нагревании сера взаимодействует с металлами, образуя соответствующие сернистые соединения (сульфиды) и многосернистые металлы (полисульфиды). При температуре 800—900 °С парысеры реагируют с углеродом, образуя сероуглерод CS2. Соединения серы с азотом (N4S4 и N2S5) могут быть получены только косвенным путём.
Получение. Элементарную серу получают из серы самородной, а также окислениемсернистого водорода и восстановлениемсернистого ангидрида. О способах добычи серы см. Серные руды. Источник сернистого водорода для производства серы — коксовые, природные газы, газыкрекинганефти. Разработаны многочисленные методы переработки H2S; наибольшее значение имеют следующие: 1) H2S извлекают из газовраствором моногидротиоарсената натрия:
Na2HAsS2 H2S = Na2HAsS3O H2O.
Затем продувкой воздуха через растворосаждают серу в свободном виде:
NaHAsS3O 1/2 O2 = Na2HAsS2O2 S.
2) H2S выделяют из газов в концентрированном виде. Затем его основная масса окисляется кислородомвоздуха до серы и частично до SO2. После охлаждения H2S и образовавшиеся газы (SO2, N2, CO2) поступают в два последовательных конвертора, где в присутствии катализатора (активированный боксит или специально изготовляемый алюмогель) происходит реакция:
2H2S SO2 = 3S 2H2O.
В основе получения серы из SO2 лежит реакциявосстановления его углём или природными углеводородными газами. Иногда это производство сочетается с переработкой пиритных руд.
В 1972 элементарной серы в мире (без социалистических стран) произведено 32,0 млн. т; основная масса её добывалась из природных самородных руд. В 70-е гг. 20 в. первостепенное значение (в связи с открытием крупных месторождений сероводородсодержащих топливных газов) приобретают методы получения серы из H2S.
Сортасеры. Выплавленная непосредственно из серных рудсера называется природной комовой; полученная из H2S и SO2 — газовой комовой. Природная комовая сера, очищенная перегонкой, называется рафинированной. Сконденсированная из паров при температуре выше точки плавления в жидком состоянии и затем разлитая в формы — черенковой серой. При конденсациисеры ниже точки плавления на стенках конденсационных камер образуется мелкий порошоксеры — серный цвет. Особо высокодисперсная сера носит название коллоидной.
Применение. Сера применяется в первую очередь для получения серной кислоты: в бумажной промышленности (для получения сульфитцеллюлозы); в сельском хозяйстве (для борьбы с болезнями растений, главным образом винограда и хлопчатника); в резиновой промышленности (вулканизующий агент); в производстве красителей и светящихся составов; для получения чёрного (охотничьего) пороха; в производстве спичек.
И. К. Малина.
В медицинской практике применение серы основано на её способности при взаимодействии с органическими веществамиорганизма образовывать сульфиды и пентатионовую кислоту, от присутствия которых зависят кератолитические (растворяющие — от греч. kéras — рог и lytikós — растворяющий), противомикробные и противопаразитарные эффекты. Сера входит в состав Вилькинсона мази и других препаратов, применяемых для лечения чесотки. Очищенную и осажденную серу употребляют в мазях и присыпках для лечения некоторых кожных заболеваний (себорея, псориаз и др.); в порошке — при глистных инвазиях (энтеробиоз); в растворах — для пиротерапии прогрессивного паралича и др.
Сера в организме. В виде органических и неорганических соединений сера постоянно присутствует во всех живых организмах и является важным биогенным элементом. Её среднее содержание в расчёте на сухое вещество составляет: в морских растениях около 1,2%, наземных — 0,3%, в морских животных 0,5—2%, наземных — 0,5%. Биологическая роль серы определяется тем, что она входит в состав широко распространённых в живой природе соединений: аминокислот (метионин, цистеин), и следовательно белков и пептидов; коферментов (кофермент А, липоевая кислота), витаминов (биотин, тиамин), глутатиона и другие Сульфгидрильные группы (— SH) остатков цистеина играют важную роль в структуре и каталитическая активности многих ферментов. Образуя дисульфидные связи (— S — S —) внутри отдельных полипептидных цепей и между ними, эти группы участвуют в поддержании пространственной структуры молекулбелков. У животных сера обнаружена также в виде органических сульфатов и сульфокислот — хондроитинсерной кислоты (в хрящах и костях), таурохолиевой кислоты (в жёлчи), гепарина, таурина. В некоторых железосодержащих белках (например, ферродоксинах) сера обнаружена в форме кислотолабильного сульфида. Сера способна к образованию богатых энергией связей в макроэргических соединениях.
Неорганические соединения серы в организмах высших животных обнаружены в небольших количествах, главным образом в виде сульфатов (в крови, моче), а также роданидов (в слюне, желудочном соке, молоке, моче). Морские организмы богаче неорганическими соединениями серы, чем пресноводные и наземные. Для растений и многих микроорганизмовсульфат (SO42-) наряду с фосфатом и нитратом служит важнейшим источником минерального питания. Перед включением в органические соединениясера претерпевает изменения в валентности и превращается затем в органическую форму в своём наименее окисленном состоянии; т. о. сера широко участвует в окислительно-восстановительных реакциях в клетках. В клеткахсульфаты, взаимодействуя с аденозинтрифосфатом (АТФ), превращаются в активную форму — аденилилсульфат:
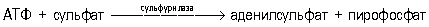
Катализирующий эту реакциюфермент — сульфурилаза (АТФ: сульфат — адснилилтрансфераза) широко распространён в природе. В такой активированной форме сульфонильная группа подвергается дальнейшим превращениям — переносится на др. акцептор или восстанавливается.
Животные усваивают серу в составе органических соединений. Автотрофные организмы получают всю серу, содержащуюся в клетках, из неорганических соединений, главным образом в виде сульфатов. Способностью к автотрофному усвоению серы обладают высшие растения, многие водоросли, грибы и бактерии. (Из культуры бактерий был выделен специальный белок, осуществляющий перенос сульфата через клеточную мембрану из среды в клетку.) Большую роль в круговороте серы в природе играют микроорганизмы — десульфурирующие бактерии и серобактерии. Многие разрабатываемые месторождения серы — биогенного происхождения. Сера входит в состав антибиотиков (пенициллины, цефалоспорины); её соединения используются в качестве радиозащитных средств, средств защиты растений.
Л. И. Беленький.
Лит.: Справочник сернокислотчика, под ред. К. М. Малина, 2 изд., М., 1971; Природная сера, под ред. М. А. Менковского, М., 1972; Некрасов Б. В., Основы обшей химии, 3 изд., т. 1, М., 1973; Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1972; Янг Л., Моу Д ж., Метаболизм соединений серы, пер. с англ., М., 1961; Горизонты биохимии, пер. с англ., М., 1964; Биохимия растений, пер. с англ., М., 1968, гл. 19; Торчинский Ю. М., Сульфгидрильные и дисульфидные группы белков, М., 1971; Дегли С., Никольсон Д., Метаболические пути, пер. с англ., М., 1973.
Медь, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Определение серы, углерода, азота и кислорода в сплавах систем ce–fe–co–b и gd–fe–co–b
dx.doi.org/ 10.18577/2307-6046-2022-0-8-90-97
УДК 669.017
А. В. Алексеев, Г. Ю. Растегаева, Т. Н. Пахомкина, М. Г. Размахов
ОПРЕДЕЛЕНИЕ СЕРЫ, УГЛЕРОДА, АЗОТА И КИСЛОРОДА В СПЛАВАХ СИСТЕМ Ce–Fe–Co–B И Gd–Fe–Co–B
Проведен анализ сплавах систем Ce–Fe–Co–B и Gd–Fe–Co–B на содержание газообразующих примесей.Содержания серы и углерода определено методом сжигания в индукционной печи газоанализатора CS-444 фирмы Leco с последующим детектированием в инфракрасной ячейке спектрометра, а для определения кислорода и азота использовали метод восстановительного плавления в токе инертного газа-носителя с последующим детектированием кислорода в инфракрасной ячейке и азота в кондуктометрической ячейке газоанализатора TC-600 фирмы Leco. Для полного извлечения определяемых элементов использованы различные катализаторы (вольфрам с оловом, оксид ванадия, медная стружка) и выбран наиболее подходящий из них.
Ключевые слова: магнитные материалы, определение кислорода, определение азота, определение серы, определение углерода, метод инфракрасно-абсорбционной спектроскопии, magnetic material, oxygen determination, nitrogen determination, sulfur determination, carbon determination, infrared absorption spectroscopy method.
Введение
Разработка современных навигационных приборов предполагает повышение требований к эксплуатационным характеристикам используемых в конструкции функциональных материалов. В динамически настраиваемых гироскопах используют постоянные магниты типа Sm2Co17 с низким температурным коэффициентом индукции (ТКИ) марок КСДГ-25 и КСГЭ-26, однако за последнее время в научной литературе исследований по повышению свойств этих материалов не публиковалось [1–4]. Перспективными материалами для навигационной техники считаются магниты системы РЗМ–Fe–Co–B с ТКИ близким к нулю [5–7]:
Негативное воздействие как на магнитные свойства, так и на их температурную стабильность могут оказать такие примеси, как сера, углерод, кислород и азот [8, 9]. Повышенное содержание этих элементов может свидетельствовать о нарушении технологического процесса изготовления магнитов либо о некачественных шихтовых материалах. Точный контроль содержания примесей в магнитах является актуальной и важной задачей.
Серу в различных сплавах возможно определять методом йодометрического титрования, при котором навеска пробы сжигается, диоксид серы поглощается водой, добавляется избыток йодистого калия и далее раствор титруют тиосульфатом натрия [10].
Потенциометрический метод применим для определения углерода. Навеску пробы также сжигают, хлорид бария поглощает образовавшийся оксид углерода и при этом происходит изменение рН раствора, степень изменения устанавливается титрованием гидратом оксида бария (вступающим в реакцию с оксидом углерода), по расходу которого рассчитывается содержание углерода [11].
Содержание кислорода определяют путем нагрева пробы в токе сухого водорода и при определении массы паров воды (образующихся в результате реакции определяемого кислорода с водородом) с помощью поглощения ее (воды) метанолом, с последующим титрованием реактивом Карла Фишера. Полученное значение массы паров воды пересчитывают на содержание кислорода (так как весь кислород, содержащийся в пробе, вступил в реакцию с водородом с образованием воды) [12].
Азот определяют спектрофотометрическим методом. Проба растворяется в кислотах, далее образующиеся аммонийные соли взаимодействуют с гидроксидом натрия. Выделившийся аммиак конденсируется и его содержание определяют в спектрофотометре с применением реактива Несслера [13].
Все вышеописанные методики чрезвычайно трудоемки, длительны и требуют использования большого количества различных реактивов и оборудования. В настоящее время для определения серы и углерода в различных объектах применяется метод сжигания навески пробы в индукционной печи газоанализатора с последующим детектированием в инфракрасной ячейке спектрометра, а для определения азота и кислорода используется восстановительное плавление в вакууме или в потоке инертного газа-носителя (под методами понимаются общие принципы и тип оборудования, которые используются для анализа независимо от вида объекта анализа, а методикой является точное описание последовательности действий для анализа конкретного объекта). Данные методы значительно упрощают процесс проведения анализа и позволяют получать точные результаты в широком диапазоне определяемых концентраций. При проведении анализа данными методами также необходимо выполнить подбор катализаторов, ускоряющих процесс горения пробы и таким образом повышающих аналитический сигнал, т. е. сигнал прибора, значение которого прямо пропорционально содержанию определяемых элементов в пробе [14, 15].
Целью данной работы являлся подбор составов катализатора и массы навески пробы для определение серы, углерода, кислорода и азота в сплавах систем Ce–Fe–Co–B и Gd–Fe–Co–B методом сжигания навески пробы в индукционной печи газоанализатора с последующим детектированием в инфракрасной ячейке спектрометра.
Работа выполнена в рамках реализации комплексной научной проблемы 11.1. «Термостабильные магнитотвердые материалы и математические модели расчета их температурных характеристик для навигационных приборов нового поколения» («Стратегические направления развития материалов и технологий их переработки на период до 2030 года») [1].
Материалы и методы
Анализ сплавов систем Ce–Fe–Co–B и Gd–Fe–Co–B на содержание серы и углерода проводили с помощью газоанализатора CS-444 фирмы Leco (США). В инфракрасной ячейке происходило формирование аналитического сигнала (пары́ оксидов серы и углерода попадали в ячейку, где в инфракрасной области спектра происходило поглощение части излучения и далее рассчитывалась оптическая плотность, являющаяся аналитическим сигналом), прямо пропорционально зависящего от концентрации серы и углерода. Для максимизации данного сигнала, а также стабильности работы прибора произведена его предварительная настройка – выбраны следующие параметры: время задержки сигнала, мощность печи, уровень компаратора, продолжительность продувки прибора перед анализом.
Пробу сплава системы РЗМ–Fe–Co–B сжигали в керамическом тигле, который предварительно подвергали нагреву при температуре ˃1000°С в муфельной печи для уменьшения фонового сигнала от остаточного содержания серы и углерода. Перед проведением анализа тигли помещали в эксикатор и вынимали только непосредственно перед помещением в прибор для максимального уменьшения времени нахождения тигля на открытом воздухе.
Необходимо также учитывать содержание серы и углерода в катализаторах и стараться использовать катализатор с минимальными значениями определяемых элементов, проводя предварительный холостой анализ. Для проведения анализа применяли катализаторы, поставляемые фирмой Leco и содержащие определяемые примеси в минимальных количествах. Применение холостой пробы (пробы, содержащей катализатор без образца, значения содержания примесей в которой далее вычитаются из значений для анализируемых образцов) также исключает вклад катализатора в конечный результат анализа.
В ходе выполнения работы установлена возможность использования следующих катализаторов: оксида ванадия (V2O5), медной стружки (Cu), вольфрама с оловом (LECOCELIIHP 502-173), никеля (NiBASKETS 502-344) – в скобках приведены торговые названия катализаторов, поставляемые фирмой Leco [14].
Анализ сплавов систем Ce–Fe–Co–B и Gd–Fe–Co–B на содержание кислорода и азота проводили с помощью газоанализатора TC-600 фирмы Leco (США). Нагрев образца происходил в индукционной печи, в результате чего кислород, содержащийся в материале пробы, вступал в реакцию с углеродом графитового тигля с образованием оксида углерода, который далее, при попадании в инфракрасную ячейку, определяли по вышеописанному принципу. Для достижения максимума аналитического сигнала и стабилизации его значения выбраны следующие параметры: время задержки сигнала, мощность печи, цикл дегазирования, уровень компаратора, ток дегазирования, задержка интегрирования, продолжительность продувки прибора перед анализом.
Как и в случае с анализом на содержание серы и углерода, для успешного определения азота и кислорода необходимо выполнить подбор катализатора, обеспечивающего полноту сгорания и выделения искомых элементов. Никель (NiBASKETS 502-344) и вольфрам с оловом (LECOCELIIHP 502-173) являются наиболее часто используемыми веществами, упрощающими проведение анализа при определении азота и кислорода [15].
Для анализа выбрали по два экспериментальных образца (маркировки проб 1 и 2) из сплавов систем Ce–Fe–Co–B и Gd–Fe–Co–B.
Результаты и обсуждение
Определение серы и углерода в сплаве системы Ce–Fe–Co–B
Результаты определения серы и углерода в двух образцах сплава системы Ce–Fe–Co–B представлены в табл. 1.
Таблица 1
Результаты определения серы и углерода в сплаве системы Ce–Fe–Co–B
с использованием различных типов катализаторов
Катализатор | Масса навески, г | Содержание, % (по массе) | ||||
серы | углерода | |||||
в экспериментальных пробах | ||||||
1 | 2 | 1 | 2 | 1 | 2 | |
Без катализатора | 0,121 | 0,117 | Нет сигнала* | Нет сигнала | Нет сигнала | Нет сигнала |
0,205 | 0,209 | То же | То же | То же | То же | |
0,307 | 0,321 | -«- | -«- | -«- | -«- | |
0,412 | 0,408 | -«- | -«- | -«- | -«- | |
0,517 | 0,508 | -«- | -«- | -«- | -«- | |
0,620 | 0,611 | -«- | -«- | -«- | -«- | |
Cu | 0,121 | 0,115 | 0,0017 | 0,0015 | -«- | -«- |
0,213 | 0,213 | 0,0017 | 0,0020 | -«- | -«- | |
0,305 | 0,304 | 0,0019 | 0,0023 | -«- | -«- | |
0,417 | 0,411 | 0,0024 | 0,0023 | -«- | -«- | |
0,517 | 0,513 | 0,0022 | 0,0025 | -«- | -«- | |
0,610 | 0,600 | 0,0023 | 0,0024 | -«- | -«- | |
Среднее значение | 0,0020 | 0,0022 | – | – | ||
V2O5 | 0,102 | 0,108 | 0,0006 | 0,0004 | Нет сигнала | Нет сигнала |
0,206 | 0,217 | 0,0007 | 0,0003 | То же | То же | |
0,301 | 0,313 | 0,0018 | 0,0012 | -«- | -«- | |
0,413 | 0,408 | 0,0011 | 0,0012 | -«- | -«- | |
0,512 | 0,515 | 0,0014 | 0,0011 | -«- | -«- | |
0,618 | 0,604 | 0,0011 | 0,0013 | -«- | -«- | |
Среднее значение | 0,0011 | 0,0009 | – | – | ||
LECOCELIIHP | 0,103 | 0,118 | 0,0023 | 0,0023 | 0,021 | 0,020 |
0,212 | 0,206 | 0,0023 | 0,0025 | 0,022 | 0,019 | |
0,318 | 0,311 | 0,0025 | 0,0024 | 0,020 | 0,021 | |
0,404 | 0,407 | 0,0024 | 0,0025 | 0,021 | 0,020 | |
0,513 | 0,505 | 0,0025 | 0,0023 | 0,021 | 0,023 | |
0,621 | 0,620 | 0,0022 | 0,0024 | 0,023 | 0,021 | |
Среднее значение | 0,0024 | 0,0024 | 0,021 | 0,021 | ||
NiBASKETS | 0,108 | 0,113 | 0,0015 | 0,0015 | 0,010 | 0,014 |
0,219 | 0,212 | 0,0017 | 0,0018 | 0,012 | 0,015 | |
0,308 | 0,304 | 0,0011 | 0,0013 | 0,011 | 0,013 | |
0,412 | 0,413 | 0,0010 | 0,0011 | 0,010 | 0,014 | |
0,514 | 0,517 | 0,0011 | 0,0010 | 0,015 | 0,015 | |
0,602 | 0,606 | 0,0010 | 0,0010 | 0,014 | 0,013 | |
Среднее значение | 0,0012 | 0,0013 | 0,012 | 0,014 | ||
* Здесь и далее – «Нет сигнала» обозначает отсутствие аналитического сигнала прибора вследствие неполного сгорания пробы в тигле.
Без использования катализатора сжигание образца происходит не в полном объеме и, как следствие, сера и углерод не выделяются. При использовании меди (Cu) и оксида ванадия (V2O5) в качестве катализатора происходит выделением только серы, причем значения содержаний низки (по сравнению с другими катализаторами), что также свидетельствует о неполном сгорании образца. В присутствии двух других катализаторов выделяются оба определяемых элемента, однако содержания серы и кислорода имеют бо́льшие значения при использовании катализатора LECOCELIIHP, чем при использовании катализатора NiBASKETS. При этом разброс полученных значений меньше, что свидетельствует о полном извлечении серы и углерода из проб и, как следствие, точном проведении определения искомых элементов. Значения содержаний серы и углерода для разных масс навески совпадают, что также свидетельствует в пользу применения соединения LECOCELIIHP в качестве катализатора. При этом надо учитывать, что данные катализаторы содержат минимальные количества углерода и серы, а также использование холостой пробы (пробы с катализатором, но без образца) полностью исключает вклад содержащихся в них примесей в конечные результаты анализа.
Таким образом, при определении серы и углерода в сплаве системы Ce–Fe–Co–B необходимо использовать катализатор LECOCELIIHP.
Определение углерода и серы в сплаве системы Gd–Fe–Co–B
Результаты определения серы и углерода в двух образцах сплава системы Gd–Fe–Co–B представлены в табл. 2.
Таблица 2
Результаты определения углерода и серы в сплаве системы Gd–Fe–Co–B
с использованием различных типов катализаторов
Катализатор | Масса навески, г | Содержание, % (по массе) | ||||
серы | углерода | |||||
в экспериментальных пробах | ||||||
1 | 2 | 1 | 2 | 1 | 2 | |
Без катализатора | 0,116 | 0,129 | Нет сигнала | Нет сигнала | Нет сигнала | Нет сигнала |
0,214 | 0,213 | То же | То же | То же | То же | |
0,312 | 0,314 | -«- | -«- | -«- | -«- | |
0,425 | 0,417 | -«- | -«- | -«- | -«- | |
0,506 | 0,502 | -«- | -«- | -«- | -«- | |
0,613 | 0,603 | -«- | -«- | -«- | -«- | |
Cu | 0,107 | 0,127 | 0,0014 | 0,0017 | -«- | -«- |
0,205 | 0,215 | 0,0014 | 0,0020 | -«- | -«- | |
0,324 | 0,303 | 0,0016 | 0,0020 | -«- | -«- | |
0,408 | 0,407 | 0,0020 | 0,0021 | -«- | -«- | |
0,516 | 0,517 | 0,0021 | 0,0025 | -«- | -«- | |
0,608 | 0,608 | 0,0022 | 0,0023 | -«- | -«- | |
Среднее значение | 0,0018 | 0,0021 | – | – | ||
V2O5 | 0,103 | 0,112 | 0,0007 | 0,0006 | Нет сигнала | Нет сигнала |
0,214 | 0,211 | 0,0005 | 0,0008 | То же | То же | |
0,305 | 0,323 | 0,0010 | 0,0010 | -«- | -«- | |
0,405 | 0,417 | 0,0011 | 0,0011 | -«- | -«- | |
0,527 | 0,514 | 0,0013 | 0,0011 | -«- | -«- | |
0,613 | 0,604 | 0,0012 | 0,0012 | -«- | -«- | |
Среднее значение | 0,0010 | 0,0009 | – | – | ||
LECOCELIIHP | 0,109 | 0,113 | 0,0035 | 0,0034 | 0,024 | 0,022 |
0,207 | 0,208 | 0,0035 | 0,0033 | 0,021 | 0,022 | |
0,315 | 0,304 | 0,0033 | 0,0033 | 0,021 | 0,024 | |
0,414 | 0,417 | 0,0034 | 0,0035 | 0,022 | 0,022 | |
0,537 | 0,528 | 0,0035 | 0,0035 | 0,023 | 0,023 | |
0,608 | 0,611 | 0,0035 | 0,0034 | 0,022 | 0,023 | |
Среднее значение | 0,0035 | 0,0034 | 0,022 | 0,023 | ||
NiBASKETS | 0,116 | 0,107 | 0,0015 | 0,0015 | 0,018 | 0,019 |
0,213 | 0,214 | 0,0011 | 0,0018 | 0,012 | 0,015 | |
0,307 | 0,327 | 0,0013 | 0,0019 | 0,015 | 0,018 | |
0,409 | 0,412 | 0,0014 | 0,0010 | 0,018 | 0,019 | |
0,506 | 0,514 | 0,0011 | 0,0011 | 0,012 | 0,014 | |
0,618 | 0,607 | 0,0015 | 0,0015 | 0,014 | 0,014 | |
Среднее значение | 0,0013 | 0,0015 | 0,015 | 0,017 | ||
При определении серы и углерода в сплаве системы Gd–Fe–Co–B, также как и при анализе сплава системы Ce–Fe–Co–B, наиболее подходящим является использование катализатора LECOCELIIHP.
Определение азота и кислорода в сплаве системы Ce–Fe–Co–B
Результаты определения азота и кислорода в двух образцах сплава системы Ce–Fe–Co–B представлены в табл. 3.
Таблица 3
Результаты определения азота и кислорода в сплаве системы Ce–Fe–Co–B
с использованием различных типов катализаторов
Катализатор | Масса навески, г | Содержание, % (по массе) | ||||
азота | кислорода | |||||
в экспериментальных пробах | ||||||
1 | 2 | 1 | 2 | 1 | 2 | |
Без катализатора | 0,131 | 0,132 | Нет сигнала | Нет сигнала | Нет сигнала | Нет сигнала |
0,202 | 0,201 | То же | То же | То же | То же | |
0,342 | 0,345 | -«- | -«- | -«- | -«- | |
0,435 | 0,424 | -«- | -«- | -«- | -«- | |
0,571 | 0,503 | -«- | -«- | -«- | -«- | |
0,627 | 0,627 | -«- | -«- | -«- | -«- | |
NiBASKETS | 0,116 | 0,102 | 0,0044 | 0,0044 | 0,0084 | 0,0082 |
0,218 | 0,278 | 0,0045 | 0,0043 | 0,0081 | 0,0082 | |
0,327 | 0,347 | 0,0043 | 0,0043 | 0,0081 | 0,0084 | |
0,412 | 0,415 | 0,0044 | 0,0045 | 0,0082 | 0,0082 | |
0,523 | 0,526 | 0,0045 | 0,0045 | 0,0083 | 0,0083 | |
0,614 | 0,612 | 0,0045 | 0,0044 | 0,0082 | 0,0083 | |
Среднее значение | 0,0044 | 0,0044 | 0,0082 | 0,0083 | ||
LECOCELIIHP | 0,103 | 0,115 | 0,0025 | 0,0035 | 0,0048 | 0,0019 |
0,218 | 0,216 | 0,0031 | 0,0028 | 0,0012 | 0,0025 | |
0,315 | 0,327 | 0,0033 | 0,0039 | 0,0035 | 0,0028 | |
0,425 | 0,419 | 0,0044 | 0,0040 | 0,0038 | 0,0019 | |
0,514 | 0,514 | 0,0021 | 0,0031 | 0,0052 | 0,0034 | |
0,607 | 0,601 | 0,0025 | 0,0035 | 0,0044 | 0,0034 | |
Среднее значение | 0,0030 | 0,0035 | 0,0038 | 0,0027 | ||
Из данных табл. 3 видно, что без использования катализатора сжигание образца происходит не в полном объеме и, как следствие, азот и кислород не выделяются. В присутствии катализатора LECOCELIIHP выделяются оба определяемых элемента, однако значения содержаний азота и кислорода больше при использовании катализатора NiBASKETS. При этом разброс полученных значений меньше, что свидетельствует о полном извлечении азота и кислорода из проб и, как следствие, точном проведении определения искомых элементов. Значения содержаний азота и кислорода для разных масс навески совпадают, что также свидетельствует в пользу применения соединения NiBASKETS в качестве катализатора.
Таким образом, при определении азота и кислорода в сплаве системы Ce–Fe–Co–B необходимо использовать катализатор NiBASKETS.
Определение азота и кислорода в сплаве системы Gd–Fe–Co–B
Результаты определения азота и кислорода в двух образцах сплава системы Gd–Fe–Co–B представлены в табл. 4.
Таблица 4
Результаты определения азота и кислорода в сплаве системы Gd–Fe–Co–B
с использованием различных типов катализаторов
Катализатор | Масса навески, г | Содержание, % (по массе) | ||||
азота | кислорода | |||||
в экспериментальных пробах | ||||||
1 | 2 | 1 | 2 | 1 | 2 | |
Без катализатора | 0,101 | 0,112 | Нет сигнала | Нет сигнала | Нет сигнала | Нет сигнала |
0,222 | 0,211 | То же | То же | То же | То же | |
0,312 | 0,335 | -«- | -«- | -«- | -«- | |
0,425 | 0,434 | -«- | -«- | -«- | -«- | |
0,521 | 0,513 | -«- | -«- | -«- | -«- | |
0,607 | 0,617 | -«- | -«- | -«- | -«- | |
NiBASKETS | 0,112 | 0,112 | 0,0044 | 0,0044 | 0,0084 | 0,0082 |
0,218 | 0,208 | 0,0045 | 0,0043 | 0,0081 | 0,0082 | |
0,324 | 0,307 | 0,0043 | 0,0043 | 0,0081 | 0,0084 | |
0,415 | 0,405 | 0,0044 | 0,0045 | 0,0082 | 0,0082 | |
0,522 | 0,516 | 0,0045 | 0,0045 | 0,0083 | 0,0083 | |
0,617 | 0,602 | 0,0045 | 0,0044 | 0,0082 | 0,0083 | |
Среднее значение | 0,0044 | 0,0044 | 0,0082 | 0,0083 | ||
LECOCELIIHP | 0,103 | 0,115 | 0,0025 | 0,0035 | 0,0048 | 0,0019 |
0,218 | 0,216 | 0,0031 | 0,0028 | 0,0012 | 0,0025 | |
0,315 | 0,327 | 0,0033 | 0,0039 | 0,0035 | 0,0028 | |
0,425 | 0,419 | 0,0044 | 0,0040 | 0,0038 | 0,0019 | |
0,514 | 0,514 | 0,0021 | 0,0031 | 0,0052 | 0,0034 | |
0,607 | 0,601 | 0,0025 | 0,0035 | 0,0044 | 0,0034 | |
Среднее значение | 0,0030 | 0,0035 | 0,0038 | 0,0027 | ||
При определении азота и кислорода в сплаве системы Gd–Fe–Co–B, также как и при анализе сплава системы Ce–Fe–Co–B, наиболее подходящим является использование катализатора NiBASKETS.
Заключения
На основе проделанной работы можно сделать следующие выводы:
– выбраны параметры настройки газоанализаторов CS-444 и TC-600 для определения серы, углерода, азота и кислорода в сплавах систем Ce–Fe–Co–B и Gd–Fe–Co–B;
– вольфрам с оловом является наилучшим катализатором марки LECOCELIIHP для определения серы и углерода в сплавах систем Ce–Fe–Co–B и Gd–Fe–Co–B;
– никель является наилучшим катализатором марки NiBASKETS для определения азота и кислорода в сплавах систем Ce–Fe–Co–B и Gd–Fe–Co–B.
ЛИТЕРАТУРАREFERENCE LIST
1. Каблов Е.Н. Инновационные разработки ФГУП «ВИАМ» ГНЦ РФ по реализации «Стратегических направлений развития материалов и технологий их переработки на период до 2030 года» // Авиационные материалы и технологии. 2022. №1 (34). С. 3–33. DOI: 10.18577/2071-9140-2022-0-1-3-33.
2. Мин П.Г., Вадеев В.Е., Пискорский В.П., Крамер В.В. Разработка технологии выплавки сплавов системы РЗМ–Fe–Co–B с высокой чистотой по примесям для термостабильных магнитов // Труды ВИАМ: электрон. науч.-технич. журн. 2022. №1 (37). Ст. 01. URL: http://www.lifeo2.ru (дата обращения: 06.06.2022). DOI: 10.18557/2307-6046-2022-0-1-1-1.
3. Каблов Е.Н., Оспенникова О.Г., Пискорский В.П., Резчикова И.И., Валеев Р.А., Давыдова Е.А. Фазовый состав спеченных материалов системы Pr-Dy–Fe–Co–B // Авиационные материалы и технологии. 2022. №S2 (39). С. 5–10. DOI: 10.18577/2071-9140-2022-0-S2-5-10.
4. Чередниченко И.В., Оспенникова О.Г., Пискорский В.П., Валеев Р.А., Бузенков А.В. Экономические аспекты производства постоянных магнитов // Новости материаловедения. Наука и техника. 2022. №4 (22). Ст. 06. URL: http://www.materialsnews.ru (дата обращения: 06.06.2022).
5. Каблов Е.Н., Оспенникова О.Г., Чередниченко И.В., Резчикова И.И., Валеев Р.А., Пискорский В.П. Влияние содержания меди на фазовый состав и магнитные свойства термостабильных спеченных магнитов систем Nd–Dy–Fe–Co–B и Pr–Dy–Fe–Co–B// Авиационные материалы и технологии. 2022. №S2 (39). С. 11–19. DOI: 10.18577/2071-9140-2022-0-S2-11-19.
6. Давыдова Е.А., Чабина Е.Б., Моисеева Н.С. Влияние гадолиния, а также способа его введения на структуру и фазавый состав магнитотвердого спеченного материала системы Pr–Dy–Fe–Co–B // Авиационные материалы и технологии. 2022. №1 (34). С. 56–59. DOI: 10.18577/2071-9140-2022-0-1-56-59.
7. Каблов Е.Н., Оспенникова О.Г., Резчикова И.И., Пискорский В.П., Валеев Р.А., Королев Д.В. Зависимость свойств спеченных материалов системы Nd–Dy–Fe–Co–B от технологических параметров // Авиационные материалы и технологии. 2022. №S2 (39). С. 24–29. DOI: 10.18577/2071-9140-2022-0-S2-24-29.
8. Каблов Е.Н., Оспенникова О.Г., Резчикова И.И., Валеев Р.А., Пискорский В.П., Сульянова Е.А. Влияние кобальта на стойкость к окислению материалов Pr(Nd)–Dy–Fe–Co–B // Металлы. 2022. №4. С. 52–56.
9. Каблов Е.Н., Чабина Е.Б., Морозов Г.А., Муравская Н.П. Оценка соответствия новых материалов с использованием СО и МИ высокого уровня // Компетентность. 2022. №2. C. 40–46.
10. ГОСТ 6689.18–92. Никель, сплавы никелевые и медно-никелевые. Методы определения серы. М.: Изд-во стандартов, 1992. С. 4.
11. ГОСТ 6689.10–92. Никель, сплавы никелевые и медно-никелевые. Методы определения углерода. М.: Изд-во стандартов, 1992. С. 4.
12. ГОСТ 29006–91. Порошки металлические. Метод определения кислорода, восстановимого водородом. М.: Изд-во стандартов, 1991. С. 3.
13. ГОСТ 12359–99. Стали углеродистые, легированные и высоколегированные. Методы определения азота. М.: Изд-во стандартов, 1999. С. 3.
14. Алексеев А.В., Растегаева Г.Ю., Пахомкина Т.Н. Определение серы и углерода в порошках никелевых сплавов // Труды ВИАМ: электрон. науч.-технич. журн. 2022. №11 (71). Ст. 03. URL: http://www.lifeo2.ru (дата обращения: 08.06.2022). DOI: 10.18557/2307-6046-2022-0-11-20-27.
15. Алексеев А.В., Растегаева Г.Ю., Пахомкина Т.Н. Определение кислорода и азота в порошках никелевых сплавов // Труды ВИАМ: электрон. науч.-технич. журн. 2022. №8 (68). Ст. 11. URL: http://www.lifeo2.ru (дата обращения: 08.06.2022). DOI: 10.18557/2307-6046-2022-0-8-112-119.
1. Kablov E.N. Innovacionnye razrabotki FGUP «VIAM» GNC RF po realizacii «Strategicheskih napravlenij razvitiya materialov i tehnologij ih pererabotki na period do 2030 goda» [Innovative developments of FSUE «VIAM» SSC of RF on realization of «Strategic directions of the development of materials and technologies of their processing for the period until 2030»] // Aviacionnye materialy i tehnologii. 2022. №1 (34). S. 3–33. DOI: 10.18577/2071-9140-2022-0-1-3-33.
2. Min P.G., Vadeyev V.E., Piskorskiy V.P., Kramer V.V. Razrabotka tekhnologii vyplavki splavov sistemy RZM–Fe–Co–B s vysokoy chistotoy po primesyam dlya termostabilnykh magnitov [Development of melting technology of high pure REM–Fe–Co–B alloys for temperature-stable magnets] // Trudy VIAM: elektron. nauch.-tekhnich. zhurn. 2022. №1 (37). St. 01. Available at: http://www.lifeo2.ru (accessed: June 06, 2022). DOI: 10.18557/2307-6046-2022-0-1-1-1.
3. Kablov E.N., Ospennikova O.G., Piskorskij V.P., Rezchikova I.I., Valeev R.A., Davydova E.A. Fazovyj sostav spechennyh materialov sistemy Pr–Dy–Fe–Co–B [Phase composition of the Pr–Dy–Fe–Co–B sintered materials] // Aviacionnye materialy i tehnologii. 2022. №S2 (39). S. 5–10. DOI: 10.18577/2071-9140-2022-0-S2-5-10.
4. Cherednichenko I.V., Ospennikova O.G., Piskorskiy V.P., Valeyev R.A., Buzenkov A.V. Ekonomicheskiye aspekty proizvodstva postoyannykh magnitov [The economics aspects of manufacturing permanents magnets (review)] // Novosti materialovedeniya. Nauka i tekhnika. 2022. №4 (22). St. 06. Available at: http://www.materialsnews.ru (accessed: June 06, 2022).
5. Kablov E.N., Ospennikova O.G., Cherednichenko I.V., Rezchikova I.I., Valeev R.A., Piskorskij V.P. Vliyanie soderzhaniya medi na fazovyj sostav i magnitnye svojstva termostabil’nyh spechennyh magnitov sistem Nd–Dy–Fe–Co–B i Pr–Dy–Fe–Co–B [Influence of Cu content to phase structure and magnetic properties of thermostable sintered magnets of Nd–Dy–Fe–Co–B and Pr–Dy–Fe–Co–B systems] // Aviacionnye materialy i tehnologii. 2022. №S2 (39). S. 11–19. DOI: 10.18577/2071-9140-2022-0-S2-11-19.
6. Davydova E.A., Chabina E.B., Moiseeva N.S. Vliyanie gadoliniya, a takzhe sposoba ego vvedeniya na strukturu i fazovyj sostav magnitotverdogo spechennogo materiala sistemy Pr–Dy–Fe–Co–B [An influence of gadolinium and the method of its introduction on the structure and phase composition of sintered hard magnetic materials of Pr–Dy–Fe–Co–B series] // Aviacionnye materialy i tehnologii. 2022. №1. S. 56–59.
7. Kablov E.N., Ospennikova O.G., Rezchikova I.I., Piskorskij V.P., Valeev R.A., Korolev D.V. Zavisimost svojstv spechennyh materialov sistemy Nd–Dy–Fe–Co–B ot tehnologicheskih parametrov [Properties dependence of the Nd–Dy–Fe–Co–B sintered materials on technological parameters] // Aviacionnye materialy i tehnologii. 2022. №S2 (39). S. 24–29. DOI: 10.18577/2071-9140-2022-0-S2-24-29.
8. Kablov E.N., Ospennikova O.G., Rezchikova I.I., Valeyev R.A., Piskorskiy V.P., Sulyanova E.A. Vliyaniye kobalta na stoykost k okisleniyu materialov Pr(Nd)–Dy–Fe–Co–B [The effect of cobalt on the oxidation resistance of materials Pr(Nd)–Dy–Fe–Co–B // Metally. 2022. №4. S. 52–56.
9. Kablov E.N., Chabina E.B., Morozov G.A., Muravskaya N.P. Otsenka sootvetstviya novykh materialov s ispolzovaniyem SO i MI vysokogo urovnya [Conformity assessment of new materials using high-level CO and MI] // Kompetentnost. 2022. №2. S. 40–46.
10. GOST 6689.18–92. Nikel, splavy nikelevyye i medno-nikelevyye. Metody opredeleniya sery [State Standard 6689.18–92. Nickel, nickel and copper-nickel alloys. Methods for the determination of sulfur]. M.: Izd-vo standartov, 1992. S. 4.
11. GOST 6689.10–92. Nikel, splavy nikelevyye i medno-nikelevyye. Metody opredeleniya ugleroda [State Standard 6689.10–92. Nickel, nickel and copper-nickel alloys. Methods for the determination of carbon]. M.: Izd-vo standartov, 1992. S. 4.
12. GOST 29006–91. Poroshki metallicheskiye. Metod opredeleniya kisloroda, vosstanovimogo vodorodom [State Standard 29006–91. Metal powders. Method for determination of oxygen reduced by hydrogen]. M.: Izd-vo standartov, 1991. S. 3.
13. GOST 12359–99. Stali uglerodistyye, legirovannyye i vysokolegirovannyye. Metody opredeleniya azota [State Standard 12359–99. Steel carbon, alloyed and high alloyed. Methods for the determination of nitrogen]. M.: Izd-vo standartov, 1999. S. 3.
14. Alekseev A.V., Rastegayeva G.Yu., Pakhomkina T.N. Opredeleniye sery i ugleroda v poroshkakh nikelevykh splavov [Determination of sulfur and carbon in the powder of nickel alloys] // Trudy VIAM: elektron. nauch.-tekhnich. zhurn. 2022. №11 (71). St. 03. Available at: http://www.lifeo2.ru (accessed: June 08, 2022). DOI: 10.18557/2307-6046-2022-0-11-20-27.
15. Alekseev A.V., Rastegayeva G.YU., Pakhomkina T.N. Opredeleniye kisloroda i azota v poroshkakh nikelevykh splavov [Determination of oxygen and nitrogen in nickel alloy powders] // Trudy VIAM: elektron. nauch.-tekhnich. zhurn. 2022. №8 (68). St. 11. Available at: http://www.lifeo2.ru (accessed: June 08, 2022). DOI: 10.18557/2307-6046-2022-0-8-112-119.

