- Аллотропия. физические свойства.
- Диспропорционирование серы в растворах щелочей
- Какие аллотропные модификации образуют кислород и сера? чем аллотропные модификации серы отличаются друг от друга? — химия
- Лекция 2 кислород и сера.
- Получение серы
- Реакции с более эо неметаллами
- Реакции с менее эо неметаллами
- Реакции с металлами
- Реакции со сложными веществами — сильными окислителями
- Сера — восстановитель:
- Сера — окислитель:
- Сера как простое вещество. аллотропия и свойства серы. химия 9 класс. кузнецова
- Сравните строение атомов и свойства кислорода и серы. укажите их сходство и различия. — знания.site
- Характеристика элемента
- Химические свойства кислорода
Аллотропия. физические свойства.
Аллотропные модификации серы: ромбическая — S8. Твердое кристаллическое вещество ли монно-желтого цвета; нерастворимо в воде, хорошо растворимо в сероуглероде, ацетоне, бензоле.
Моноклинная — S8. Существует при температуре около 950С. Отличается от ромбической взаимной ориентацией октаэдров в кристаллической решетке.
Пластическая. Длинные зигзагообразные цепи.
Диспропорционирование серы в растворах щелочей
3S 6NaOH = 2Na2S Na2SO3 3Н2O
Какие аллотропные модификации образуют кислород и сера? чем аллотропные модификации серы отличаются друг от друга? — химия
Элемент кислород, образует 2 простых вещества: кислород О₂ и озон О₃.
Существует три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Ромбическая и моноклинная модификации построены из циклических молекул S₈, размещенных по узлам ромбической и моноклинной решеток.
При комнатной температуре устойчива ромбическая сера. При нагревании она плавится, превращаясь в желтую легкоподвижную жидкость, при дальнейшем нагревании жидкость загустевает, так как в ней образуются длинные полимерные цепочки. При медленном охлаждении расплава образуются темно-желтые игольчатые кристаллы моноклинной серы, а если вылить расплавленную серу в холодную воду, получится пластическая сера – резиноподобная структура, состоящая из полимерных цепочек. Пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в ромбическую.
Лекция 2 кислород и сера.
План.
- Общая характеристика подгруппы. Кислород как химический элемент.
- Кислород как простое вещество.
- Озон.
- Сера как химический элемент.
- Сера как простое вещество.
- Соединения серы с отрицательной степенью окисления.
- Оксиды серы.
- Серная кислота и ее соли.
Главную подгруппу 6 группы составляют кислород, сера, селен, теллур и полоний. Все эти элементы (их иногда называют халькогены) имеют на внешнем валентном слое конфигурацию типа s2p4 , т.е. близкую к завершению. Это обуславливает окислительные способности этих элементов. Следует отметить, что их ЭО при переходе от кислорода к теллуру резко снижается, т.к. появление новых электронных слоев ведет к увеличению радиуса атомов. Наибольшей окислительной способностью обладают типичные неметаллы — кислород и сера.
Кислород как химический элемент. Кислород или Оксиген №8. 2 период, 6 группа, главная подгруппа.
Состав атома:8р, 8е—, 8n.
Схема строения: заряд ядра 8, два электронных слоя (2 е—, 6 е—)
Электронная и графическая формулы: 1s22s22p4
Типичный неметалл, сильный окислитель. Практически единственная степени окисления: -2.
Практически единственная валентность: II.
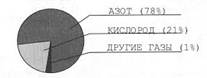 Самый распространенный элемент на Земле. На его долю приходится почти половина массы земной коры и около 90% массы мирового океана. Встречается в свободном состоянии в виде двух аллотропных модификаций: кислород О2 и озон О3. Эти газы входят в состав атмосферы, кислород в нем составляет около 21% по объему, озон – доли процента. Входит в состав неорганических соединений оксидов и гидроксидов, а также в состав многих солей. Содержится в важнейших органических соединениях: спиртах, альдегидах, кислотах и сложных эфирах. Является органогеном, входит в состав белков, жиров и углеводов, нуклеотидов и т.д.
Самый распространенный элемент на Земле. На его долю приходится почти половина массы земной коры и около 90% массы мирового океана. Встречается в свободном состоянии в виде двух аллотропных модификаций: кислород О2 и озон О3. Эти газы входят в состав атмосферы, кислород в нем составляет около 21% по объему, озон – доли процента. Входит в состав неорганических соединений оксидов и гидроксидов, а также в состав многих солей. Содержится в важнейших органических соединениях: спиртах, альдегидах, кислотах и сложных эфирах. Является органогеном, входит в состав белков, жиров и углеводов, нуклеотидов и т.д.
2. Физические свойства кислорода. При н.у. это бесцветный газ, не имеющий запаха. Температура кипения кислорода (-183оС). Немного тяжелее воздуха, немного растворим в воде (в 100 объемах воды — около 5 объемов кислорода при 0оС). Жидкий кислород притягивается магнитом.
Химические свойства кислорода. Кислород во всех химических реакциях проявляет сильные окислительные свойства. Его бинарные соединения с элементами называются оксидами. Кислород образует оксиды со всеми элементами, кроме гелия, неона и аргона. Оксиды образуются при окислении простых веществ (непосредственно не взаимодействуют с кислородом только галогены, золото и платина), при окислении сложных веществ. Реакции взаимодействия веществ с кислородом часто сопровождаются выделением тепла и света и поэтому их называют горением. При горении веществ на воздухе выделяется такое же тепла, но часть его тратится на нагревание азота, входящего в состав воздуха, поэтому температура пламени значительно снижается. Оксиды могут образовываться и при разложении сложных веществ (гидроксидов и солей), эти реакции, наоборот, обычно идут с поглощением энергии.
P0 O20 => P2 5 O5-2
S O2 => SO2
Mg O2 => MgO
Fe O2 => Fe2O3
CH4 O2 => CO2 H2O
ZnS O2 => ZnO SO2
Cu(OH)2 => CuO H2O
CaCO3 => CaO CO2
Роль в природе: процессы дыхания, гниения по химической сути являются процессами окисления сложных органических веществ.
Применение: Как сырье для получения различных соединений; для интенсификации процессов в химической и металлургической промышленности; для получения высоких температур (сварка и резка металла, ракетное топливо); жидкий кислород в смеси с опилками или другими горючими веществами используют как ВВ; газообразный кислород используют в медицине для лечения различных заболеваний (оксигенотерапия).
3. Озон. При н.у. это газ, обладающий характерным запахом. Температура кипения озона (-112оС). Он тяжелее воздуха, растворим в воде (в 100 объемах воды — около 50 объемов озона при 0оС). 
Озон образуется из кислорода при пропускании через него электрического разряда или жесткого УФ излучения.
О2 => O3
Обратная реакция – распад озона – протекает самопроизвольно, т.е. озон неустойчивое соединение. Озон – один из сильнейших окислителей, при его взаимодействии с веществами тоже образуются оксиды, но реакции протекают более энергично, чем с кислородом. Как сильный окислитель озон убивает бактерии и применяется для обеззараживания воды и помещений. Озон ядовит, ПДК в воздухе 10-5% , при этой концентрации хорошо ощущается его запах. В верхних слоях атмосферы концентрация озона обычно лежит в пределах 10-7-10-6.
Оксиды- один из важнейших классов неорганических веществ. Они делятся на основные, кислотные и амфотерные оксиды. Все они образуют гидроксиды и соответствующие соли. Кислород входит также в состав большого количества органических соединений.
Роль кислорода в организме и использование кислорода и озона в медицине. Содержание кислорода в организме 62,43%. Взрослый человек потребляет 264 см3 кислорода в мин. Оксиген имеет исключительное биологической значение, от него зависят важнейшие биохимические процессы, он участвует во всех видах обмена веществ. Наиболее известный физиологический процесс с участием кислорода – дыхание. Этот сложный физиологический процесс включает в себя не только процесс газообмена в легких, но и транспорт кислорода с током крови от легких к клеткам. Именно там в митохондриях происходит процесс тканевого дыхания, т.е. процесс окисления органических веществ. Продукты окисления (СО2) кровь уносит к легким. А энергия, которая выделяется в процессе реакции окисления тратится на образование молекул АТФ. При гидролизе АТФ энергия снова выделяется и расходуется на нужды организма. Т.е. с участием кислорода проходят все окислительные реакции в организме, за счет энергии этих реакций протекают все физиологические процессы. С кислородом связаны также фагоцитарные функции организма. Вспомните особенности строения атома кислорода. У него ярко выраженные неметаллические, окислительные свойства. В медицинской практике используются не только множество соединений кислорода (оксидов, гидроксидов, кислот, солей, органических и неорганических соединений) но и простые вещества – кислород и озон. Оксигенотерапия – кислородом лечат гельминтозы, сердечно-сосудистые и инфекционные заболевания, он стимулирует работу нервной системы, обладает снотворным действием и т.д. Оксигенотерапия лежит в основе климатолечения. Оксигенобаротерапия – метод лечения, в котором используется дыхание воздушной смесью с повышенным содержанием кислорода, в специальных герметичных помещениях барокамерах. В озонотерапии используют озон. Это сильнейший окислитель, в больших количествах он ядовит. Образуется из кислорода при электрическом разряде, под действием УФ. Озон обладает бактерицидным, дезодорирующим действием; используется для обработки питьевой воды, помещений, белья; в смеси с кислородом используется для лечения различных заболеваний.
4.Сера как химический элемент. Сульфур №16. 3 период,6 группа, главная подгруппа.
Состав атома: 16р, 16е—, 16n.
Схема строения: заряд ядра 16, три электронных слоя (2 е—, 8 е—, 6 е—)
Электронная и графическая формулы:
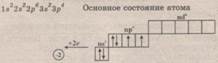
 Типичный неметалл. Характерные степени окисления: 6 и -2, возможна 4.
Типичный неметалл. Характерные степени окисления: 6 и -2, возможна 4.
Возможные валентности: II, IV, VI.

 Широко распространен в природе, содержание в земной коре 0,1%. Встречается в свободном состоянии (самородная сера) и в виде соединений. Например: сульфидов (железный колчедан FeS2, свинцовый блеск PbS) и сульфатов (гипс CaSO4∙2H2O, глауберова соль Na2SO4∙10H2O).Органоген, входит в состав белка
Широко распространен в природе, содержание в земной коре 0,1%. Встречается в свободном состоянии (самородная сера) и в виде соединений. Например: сульфидов (железный колчедан FeS2, свинцовый блеск PbS) и сульфатов (гипс CaSO4∙2H2O, глауберова соль Na2SO4∙10H2O).Органоген, входит в состав белка
.
5. Сера как простое вещество. Для серы характерна аллотропия. Три модификации. Сера ромбическая: твердое вещество желтого цвета, молекулярная кристаллическая решетка, S8, плавится при 112,8оС, плотность 2,07 г/см3. Нерастворима в воде, не смачивается. Растворяется в бензоле. Сера моноклинная: твердое вещество темно-желтого цвета, молекулярная кристаллическая решетка, S8, плавится при 119,3оС, плотность 1,96г/см3 . При н.у. неустойчива, превращается в ромбическую. Сера пластическая: резиноподобная коричневая масса, аморфное строение, S∞. При н.у. неустойчива, превращается в ромбическую.
 Химические свойства: типичный неметалл, может быть и окислителем и восстановителем.
Химические свойства: типичный неметалл, может быть и окислителем и восстановителем.
Как окислитель взаимодействует с металлами и водородом:
Al S→ Al2S3
Na S → Na2S
H2 S → H2S
Как восстановитель – с активными неметаллами:
S O2 →SO2


Получение:
1). Самородная сера. Перегретым водяным паром обрабатывают породу.
2). Разложение пирита без доступа воздуха: FeS2 → FeS S
3). Неполное сгорание сероводорода: H2S O2 → S H2O
Применение:
1). Получение серной кислоты и сульфатов.
2). Получение сульфитов.
3). Производство красителей, резины, черного пороха, спичек, лекарств.
Сера в организме человека и ее использование в медицине.
Содержание в организме 0,16%, суточная потребность 4-5 грамм. Больше всего серы содержится в кератине волос, костях, нервной ткани; входит в состав белков (аминокислоты цистеин и метионин), гормонов, витаминов. В организме серная кислота, образующаяся в процессе метаболизма, обезвреживает ядовитые продукты метаболизма (фенол, скатол, крезол) и чужеродные токсины (тяжелые металлы). Простое вещество сера оказывает противомикробное и противопаразитарное действие, серные мази и суспензии используют для лечения кожных заболеваний, гельминтозов. 1% раствор серы в персиковом масле (сульфозин) используют при лечении шизофрении и алкоголизма. Тиосульфат натрия обладает противовоспалительным и противоаллергическим действием.
Дата добавления: 2022-02-09; просмотров: 82; Нарушение авторских прав
§

 H2S — сероводород, бесцветный газ с характерным запахом гниющего белка. Кристаллизуется при -85,7оС, кипит при -60,8оС. Немного тяжелее воздуха, при н.у. в 1л воды растворяется 2,5 л сероводорода.
H2S — сероводород, бесцветный газ с характерным запахом гниющего белка. Кристаллизуется при -85,7оС, кипит при -60,8оС. Немного тяжелее воздуха, при н.у. в 1л воды растворяется 2,5 л сероводорода.
Восстановитель, окисляется кислородом воздуха (горение)
H2S O2 →SO2 H2O, при недостатке кислорода или низкой температуре H2S O2 →S H2O
Водный раствор называют сероводородной водой, на воздухе, на свету она становится мутной (опалесцирует) в результате образования коллоидного раствора серы в воде (см. предыдущую реакцию). Кроме того раствор сероводорода обладает свойствами кислоты, поэтому его называют сероводородной кислотой, это слабая кислота. Образуется при гниении белков, встречается в водах минеральных источников и вулканических газах. Такие источники могут быть причиной гибели человека ( Сероводород очень ядовит!), но могут использоваться и для лечения желудка, почек, кожи. Соли сероводородной кислоты называют сульфидами. Большинство из них нерастворимо в воде. В природе эти соли образуют минералы, которые используют как руды цветных металлов: ZnS, CuS, PbS…Многие сульфиды имеют переменный состав. В легкой промышленности используют сульфиды натрия и кальция для очистка кожи от шерсти. Сульфиды щелочноземельных металлов служат основой люминофоров. А в лабораториях реакции образования сульфидов используют для определения многих металлов, т.к. эти соли имеют характерный цвет.


Дата добавления: 2022-02-09; просмотров: 17; Нарушение авторских прав
§
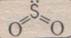 SO2 — оксид серы (IV), сернистый газ. Бесцветный газ с резким запахом, на воздухе не горит, легко растворяется в воде, ядовит.
SO2 — оксид серы (IV), сернистый газ. Бесцветный газ с резким запахом, на воздухе не горит, легко растворяется в воде, ядовит.
Химические свойства: кислотный оксид, характерны восстановительные свойства.
Как восстановитель:
SO2 O2 SO3, катализатор V2O5
SO3, катализатор V2O5
Как кислотный оксид сернистый газ взаимодействует со щелочами:
SO2 NaОН →NaНSO3 и Na2SO3 H2O (соли гидросульфиты и сульфиты).
С водою образуется сернистая (сульфитная) кислота.
SO2 H2O ↔ H2 SO3 Это слабый электролит. Нестойкая, существует только в водных растворах, легко окисляется кислородом воздуха до серной кислоты: H2 SO3 O2 → H2 SO4.
 Обесцвечивает органические красители.
Обесцвечивает органические красители.
Получение:
1). Горение серы: S O2 →SO2
2). Обжиг сульфидов: ZnS O2 → ZnO SO2 и т.д.
Большое количество сернистого газа образуется при горении органических соединений (каменный уголь).
Применение:
1). Производство серной кислоты.
2). Производство сульфитов и гидросульфитов.
3). В с/х для уничтожения насекомых и микроорганизмов.
4). В текстильной промышленности для отбеливания тканей, соломки и т.д.
5). При консервировании фруктов и ягод.
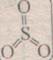 SO3 – оксид серы (VI), серный ангидрид. Молекула существует только в парах, при понижении температуры полимеризуется. При н.у. это бесцветная жидкость, летучая, «дымит» на воздухе, кристаллизуется при 17оС, кипит при 66оС. Легко растворяется в воде, токсичен.
SO3 – оксид серы (VI), серный ангидрид. Молекула существует только в парах, при понижении температуры полимеризуется. При н.у. это бесцветная жидкость, летучая, «дымит» на воздухе, кристаллизуется при 17оС, кипит при 66оС. Легко растворяется в воде, токсичен.
Химические свойства: сильный окислитель, кислотный оксид.
Как кислотный оксид:
SO3 H2O →H2 SO4 Q, взаимодействует с водой, образуя серную кислоту, при этом выделяется большое количества тепла.
SO3 NaОН →NaНSO4 и Na2SO4 H2O, т.е. образует гидросульфаты и сульфаты
Получение: в промышленности SO2 O2 SO3, катализатор V2O5
SO3, катализатор V2O5
Применение: как промежуточный продукт при производстве серной кислоты, в лаборатории как сильное водопоглощающее средство.
Дата добавления: 2022-02-09; просмотров: 13; Нарушение авторских прав
§
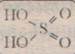 H2 SO4 –ббесцветная маслянистая жидкость, плотность 98% раствора 1,84 г/см,— нелетучая и запаха не имеет. Чрезвычайно гигроскопична, легко поглощает воду. При растворении выделяется большое количество тепла.
H2 SO4 –ббесцветная маслянистая жидкость, плотность 98% раствора 1,84 г/см,— нелетучая и запаха не имеет. Чрезвычайно гигроскопична, легко поглощает воду. При растворении выделяется большое количество тепла.
Химические свойства: 1. Сильная кислота, распадается на ионы по двум ступеням практически на 100%, образует два ряда солей.
H2SO4 ↔ H HSO4— — гидросульфат –ион
HSO4— ↔ H SO4 2- — сульфат- ион
Разбавленная кислота H2 SO4 обладает всеми общими свойствами кислот: изменяет окраску растворов индикаторов); взаимодействует с основаниями, основными оксидами и солями (реакции ионного обмена, не ОВР!):
H2SO4 2 KOH → K2SO4 2H2O;
2H SO42- 2K 2OH— = 2K SO42- 2H2O; H OH— = H2O
H2SO4 KOH → KНSO4 H2O
3H2SO4 Al2O3 → Al2(SO4)3 3H2O;
2H 3SO42- Al2O3 → 2Al3 3SO42- H2O ; 2H Al2O3 → 2Al3 H2O
H2SO4 Na2CO3→ Na2SO4 H2CO3 → Na2SO4 H2O CO2↑;
2H SO42- 2Na CO3→ 2Na SO42- H2O CO2↑; 2H CO3→ H2O CO2↑;
Во всех этих реакциях главную роль играют ионы водорода, а SO42- просто присутствует в растворе. Специфической реакцией иона SO42- (т.е. серной кислоты и всех ее солей) является реакция с солями бария.
H2SO4 BaCl2 → 2HCl BaSO4↓
2H SO42- Ba2 2Cl— → 2H 2Cl— BaSO4↓
SO42- Ba2 → BaSO4↓
Na2SO4 Ba(NO3)2 → 2NaNO3 BaSO4↓
2Na SO42- Ba2 2NO3— → 2Na 2NO3— BaSO4↓
SO42- Ba2 → BaSO4↓
Эту реакцию называют «качественной реакцией» на серную кислоту и ее соли, потому что в ней образуется характерный мелкокристаллический белый осадок BaSO4. Реакцию используют в лабораторной практике для определения наличия в растворе иона SO42-.
При взаимодействии с металлами серная кислота может вести себя по-разному, в зависимости от концентрации и активности металла.
В разбавленной H2SO4 окислителем является ион Н , поэтому разбавленная серная кислота взаимодействует только с металлами стоящими в ряду напряжений до водорода, причем, одним из продуктов реакции будет газ водород.
H2SO4(разб.) Zn → H2 ↑ ZnSO4
Zn0 – 2e— → Zn 2 H e— → H0
Но если мы возьмем концентрированную кислоту, то в роли окислителя выступит S 6 , и вместо водорода мы получим продукт ее восстановления – какое-то соединение серы. Какое? Это зависит от активности металла, температуры, концентрации кислоты. Обычно образуется смесь таких веществ. Но, упрощая, можно считать, что чем активнее металл, тем более глубоко идет процесс восстановления, и степень окисления серы в продукте реакции будет ниже. Следует также отметить, что с концентрированной H2SO4 взаимодействуют все металлы, кроме золота и платины, но на холоду железо, алюминий и хром пассивируются (не реагируют из-за образования прочной пленки на поверхности металла), а некоторые металлы не реагируют и с разбавленной серной кислотой (если при этом образуется нерастворимая соль).
H2SO4(конц.) Zn → ZnSO4 H2О S Zn0 – 2e— → Zn2 S 6 6e— → S0
H2SO4(конц.) Cu → ZnSO4 H2О SO2 Cu0 – 2e— → Cu2 S 6 2e— → S 4
H2SO4(конц.) Ca → CaSO4 H2О CaS Ca0 – 2e— → Ca2 S 6 8e— → S-2
H2SO4(конц.)– сильный окислитель, и может окислять не только металлы, но и неметаллы и даже их соединения, обугливает органические вещества (т.к. забирает воду, например, у углеводов)
H2SO4(конц.) C → СО2↑ H2О SO2↑
C0 – 4e— → C4 S 6 2e— → S 4
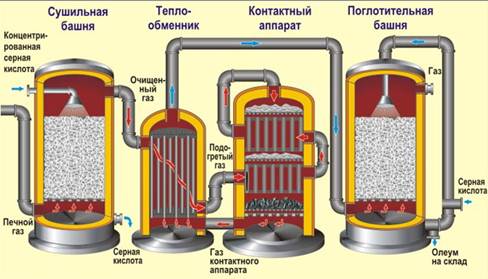
 Получение серной кислоты. В промышленности процесс получения серной кислоты обычно включает в себя три стадии. Сырьем является FeS2 (пирит, железный колчедан).
Получение серной кислоты. В промышленности процесс получения серной кислоты обычно включает в себя три стадии. Сырьем является FeS2 (пирит, железный колчедан).
1) обжиг колчедана (принцип теплообмена, в «кипящем слое», воздух обогащен кислородом):
FeS2 O2 → Fe2O3 SO2 13746кДж
2) каталитическое окисление сернистого газа (4500С, катализатор V2O5 оксид ванадия (V), принцип противотока):
SO2 O2 ↔ SO3 197,9кДж
 3) гидратация оксида серы (VI) (принцип противотока, принцип теплообмена, орошение концентрированной серной кислотой)
3) гидратация оксида серы (VI) (принцип противотока, принцип теплообмена, орошение концентрированной серной кислотой)
SO3 H2O →H2 SO4 130,6 кДж
Конечным продуктом является «олеум» — раствор SO3 в концентрированной H2 SO4.
В производстве серной кислоты часто используют сернистый газ, получаемый при обжиге цветных руд, горении топлива или свободной серы. Т.е. первая стадия может быть немного другой, а вот две последние – всегда одинаковы.
Применение. Серная кислота – «хлеб» химической промышленности.
 1) получение сульфатов, которые широко используются в народном хозяйстве, например:
1) получение сульфатов, которые широко используются в народном хозяйстве, например:
— K2SO4 и (NH4)2 SO4 — сульфаты калия и аммония, в с/х как минеральные удобрения
— CuSO4∙5H2O – медный купорос, в с/х как средство борьбы с болезнями растений, в легкой промышленности как краситель, в строительстве как противогрибковое средство, в гальванопластике (покрытие слоем меди)
FeSO4∙ 7H2O – железный купорос, в с/х средство борьбы с вредителями растений, в легкой промышленности при крашении тканей.
CaSO4∙ 2H2O – минерал гипс, в строительстве используют «жженый гипс» 2CaSO4∙ H2O под названием «алебастр» в состав шпаклевок, в медицине — слепки, шины, в художественно- прикладном творчестве.
Na2SO4∙ 10H2O – глауберова соль, в медицине как слабительное, в производстве стекла
BaSO4 –в медицине, (рентген желудка), в производстве бумаги, резины как наполнитель
2) в цветной металлургии (гидрометаллургия, получение меди, никеля и т.д.) и обработке металлов (печатные платы, гальваника, аккумуляторы и т.д.)
3) неорганический синтез (производство минеральных удобрений, пигментов, кислот…) и органический синтез (производство красителей, ВВ, полимеров…)
4) производство бумаги
5) производство соды (стекло, СМС)
Соли серной кислоты не обладают окислительными свойствами, вступают в обычные реакции ионного обмена.
Дата добавления: 2022-02-09; просмотров: 38; Нарушение авторских прав
Получение серы
1. Извлечение самородной серы из ее месторождений
2. Переработка природных газов, содержащих H2S (окисление при недостатке О2).
3. В лаборатории серу получают взаимодействием SО2 и H2S в водном растворе:
SО2 2H2S = 3S↓ 2H2О
Реакции с более эо неметаллами
Непосредственно сера не взаимодействует с азотом и йодом.
Практически важными являются реакции соединения серы с кислородом. При обычных условиях сера горит на воздухе, окисляясь кислородом до диоксида серы:
S O2 = SO2
Высший оксид SO3 образуется при окислении серы или SO2 кислородом в присутствии катализаторов:
2S 3O2 = 2SO3 триоксид серы (оксид серы (VI)).
Сера непосредственно соединяется с фтором (при обычной температуре) и с хлором (расплавленная сера):
S 3F2 = SF6 гексафторид серы
2S Cl2 = S2CI2 дитиодихлорид серы
S2Cl2 Cl2 = 2SCI2 дихлорид серы
Реакции с менее эо неметаллами
S Н2 = H2S сероводород
2S С = CS2 сероуглерод
3S 2Р = P2S3 сульфид фосфора (III)
Реакции с металлами
1) Сера непосредственно соединяется с большинством Me (кроме Pt, Au), образуя сульфиды. С некоторыми Me реакция протекает при обычной температуре, например:
S Сu = CuS
S 2Ag = Ag2S
S Hg = HgS
С железом и многими другими Me сера реагирует при нагревании:
S Fe = FeS
Реакции со сложными веществами — сильными окислителями
Сильные окислители (HNO3, H2SO4 конц., К2Сr2O7 и др.) окисляют свободную серу до SO2 или H2SO4:
S 2HNO3(разб.) = H2SO4 2NO↑
S 6HNO3(конц.) = H2SO4 6NO2↑ 2Н2O
S 2H2SO4(конц.) = 3SO2↑ 2Н2O
S К2Сr2O7 = Сr2O3 K2SO4
Сера — восстановитель:
S — 4e- = S 4; S — 6e- = S 6
В соединениях с более ЭО элементами атомы серы находятся в положительно заряженном состоянии.
Сера — окислитель:
S 2e- = S2-
Для завершения октета на внешнем слое атомы серы принимают недостающие 2 электрона и в состоянии S2- образуют ионные и ковалентные связи с водородом, металлами и некоторыми неметаллами.
Сера как простое вещество. аллотропия и свойства серы. химия 9 класс. кузнецова
Глава 4. Подгруппа кислорода и ее типичные представители



Сера широко встречается в природе как в виде простого вещества (самородная сера), так и в виде соединений (сульфиды и сульфаты). Большие залежи самородной серы у нас в стране находятся в Поволжье. Крупные ее месторождения имеются в Туркмении, Узбекистане, США, Италии, Японии и Испании. Это один из распространенных элементов земной коры.
 Сера известна народам с глубокой древности и упоминается Гомером в «Одиссее» как лекарство от недугов. Подробные сведения о добывании и применении серы дает в своей энциклопедии античных знаний — «Естественной истории» — Плиний Старший. Сера применялась в Древнем Египте уже за две тысячи лет до новой эры для приготовления красок и косметических средств, для беления тканей. В Древнем Риме ее использовали для лечения кожных заболеваний, а в Древней Греции, сжигая ее, дезинфицировали помещение и вещи. В Средние века сера была одним из «основных начал природы» у алхимиков. Благодаря ее горючести она считалась необходимой составной частью «философского камня». Но именно из-за этого серу долго не рассматривали с научных позиций как химический элемент. Серу начали изучать лишь с момента крушения теории флогистона и кислородной теории кислот. В отличие от названий кислорода (от лат. oxigenium — «рождающий кислоту»), селена (от греч. selene — «Луна») и теллура (от лат. tellus — «Земля»), происхождение названия «сера» неизвестно. В наши дни сера широко используется в химической промышленности.
Сера известна народам с глубокой древности и упоминается Гомером в «Одиссее» как лекарство от недугов. Подробные сведения о добывании и применении серы дает в своей энциклопедии античных знаний — «Естественной истории» — Плиний Старший. Сера применялась в Древнем Египте уже за две тысячи лет до новой эры для приготовления красок и косметических средств, для беления тканей. В Древнем Риме ее использовали для лечения кожных заболеваний, а в Древней Греции, сжигая ее, дезинфицировали помещение и вещи. В Средние века сера была одним из «основных начал природы» у алхимиков. Благодаря ее горючести она считалась необходимой составной частью «философского камня». Но именно из-за этого серу долго не рассматривали с научных позиций как химический элемент. Серу начали изучать лишь с момента крушения теории флогистона и кислородной теории кислот. В отличие от названий кислорода (от лат. oxigenium — «рождающий кислоту»), селена (от греч. selene — «Луна») и теллура (от лат. tellus — «Земля»), происхождение названия «сера» неизвестно. В наши дни сера широко используется в химической промышленности.
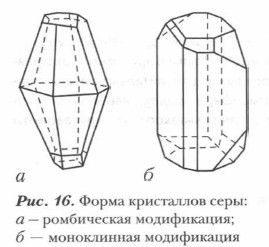
Аллотропия и физические свойства серы. В отличие от кислорода, образующего две аллотропные формы, сера образует значительно большее число аллотропных видоизменений (модификаций), отличающихся не только составом, но и строением кристаллической решетки, а следовательно, и свойствами.
Сера в свободном виде образует две относительно устойчивые аллотропные модификации: ромбическую и моноклинную (табл. 15). Известны и другие, менее стойкие модификации серы. На образование аллотропных модификаций влияет и способность серы образовывать цепи —S—S—S—S—S—S—S—S—, которые могут замыкаться в кольца, образуя циклические молекулы из восьми атомов S8. Из них состоят молекулярные кристаллы ромбической и моноклинной серы (рис. 16). Все аллотропные модификации со временем переходят в ромбическую форму как наиболее устойчивую.
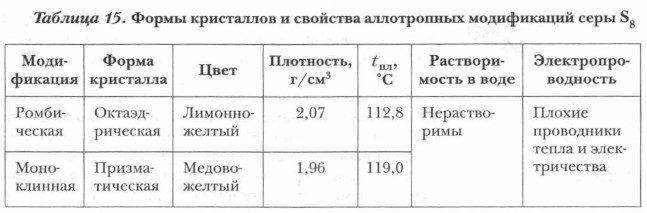
Ромбическая сера встречается в природе в свободном состоянии. При обычных условиях это хрупкое кристаллическое вещество желтого цвета. Ее кристаллы плавятся при 119 °С. Она нерастворима в воде, но хорошо растворяется в сероуглероде, бензине, бензоле и других органических растворителях. Сера плохо проводит тепло и электричество.
 На примере серы можно понять переход ее разных аллотропных форм друг в друга.
На примере серы можно понять переход ее разных аллотропных форм друг в друга.
При нормальных условиях в узлах кристаллической решетки ромбической серы находятся кольцевые молекулы S8. При нагревании выше 119 °С сера плавится. Начинается разрыв колец с образованием открытых цепей, способных соединяться друг с другом, что приводит к увеличению вязкости, разрушению кристаллической решетки и переходу серы в пластическую модификацию.
Окончание параграфа >>>
Сравните строение атомов и свойства кислорода и серы. укажите их сходство и различия. — знания.site
Сходство: на внешнем энергетическом уровне 6 электронов у каждого, низшая степень окисления равна -2.
Различия: у кислорода — 2 энергетических уровня, у атома серы — три, поэтому при переходе в возбужденное состояние в атоме серы есть возможность распаривания электронов и их переходе на свободный 3d подуровень. получается, что сера может образовать 4 и 6 связей (по числу неспаренных электронов). Возможные степени окисления серы: 4, 6. У кслорода возможность распаривания отсутствует, поэтому у него только 2 неспаренных электрона и атом кислорода может образовать 2 связи и проявляет степень окисления 2 (в молекуле фторида кислорода OF2).
Радиус атома серы больше, чем радиус атома кислорода. Кислород проявляет более сильные неметаллические свойства, более сильные окислительные способности.
Характеристика элемента
16S1s22s22p63s23p4
Аr = 32,066
ЭО — 2,5
Изотопы: 32S (95,084 %); 34S (4,16 %); 33S и 36S (< 1 %)
Кларк в земной коре 0,05 % по массе. Формы нахождения:
1) самородная сера (свободная S);
2) S2- (H2S и сульфиды металлов);
3) S 6 (сульфаты Ва и Са);
4) в составе белков, витаминов.
Сера — типичный неметалл, р-элемент. Устойчивые С.О. в соединениях -2, 4, 6.
Отличительное свойство — способность образовывать прочные гомоатомные связи-S-S-S- что приводит к существованию линейных и циклических цепей.
Химические свойства кислорода
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т.е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.
Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O2, прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств.
Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 oC и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:

