- — сероуглерод — химическая энциклопедия
- В производстве вискозы и целлофана
- В различных приложениях
- В химической промышленности
- Давление газа
- Древнее использование
- Молекулярный вес
- Номенклатура
- Плотность
- Получение
- При производстве тетрахлорметана
- Присутствие в природе
- Растворимость
- Риски
- Состав
- Температура самовоспламенения
- Точка возгорания
- Точка кипения
- Точка плавления или затвердевания
- Физическое состояние
- Химические свойства
— сероуглерод — химическая энциклопедия
СЕРОУГЛЕРОД (дисульфид
углерода) CS2, мол. м. 76,143; бесцв. жидкость с приятным запахом,
под действием света разлагается, продукты разложения придают желтый цвет и отвратит.
запах. Молекула CS2 линейна, длина связи С — S 0,15529 нм; энергия
диссоциации 1149 кДж/моль. Т. пл. — 111,9°С, т. кип. 46,24°С; плотн.
1,2927 г/см3 (0°С), 1,2630 г/см3 (20 °С);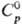 75,56
75,56
Дж/(моль·К);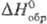 89,41
89,41
кДж/моль, DHпл
4,39 кДж/моль, 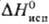
27,4 кДж/моль; S0298 151.3 Дж/(моль·К);
tкрит 273,05 °С, pкрит 7,90 МПа, dкрит
0,44 г/см3; 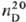
1,62546; e 2,625(25°С); h 0,365·10-7 Пa·c (20°C);
g 3,24 · 10 4 Н/см (20 °С); ур-ние температурной зависимости
давленияпара lgp(мм рт. ст.) =-1385,15/T 7,180 2,088·10-2lgT
— 0,29294·10-3T(161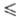 T
T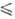 319
319
К), в паре-молекулы CS2. Твердый сероуглерод кристаллизуется в тетрагон/ решетке
(при — 185 °С а = 0,812 нм, с = 0,377 нм, z = 3).
В инертной атмосфере сероуглерод
заметно разлагается выше 300 °С с образованием графита и паров S. Легко
воспламеняется на воздухе ниже 100 °С, горит с образованием СО2 и
SO2. Р-римость сероуглерода в воде (г в 100 г): 0,26 (0°С), 0,19 (30°С).
Ок. — 3 °С образуется гидрат 2CS2 · Н2О. Гидролизуется
водой выше 150°С с образованием СО2, COS, H2S. С этанолом,
диэтиловым эфиром, СНС13 смешивается во всех соотношениях. Сероуглерод-прекрасный
р-ритель жиров, масел, смол, каучуков; растворяет S, P, I2.
При взаимод. с сульфидамищелочных металлов сероуглерод образует тиокарбонаты. Со спиртовыми р-рами щелочей дает
ксантогенаты. Сероуглерод хлорируется в присут. катализаторов: CS2
3Cl2 : CC14 S2Cl2 2S2Cl2 CS2
: CCl4 6S
Легко обменивает S на кислород
при нагр. с оксидамиметаллов.
В пром-сти сероуглерод получают
р-цией СН4 или прир. газа с парами S в присут. силикагеля при 500-700
°С в камере из хромоникелевой стали. Сероуглерод получают также взаимод. древесного
угля и паров S при 750-1000 °С; по одному способу уголь загружают на дно
реторты из нержавеющей стали, жидкая S поступает из плавильного чана, по электротермич.
методу уголь помещают между электродами. Выделяют сероуглерод дистилляцией. Применяют
для получения ксантогенатов целлюлозы в произ-ве вискозы, дитиокарбоковых к-т
(напр., 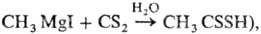
для пром. синтеза ССl4, как р-ритель, экстрагент, вулканизующий агент
для каучука.
Сероуглерод токсичен, поражает нервную
и сердечно-сосудистую системы; ПДК в воздухе рабочей зоны 1 мг/м3,
в атм. воздухе 0,005
мг/м3. Пожароопасен, т. вел. -30°C. КПВ 1,25-50% по объему. Хранят
сероуглерод под слоем воды. И.Н. Один.
Еще по теме:
В производстве вискозы и целлофана
С CS2 Получают ксантаты, которые представляют собой соединения, используемые при производстве вискозы и целлофана.
Для получения искусственного шелка или искусственного шелка используется целлюлоза, которую обрабатывают щелочью и сероуглеродом CS.2 и превращается в ксантогенат целлюлозы, растворимый в щелочи. Этот раствор вязкий и поэтому называется «вязким».
Вискоза проталкивается через очень маленькие отверстия в кислотной ванне. Здесь ксантогенат целлюлозы снова превращается в целлюлозу, которая нерастворима, и образуются длинные блестящие нити.
Нити или волокна могут быть скручены в материал, известный как вискоза.
(1) Целлюлоза NaOH → Щелочная целлюлоза
ROH NaOH → RONa
(2) Щелочная целлюлоза сероуглерод → ксантогенат целлюлозы
RONa S = C = S → RO — C (= S) –SNa
(3) Ксантогенат целлюлозы кислота → Целлюлоза (волокна)
RO — C (= S) –SNa кислота → ROH

Если целлюлозу осаждают путем пропускания ксантогената через узкую щель, целлюлоза регенерируется в виде тонких листов, составляющих целлофан. Он смягчается глицерином и используется в качестве защитной пленки для предметов.

В различных приложениях
Сероуглерод участвует в холодной вулканизации каучуков, служит промежуточным продуктом при производстве пестицидов и используется для получения катализаторов в нефтяной промышленности и при производстве бумаги.
Ксантаты, приготовленные с CS2 Они используются при флотации полезных ископаемых.
В химической промышленности
Сероуглерод является важным химическим соединением, поскольку он используется для получения других химикатов. Он может действовать как промежуточный химический продукт.
Он также используется в качестве технологического растворителя, например, для растворения фосфора, серы, селена, брома, йода, жиров, смол, восков, лаков и камедей.
Это позволяет, среди прочего, производить фармацевтические продукты и гербициды.
Давление газа
279 мм рт. Ст. При 25 ° C.
Это высокое давление пара.
Древнее использование
CS2 это яд для живых организмов. Раньше его использовали для уничтожения вредителей, таких как крысы, сурки и муравьи, выливая жидкость в любое закрытое пространство, в котором эти животные жили (норы и муравейники).
При использовании для этой цели густые токсичные пары уничтожали все живые организмы, находившиеся в замкнутом пространстве.
Он также использовался как глистогонное средство для животных и для удаления личинок мясной мухи из желудка лошадей.
В сельском хозяйстве он использовался как инсектицид и нематоцид, для фумигации почвы, для фумигации питомников, зернохранилищ, силосов и зерновых мельниц. Также были опрысканы железнодорожные вагоны, корабли и баржи.

Все эти виды использования были запрещены из-за высокой воспламеняемости и токсичности CS.2.
Молекулярный вес
76,15 г / моль
Номенклатура
— сероуглерод
— сероуглерод
— дитиокарбоновый ангидрид
Плотность
Жидкость = 1,26 г / см3 при 20 ° С.
Пар = 2,67 раза больше воздуха.
Его пары более чем в два раза тяжелее воздуха, а жидкость тяжелее воды.
Получение
Сероуглерод коммерчески получают реакцией серы с углеродом. Процесс проводят при температуре 750-900 ° С.
С 2 S → CS2
Вместо угля также можно использовать метан или природный газ, и даже могут использоваться этан, пропан и пропилен, и в этом случае реакция протекает при 400-700 ° C с высоким выходом.
Его также можно получить реакцией природного газа с сероводородом H2S при очень высокой температуре.
При производстве тетрахлорметана
Сероуглерод реагирует с хлором Cl2 дать четыреххлористый углерод CCl4, который является важным негорючим растворителем.
CS2 3 Cl2 → CCl4 S2Cl2
Присутствие в природе
CS2 это натуральный продукт, присутствующий в атмосфере в очень небольших количествах (следы). Он образуется фотохимически в поверхностных водах.
Воздействие солнечного света на определенные соединения, присутствующие в морской воде, такие как цистеин (аминокислота), приводит к образованию сероуглерода.

Он также выделяется естественным путем во время извержений вулканов и в небольших количествах обнаруживается на болотах.
Обычно мы вдыхаем его в очень небольших количествах, и он присутствует в некоторых продуктах питания. Он также содержится в сигаретном дыме.
В окружающей среде он разлагается солнечным светом. На земле он движется сквозь него. Некоторые микроорганизмы в почве разрушают его.
Растворимость
Очень мало растворим в воде: 2,16 г / л при 25 ° C. Растворим в хлороформе. Смешивается с этанолом, метанолом, эфиром, бензолом, хлороформом и четыреххлористым углеродом.
Риски
CS2 он легко воспламеняется. Многие из их реакций могут вызвать пожар или взрыв. Смеси его паров с воздухом взрывоопасны. При воспламенении выделяет раздражающие или токсичные газы.
Сероуглерод нельзя сливать в канализацию, так как в трубках остается смесь CS.2 и воздух, который может вызвать взрыв при случайном воспламенении.
Его пары самопроизвольно воспламеняются при контакте с искрами или горячими поверхностями.
Сероуглерод сильно раздражает глаза, кожу и слизистые оболочки.
При вдыхании или проглатывании он серьезно влияет на центральную нервную систему, сердечно-сосудистую систему, глаза, почки и печень. Он также может всасываться через кожу, вызывая повреждение.
Состав
Сероуглерод имеет один атом углерода и два атома серы по бокам от него.
Связи между атомом углерода и атомами серы ковалентные и двойные, поэтому они очень прочные. Молекула CS2 он имеет линейную и симметричную структуру.

Температура самовоспламенения
90 ° С
Точка возгорания
-30 ºC (метод закрытой чашки).
Точка кипения
46,0 ºC
Точка плавления или затвердевания
-110,8 ° С
Физическое состояние
От бесцветной до желтоватой жидкости.
Химические свойства
CS2 он легко испаряется при комнатной температуре, так как его температура кипения очень низкая, а давление пара очень высокое.
Сероуглерод очень легко воспламеняется. Его пары очень легко воспламеняются даже при нагревании от электрической лампочки. Это означает, что он очень быстро реагирует с кислородом:
CS2 3 O2 → CO2 2 СО2
Тот факт, что он имеет высокое давление пара при комнатной температуре, делает опасным находиться рядом с пламенем.
При нагревании до разложения он может легко взорваться с выделением токсичных газов оксида серы. При температуре выше 90 ° C он самовоспламеняется.
Он разлагается при длительном хранении. Агрессивно в отношении меди и ее сплавов. Он также вступает в реакцию с некоторыми пластиками, каучуками и покрытиями.
Реагирует при определенных условиях с водой с образованием карбонилсульфида OCS, диоксида углерода CO.2 и сероводород H2S:
CS2 H2O → OCS H2S
CS2 2 часа2O → CO2 2 часа2S
Со спиртами (ROH) в щелочной среде образует ксантогенаты (RO-CS-SNa):
CS2 ROH NaOH → H2O RO — C (= S) –SNa
