Изучение свойств газов, уравнения реакций
Свойства газообразных веществ активно изучают в настоящее время. Повышенный интерес науки к газам объясняется их большим значением для существования всего человечества. Газообразные вещества и их смеси применяют в разных сферах хозяйственной деятельности.
Газообразные углеводороды могут использоваться как автомобильное топливо, которое дешевле по сравнению с бензином. С помощью газа отапливают жилые дома, здания и сооружения разного целевого назначения. Без газов не обходится медицина и фармацевтика. С помощью газов производят многие лекарственные препараты и компоненты.
- хроматография;
- спектральный анализ.
В процессе практических опытов устанавливают степень чистоты газообразных веществ и наличие в их составе примесей, а также определяют температуру конденсации и содержание масла. Особенно ценными для фармакологии являются следующие газообразные вещества и смеси:
- диоксид углерода;
- кислород;
- сжатый воздух;
- углерод.
Данные газы используют в качестве формообразующих для многих лекарственных средств. Газообразные вещества необходимы для реализации разнообразных технологических процессов в медицине и дезинфекции профессионального оборудования. С помощью газообразных веществ и их смесей упаковывают продукцию на предприятиях пищевой промышленности.
В тяжелой промышленности также используют разные газы. В больших объемах газообразные вещества получают с использованием природного сырья, к примеру:
- уголь;
- кокс;
- природный газ.
Наиболее популярным методом получения газов из атмосферного воздуха газов является криогенная технология. В процессе газы из атмосферы подвергают воздействию низких температур и сжижению. Другим известным способом синтеза газообразных веществ служит адсорбционный метод, который заключается в избирательном поглощении газов сорбентами.
Свойства и уравнения химических реакций для газообразных веществ:
История открытия кислорода
Открытие кислорода ознаменовало новый период в развитии химии. С глубокой древности было известно, что для горения необходим воздух. Процесс горения веществ долгое время оставался непонятным. В эпоху алхимии широкое распространение получила теория флогистона, согласно которой вещества горят благодаря их взаимодействию с огненной материей, то есть с флогистоном, который содержится в пламени.
2HgO t° → 2Hg O2↑
Оксиды – бинарные соединения, в состав которых входит кислородПри внесении тлеющей лучины в сосуд с газом она ярко вспыхивала. Ученый считал, что тлеющая лучина вносит в газ флогистон, и он загорается. Д. Пристли пробовал дышать полученным газом, и был восхищен тем, как легко и свободно им дышится.
Имея хорошо оснащенную на то время лабораторию, А. Лавуазье повторил и усовершенствовал опыты Д. Пристли. А. Лавуазье измерил количество газа, выделяющееся при разложении определенной массы оксида ртути. Затем химик нагрел в герметичном сосуде металлическую ртуть до тех пор, пока она не превратилась в оксид ртути (II).
Он обнаружил, что количество выделившегося газа в первом опыте равно газу, поглотившемуся во втором опыте. Следовательно, ртуть реагирует с каким-то веществом, содержащимся в воздухе. И это же вещество выделяется при разложении оксида. Лавуазье первым сделал вывод, что флогистон здесь совершенно ни при чем, и горение тлеющей лучины вызывает именно неизвестный газ, который в последствии был назван кислородом. Открытие кислорода ознаменовало крах теории флогистона!
Кислород и его получение
Здравствуйте. Вы уже читали мои статьи в блоге Tutoronline.ru. Сегодня я расскажу Вам о кислороде и о способах его получения. Напоминаю, если у Вас будут ко мне вопросы, Вы можете писать их в комментариях к статье. Если же Вам понадобиться любая помощь по химии, записывайтесь на мои занятия в расписании. Буду рад Вам помочь.
Кислород распространён в природе в виде изотопов 16О, 17О, 18О, которые имеют следующее процентное содержание на Земле – 99,76%, 0,048%, 0,192% соответственно.
В свободном состоянии кислород находится в виде трёх алло-тропных модификаций: атомарного кислорода — Оо , дикислорода – О2 и озона – О3. Причём, атомарный кислород может быть получен следующим образом:
КClO3 = KCl 3O0
KNO3 = KNO2 O0
Кислород входит в состав более 1400 различных минералов и органических веществ, в атмосфере его содержание составляет 21% по объёму. А в человеческом теле содержится до 65% кислорода. Кислород газ без цвета и запаха, мало растворим в воде (в 100 объёмах воды при 20оС растворяется 3 объёма кислорода).
В лаборатории кислород получают умеренным нагреванием некоторых веществ:
1)При разложении соединений марганца ( 7) и ( 4):
2KMnO4 → K2MnO4 MnO2 O2
перманганат манганат
калия калия
2MnO2 → 2MnO O2
2)При разложении перхлоратов:
2KClO4 → KClO2 KCl 3O2
перхлорат
калия
3) При разложении бертолетовой соли (хлората калия).
При этом образуется атомарный кислород:
2KClO3 → 2 KCl 6O0
хлорат
калия
4) При разложении на свету солей хлорноватистой кислоты — гипохлоритов:
2NaClO → 2NaCl O2
Ca(ClO)2 → CaCl2 O2

5) При нагревании нитратов.
При этом образуется атомарный кислород. В зависимости от того, какое положение в ряду активности занимает металл нитрата, образуются различные продукты реакции:
2NaNO3 → 2NaNO2 O2
Ca(NO3)2 → CaO 2NO2 O2
2AgNO3 → 2 Ag 2NO2 O2
6) При разложении пероксидов:
2H2O2 ↔ 2H2O O2
7) При нагревании оксидов неактивных металлов:
2Аg2O ↔ 4Аg O2
Данный процесс имеет актуальное значение в быту. Дело в том, что посуда, изготовленная из меди или серебра, имея естественный слой оксидной плёнки, при нагревании образует активный кислород, что является антибактериальным эффектом. Растворение солей неактивных металлов, особенно нитратов, также приводит к образованию кислорода. Например, суммарный процесс растворения нитрата серебра можно представить по этапам:
AgNO3 H2O → AgOH HNO3
2AgOH → Ag2O O2
2Ag2O → 4Ag O2
или в суммарном виде:
4AgNO3 2H2O → 4Ag 4HNO3 7O2
8) При нагревании солей хрома высшей степени окисления:
4K2Cr2O7 → 4K2CrO4 2Cr2O3 3 O2
бихромат хромат
калия калия
В промышленности кислород получают:
1) Электролитическим разложением воды:
2Н2О → 2Н2 О2
2) Взаимодействием углекислого газа с пероксидами:
СО2 К2О2 →К2СО3 О2
Данный способ представляет собой незаменимое техническое решение проблемы дыхания в изолированных системах: подводных лодках, шахтах, космических аппаратах.
3) При взаимодействии озона с восстановителями:
О3 2КJ H2O → J2 2KOH O2
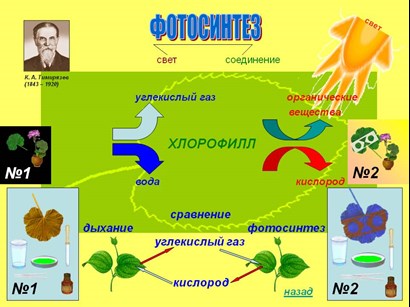 Особое значение получение кислорода имеет место в процессе фотосинтеза, происходящего в растениях. Кардинальным образом от этого процесса зависит вся жизнь на Земле. Фотосинтез – сложный многоступенчатый процесс. Начало ему даёт свет. Сам фотосинтез состоит из двух фаз: световой и темновой. В световую фазу пигмент хлорофилл, содержащийся в листьях растений, образует так называемый «светопоглощающий» комплекс», который отнимает электроны у воды, и тем самым расщепляет её на ионы водорода и кислород:
Особое значение получение кислорода имеет место в процессе фотосинтеза, происходящего в растениях. Кардинальным образом от этого процесса зависит вся жизнь на Земле. Фотосинтез – сложный многоступенчатый процесс. Начало ему даёт свет. Сам фотосинтез состоит из двух фаз: световой и темновой. В световую фазу пигмент хлорофилл, содержащийся в листьях растений, образует так называемый «светопоглощающий» комплекс», который отнимает электроны у воды, и тем самым расщепляет её на ионы водорода и кислород:
2Н2О = 4е 4Н О2
Накопившиеся протоны способствуют синтезу АТФ:
АДФ Ф = АТФ
В темновую фазу происходит преобразование углекислого газа и воды в глюкозу. И побочно выделяется кислород:
6СО2 6Н2О = С6Н12О6 О2
© lifeo2.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Окисление. окислы
Примером медленного окисления сложных веществ может служить процесс дыхания, который рассматривается на уроках биологии. Обращение к тому, что изучено на уроках по другому предмету, и в частности к биологии, имеет большое образовательное значение, так как способствует формированию правильного взгляда на химию как одну из наук о природе.
При этом следует отметить энергетическую сторону этих реакций, что за счет энергии окисления осуществляются многие жизненно важные процессы, связанные с затратой энергии.
Обращая внимание учащихся на экзотермичность многих окислительных реакций, следует предупредить образование ошибочного обобщения, состоящего в том, что учащиеся считают все реакции соединения элементов с кислородом экзотермическими. Нужно сообщить, что существуют и эндотермические окислительные реакции, например соединение азота с кисло родом.
В связи с изучением кислорода формируется понятие «окисел»: учащиеся наблюдают образование окислов при горении простых веществ. На этом основании они часто определяют окисел как соединение элемента с кислородом. В этом определении нет ошибки, но если этим определением ограничиться, то учащиеся распространяют его на продукты окисления и сложных веществ.
Поэтому к определению окисла нужно подводить учащихся на основе сравнения состава нескольких окислов. Для этого можно организовать самостоятельную работу по плану, указанному в работе № 8, стр. 99 учебника (изд. 1969 г.). Но нужно добавить требование к учащимся: на основании сравнения состава окислов указать, что общего у всех окислов, и написать, какие вещества называются окислами.
Распространение в природе и применение кислорода. Приобретенные учащимися знания о химических свойствах кислорода позволяют установить причинно-следственные связи между этими свойствами, нахождением этого элемента в природе и применением в различных областях народного хозяйства.
Так как необходимые сведения, предусмотренные программой по этой теме, даны в учебнике, то представляется возможным организовать самостоятельную работу учащихся с учебником на уроке по заданию учителя. Во вводном слове учитель указывает на необходимость связывать описанные в учебнике сведения о нахождении кислорода в природе, о его роли в жизни животных, человека и о применении со свойствами кислорода.
Чтобы закрепить эти связи в сознании учащихся, можно организовать их самостоятельную работу с учебником на уроке. Пользуясь учебником, они должны кратко ответить (желательно письменно) на вопросы о нахождении кислорода в природе: в каком виде (в смеси, или в растворе, или в соединении с другими элементами) находится кислород в природе: в атмосфере, в воде (в гидросфере), в земной коре, в живой природе? Какое участие он принимает в важнейших химических процессах, происходящих в живой и неживой природе?
О применении кислорода: укажите важнейшие области народного хозяйства, где применяется кислород (учебник, § 23). На каком свойстве кислорода Основано это применение?
После выполнения задания учитель проводит заключительную беседу со всем классом. В $той беседе зачитывается выборочно два-три отчета и вносятся исправления. Кроме того, учитель сообщает дополнительные сведения, не вошедшие еще в учебник, но имеющие большое научное или практическое значение.
Получение кислорода. Так как учащиеся уже приобрели предусмотренные программой знания о свойствах кислорода, то ученические экспериментальные работы на эту тему имеют целью уточнение и закрепление этих знаний и развитие умений, относящихся к технике химического эксперимента, а также умений самостоятельно, пользуясь знаниями учителя, выполнять сравнительно сложные опыты получения, собирания кислорода и испытание его свойств.
В качестве исходного материала для получения кислорода можно рекомендовать марганцовокислый калий, так как разложение его идет спокойно и реакция эта вполне безопасна. Можно получить кислород и из бертолетовой соли. В этом случае необходимо соблюдать осторожность и быть особенно внимательным при наблюдении за выполнением этого опыта учащимися: примеси угля и других органических веществ к бертолетовой соли могут послужить причиной взрыва при ее нагревании.
Собирать кислород можно путем вытеснения воздуха или воды из сосуда. Первый способ проще. Опыт проходит гладко, но учащиеся затрудняются определить, когда сосуд наполнен кислородом. При испытании тлеющей лучинкой они опускают ее на дно банки так часто, что кислород расходуется на горение этой лучинки и учащиеся иногда не в состоянии набрать в банку столько кислорода, чтобы можно было проделать с ним необходимые опыты.
При собирании кислорода в банку, наполненную водой, учащиеся видят, сколько газа собирается, но для успешного выполнения опыта в такой постановке требуются некоторые экспериментальные навыки. Иногда учащиеся неправильно рассчитывают, сколько нужно влить воды в пневматическую ванну, и при вытеснении кислородом воды из банки в ванне оказывается избыток воды, которая выливается на стол.
В некоторых случаях учащиеся временно прекращают нагревание пробирки с разлагаемой солью, не вынимая газоотводной трубки из воды. Вода перетягивается в пробирку с нагреваемым веществом. Такие неудачи постигают не только учащихся, начинающих работать по химии, но и учащихся старших классов.
Поэтому для таких опытов лучше пользоваться прибором, изображенным на рисунке 32. Склянка является предохранителем: в случае прекращения нагревания пробирки с разлагаемым веществом вода перебрасывается в этот сосуд, а при продолжении опыта она перекачивается давлением газа опять в пневматическую ванну.
В кислороде, собранном тем или иным способом в стеклянные банки, учащиеся могут сжечь уголь или стальное перо в зависимости от условий выполнения опыта. Нужно учесть, что для сжигания стального пера или железной проволоки нужно не менее полулитра чистого кислорода. Кроме того, нужно подробно рассказать и показать, как это делается.
В данной работе учащиеся приобретают следующие умения: 1) собирать прибор, в котором основные детали монтируются на железном штативе, 2) проверять герметичность прибора, 3) собирать малорастворимый газ над водой, 4) избегать переброса воды из сосуда с водой в пробирку, в которой нагревается твердое вещество (перманганат калия или бертолетова соль).
Эта работа сходна с первым лабораторным занятием. Здесь учащиеся не приобретают новых для них знаний, а учатся применять полученные знания и овладевать техникой химического эксперимента. Но организация ее должна отличаться тем, что задание расчленяется на меньшее количество частей и каждая часть включает более сложные требования.
В этой практической работе следует уделить особое внимание ознакомлению с прибором, чтобы учащиеся могли установить связь между конструкцией прибора и его назначением, между материалом, из которого он изготовлен, и теми процессами, которые в нем должны происходить.
В прилагаемой ниже работе три части. После выполнения каждой из них следует обсуждение ее выполнения.
Примерное задание для самостоятельной работы на тему «Получение кислорода и изучение его свойств». Подготовка прибора к опыту. Если для опыта использовать прибор, изображенный на рисунке 32, то надо сначала поставить горелку на подставку штатива, укрепить на штоке муфту и держатель, в котором закрепить пустую пробирку.
После этого следует передвинуть муфту с держателем и с пробиркой так, чтобы нижняя часть ее находилась в средней части пламени горелки. Затем необходимо закрыть пробирку пробкой с газоотводной трубкой, а конец ее опустить в ванночку с водой и проверить герметичность прибора.
Для этого нагреть пробирку, обхватив ее рукой, или слегка подогреть пламенем горелки и наблюдать выделение пузырьков воздуха из того конца трубочки, который погружен в воду. Воздух выходит из пробирки вследствие того, что его объем увеличивается при повышении температуры.
Когда пробирка охладится, вода станет подниматься по трубке вверх. Если пробирку нагревали сильно и воздуха из пробирки вышло много, то при ее охлаждении вода может перейти из ванночки в пробирку. Чтобы не допустить этого, нужно открыть пробирку, как только вода поднимется высоко по трубке.
Если прибор негерметичен (плохо подогнана пробка или слишком свободно входит в нее стеклянная трубка), то ни выхода воздуха из пробирки, ни подъема воды по трубке не происходит. После проверки и исправления прибора нужно наполнить водой банку, предназначенную для собирания кислорода, закрыть ее картонным кружочком, перевернуть вверх дном, погрузить в ванночку с водой и снять под водой кружочек.
Когда прибор будет подготовлен, следует показать его учителю и после его разрешения приступить к опыту.
Получение кислорода. Откройте пробирку, заполните около половины ее объема марганцовокислым калием и снова присоедините ее к прибору. Осторожно обогрейте всю пробирку пламенем горелки, чтобы удалить из нее воздух. Затем обогрейте только ту часть, где находится марганцовокислый калий.
Как только усилится выделение газа, введите конец газоотводной трубки в стеклянную банку и наблюдайте наполнение ее газом. Вода в ванночке иногда окрашивается в фиолетовый цвет (часть, пылевидного марганцовокислого калия увлекается кислородом и растворяется в воде).
Как только банка наполнится газом (вода опустится до ее горла), выньте газоотводную трубку из банки и из воды и только после этого прекращайте нагревание пробирки. Если же прекратить нагревание, а газоотводную трубку оставить в воде, то может произойти следующее: при охлаждении пробирки прекратится выделение кислорода, охладится оставшийся в пробирке газ и уменьшится его объем.
Если будете пользоваться прибором, изображенным на рисунке 32, то можно прекращать нагревание пробирки, не вынимая газоотводной трубки. В этом случае при охлаждении пробирки вода тоже может подняться по газоотводной трубке, но перельется не в пробирку, а в предохранительную склянку.
При возобновлении нагревания пробирки с марганцовокислым калием вода под давлением поступающего в склянку кислорода перейдет обратно из этой склянки в пневматическую ванну. Этот, прибор труднее изготовить, но пользоваться им значительно удобнее. Для этого прибора не требуется металлического штатива, его заменяет предохранительная склянка. Собранный газ покажите преподавателю.
Испытание полученного газа. Чтобы проверить, действительно ли полученный газ — кислород, осторожно откройте банку, внесите в ее верхнюю часть тлеющую лучинку, не погружая ее внутрь банки, чтобы не израсходовать много кислорода на эту пробу.
Поместите в железную ложечку небольшое количество серы, внесите ложечку в пламя горелки и держите до тех пор, пока она не загорится. Тогда внесите горящую серу в баночку с кислородом, наблюдайте за пламенем горящей серы, опускай постепенно ложечку ко дну банки. Отметьте различие в пламени серы, горящей в воздухе и в кислороде.
Напишите отчет, в котором укажите цель работы, нарисуйте прибор с указанием, где и какие вещества находились, нарисуйте опыт сжигания серы. Опишите кратко, как горит это вещество на воздухе и в кислороде. Затем прочитайте § 24 учебника и внесите в отчет исправления и дополнения, если в этом будет необходимость.
Приготовьте ответы на следующие вопросы:
1. Какие вещества называются катализаторами?
2. Назовите вещества, которые действуют как катализаторы в растениях и организмах животных?
Урок №24. практическая работа №3. получение и свойства кислорода
Цель работы: Получить кислород (методом вытеснения воздуха) и изучить его свойства.
Необходимое оборудование и реактивы
штатив лабораторный с лапкой или пробиркодержатель;
два химических стакана;
пробка с газоотводной трубкой;
ложка для сжигания веществ;
перманганат калия (твердый) KMnO 4 ;
известковая вода — Са(ОН) 2.
Меры предосторожности
Работа со спиртовкой:
Не переносите горящую спиртовку с места на место.
Гасите спиртовку только с помощью колпачка.
При нагревании не забудьте прогреть пробирку. Для этого пробирку, закрепленную в лапке штатива, медленно проведите сквозь пламя от донышка до отверстия и обратно. Эту операцию повторите несколько раз: чтобы стекло равномерно прогрелось. Признаком прогрева стекла можно считать исчезновение запотевания на стенках пробирки.
Дно пробирки должно находиться в верхней части пламени.
Дно пробирки не должно касаться фитиля.
Работа со стеклом:
Помните, что горячее стекло по внешнему виду не отличается от холодного. Не прикасайтесь к горячей пробирке. Закрепляя пробирку в лапке штатива, не закручивайте сильно винт. При нагревании стекло расширяется и пробирка может треснуть
Проверка прибора на герметичность:
Закройте пробирку пробкой с газоотводной трубкой, опустите конец трубки в стакан с водой. Плотно обхватите ладонью пробирку и внимательно следите за появлением пузырьков воздуха.
Загрузите по очереди два следующих видео — опыта и внимательно наблюдайте за экспериментом:
1. Получение кислорода (нажмите «Посмотреть опыт»)
Кислород( O 2 ) в лаборатории получают разложением перманганата калия KMnO 4 (марганцовки). Для опыта понадобится пробирка с газоотводной трубкой. В пробирку насыпаем кристаллический перманганат калия. Для сбора кислорода приготовим колбу. При нагревании перманганат калия начинает разлагаться, выделяющийся кислород поступает по газоотводной трубке в колбу.
2KMnO4= K2MnO4 MnO2 O2↑
Чистый кислород впервые получили независимо друг от друга шведский химик Шееле (при прокаливании селитры) и английский ученый Пристли (при разложении оксидов ртути и свинца). До их открытия ученые считали, что воздух ‑ однородная субстанция. После открытия Шееле и Пристли Лавуазье создал теорию горения и назвал новый элемент Oxygenium (лат.) – рождающий кислоту, кислород. Кислород — необходим для поддержания жизни. Человек может выдержать без кислорода всего несколько минут.
2. Обнаружение кислорода
Кислород поддерживает горение — это свойство кислорода используется для его обнаружения
Кислород активно взаимодействует со многими веществами. Посмотрим, как реагирует кислород с углем. Для этого раскалим кусочек угля на пламени спиртовки. На воздухе уголь едва тлеет, потому что кислорода в атмосфере около двадцати процентов по объему.
С О2= СО2
Добавим в колбу с газом известковую воду – она мутнеет. Известковая вода обнаруживает углекислый газ. Вспомните, как разжигают гаснущий костер. Дуют на угли или интенсивно обмахивают их для того, чтобы увеличить подачу кислорода в зону горения.
Источник

