- I .4. химические свойства ванадия — мегалекции
- Двуокись (диоксид) ванадия (iv) vo2
- Другие соединения ванадия
- Получение
- Применение
- Изображения по теме
- Промышленное получение пентаоксида ванадия
- Пятиокись (пентаоксид) ванадия
- Распространение в природе
- Соединения «v-о» (оксиды ванадия)
- Сплавы ванадия
- Токсичность
- Физические свойства
I .4. химические свойства ванадия — мегалекции
На воздухе ванадий не изменяется, устойчив он к воде, к растворам минеральных солей и щелочей. Кислоты на него действуют только такие, которые одновременно являются окислителями. На холоде на него не действуют разбавленные азотная и серная кислоты. По-видимому, на поверхности металла образуется тончайшая пленка оксида, препятствующая дальнейшему окислению металла («пассивированное состояние»). Для того чтобы заставить пассивированный ванадий интенсивно реагировать, его нужно нагреть. При 600—700°С происходит интенсивное окисление компактного металла, а в мелкораздробленном состоянии он вступает в реакции при более низкой температуре:
2V 5O2 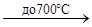 2V2O5
2V2O5 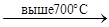 2VO2 O2;
2VO2 O2;
2V 5F 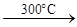 2VF5;
2VF5;
 2V 2Cl2 в токе хлора t VCl4
2V 2Cl2 в токе хлора t VCl4
Прямым взаимодействием элементов при нагревании могут быть получены сульфиды, карбиды, нитриды, арсениды, силициды. Для техники важны желто-бронзовый нитрид VN (tпл = 2050°С), устойчивый к воде и кислотам, а также обладающий высокой твердостью карбид VC (tпл = 2800 °С).
Ванадий очень чувствителен к примесям газов (O2, N2, H2), которые резко меняют его свойства, даже если присутствуют в самых незначительных количествам. Поэтому и сейчас можно в разных справочниках встретить различную температуру плавления ванадия. Загрязненный ванадий, в зависимости от чистоты и способа получения металла, может плавиться в интервале от 1700 до 1900°С. При чистоте 99,8 — 99,9 % его плотность равна 6,11 г/см3 при 20°С, температура плавления составляет 1919°С, а температура кипения 3400 °С.
Металл исключительно стоек как в органических, так и в большинстве неорганических агрессивных средах. По стойкости к действию НС1, НВr и холодной серной кислоты он значительно превосходит титан и нержавеющую сталь. С галогенами, за исключением самого агрессивного из них — фтора, соединений не образует. С фтором же дает кристаллы VF5, бесцветные, возгоняющиеся без превращения в жидкость при 111°С. Атмосфера из углекислого газа на металлический ванадий действует значительно слабее, чем на его аналоги — ниобий и тантал. Он обладает высокой стойкостью к расплавленным металлам, поэтому может применяться в конструкциях атомных реакторов, где расплавленные металлы используются как теплоносители. Ванадий не ржавеет ни в пресной, ни в морской воде, ни в растворах щелочей. Действуют на него лишь расплавленные щелочи:
4V 12NaOH 5O2 = 4Na3VО4 6H2О
Из кислот на него действуют концентрированная серная и азотная кислоты, плавиковая и их смеси:
V 4H2SО4 = V(SО4)2 2H2О 2SО2
Особенностью ванадия считается высокая растворимость в нем водорода. В результате такого взаимодействия образуются твердые растворы и гидриды. Наиболее вероятная форма существования гидридов — металлообразные соединения с электронной проводимостью. Они способны довольно легко переходить в состояние сверхпроводимости. Гидриды ванадия могут с некоторыми твердыми или жидкими металлами образовывать растворы, в которых повышается растворимость водорода.
Самостоятельный интерес представляют карбиды ванадия, так как по своим качествам дают для современной техники материал с весьма ценными свойствами. Они исключительно тверды, тугоплавки и обладают хорошей электрической проводимостью. Ванадий способен для образования своих карбидов даже вытеснить другие металлы из их карбидов:
3V Fе3С = V3С 3Fе
Известен целый ряд соединений ванадия с углеродом:
V3С; V2C; VC; VзС2; V4С3
С большинством членов главной подгруппы ванадий дает соединения как бинарные (т. е. состоящие только из двух элементов.), так и более сложного состава. Нитриды образуются при взаимодействии порошка металла или его оксидов с газообразным аммиаком:
6V 2NН3 = 2V3N 3Н2
V2О2 2NH3 = 2VN 2H2О H2
Для, полупроводниковой техники интерес представляют фосфиды V3Р, V2P, VP, VP2 и арсениды V3As, VAs.
Комплексообразующие свойства ванадия проявляются в образовании соединений сложного состава типа фосфорно-ванадиевой кислоты H7PV12O36 или Н7[Р(V2O6)6].
I .5. Оксиды ванадия
В системе ванадий — кислород взаимодействие начинается при нагревании до температуры примерно 300°С. Получено большое количество оксидов ванадия, характер которых постепенно меняется при переходе от низших оксидов к высшим. Относительно недавно обнаружен низший оксид V2О. Он нестоек и по своему характеру близок к металлическому состоянию. Его светло-серые кристаллы отливают металлическим блеском, хорошо проводят электрический ток.
Оксид VO более стоек, нерастворим в воде, но растворяется в разбавленных кислотах с образованием двухзарядного катиона V2 .
VO H2SО4 = VSО4 H2О
Водные растворы ванадия в такой степени окисления окрашены в фиолетовый, или в бледно-голубой цвет. Растворы солей иона V2 неустойчивы и настолько сильные как восстановители, что при стоянии выделяют водород прямо из воды, а ион ванадия переходит в более устойчивые высшие степени окисления. При добавлении к растворам любого даже слабого основания образуется бурый аморфный осадок V(OH)2. В чистом виде, однако, выделить его нельзя, так как на воздухе он быстро превращается в серо-зеленый гидроксид V(ОН)3.
Из особенностей оксида можно отметить существование при определенных концентрациях ванадия димера V2О2, а также совершенно особое влияние температуры на его состояние. Оксиды обычно делаются нестойкими при высоких температурах и разлагаются. Здесь же наблюдается совершенно удивительное свойство: оксид VO устойчив лишь при высокой температуре. Даже при медленном и постепенном охлаждении он разлагается и переходит в высшие оксиды.
Оксид ванадия, соответствующий степени окисления 3, имеет амфотерный характер с преобладанием основных свойств. Как кислотные качества можно рассматривать образование им с оксидами MgO, MnO, СаО двойных соединений, а с Fe2О3, Сr2О3, Аs2О3 непрерывный ряд твердых растворов. С оксидами же щелочных металлов Li2О и Na2О получаются соли LiVO3, NаVОз, которые можно считать ванадиевыми солями.
Внешне V2O3 — блестящие черные кристаллы (tпл = 1970°С), по структуре подобны корунду, в воде, растворах щелочей и кислотах не растворяются, кроме плавиковой и азотной (быстрее всего в кипящей):
V2O3 6НМОз = 2V(NО3)3 ЗН2O
Водные растворы таких солей окрашены в зеленый цвет. Из них добавлением аммиака можно осадить рыхлый серо-зеленый осадок, который считается гидроксидом ванадия в степени окисления 3. Отметим, что такое состояние менее устойчиво и менее характерно для ванадия, чем 4 и 5. Поэтому соединения ванадия со степенью окисления 3 стремятся перейти в более стабильное состояние и проявляют, следовательно, свойства восстановителей.
Сине-голубые кристаллы VO2 на воздухе теряют свою форму, так как вещество гигроскопично. Это наиболее устойчивый оксид ванадия, поэтому его можно получить либо окислением низших оксидов:
2V2О3 О2 = 4VО2,
либо восстановлением высшего:
V2O5 Н2С2О4 = 2VО2 2СО2 Н2О
Оксид VO2 амфотерен и одинаково легко растворяется как в основаниях:
4VО2 2NaOH 6H2О = Na2 [V4O5] • 7Н2O,
так и в кислотах:
VО2 2HC1 = VОСl2 Н2O;
VO2 H2SO4 = VOSO4 H2O
Водный его раствор не изменяет цвета ни синей, ни красной лакмусовой бумажек, т. е. его амфотерность распределена поровну между кислотными качествами и основными. Водные растворы солей содержат ванадий не в виде простого катиона, а в виде иона ванадила, имеющего две формы существования: VO2 — и V2O24 — и придающего синий цвет растворам.
В щелочах образуются соли поливанадиевых кислот H4V4O9 или H2V2O5, называются соли ванадитами или поливанадатами. При величине рН = 4 из растворов солей можно осадить серовато-бурый аморфный гидроксид VO(OH)2. Если щелочность увеличить, при рН от 8 до 10 гидроксид (в соответствии со своими амфотерными качествами) будет растворяться, превращаясь в соли. При сплавлении этого оксида ванадия с оксидами щелочноземельных металлов получаются ванадаты:
VO2 CaO = CaVO3
Могут образовываться три ряда ванадатов СаVО3, Са2VO4, Ca3VO5 со сложной структурой.
Наиболее важным и интересным, с точки зрения химика, считается высший оксид ванадия V2O5, который может иметь вид красных или красно-желтых кристаллов либо оранжевого порошка. Получается он по реакции ванадия с кислородом. При 600—700°С взаимодействие идет очень быстро, так как образующийся оксид V2О5 расплавляется (tпл = 675°С) и скатывается с поверхности металлического ванадия. Лабораторный способ его получения — из метаванадата аммония;
2NH4VО3 = V2О5 2NH3 H2О
Высший оксид ванадия имеет ярко выраженный кислотный характер и при растворении в воде образует ванадиевую кислоту:
V2О5 Н2О = 2НVО3
Форма существования ванадия в растворе кислоты — в виде катиона VO2 , цвет раствора желтовато-оранжевый. При растворении оксида ванадия (V) в основаниях получаются соли изомерных ванадиевых кислот, напоминающих фосфаты:
V2O5 2NaOH = 2NaVO3 H2O
V2O5 6NaOH = 2Na3VO4 3H2O
По форме они соответствуют мета — [НVO3], орто — [Н3VO4]и H2V2O7 пированадиевым кислотам. В этом отношении ванадий обнаруживает сходство уже не с азотом, а с фосфором.
Особенность ванадия (в степени окисления 5) при растворении в сильных кислотах — образовывать комплексные соединения, содержащие до девяти -двенадцати атомов ванадия на молекулу. Другим замечательным свойством оксида можно считать способность в расплавленном состоянии проводить электрический ток, скорее всего вследствие диссоциации на ионы:
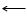
 V2O5 VO2 VO3-
V2O5 VO2 VO3-
А ведь пропускание электрического тока считается безусловной «привилегией» металлов. По этому свойству распознается принадлежность вещества к металлам или неметаллам.
Характер гидратных форм оксидов ванадия меняется закономерно с изменением степени его окисления. В состоянии наибольшего окисления он образует кислоты, подобные кислотам фосфора и мышьяка, элементов, которые являются соседями ванадия, но относятся к противоположной подгруппе. Слово «противоположная» означает, что элементы различных подгрупп одной группы — химические антиподы: для одних должны быть более характерны свойства металлов, а для других — неметаллов. Но при сравнении членов обеих подгрупп можно заметить, что «противоположности» сближаются. У элементов побочной подгруппы все более усиливаются свойства неметаллов, характерные для главной подгруппы, и наоборот.
Ванадий в этом отношении служит примером. В высшей окислительной степени у него преобладают свойства неметалла. При состоянии окисления 4 его гидроксид в одинаковой мере проявляет. Свойства обеих противоположностей, т. е. он амфотерен.
Сопоставив приведенные данные об оксидах ванадия с аналогичными сведениями о подобных соединениях других членов V группы, можно прийти к следующему выводу: по количеству оксидов и по числу состояний окисления ванадий далеко превосходит не только членов побочной подгруппы (это естественно), но и некоторые элементы главной подгруппы. Если судить по кислородным соединениям (именно их особенности несколько десятилетий назад считались основным признаком сходства и различия), то ванадий должен считаться более близким «родственником» азота, чем висмут, сурьма и даже мышьяк. Ведь эти элементы не образуют всех типов оксидов, присущих азоту, а существующие у них по своим свойствам подобны оксидам фосфора.
Воспользуйтесь поиском по сайту:

Двуокись (диоксид) ванадия (iv) vo2
Двуокись (диоксид) ванадия (IV) VO2 – кристаллы темно-синего цвета (рис. 3).
Рисунок 3. Диоксид ванадия(IV) VO2.
Диоксид VO2 существует в 2-х кристаллических модификациях: α и β. При 68°С αформа, в которой VO2 проявляет себя как диэлектрик, переходит в βфазу тетрагональной сингонии, в которой VO2 ведет себя уже как проводник. Примечательно, что такой межфазовый переход осуществляется практически мгновенно, в течение одной наносекунды.
Рисунок 4. Одно из электронных устройств на основе свойств VO2.
В αформе VO2 является антиферромагнетиком. Не растворяется в H2O. Характеризуется гигроскопичностью. VO2 имеет амфотерный генезис. В растворах кислот образует катион ванадила VO2 (имеет лазурный окрас). В щелочах образует ванадаты(IV) в виде солей изополиванадиевой(IV) кислоты H2V4O9. Является сильным восстановителем, в воздушной среде окисляется.
Получение возможно тремя способами:
- методом сплавления пентаоксида V2O5 с C2H2O4 (щавелевая к-та);
- нагревом в вакууме микса V2O3 V2O5;
- путем окисления V2O3.
Применение: для производства разновидностей ванадиевой бронзы и латуни, в качестве полупроводникового материала при изготовлении компонентов различных электронных устройств.
Другие соединения ванадия
К прочим соединениям V, актуальным для промышленного применения, можно отнести:
- сульфиды VS, V2S3 и V2S5;
- нитриды VN, V2N;
- галогениды (фториды – VF, VF4, VF5, VF3-3H2О; хлориды – VCI2, VCl3, VCl4, VOCl, VОC13; йодиды – VI2, VI3; бромиды –VBr2, VBr3).
Подробное описание, свойства, способы получения и сфера практического использования данных химических веществ – тема отдельной статьи.
Получение
Основным способом синтеза оксида ванадия является термическое разложение ванадатов аммония на воздухе:
Также применяется сжигания порошка ванадия в струе кислорода под давлением:
Менее распространенными способами являются термическое разложение и гидролиз соединений ванадила:
Применение
Оксид ванадия широко используется в качестве катализатора для гомогенного и гетерогенного катализа — в производстве серной кислоты, фталевого и малеинового ангидрида, адипиновой и акриловой кислот. Также незначительные количества используются для получения щавелевой кислоты и антрахинона.
Он является составной специального стекла, задерживает ультрафиолетовое излучение, также применяется в изготовлении пигментов (желтого SnO 2 / V 2 O 5 и синего ZrO 2 / V 2 O5) и как антистатический слой в фотографических материалах.
Изображения по теме
Промышленное получение пентаоксида ванадия
Порошковый пентаоксид ванадия являет собой завершающую фазу промышленной переработки ванадийсодержащего сырья (рис. 2).
Рисунок 2. Промышленные установки для получения V2O5. (ОАО «Чусовской металлургический завод»).
Важнейшими технологическими циклами промышленного выпуска V2O5 являются:
- подготовка ванадийсодержащей шихты;
- этап окислительного обжига;
- этап выщелачивания;
- осаждение готового V2O5.
В металлургическом производстве применяется пентаоксид ванадия марок ВнО-1 и ВнО-2, получаемый согласно ТУ 48-4-429-82 (Ванадия пятиокись для металлургических целей. Технические условия).
V2O5 данных марок используют в процессе выпуска феррованадия (80%, ГОСТ 27130-94 Феррованадий. Технические требования и условия поставки), а также при изготовлении сплавов с Ti и другими цветными металлами.
Показатели допустимых пределов содержания основного компонента и контролируемых примесей представлены в таблице 1.
| Наименование показателя | Массовая доля элемента, % | |
|---|---|---|
| ВнО-1 | ВнО-2 | |
| Содержание основного вещества | 98.5 | 97 |
| Пятиокись ванадия V2O5, ≥ | 1.3 | 2 |
| Четырехокись ванадия V2O4, ≤ | 0.2 | 0.3 |
| Нерастворимый остаток, ≤ | 0.05 | 0.15 |
| Железо (Fe), ≤ | 0.05 | 0.1 |
| Кремний (Si), ≤ | 0.04 | 0.1 |
| Марганец (Mn), ≤ | 0.02 | 0.07 |
| Хром (Cr), ≤ | 0.005 | 0.01 |
| Сера (S), ≤ | 0.01 | 0.01 |
| Фосфор (P), ≤ | 0.01 | 0.02 |
| Хлор (Cl), ≤ | 0.1 | 0.3 |
| Щелочные металлы (Na K), ≤ | 0.2 | 0.3 |
| Мышьяк (As), ≤ | 0.003 | 0.01 |
Примечание: Допустимо включение частиц твердого V
25
Ø ≤ 3мм.
Значительная доля промышленного выпуска V2O5 осуществляется также согласно ТУ 14-5-92-90 (Ванадия пятиокись техническая. Технические условия). Распространяются на техническую пятиокись ванадия, используемую как исходный материал для производства анодного компонента мощных литиевых аккумуляторных батарей, при производстве широкого сортамента катализаторов для химич. промышленности (в т. ч. при получении H2SO4), а также предназначенный для введения в состав стекла и люминофоров.
Пятиокись (пентаоксид) ванадия
Самым актуальным в промышленном отношении кислородным соединением V является его пятиокись V2O5, имеющая в порошковой модификации охристые цветовые оттенки (рис. 1).
Рисунок 1. Пятиокись (пентаоксид) ванадия.
Пентаоксид V2O5 имеет кислотный характер. При температуре свыше 700°С диссоциирует. Является диамагнетиком. Практически нерастворим в H2O. Взаимодействуя в щелочных растворах с линейкой основных оксидов, образует ряд соответствующих ванадатов — солей ванадиевой кислоты HVO3.
Распространение в природе
Поскольку оксид ванадия легко образует гидраты, в минеральных залежах он находится именно в сочетании с водой — для него известны гидраты алаит V 2 O 5 · H 2 O и навахоит V 2 O 5 · 3H 2 O.
Также он входит в состав природных ванадатов: ванадинит 3Pb 3 (VO4) 2 · PbCl 2, карнотита K 2 (UO 2) 2 [VO 4]2 · 3H 2 O, деклуазиту (Zn, Cu)
Соединения «v-о» (оксиды ванадия)
Кислородные соединения V представляют собой ряд оксидов: VO, V2O3, VO2,V2O5. Оранжевато-коричневый пентаоксид V2O5 имеет кислотный генезис, сине-фиолетовый диоксид VO2 — амфотерный, прочие оксиды V — основные.
Соединения V со степенями окисления 2(II) и 3(III) проявляют свойства восстановителей, со степенью 5(V) являются окислителями. Во всех степенях окисления V чаще всего имеет координационное число 6. В степенях окисления 4(IV) и 5(V) возможно также образование соединений с к.ч. 4 (напр., в ди-, орто- и метаванадатах), а также 5 и 8.
Оксиды ванадия широко применяются как промышленные катализаторы в таких сферах, как производство кислот, органический синтез, стекольное производство, текстильная и резинотехническая промышленность, иных хозяйственных отраслях.
Сплавы ванадия
V перспективен для создания сплавов, способных функционировать в режиме более высоких температур, чем жаростойкие сплавыникеля и кобальта. Содержание в составе стали всего 0,1 – 0,3% V обеспечивает значительное повышение ее прочности и упругости, снижая чувствительность к ударным деформациям.
Номенклатура и свойства сплавов V регламентируются ГОСТ 26473.13-85 «Сплавы и лигатуры на основе ванадия. Метод спектрального анализа». Ванадиевые сплавы используются, по преимуществу, в виде легирующих компонентов в сталелитейном производстве. Наиболее потребляемым в чернометаллургической отрасли сплавом легирующего назначения является феррованадий FeV 80% (ГОСТ 27130-94 Феррованадий. Технические требования и условия поставки).
Помимо Fe, рецептура сплавов и лигатур ванадия предусматривает наличие таких легирующих элементов, как Al, Cr, Ni, W, Mo, Ti, Та, Nb, Zr. При этом добавки W, Та и Nb способствуют снижению пластичности сплавов V. Ванадий-ниобиевые сплавы имеют низкую степень пластичности даже в режиме очень высоких температур. Наиболее же пластичными являются сплавы типа V – Ti и V – Zr.
Токсичность
Оксид ванадия (V) является опасным. Его вдыхание серьезно раздражает дыхательные пути, может сопровождаться одышкой и астмой, негативным влиянием на легкие. Проглатывания вещества потенциально смертельным, попав в организм, она влияет на ЦНС. При контакте с кожей может наблюдаться аллергическая реакция. Оксид ванадия классифицируется как потенциальный канцероген.
Физические свойства
Оксид ванадия — ядовитый порошок без запаха и вкуса. Его цвет колеблется от оранжево-желтого до кирпично-коричневого. При охлаждении из жидкого состояния он кристаллизуется в красноватые ромбические иглы по слабым парамагнитными свойствами.
Оксид ванадия занимает промежуточное положение по сравнению с высшими оксидами 4 и 6 групп своего периода — TiO 2 и CrO 3. В частности, он менее температурно устойчивым, чем оксид титана, и устойчивым по оксид хрома.
