- Взаимодействие металлов с растворами солей
- История открытия
- Нахождение в природе
- Номенклатура солей
- Разложение кислородсодержащих веществ
- Распространенность оксигена в природе
- Сварка и резка металлов
- Свойства
- Соли в природе
- Суммарные процессы электролиза
- Физические свойства
- Физические свойства солей
- Химические свойства
Взаимодействие металлов с растворами солей
Какие соли вы встречали в повседневной жизни?
Химически активные металлы вытесняют менее активные металлы из растворов солей, при этом протекает реакция замещения. Например, из раствора сульфата меди (ІІ) железо вытесняет медь (рис. 19):
Выделение красного налета меди является признаком реакции. Обратная реакция не протекает 
Схема реакций замещения выглядит следующим образом:
соль 4- активный металл = новая соль новый металл (менее активный)
Реакции такого типа протекают при следующих условиях:1) взаимодействующие соли должны быть растворимыми в воде;2) более активный металл вытесняет из соли менее активный металл.
Демонстрация №3Вытеснение металлов из растворов солей
Цель: понимать, что более активный металл вытесняет менее активный металл из растворов его солей.
В пробирку поместите гранулы цинка и налейте раствор сульфата меди. В другую пробирку поместите небольшие кусочки железа и налейте раствор сульфата меди. Что наблюдаете? Напишите уравнение реакции. Сделайте вывод.
Практическая работа № 1 Сравнение активности металлов
Цель: Разработать ряд активности металлов. Обобщить результаты и сделать выводы.
Ход работы
В пять пробирок налейте растворы солей по 5 мл, опустите в каждую пробирку стружки меди. Затем такие опыты повторите с другими металлами. Наблюдайте за интенсивностью хода реакций. Заполните таблицу: где идет реакция следует поставить знак “ ”, если не идет реакция – знак “–”. По сравнительной интенсивности, т. е. по числу протекающих реакций, составьте ряд активности металлов.
ДЕЛАЕМ ВЫВОДЫ:
- 1. Атомы металлов в реакциях только отдают электроны, образуя положительно заряженные ионы.
- 2. Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- 3. Сравнительную активность металлов можно определить с помощью ряда активности, составленного Н. Н. Бекетовым.
- 4. Металлы IA, НА группы очень легко вступают во взаимодействие с кислородом и водой. Многие металлы образуют оксидную пленку, которая препятствует дальнейшему окислению. Благородные металлы вообще не реагируют с кислородом и водой.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
История открытия
Официально считается[4][5], что кислород был открыт английским химиком Джозефом Пристли1 августа1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью большой линзы).
- 2HgO→t2Hg O2↑{displaystyle {ce {2HgO ->[t] 2Hg O2 ^}}}.
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела очень большое значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по изменению веса сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Нахождение в природе

Накопление O
2
в
атмосфере
Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1
. (3,85—2,45 млрд лет назад) — O
2
не производился
2
. (2,45—1,85 млрд лет назад) — O
2
производился, но поглощался океаном и породами морского дна
3
. (1,85—0,85 млрд лет назад) — O
2
выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4
. (0,85—0,54 млрд лет назад) — все горные породы на суше окислены, начинается накопление O
2
в атмосфере
5
. (0,54 млрд лет назад — по настоящее время) — современный период, содержание O
2
в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе).
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн[7]). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад в атмосфере его практически не было.
Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита.
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими[10].
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму[11]. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время[12].
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов[13].
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере[14][нет в источнике].
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %[6].
В 2022 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад[16].
Номенклатура солей
Номенклатура солей (речь пойдет о так называемых средних солях, которые соответствуют приведенной общей формуле и являются продуктами полного замещения атомов водорода в кислоте). Название солей состоит из двух слов: названия металлического элемента и названия кислотного остатка в именительном падеже, например 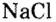
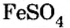
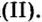
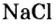
Определение валентности металлов в формулах солей и составление формул солей по валентности. Определяя валентность металла в формуле соли или составляя формулы солей, придерживаются общего правила, как при определении валентности элементов в бинарных соединениях и составлении их формул.
Сумма единиц валентности одной части формулы соли (атомов металла) равна сумме единиц валентности второй ее части (кислотного остатка).
Пример №
Определить валентность хрома в солях, формулы которых: 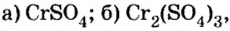
Решение
Обе соли содержат двухвалентный кислотный остаток серной кислоты.
Сумма единиц валентности кислотного остатка в первой формуле равна 2. Такой же должна быть и сумма валентностей атомов хрома. Поскольку атом хрома в этой формуле один, то обе валентности принадлежат ему. Следовательно, хром в формуле 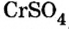
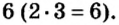
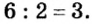
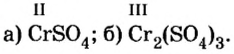
Пример №
Составить формулу нитрата алюминия.
Решение
1. Записываем символы металла и кислотного остатка: 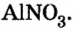
2. Над металлом и кислотным остатком проставляем валентность:
3. Для единиц валентности металла и кислотного остатка находим наименьшее общее кратное: это число 3.
4. Делением общего кратного 3 на валентность металла и кислотного остатка находим индексы:
а) 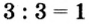
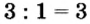
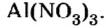
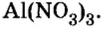
Из общей формулы солей следует, что индекс металла совпадает с валентностью кислотного остатка, а индекс кислотного остатка — с валентностью металла. Однако, как и у оксидов, в формулах кислот четных индексов нет. Поэтому при составлении формул кислот по валентности проводят сокращение четных индексов.
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
- 2KMnO4→tK2MnO4 MnO2 O2↑{displaystyle {ce {2KMnO4 ->[t] K2MnO4 MnO2 O2 ^}}}
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца(IV):
- 2H2O2→MnO22H2O O2↑{displaystyle {ce {2H2O2 ->[MnO2] 2H2O O2 ^}}}
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
- 2KClO3⟶2KCl 3O2↑{displaystyle {ce {2KClO3 -> 2KCl 3O2 ^}}}
Разложение оксида ртути(II) (при t = 100 °C) было первым методом синтеза кислорода:
- 2HgO→100°C2Hg O2↑{displaystyle {ce {2HgO ->[100{°}C] 2Hg O2 ^}}}
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 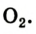
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 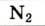 | 78,09 | 75,51 |
| Кислород | 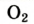 | 20,95 | 23,15 |
| Аргон | 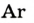 | 0,93 | 1,28 |
| углекислый газ | 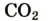 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой 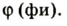
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52).
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 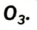 Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород:
Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород: 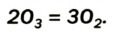
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
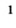
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Сварка и резка металлов
Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения.
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
Медицинский кислород хранится в металлических газовых баллонах высокого давления голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей.
Крупные медицинские учреждения могут использовать не сжатый кислород в баллонах, а сжиженный в сосуде Дьюара большой ёмкости. Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки.
Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха.
Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометруредуктора) умножают на величину ёмкости баллона в литрах. Например, в баллоне вместимостью 2 литра манометр показывает давление кислорода 100 атм.
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавкиE948[26], как пропеллент и упаковочный газ.
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), диоксид серы в триоксид серы, аммиака в оксиды азота в производстве азотной кислоты.
В тепличном хозяйстве для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Свойства
Строение внешней электронной оболочки атома К. 2s22p4; в соединениях проявляет степени окисления –2, –1, редко 1, 2; электроотрицательность по Полингу 3,44 (наиболее электроотрицательный элемент после фтора); атомный радиус 60 пм; радиус иона О2– 121 пм (координац. число 2). В газообразном, жидком и твёрдом состояниях К. существует в виде двухатомных молекул О2. Молекулы О2 парамагнитны. Существует также аллотропная модификация К. – озон, состоящая из трёхатомных молекул О3.
В осн. состоянии атом К. имеет чётное число валентных электронов, два из которых не спарены. Поэтому К., не имеющий низкой по энергии вакантной d-орбитали, в большинстве химич. соединений двухвалентен. В зависимости от характера химич. связи и типа кристаллич. структуры соединения координац. число К. может быть разным: 0 (атомарный К.), 1 (напр., О2, СО2), 2 (напр., Н2О, Н2О2), 3 (напр., Н3О ), 4 (напр., оксоацетаты Ве и Zn), 6 (напр., MgO, CdO), 8 (напр., Na2O, Cs2O). За счёт небольшого радиуса атома К. способен образовывать прочные π-связи с др. атомами, напр. с атомами К. (О2, О3), углерода, азота, серы, фосфора. Поэтому для К. одна двойная связь (494 кДж/моль) энергетически более выгодна, чем две простые (146 кДж/моль).
Парамагнетизм молекул О2 объясняется наличием двух неспаренных электронов с параллельными спинами на дважды вырожденных разрыхляющих π*-орбиталях. Поскольку на связывающих орбиталях молекулы находится на четыре электрона больше, чем на разрыхляющих, порядок связи в О2 равен 2, т. е. связь между атомами К. двойная. Если при фотохимич. или химич. воздействии на одной π*-орбитали оказываются два электрона с противоположными спинами, возникает первое возбуждённое состояние, по энергии расположенное на 92 кДж/моль выше основного. Если при возбуждении атома К. два электрона занимают две разные π*-орбитали и имеют противоположные спины, возникает второе возбуждённое состояние, энергия которого на 155 кДж/моль больше, чем основного. Возбуждение сопровождается увеличением межатомных расстояний О–О: от 120,74 пм в осн. состоянии до 121,55 пм для первого и до 122,77 пм для второго возбуждённого состояния, что, в свою очередь, приводит к ослаблению связи О–О и к усилению химич. активности К. Оба возбуждённых состояния молекулы О2 играют важную роль в реакциях окисления в газовой фазе.
К. – газ без цвета, запаха и вкуса; tпл –218,3 °C, tкип –182,9 °C, плотность газообразного К. 1428,97 кг/дм3 (при 0 °C и нормальном давлении). Жидкий К. – бледно-голубая жидкость, твёрдый К. – синее кристаллич. вещество. При 0 °C теплопроводность 24,65·10—3 Вт/(м·К), молярная теплоёмкость при постоянном давлении 29,27 Дж/(моль·К), диэлектрич. проницаемость газообразного К. 1,000547, жидкого 1,491. К. плохо растворим в воде (3,1% К. по объёму при 20 °C), хорошо растворим в некоторых фторорганич. растворителях, напр. перфтордекалине (4500% К. по объёму при 0 °C). Значит. количество К. растворяют благородные металлы: серебро, золото и платина. Растворимость газа в расплавленном серебре (2200% по объёму при 962 °C) резко понижается с уменьшением темп-ры, поэтому при охлаждении на воздухе расплав серебра «закипает» и разбрызгивается вследствие интенсивного выделения растворённого кислорода.
К. обладает высокой реакционной способностью, сильный окислитель: взаимодействует с большинством простых веществ при нормальных условиях, в осн. с образованием соответствующих оксидов (мн. реакции, протекающие медленно при комнатной и более низких темп-рах, при нагревании сопровождаются взрывом и выделением большого количества теплоты). К. взаимодействует при нормальных условиях с водородом (образуется вода Н2О; смеси К. с водородом взрывоопасны – см. Гремучий газ), при нагревании – с серой (серы диоксид SO2 и серы триоксид SO3), углеродом (углерода оксид СО, углерода диоксид СО2), фосфором (фосфора оксиды), мн. металлами (оксиды металлов), особенно легко со щелочными и щёлочноземельными (в осн. пероксиды и надпероксиды металлов, напр. пероксид бария BaO2, надпероксид калия KO2). С азотом К. взаимодействует при темп-ре выше 1200 °C или при воздействии электрич. разряда (образуется монооксид азота NO). Соединения К. с ксеноном, криптоном, галогенами, золотом и платиной получают косвенным путём. К. не образует химич. соединений с гелием, неоном и аргоном. Жидкий К. также является сильным окислителем: пропитанная им вата при поджигании мгновенно сгорает, некоторые летучие органич. вещества способны самовоспламеняться, когда находятся на расстоянии нескольких метров от открытого сосуда с жидким кислородом.
К. образует три ионные формы, каждая из которых определяет свойства отд. класса химич. соединений: $ce{O2^-}$– супероксидов (формальная степень окисления атома К. –0,5), $ce{O2^2^-}$ – пероксидных соединений (степень окисления атома К. –1, напр. водорода пероксид Н2О2), О2– – оксидов (степень окисления атома К. –2). Положительные степени окисления 1 и 2 К. проявляет во фторидах O2F2 и ОF2 соответственно. Фториды К. неустойчивы, являются сильными окислителями и фторирующими реагентами.
Молекулярный К. является слабым лигандом и присоединяется к некоторым комплексам Fe, Co, Mn, Cu. Среди таких комплексов наиболее важен железопорфирин, входящий в состав гемоглобина – белка, который осуществляет перенос К. в организме теплокровных.
Соли в природе
По распространенности неорганических соединений в природе соли занимают второе место после оксидов. Так, горные породы и глина состоят из солей кремниевой кислоты, которые имеют сложное строение. Их формулы записывают с помощью формул оксидов, например формула полевого шпата — 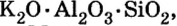 глины —
глины — 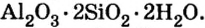
Местонахождение залежей солей в Украине представлено на рисунке 15.
Наиболее известная вам соль — хлорид натрия 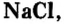 галит). Месторождения этой соли в Украине расположены вблизи г. Артемовен Донецкой области, в Автономной Республике Крым, в Карпатах. Человек очень давно оценил значение хлорида натрия и стал использовать эту соль как пищевой продукт и консервант (соление рыбы, мяса, грибов, квашение овощей и т. п.). Было время, когда соль стоила дороже золота: еще в старину возник обычай встречать гостей хлебом-солью. Существует поговорка: «Чтобы узнать человека, нужно с ним пуд соли съесть». Пуд долгое время был распространенной единицей массы, он равен 16 кг. Человек за год потребляет около 3 кг соли. Нетрудно подсчитать, что два человека пуд соли съедят примерно за 2,5—3 года. Так жизненный опыт подтверждает мудрость этой поговорки.
галит). Месторождения этой соли в Украине расположены вблизи г. Артемовен Донецкой области, в Автономной Республике Крым, в Карпатах. Человек очень давно оценил значение хлорида натрия и стал использовать эту соль как пищевой продукт и консервант (соление рыбы, мяса, грибов, квашение овощей и т. п.). Было время, когда соль стоила дороже золота: еще в старину возник обычай встречать гостей хлебом-солью. Существует поговорка: «Чтобы узнать человека, нужно с ним пуд соли съесть». Пуд долгое время был распространенной единицей массы, он равен 16 кг. Человек за год потребляет около 3 кг соли. Нетрудно подсчитать, что два человека пуд соли съедят примерно за 2,5—3 года. Так жизненный опыт подтверждает мудрость этой поговорки.
Как сырье хлорид натрия используется для производства гидроксида натрия, натрия, хлора, соляной кислоты, мыла, синтетических моющих средств. В пищевой, кондитерской и фармацевтической промышленности используют такие соли: хлорид натрия, карбонат натрия, нитрат натрия, сульфат магния и другие.
Карбонат кальция 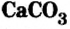
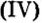
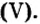 ортофосфат кальция
ортофосфат кальция 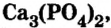 фторид кальция
фторид кальция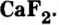
Соли входят также в состав крови, клеточного сока, нервной и мускульной тканей.
Из курсов природоведения и ботаники вам известно, что для полноценного роста и развития растениям нужны химические элементы калий, азот, фосфор. Их вносят в почву в виде минеральных удобрений. По своему составу почти все минеральные удобрения — это соли, в частности 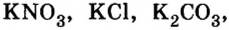 сульфата кальция
сульфата кальция  гипса
гипса 
 алебастр
алебастр 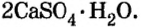 Карбонат натрия
Карбонат натрия 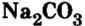
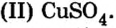 Хлорид калия
Хлорид калия 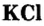 сильвина. Это вещество используют в качестве калийного удобрения, а также в производстве калия и гидроксида калия.Из ортофосфата кальция
сильвина. Это вещество используют в качестве калийного удобрения, а также в производстве калия и гидроксида калия.Из ортофосфата кальция 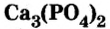 Сульфат бария
Сульфат бария 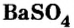
Ознакомившись с рисунком 16, вы пополните знания о применении солей новыми сведениями.
Приведенные здесь примеры — лишь небольшая часть того, как используются соли.
Итоги:
- Соли относятся к распространенным в природе сложным неорганическим веществам, среди которых больше всего хлоридов, силикатов, карбонатов, сульфатов, ортофосфатов.
- Часть солей используется непосредственно после добычи, а часть поддается химической переработке с целью получения новых веществ.
- Соли находят самое разнообразное применение в химической промышленности и многих других отраслях народного хозяйства, а также в быту.
Вода морей и океанов из-за содержащихся в ней различных солей на вкус солено-горькая. 100 г морской воды в среднем содержат 3,5 г солей, среди которых хлорида натрия почти 78 %. Моря и океаны имеют разную соленость — YaK называют содержание солей в единице объема морской воды.
Морские растения и животные приспособились к жизни в соленой воде. Более того, в их организмах накапливаются ионы, которые входят в состав солей морей и океанов. Морепродукты богаты кальцием, кремнием, иодом, медью, магнием, фосфором и другими элементами.
Используя сведения из географии и различных информационных источников, подготовьте рассказ (сообщение, реферат) о распространении какой-либо соли в природе и ее использовании.
Поработайте самостоятельно с дополнительной литературой, Интернетом и выясните, на каких химических свойствах солей основывается производство из них других веществ. Рассказ подтвердите примерами.
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например, электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu2 2ē → Cu0
На анодеокисляются молекулы воды:
Анод ( ): 2H2O-2 – 4ē → O2 4H
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2Cu2 SO4 2H2O-2 → 2Cu0 2H2SO4 O20
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–):2H 2O 2ē → H20 2OH–
На анодеокисляются хлорид-ионы:
Анод ( ): 2Cl– – 2ē → Cl20
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия:
2H 2O 2NaCl– → H20 2NaOH Cl20
Следующий пример: электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–):2H 2O 2ē → H20 2OH–
На анодеокисляются молекулы воды до молекулярного кислорода:
Анод ( ): 2H2O-2 – 4ē → O20 4H
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2H2 O-2→ 2H20 O20
Еще один пример: электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu2 2ē → Cu0
На анодеокисляются хлорид-ионы до молекулярного хлора:
Анод ( ): 2Cl– – 2ē → Cl20
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu2 Cl2– → Cu0 Cl20
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–):2H 2O 2ē → H20 2OH–
На анодеокисляются гидроксид-ионы до молекулярного кислорода:
Анод ( ): 4O-2H– – 4ē → O20 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2H2 O-2→ 2H20 O20
Физические свойства
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его при нормальных условиях имеет массу 1,429 г., то есть немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C,2,09 мл/100 г при 50 °C) и спирте(2,78 мл/100 г при 25 °C).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы, концентрация диссоциированных атомов в смеси при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород кипит под давлением 101,325 кПа при температуре −182,98 °C и представляет собой бледно-голубую жидкость. Критическая температура кислорода 154,58 К (-118,57 °C), критическое давление 4,882 МПа[17].
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы.
Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейкиa=5,403 Å,b=3,429 Å,c=5,086 Å;β=132,53°[18].β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å,α=46,25°[18].γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å[18].
Ещё три фазы существуют при высоких давлениях:
Физические свойства солей
При нормальных условиях соли находятся только в твердом состоянии. Это тугоплавкие кристаллические вещества, поэтому, чтобы перевести их в жидкое состояние, а тем более в парообразное, нужны высокие температуры. Так, температура плавления сульфида бария равна 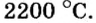 растворимые (хлорид натрия, нитрат калия), малорастворимые (сульфит магния, хлорид свинца
растворимые (хлорид натрия, нитрат калия), малорастворимые (сульфит магния, хлорид свинца нерастворимые (карбонат кальция, сульфат бария). Информация о растворимости солей и кислот содержится в таблице растворимости этих соединений в воде (см. Приложение).
нерастворимые (карбонат кальция, сульфат бария). Информация о растворимости солей и кислот содержится в таблице растворимости этих соединений в воде (см. Приложение).
Соли — это вещества без запаха, разного вкуса. Может показаться, что класс веществ «Соли» получил такое название благодаря соленому вкусу его соединений. В действительности же с «чистым» соленым вкусом существует лишь одна соль, и вам она хорошо известна, это — хлорид натрия.
Врачи предостерегают от избыточного употребления поваренной соли, однако в жизненно необходимых порциях хлорида натрия нуждается организм и человека, и животных. Она нужна для поддержания состава крови, а также вырабатывания желудочного сока. Физраствор, который используется для лечения больных,— ничто иное, как раствор хлорида натрия.
Соли бериллия — сладкие на вкус, соли магния — горькие, карбонат кальция (мел) — безвкусный. В большинстве своем соли имеют смешанный вкус — кисло-сладкий, горько-соленый.
Помните! В химическом кабинете соли ни в коем случае не пробуют на вкус!
Большинство солей белого цвета. Цвет перманганата калия 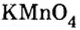
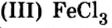
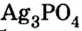
Внимательно рассмотрите образцы солей, которые учитель демонстрирует вам на урюке, и определите цвет и растворимость каждой из них.
Итоги:
- К классу солей относятся сложные вещества, образованные атомами металлов и кислотными остатками.
- В формулах солей сумма единиц валентности металла равна сумме единиц валентности кислотного остатка.
- Составляя формулу соли, необходимо знать валентность металла и кислотного остатка.
- По современной номенклатуре, названия солей образуют из названия металла и названия кислотного остатка и проставляют валентность металлов, у которых она имеет несколько значений.
Наиболее распространенной из солей угольной кислоты является карбонат кальция 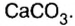
Жемчужина формируется в раковине моллюска вокруг раздражителей — чаще всего песчинок — и приблизительно за 12 лет вырастает величиной с горошину. Большие жемчужины правильной формы — чрезвычайная редкость.
Жемчуг издавна используют в качестве украшений. Особенно ценятся жемчужины правильной шарообразной формы. Они очень дорогостоящие: жемчужина диаметром 1 см стоит около 4000 долларов.
Средняя продолжительность хранения жемчужин составляет от 250 до 500 лет, после чего они теряют блеск и их легко измельчить в порошок.
Скелет других водных обитателей — коралловых полипов — по составу близок к жемчугу. Большие скопления коралловых полипов образуют коралловые рифы. В результате археологических раскопок обнаружилось, что люди издавна изготавливают украшения из кораллов (так называется скелет коралловых полипов).
Благодаря несколько иному составу, чем у жемчужин, такие изделия сохраняются дольше. В зависимости от содержания органических веществ, кораллы бывают разного цвета: розовые, красные и даже черные. Изготовленные из таких кораллов украшения — ожерелья, серьги, кольца — считаются самыми дорогими. Владельцам кораллов нужно знать, что даже при легком нагревании эти драгоценности теряют свой цвет.
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона, фтора (с фтором кислород образует фторид кислорода, так как фтор более электроотрицателен, чем кислород).
- 4Li O2⟶2Li2O{displaystyle {ce {4Li O2 -> 2Li2O}}}
- 2Sr O2⟶2SrO{displaystyle {ce {2Sr O2 -> 2SrO}}}
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO O2⟶2NO2↑{displaystyle {ce {2NO O2 -> 2NO2 ^}}}
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6 15O2⟶12CO2 6H2O{displaystyle {ce {2C6H6 15O2 -> 12CO2 6H2O}}}
- CH3CH2OH 3O2⟶2CO2 3H2O{displaystyle {ce {CH3CH2OH 3O2 -> 2CO2 3H2O}}}
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH O2⟶CH3COOH H2O{displaystyle {ce {CH3CH2OH O2 -> CH3COOH H2O}}}
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета.
Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #Фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- 2Na O2⟶Na2O2{displaystyle {ce {2Na O2 -> Na2O2}}}
- 2BaO O2⟶2BaO2{displaystyle {ce {2BaO O2 -> 2BaO2}}}
- H2 O2⟶H2O2{displaystyle {ce {H2 O2 -> H2O2}}}
- Na2O2 O2⟶2NaO2{displaystyle {ce {Na2O2 O2 -> 2NaO2}}}
- K O2⟶KO2{displaystyle {ce {K O2 -> KO2}}}
- 3KOH 3O3⟶2KO3 KOH⋅H2O 2O2↑{displaystyle {ce {3KOH 3O3 -> 2KO3 KOH * H2O 2O2 ^}}}
- PtF6 O2⟶O2PtF6{displaystyle {ce {PtF6 O2 -> O2PtF6}}}
В этой реакции кислород проявляет восстановительные свойства.


![{displaystyle {ce {2HgO ->[t] 2Hg O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/804710fd51b4d0c4adca861caa5d341fb5921d84)
![{displaystyle {ce {2KMnO4 ->[t] K2MnO4 MnO2 O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fa985cedcb06a74333be1dbf055f4b95e5b416e4)
![{displaystyle {ce {2H2O2 ->[MnO2] 2H2O O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39356fdea2f393003bf49298522c43c2aa66e358)

![{displaystyle {ce {2HgO ->[100{°}C] 2Hg O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8ed83305529bb4aea427f4cd72a0f92c5fe51aef)












