- Основное и возбужденное состояние атома серы
- So2 o2 = so3 расставить коэффициенты
- Оксид серы — so2
- Оксид серы vi — so3
- Получение сульфида железа (ii):
- Применение и использование сульфида железа (ii):
- Природные соединения
- Сернистая кислота
- Сернистый газ, химические свойства, получение
- Физические свойства сульфида железа (ii):
- Химические свойства сульфида железа (ii). химические реакции сульфида железа (ii):
Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных
электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
So2 o2 = so3 расставить коэффициенты
Реакция протекает по схеме:
SO2 O2 = SO3.
В ходе реакции степень окисления серы повышается от ( 4) до ( 6) (сера окисляется), а кислорода понижается от 0 до (-2) (кислород восстанавливается).
Уравнение полуреакции окисления серы:
![]()
Уравнение полуреакции восстановления кислорода:
![]()
Поскольку отношение чисел электронов, принятых при восстановлении кислорода и отданных при окислении серы, равно 2:2, то, складывая уравнения полуреакций восстановления и окисления, ни одно из них ни на что домножать не нужно:
![]()
В молекулярной форме полученное уравнение имеет следующий вид:
![]()
Реакция протекает при нагревании (![]() ) и в присутствии катализатора – платины, оксида ванадия (V) или оксида железа (III).
) и в присутствии катализатора – платины, оксида ванадия (V) или оксида железа (III).
Серный ангидрид – одно из самых реакционноспособных соединений. Он проявляет окислительные свойства, например превращает уголь в углекислый газ:
![]()
Особенности взаимодействия ![]() с галогенводородами связаны с ростом восстановительных свойств в ряду HCl – HBr – HI. Окислительные свойства
с галогенводородами связаны с ростом восстановительных свойств в ряду HCl – HBr – HI. Окислительные свойства ![]() с галогенводородами связаны с ростом восстановительных свойств в ряду HCl – HBr – HI. Окислительные свойства
с галогенводородами связаны с ростом восстановительных свойств в ряду HCl – HBr – HI. Окислительные свойства  усиливаются с ростом температуры. При слабом нагревании
усиливаются с ростом температуры. При слабом нагревании ![]() реагирует с газообразным HCl, образуя хлорсульфоновую кислоту
реагирует с газообразным HCl, образуя хлорсульфоновую кислоту ![]() реагирует с газообразным HCl, образуя хлорсульфоновую кислоту
реагирует с газообразным HCl, образуя хлорсульфоновую кислоту  :
:
![]()
При повышении температуры HCl восстанавливает ![]() до
до ![]() до
до 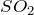 с одновременным образованием
с одновременным образованием ![]() . При действии на HBr триоксида серы при
. При действии на HBr триоксида серы при ![]() . При действии на HBr триоксида серы при
. При действии на HBr триоксида серы при  выделяются
выделяются ![]() и свободный бром:
и свободный бром:
![]()
Иодистым водородом ![]() восстанавливается до
восстанавливается до ![]() восстанавливается до
восстанавливается до  даже при охлаждении ниже
даже при охлаждении ниже ![]() :
:
![]()
Серный ангидрид бурно взаимодействует с водой с выделением большого количества теплоты. Термически неустойчив. Его термическая диссоциация на ![]() и
и ![]() и
и  начинается при
начинается при ![]() , а при
, а при ![]() , а при
, а при  в газовой фазе полностью отсутствуют молекулы
в газовой фазе полностью отсутствуют молекулы ![]() .
.
Оксид серы — so2
Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся
спички).
Получение
В промышленных условиях сернистый газ получают обжигом пирита.
FeS2 O2 = (t) FeO SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота,
распадающаяся на сернистый газ и воду.
K2SO3 H2SO4 = (t) K2SO4 H2O SO2↑
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Cu H2SO4(конц.) = (t) CuSO4 SO2 H2O
Оксид серы vi — so3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
Получение
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора
(оксид ванадия — Pr, V2O5).
SO2 O2 = (кат) SO3
В лабораторных условиях разложением солей серной кислоты — сульфатов.
Fe2(SO4)3 = (t) SO3 Fe2O3
Химические свойства
Получение сульфида железа (ii):
Сульфид железа (II) получается в результате следующих химических реакций:
- 1. взаимодействия железа и серы:
Fe S → FeS (t = 600-950 оС).
Реакция протекает путем сплавления алюминия с углеродом в дуговой печи.
- 2. взаимодействия оксида железа и сероводорода:
FeO H2S → FeS H2O (t = 500 оС).
- 3. взаимодействия хлорида железа и сульфида натрия:
FeCl2 Na2S → FeS 2NaCl.
- 4. взаимодействия сульфата железа и сульфида натрия:
FeSO4 Na2S → FeS Na2SO4.
Применение и использование сульфида железа (ii):
Сульфид железа (II) используется лишь в нескольких отраслях:
- в качестве исходного продукта для получения сероводорода в лабораторных условиях,
- в качестве сырья в производстве чугуна, как твердый источник сероводорода.
Ссылка на источник
Природные соединения
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.
Получение
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S,
SO2.
H2S O2 = S H2O (недостаток кислорода)
SO2 C = (t) S CO2
Серу можно получить разложением пирита
FeS2 = (t) FeS S
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
H2S H2SO4 = S H2O (здесь может также выделяться SO2)
Химические свойства
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Получение
SO2 H2O ⇄ H2SO3
Химические свойства
Сернистый газ, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Физические свойства сульфида железа (ii):
| Наименование параметра: | Значение: |
| Химическая формула | FeS |
| Синонимы и названия иностранном языке | iron (II) sulfide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | коричнево-черные гексагональные кристаллы |
| Цвет | коричнево-черный |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 4840 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 4,84 |
| Температура кипения, °C | — |
| Температура плавления, °C | 1194 |
| Молярная масса, г/моль | 87,91 |
* Примечание:
— нет данных.
Химические свойства сульфида железа (ii). химические реакции сульфида железа (ii):
Химические свойства сульфида железа (II) аналогичны свойствам сульфидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция сульфида железа (II) и кремния:
Si FeS → SiS Fe (t = 1200 оС).
В результате реакции образуются сульфид кремния и железо.
2. реакция сульфида железа (II) и кислорода:
FeS 2O2 → FeSO4.
В результате реакции образуются сульфат железа (II). Реакция протекает медленно. В ходе реакции используется влажный сульфид железа. Также образуются примеси: сера S, полигидрат оксида железа (III) Fe2O3 • nH2O.
3. реакция сульфида железа (II), кислорода и воды:
4FeS O2 10H2O → 4Fe(OH)3 4H2S.
В результате реакции образуются гидроксид железа и сероводород.
4. реакция сульфида железа (II), оксида кальция и углерода:
FeS CaO C → Fe CO CaS (tо).
В результате реакции образуются железо, оксид углерода и сульфид кальция.
5. реакция сульфида железа (II) и сульфида меди:
CuS FeS → CuFeS2.
В результате реакции образуются дитиоферрата (II) меди (II) (халькопирит).
6. реакции сульфида железа (II) с кислотами:
Сульфид железа (II) реагирует с сильными минеральными кислотами.
7. реакция термического разложения сульфида железа (II):
FeS → Fe S (t = 700 оС).
В результате реакции термического разложения сульфида железа (II) образуются железо и сера. Реакция протекает в вакууме.
