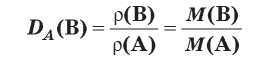- Краткое описание химических свойств и плотность кислорода
- Краткое описание химических свойств и плотность гелия
- Что такое плотность кг м3?
- Почему у газов низкая плотность?
- Что влияет на плотность?
- Таблица: плотности, химические формулы и молекулярные веса основных распространенных газов — ацетилен, воздух, метан, азот, кислород и многих других — таблицы
- Что вызывает плотность?
- Как температура влияет на плотность газа?
- Какая плотность кислорода в кг м3?
- Какая плотность кислорода?
- Какие 5 газов?
- Какие газы легче воздуха?
- Какие два газа самые легкие?
- Какова плотность земли в кг м3?
- Какова формула газообразного кислорода?
- Какой газ используется в воздушных шарах?
- Какой газ легче?
- Какой газ самый легкий?
- Меняет ли температура плотность воды?
- Относительная плотность газа
- Плотность газа и другие его физические свойства
- Плотность газов при нормальных условиях – таблица
- Плотность кислорода и другие его физические свойства
- Распространенность гелия в природе
- Распространенность кислорода в природе
- Снг тяжелее воды?
- Таблица плотности веществ
- Таблица плотности газов
- Таблица плотности. плотность — таблица (в т.ч. насыпная) материалов, веществ, продуктов, жидкостей и газов при атмосферном давлении. состояние вещества. английские наименования. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
- У газов низкая плотность?
- Физика. таблица плотностей
- Формула плотности
- Химия 9 класс еремина в.в. кузьменко н.е. дроздова а.а. лунина в.в. §6 относительная плотность газов решебник ответы
Краткое описание химических свойств и плотность кислорода
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно (кроме галогенов, золота и платины). Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры.
Некоторые вещества, например оксид азота (II), гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакции окисления ускоряются катализаторами. Например, в присутствии дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре.
O2 2H2 = 2H2O (550oС, сгорание H2в O2);
O2 F2 = O2F2 (-183oС, электрический разряд);
O2 N2↔2NO (электрический разряд);
O2 S = SO2 (сгорание на воздухе);
5O2 4P = P4O10 (сгорание на воздухе);
O2 C = CO2 (600-700oС, сжигание на воздухе);
O2 2Na = Na2O2 (сжигание на воздухе);
O2 2Mg = 2MgO (сгорание на воздухе);
3O2 4Al = 2Al2O3 (сгорание на воздухе).
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе. Хотя при этом выделяется такое же количество теплоты, как и при горении в воздухе, но процесс протекает быстрее и выделяющаяся теплота не тратится на нагревание азота воздуха; поэтому температура горения в кислороде значительно выше, чем в воздухе.
Краткое описание химических свойств и плотность гелия
Для инертных газов характерно полное или почти полное отсутствие химической активности. Так, в обычных условиях гелий химически инертен, но при сильном возбуждении атомов он может образовывать молекулярные ионы He2 [ss2ss*1]. В обычных условиях эти ионы неустойчивы; захватывая недостающий электрон, они распадаются на два нейтральных атома.
Что такое плотность кг м3?
| Килограмм на кубический метр | |
|---|---|
| Плотность куба: 1 кг / м 3 | |
| Общая информация | |
| Система единиц | Производная единица СИ |
| Единица | Плотность |
Почему у газов низкая плотность?
Газы обычно имеют низкую плотность главным образом потому, что межмолекулярная сила притяжения лучше молекул газа очень низкая. В результате они перемещаются повсюду, что в дальнейшем приводит к образованию более крупных межмолекулярных пространств. … В газах они имеют наименьшую массу / объем.
Что влияет на плотность?
Температура Влияет на плотность
На плотность воды также может влиять температура. Когда одно и то же количество воды нагревается или охлаждается, ее плотность меняется. Когда вода нагревается, она расширяется, увеличиваясь в объеме. Это представлено увеличением размера коробки с рис.
Таблица: плотности, химические формулы и молекулярные веса основных распространенных газов — ацетилен, воздух, метан, азот, кислород и многих других — таблицы
Таблица: плотности, химические формулы и молекулярные веса основных распространенных газов — ацетилен, воздух, метан, азот, кислород и многих других
| Газ | Химическая формула | Молегулярный вес | Плотность | |
|---|---|---|---|---|
кг/м3 | футов/фут3(lb/ft3) | |||
| Азот / Nitrogen | N2 | 28.02 | 1.1651) 1.25062) | 0.07271) 0.0780722) |
| Ацетилен = этин / Acetylene (ethyne) | C2H2 | 26 | 1.0921) 1.1702) | 0.06821) 0.07292) |
| Аммиак / Ammonia | NH3 | 17.031 | 0.7171) 0.7692) | 0.04481) 0.04802) |
| Аргон / Argon | Ar | 39.948 | 1.6611) 1.78372) | 0.10371) 0.1113532) |
| Бензол / Benzene | C6H6 | 78.11 | 3.486 | 0.20643 |
| Биогаз, генерируемый метантенком; метан, генерируемый метантенком / Digester Gas (Sewage or Biogas) | 0.062 | |||
| Бутан / Butane | C4H10 | 58.1 | 2.4891) 2.52) | 0.15541) 0.1562) |
| Бутилен = Бутен / Butylene (Butene) | C4H8 | 56.11 | 2.504 | 0.1482) |
| Веселящий газ, закись азота / Nitrous Oxide | N2O | 44.013 | 0.114 | |
| Водород / Hydrogen | H2 | 2.016 | 0.08992) | 0.00562) |
| Водяной пар / Water Vapor, steam | H2O | 18.016 | 0.804 | 0.048 |
| Водяной битуминозный газ= голубой водяной газ жирный / Water gas (bituminous) | 0.054 | |||
| Водяной карбюрированный газ = голубой водяной газ / Carbureted Water Gas | 0.048 | |||
| Воздух / Air | 29 | 1.2051) 1.2932) | 0.07521) 0.08062) | |
| Гелий / Helium | He | 4.02 | 0.16641) 0.17852) | 0.010391) 0.0111432) |
| Гексан / Hexane | 86.17 | |||
| Двукосиь азота / Nitric oxide | NO | 30.0 | 1.2491) | 0.07801) |
| Двуокись азота = перекись азота / Nitrogen Dioxide | NO2 | 46.006 | ||
| Доменный газ = колошниковый газ / Blast furnace gas | 1.2502) | 0.07802) | ||
| Дисульфид углерода = двусернистый углерод = сернистый углерод = сероуглерод / Carbon disulphide | 76.13 | |||
| Криптон / Krypton | 3.742) | |||
| Коксовальный газ = коксовый газ / Coke Oven Gas | 0.0342) | |||
| Метан / Methane | CH4 | 16.043 | 0.6681) 0.7172) | 0.04171) 0.04472) |
| Метиловый спирт / Methyl Alcohol | 32.04 | |||
| Пригодный газ = натуральный газ / Natural gas | 19.5 | 0.7 — 0.92) | 0.044 — 0.0562) | |
| Продукты сгорания = смесь продуктов полного сгорания в виде CO2, Н2О, SO2 и золы неполного сгорания в виде СО, Н2, и др., а также азота и кислорода / Combustion products | 1.112) | 0.0692) | ||
| Изопентан / Iso-Pentane | 72.15 | |||
| Кислород / Oxygen | O2 | 32 | 1.3311) 1.42902) | 0.08311) 0.0892102) |
| Ксенон / Xenon | 5.862) | |||
| Метилбензол = толуол / Toluene | C7H8 | 92.141 | 4.111 | 0.2435 |
| Неон / Neon | Ne | 20.179 | 0.89992) | 0.0561792) |
| Н-гептан / N-Heptane | 100.20 | |||
| Н-октан / N-Octane | 114.22 | |||
| Н-пентан / N-Pentane | 72.15 | |||
| Озон / Ozone | O3 | 48.0 | 2.142) | 0.125 |
| Оксид серы (II)= диоксид серы = двуокись серы = сернистый ангидрид = сернистый газ / Sulfur Dioxide | SO2 | 64.06 | 2.2791) 2.9262) | 0.17031) 0.18282) |
| Оксид серы (III)= триоксид серы = серный ангидрид = серный газ / Sulfur Trioxide | SO3 | 80.062 | ||
| Оксид серы (I)= моноксид серы / Sulfuric Oxide | SO | 48.063 | ||
| Пропан / Propane | C3H8 | 44.09 | 1.8821) | 0.11751) |
| Пропен = пропилен / Propene (propylene) | C3H6 | 42.1 | 1.7481) | 0.10911) |
| Перокид азота / Nitrous Trioxide | NO3 | 62.005 | ||
| Светильный газ угольный газ (горючий газ, состоящий из 20-30% метана и 50% водорода получаемый из каменного угля в процессе его полукоксования и частичного термического крекинга / Coal gas | 0.582) | |||
| Сера / Sulfur | S | 32.06 | 0.135 | |
| Соляная кислота = хлористый водород / Hydrochloric Acid = Hydrogen Chloride | HCl | 36.5 | 1.5281) | 0.09541) |
| Сероводород = сернистый водород / Hydrogen Sulfide | H2S | 34.076 | 1.4341) | 0.08951) |
| Угарный газ, моноксид углерода / Carbon monoxide | CO | 28.01 | 1.1651) 1.2502) | 0.07271) 0.07802) |
| Углекислый газ = двуокись углерода / Carbon dioxide | CO2 | 44.01 | 1.8421) 1.9772) | 0.11501) 0.12342) |
| Хладагент R-11 | 137.37 | |||
| Хладагент R-12 | 120.92 | |||
| Хладагент R-22 | 86.48 | |||
| Хладагент R40 = хлористый метил / Methyl Chloride | 50.49 | |||
| Хладагент R-114 | 170.93 | |||
| Хладагент R-123 | 152.93 | |||
| Хладагент R-134a | 102.03 | |||
| Холодильный агент R160 =хлористый этил / Ethyl Chloride | 64.52 | |||
| Хлор / Chlorine | Cl2 | 70.906 | 2.9941) | 0.18691) |
| Циклогексан / Cyclohexane | 84.16 | |||
| Этан / Ethane | C2H6 | 30.07 | 1.2641) | 0.07891) |
| Этиловый спирт = этанол / Ethyl Alcohol | 46.07 | |||
| Этилен / Ethylene | C2H4 | 28.03 | 1.2602) | 0.07862) |
1)NTP — Нормальная температура и давление (Normal Temperature and Pressure) — 20oC (293.15 K, 68oF) при 1 атм ( 101.325 кН/м2, 101.325 кПа, 14.7 psia, 0 psig, 30 in Hg, 760 мм.рт.ст)
2)STP — Стандартная температура и давление (Standard Temperature and Pressure) — 0oC (273.15 K, 32oF) при 1 атм (101.325 кН/м2, 101.325 кПа, 14.7 psia, 0 psig, 30 in Hg, 760 torr=мм.рт.ст)
Что вызывает плотность?
Плотность материала варьируется с температурой и давлением. Это изменение обычно невелико для твердых тел и жидкостей, но намного больше для газов. Увеличение давления на объект уменьшает объем объекта и, следовательно, увеличивает его плотность. … Это заставляет его подниматься по сравнению с более плотным ненагретым материалом.
Как температура влияет на плотность газа?
Основной вопрос: Как температура влияет на плотность? Когда жидкость или газ нагреваются, молекулы движутся быстрее, сталкиваются друг с другом и расходятся. Поскольку молекулы разнесены, они занимают больше места. Они менее плотные.
Какая плотность кислорода в кг м3?
Кислород весит 0.001429 грамма на кубический сантиметр или 1.429 килограмм на кубический метр, т.е. плотность кислорода равна 1.429 кг / м³; при 0 ° C (32 ° F или 273.15K) при стандартном атмосферном давлении.
Какая плотность кислорода?
Физические свойства кислорода
| Кислород | |
|---|---|
| Плотность газа при 70 ° F, 1 атм (фунт / фут3) | 0.0828 |
| Удельный объем при 70 ° F 1 атм (фут3 / фунт) | 12.08 |
| Удельный вес | 1.1 |
| Удельная теплоемкость при 70 ° F (БТЕ / фунт-моль- ° F) | 7.03 |
Какие 5 газов?
Примеры газов
- Водород.
- Азот.
- Кислород.
- Углекислый газ.
- Монооксид углерода.
- Водяной пар.
- Гелий.
- Неон.
Какие газы легче воздуха?
Есть только 14 газов и паров с плотностью пара меньше единицы, что означает, что они легче воздуха. Эти ацетилен, аммиак, окись углерода, диборан, этилен, гелий, водород, цианистый водород, фтороводород, метан, метиллитий, неон, азот и вода.
Какие два газа самые легкие?
Водород и гелийДва самых легких газа весят настолько мало, что гелиевые шары и водородные дирижабли могут парить в атмосфере.
Какова плотность земли в кг м3?
На основании различных методов измерения мы знаем, что плотность Земли составляет 5.52 грамма на кубический сантиметр. [Это значение равно 5520 килограмма на кубический метр.
Какова формула газообразного кислорода?
Модель молекулярного или двухатомного кислорода, состоящая из двух атомов кислорода, связанных вместе. Молекулярный кислород (O2) представляет собой двухатомную молекулу, состоящую из двух атомов кислорода, удерживаемых вместе ковалентной связью.
…
Свойства.
| Химическая формула | O 2 |
|---|---|
| Температура плавления | -219 ° С |
•Август 29, 2022
Какой газ используется в воздушных шарах?
гелий это особый газ, называемый благородным газом, что означает, что он не горит. Когда спичка проводится возле воздушного шара, наполненного гелием, воздушный шар лопается.
Какой газ легче?
водород, будучи самым легким из существующих газов (7% плотности воздуха), кажется, наиболее подходящим газом для подъема. Его можно легко производить в больших количествах, например, с помощью реакции конверсии водяного газа, но водород имеет несколько недостатков: водород чрезвычайно огнеопасен.
Какой газ самый легкий?
гелий является вторым по распространенности элементом во Вселенной после водорода. Гелий имеет одноатомные молекулы и является самым легким из всех газов, кроме водорода. . Гелий, как и другие благородные газы, химически инертен.
Меняет ли температура плотность воды?
Плотность воды составляет примерно 1 грамм на миллилитр, но, это меняется в зависимости от температуры или наличия растворенных в нем веществ. Лед менее плотный, чем жидкая вода, поэтому кубики льда плавают в стакане. Как и следовало ожидать, плотность воды — важный показатель воды.
Относительная плотность газа
Обозначим относительную плотность газа m1 / m2 буквой D. Тогда
D = M1 / M2,
откуда
M1 = D×M2.
Следовательно, молярная масса газа равна его плотности по отношению у другому газа, умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода равна 2,0158 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид:
M = 2,0158 ×D
или, если округлить молярную массу водорода до 2:
M = 2 ×D.
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше равна 22, находим:
M(CO2) = 2 × 22 = 44 г/моль.
Плотность газа в лабораторных условиях самостоятельно можно определить следующим образом: необходимо взять стеклянную колбу с краном и взвесить её на аналитических весах. Первоначальный вес – вес колбы, из которой откачали весь воздух, конечный – вес колбы, наполненной до конкретного давления исследуемым газом. Разность полученных масс следует разделить на объем колбы. Вычисленное значение и есть плотность газа в данных условиях.
Чтобы рассчитать плотность газа при н.у. нужно воспользоваться уравнением состояния идеального газа:
p2 = pN;
V2 = VN;
T2 = TN.
p1/pN×V1/m×m/VN = T1/TN;
т.к. m/V1 = r1 и m/VN = rN, получаем, что
rN = r1×pN/p1×T1/TN.
В таблице ниже приведены значения плотностей некоторых газов.
Таблица 1. Плотность газов при нормальных условиях.
Газ | Плотность, кг/м3 | Dair | DH2 |
Воздух | 1,293 | 1 | 14,5 |
Водород | 0,0899 | 0,00695 | 1 |
Азот | 1,25 | 0,967 | 14 |
Кислород | 1,43 | 1,11 | 16 |
Диоксид углерода | 1,997 | 1,53 | 22 |
Гелий | 0,179 | 0,139 | 2 |
Плотность газа и другие его физические свойства
Одной из важнейших физических свойств газообразных веществ является значение их плотности.
Данную величину обычно обозначают греческой буквой r или латинскими D и d. Единицей измерения плотности в системе СИ принято считать кг/м3, а в СГС – г/см3. Плотность газа – справочная величина, её обычно измеряют при н. у.
Зачастую, применительно к газам используют понятие «относительная плотность». Данная величина представляет собой отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму.
Например, при нормальных условиях масса диокисда углерода в объеме 1 л равна 1,98 г, а масса водорода в том же объеме и при тех же условиях – 0,09 г, откуда плотность диоксида углерода по водороду составит: 1,98 / 0,09 = 22.
Плотность газов при нормальных условиях – таблица
| Газ (газовая фаза) | Хим. формула | Плотность | ||
| г/см3 | г/л | кг/м3 | ||
| Азот | N2 | 1.251⋅10−3 | 1.251 | 1.251 |
| Аммиак | NH3 | 7,723⋅10−4 | 0,7723 | 0,7723 |
| Аргон | Ar | 1,784⋅10−3 | 1,784 | 1,784 |
| Арсин (мышьяковистый водород) | H3As | 3,48⋅10−3 | 3,48 | 3,48 |
| Ацетилен | C2H2 | 1,16⋅10−3 | 1,16 | 1,16 |
| Бромоводород (бромистый водород) | HBr | 3.664⋅10−3 | 3.664 | 3.664 |
| Бутан | C4H10 | 2,7⋅10−3 | 2,7 | 2,703 |
| Водород | H2 | 8,987⋅10−5 | 0.08987 | 0.08987 |
| Гелий | He | 1,785⋅10−4 | 0,1785 | 0,1785 |
| Герман (германия тетрагидрид) | GeH4 | 3,42⋅10−3 | 3,42 | 3,420 |
| Диметиламин | (CH3)2NH | 2,0125⋅10−3 | 2,0125 | 2,0125 |
| Диметиловый эфир (метиловый эфир, метоксиметан, древесный эфир) | C2H6O | 2,1098⋅10−3 | 2,1098 | 2,1098 |
| Диоксид углерода (двуокись углерода, углекислый газ, углекислота, оксид углерода(IV), угольный ангидрид) | CO2 | 1,9768⋅10−3 | 1,9768 | 1,9768 |
| Диоксид хлора (двуокись хлора) | ClO2 | 3,01⋅10−3 | 3,01 | 3,01 |
| Дифтордихлорметан (дихлордифторметан, Фреон R 12, Фреон-12, Хладон-12, CFC-12, R-12) | CF2Cl2 | 5,51⋅10−3 | 5,51 | 5,510 |
| Закись азота (оксид диазота, оксид азота(I), веселящий газ) | N2O | 1,978⋅10−3 | 1,978 | 1,978 |
| Изобутан | C4H10 | 2,673⋅10−3 | 2,673 | 2,673 |
| Иодоводород (водород иодистый) | HI | 5,789⋅10−3 | 5,789 | 5,789 |
| Кислород | O2 | 1,429⋅10−3 | 1,429 | 1,429 |
| Кремния гексагидрид | Si2H6 | 2,85⋅10−3 | 2,85 | 2,85 |
| Криптон | Kr | 3,74⋅10−3 | 3,74 | 3,74 |
| Ксенон | Xe | 5,89⋅10−3 | 5,89 | 5,89 |
| Метан | CH4 | 7,168⋅10−4 | 0,7168 | 0,7168 |
| Метиламин | CH5N | 1,388⋅10−3 | 1,388 | 1,388 |
| Метилфторид | CH3F | 1,545⋅10−3 | 1,545 | 1,545 |
| Монооксид углерода (угарный газ, окись углерода, оксид углерода(II)) | CO | 1,25⋅10−3 | 1,25 | 1,25 |
| Моносилан (тетрагидрид кремния) | SiH4 | 1,44⋅10−3 | 1,44 | 1,44 |
| Неон | Ne | 0,9⋅10−3 | 0,9 | 0,900 |
| Озон | O3 | 2,14⋅10−3 | 2,14 | 2,14 |
| Оксид азота(II) (мон(о)оксид азота, окись азота, нитрозил-радикал) | NO | 1,3402⋅10−3 | 1,3402 | 1,3402 |
| Оксид серы(IV) (диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид) | SO2 | 2,9263⋅10−3 | 2,9263 | 2,9263 |
| Оксид хлора(I) (окись хлора) | Cl2O | 3,88⋅10−3 | 3,88 | 3,88 |
| Оксифторид фосфора | POF3 | 4,8⋅10−3 | 4,8 | 4,8 |
| Пропан | C3H8 | 2,0037⋅10−3 | 2,0037 | 2,0037 |
| Пропилен | C3H6 | 1,915⋅10−3 | 1,915 | 1,915 |
| Радон | Rn | 9,81⋅10−3 | 9,81 | 9,81 |
| Селеноводород | H2Se | 3,6643⋅10−3 | 3,6643 | 3,6643 |
| Сероводород (сернистый водород) | H2S | 1,5206⋅10−3 | 1,5206 | 1,5206 |
| Сероокись углерода (карбонилсульфид) | COS | 2,72⋅10−3 | 2,72 | 2,72 |
| Стибин (сурьмянистый водород) | H3Sb | 5,48⋅10−3 | 5,48 | 5,48 |
| Теллуроводород (теллуран) | H2Te | 5,81⋅10−3 | 5,81 | 5,81 |
| Тетрафторид кремния | SiF4 | 4,96⋅10−3 | 4,96 | 4,96 |
| Триметиламин | C3H9N | 2,64⋅10−3 | 2,64 | 2,64 |
| Триметилбор | C3H9B | 2,52⋅10−3 | 2,52 | 2,52 |
| Трифторид мышьяка (мышьяк фтористый) | AsF5 | 7,71⋅10−3 | 7,71 | 7,71 |
| Фосфин (фосфористый водород, фосфид водорода, гидрид фосфора) | PH3 | 1,53⋅10−3 | 1,53 | 1,53 |
| Фтор | F2 | 1,695⋅10−3 | 1,695 | 1,695 |
| Фторид бора (III), (трифторид бора, бор трехфтористый) | BF3 | 3,028⋅10−3 | 3,028 | 3,028 |
| Фторид нитрила (фторокись азота) | (NO2)F | 2,9⋅10−3 | 2,90 | 2,90 |
| Фторид нитрозила (нитрозил фтористый) | (NO)F | 2,1875⋅10−3 | 2,1875 | 2,1875 |
| Фторид серы(VI) (Гексафторид серы, элегаз, шестифтористая сера) | SF6 | 6,56⋅10−3 | 6,56 | 6,56 |
| Фторид фосфора(III) | PF3 | 3,91⋅10−3 | 3,91 | 3,91 |
| Фторид фосфора(V) (пентафторид фосфора) | PF5 | 5,81⋅10−3 | 5,81 | 5,81 |
| Хлор | Cl2 | 3,22⋅10−3 | 3,22 | 3,22 |
| Хлорид нитрозила (нитрозилхлорид, хлористый нитрозил, оксид-хлорид азота) | NOCl | 2,992⋅10−3 | 2,992 | 2,992 |
| Хлорметан (метилхлорид) | CH3Cl | 2,307⋅10−3 | 2,307 | 2,307 |
| Хлороводород (хлористый водород) | HCl | 1,6391⋅10−3 | 1,6391 | 1,6391 |
| Хлорокись азота | NO2Cl | 2,57⋅10−3 | 2,57 | 2,57 |
| Циан (дициан) | C2N2 | 2,38⋅10−4 | 0,238 | 0,238 |
| Этан | C2H6 | 1,356⋅10−3 | 1,356 | 1,356 |
| Этилен | C2H4 | 1,26⋅10−3 | 1,26 | 1,2605 |
В различных источниках информация может немного различаться.
Нормальные условия (н. у.) — физические условия, определяемые давление p=0,1013 МПа = 760 мм рт. ст. (нормальная атмосфера) и температурой 273,15 К (0 °С).
Плотность кислорода и другие его физические свойства
Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0oC растворяют 4,9, а при 20oC – 3,1 объема кислорода. Важнейшие константы кислорода представлены в таблице ниже:
Таблица 1. Физические свойства и плотность кислорода.
Плотность, кг/м3 | 1,42987 – газ 1141 – жидкость |
Температура плавления, oС | -218,35 |
Температура кипения, oС | -182,96 |
Энергия ионизации атома, эВ | 9,32 |
Относительная электроотрицательность | 1,51 |
Радиус атома, нм | 112 |
Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 1500oC она становится заметной.
Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
Известны три аллотропные формы кислорода: кислород O2, озон O3 и крайне неустойчивый тетракислород O4.
Распространенность гелия в природе
Гелий относится к группе благородный газов. Он впервые был обнаружен на Солнце, а затем и на Земле. Спектральный анализ показывает присутствие гелия в атмосфере звезд и в метеоритах.
Распространенность кислорода в природе
Кислород является самым распространенным элементом земной коры. В атмосфере его находится около 23% (масс.), в составе воды – около 89%, в человеческом организме – около 65%, в песке содержится 53% кислорода, в глине – 56% и т.д. Если подсчитать его количество в воздухе (атмосфере), воде (гидросфере) и доступной непосредственному химическому исследованию части твердой земной коры (литосфере), то окажется, что на долю кислорода приходится примерно 50% их общей массы.
В связанном состоянии кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, встречающиеся в земной коре, содержат кислород. Кислород является составной частью многих органических соединений, например белков, жиров и углеводов, имеющих исключительно большое значение в жизни растений, животных и человека.
Снг тяжелее воды?
Плотность СУГ меньше, чем у воды. Плотность или удельный вес сжиженного нефтяного газа примерно вдвое меньше, чем у воды, 1 литр равен 0.51 кг (при 15 ° C). В отличие от воды, 1 килограмм LPG НЕ равен 1 литру LPG. 1 кг сжиженного нефтяного газа имеет объем 1.96 л.
Таблица плотности веществ
В таблице приведена плотность различных материалов и веществ:
- газов,
- металлов,
- сплавов,
- продуктов.
Для вашего удобства реализован поиск по таблице. Для этого в поле «Найти» введите интересующий вас материал.
| Вещество (материал) | Плотность ρ, кг/м3 | Плотность ρ, г/см3 |
|---|---|---|
| Агат плотность агата | 2600 | 2,6 |
| Азот плотность азота | 1250 | 1,25 |
| Азот сжиженный (-195°C) плотность сжиженного азота | 850 | 0,850 |
| Азота закись N2O плотность закиси азота | 1,98 | 0,00198 |
| Азота окись NO плотность окиси азота | 1,3402 | 0,00134 |
| Азота фторокись NO2F плотность фторокиси азота | 2,9 | 0,0029 |
| Азота хлорокись NO2Cl плотность хлорокиси азота | 2,57 | 0,00257 |
| Азотная кислота, HNO3 водный раствор 91% плотность азотной кислоты | 1505 | 1,505 |
| Актиний плотность актиния | 10070 | 10,07 |
| Алебастр плотность алебастра | 1800-2500 | 1,8-2,5 |
| Алмаз плотность алмаза | 3510 | 3,51 |
| Алюминиевая бронза (3-10% Al) плотность алюминиевой бронзы | 7700-8700 | 7,7-8,7 |
| Алюминиевая фольга плотность алюминиевой фольги | 2700 -2750 | 7,7-2,75 |
| Алюминий плотность алюминия | 2710 | 2,71 |
| Алюминий крупнокусковой плотность крупнокускового алюминия | 880 | 0,88 |
| Алюминий порошкообразный плотность порошкообразного алюминия | 750 | 0,75 |
| Алюминий фтористый (криолит) плотность фтористого алюминия | 1600 | 1,6 |
| Алюминия оксид Al2O3 (чистый сухой) плотность оксида алюминия | 1520 | 1,52 |
| Америций чистый плотность амерция | 13670 | 13,67 |
| Аммиак плотность аммиака | 770 | 0,77 |
| Аммиачная селитра (нитрат аммония) плотность аммиачной селитры | 730 | 0,73 |
| Аммония сульфат; сернокислый аммоний (мокрый) плотность сульфата аммония | 1290 | 1,29 |
| Аммония сульфат; сернокислый аммоний (сухой) плотность сульфата аммония | 1130 | 1,13 |
| Андезит цельный плотность андезита цельного | 2770 | 2,77 |
| Анилин плотность анилина | 1020 | 1,02 |
| Апатит плотность апатита | 3190 | 3,19 |
| Арахис нечищеный (земляной орех) плотность арахиса нечищеного | 270 | 0,27 |
| Арахис чищенный (земляной орех) плотность арахиса чищенного | 650 | 0,65 |
| Аргон плотность аргона | 1784 | 1,784 |
| Асбест кусками плотность асбеста | 1600 | 1,6 |
| Асбест цельный плотность асбеста | 2350-2600 | 2,35-2,6 |
| Асфальтобетон плотность асфальтобетона | 2250 | 2,25 |
| Асфальтовая крошка плотность асфальтовой крошки | 720 | 0,72 |
| Ацетилен C2H2 плотность ацетилена | 1,17 | 0,00117 |
| Ацетон плотность ацетона | 800 | 0,8 |
| Ацетонитрил плотность ацетонитрила | 780 | 0,78 |
| Баббит плотность баббита | 7270 | 7,27 |
| Базальт дробленый плотность базальта дробленного | 1950 | 1,95 |
| Базальт цельный плотность базальта цельного | 3000 | 3 |
| Бакелит цельный плотность бакелита цельного | 1360 | 1,36 |
| Барий чистый плотность бария чистого | 3590 | 3,59 |
| Бариллиево-медный сплав, бериллиевая бронза плотность бериллиевой бронзы | 8100 — 8250 | 8,1 — 8,25 |
| Бария сульфат (барит), дробленый плотность сульфата бария | 2880 | 2,88 |
| Бензин плотность бензина | 750 | 0,75 |
| Бензол плотность бензола | 880 | 0,88 |
| Бериллий плотность бериллия | 1848 | 1,848 |
| Берклий чистый плотность берклий чистый | 14780 | 14,78 |
| Бетон плотность бетона | 2300 | 2,3 |
| Бетонит сухой плотность бетонита сухого | 600 | 0,6 |
| Бобы какао плотность какое бобов | 600 | 0,6 |
| Бобы касторовые плотность бобов касторовых | 580 | 0,58 |
| Бобы соевые плотность соевых бобов | 720 | 0,72 |
| Бокситы дробленые плотность дробленых бокситов | 1282 | 1,282 |
| Бор плотность бора | 2460 | 2,46 |
| Бор фтористый плотность фтористого бора | 2,99 | 0,00299 |
| Бром чистый плотность брома | 3120 | 3,12 |
| Бронза плотность бронзы | 8700-8900 | 8,7-8,9 |
| Бронза свинцовистая плотность свинцовистой бронзы | 7700 — 8700 | 7,7-8,7 |
| Бронза фосфористая плотность бронзы фосфористной | 8780 — 8920 | 8,78-8,92 |
| Бумага обычная плотность бумаги | 1201 | 1,201 |
| Бура (пироборнокислый натрий) плотность буры | 850 | 0,85 |
| Буровой раствор глинистый жидкий плотность раствора буры | 1730 | 1,73 |
| Бутан (i-Бутан) C4H10 плотность i-бутана | 2,67 | 0,00267 |
| Бутан (n-Бутан) C4H10 плотность n-бутана | 2,7 | 0,0027 |
| Бытовые отходы, бытовой мусор плотность мусора | 480 | 0,48 |
| Ванадий чистый плотность ванадия | 6020 | 6,02 |
| Винипласт плотность винипласта | 1380 | 1,38 |
| Висмут чистый плотность висмута | 9750 | 9,75 |
| Вода дистиллированная плотность воды дистиллированной | 998 | 0,998 |
| Вода морская плотность морской воды | 1020 | 1,02 |
| Водород плотность водорода | 90 | 0,09 |
| Водород сжиженный плотность сжиженного водорода | 72 | 0,072 |
| Водород бромистый HBr плотность бромистого водорода | 3,66 | 0,00366 |
| Водород йодистый Hl плотность йодистого водорода | 5,79 | 0,00579 |
| Водород мышьяковистый H3As плотность мышьяковистого водорода | 3,48 | 0,00348 |
| Водород селенистый H2Se плотность селенистого водорода | 3,66 | 0,00366 |
| Водород сернистый H2S плотность сернистого водорода | 1,54 | 0,00154 |
| Водород теллуристый H2Te плотность теллуристого водорода | 5,81 | 0,00581 |
| Водород фосфористый H3P плотность фосфористого водорода | 1,53 | 0,00153 |
| Водород хлористый HCl плотность хлористого водорода | 1,64 | 0,00164 |
| Водяной пар (100°C) плотность водяного пара | 880 | 0,88 |
| Воздух плотность воздуха | 1290 | 1,29 |
| Воздух сжиженный плотность воздуха | 861 | 0,861 |
| Вольфрам плотность вольфрама | 19100 | 19,1 |
| Гадолиний чистый Gadolinium Gd плотность гадолиния | 7895 | 7,895 |
| Галлий чистый плотность галлия | 5900 | 5,9 |
| Гафний чистый Hafnium Hf плотность гафния | 13310 | 13,31 |
| Гелий плотность гелия | 0,18 | 0,00018 |
| Гелий сжиженный плотность гелия | 147 | 0,147 |
| Гематит (красный железняк) дробленый плотность гематита | 2100-2900 | 2,1-2,9 |
| Гематит (красный железняк) цельный плотность гематита | 5095 — 5205 | 5,095 — 5,205 |
| Германий чистый плотность германия | 5300 | 5,3 |
| Глицерин плотность глицерина | 1260 | 1,26 |
| Гранит плотность гранита | 2800 | 2,8 |
| Двуокись углерода плотность углекислого газа | 1980 | 1,98 |
| Дедерон плотность дедерона | 1100 | 1,1 |
| Дизельное топливо (солярка) плотность дизельного топлива | 850 | 0,85 |
| Дуб плотность дуба | 800 | 0,8 |
| Дюралюминий плотность дюралюминия | 2790 | 2,79 |
| Дюралюминий плотность дюралюминия | 2790 | 2,79 |
| Железо плотность железа | 7800 | 7,8 |
| Золото плотность золота | 19300 | 19,3 |
| Инвар плотность инвара | 8700 | 8,7 |
| Иридий плотность иридия | 22400 | 22,4 |
| Каменный уголь плотность каменного угля | 1400 | 1,4 |
| Керосин плотность керосина | 800 | 0,8 |
| Кислород плотность кислорода | 1470 | 1,47 |
| Кокс плотность кокса | 600 | 0,6 |
| Криптон плотность криптона | 3743 | 3,743 |
| Ксенон плотность ксенона | 5851 | 5,851 |
| Латунь плотность латуни | 8600 | 8,6 |
| Лед (вода ниже 0°С) плотность льда | 900 | 0,9 |
| Литий плотность лития | 535 | 0,535 |
| Магний плотность магния | 1738 | 1,738 |
| Медь плотность меди | 8900 | 8,9 |
| Метан плотность метана | 717 | 0,717 |
| Молоко плотность молока | 1030 | 1,03 |
| Натрий плотность натрия | 968 | 0,986 |
| Неон плотность неона | 900 | 0,9 |
| Окись углерода плотность угарного газа | 1250 | 1,25 |
| Пертинакс плотность пертинакса | 1350 | 1,35 |
| Песчаник плотность песчаника | 2400 | 2,4 |
| Платина плотность платины | 21500 | 21,5 |
| Пропан плотность пропана | 2200 | 2,2 |
| Органическое стекло плотность органического стекла | 1180 | 1,18 |
| Пробковая кора плотность пробковой коры | 150 | 0,15 |
| Ртуть плотность ртути | 13500 | 13,5 |
| Свинец плотность свинца | 11340 | 11,34 |
| Серебро плотность серебра | 10500 | 10,5 |
| Серная кислота (концентрированная) плотность серной кислоты | 1830 | 1,83 |
| Сосна плотность сосны | 500 | 0,5 |
| Спирт (ректификат) плотность спирта | 830 | 0,83 |
| Стекло оконное плотность оконного стекла | 2500 | 2,5 |
| Титан плотность титана | 4500 | 4,5 |
| Углерод плотность углерода | 2260 | 2,26 |
| Фтор плотность фтора | 1696 | 1,696 |
| Хлор плотность хлора | 3220 | 3,22 |
| Цинк плотность цинка | 7100 | 7,1 |
| Электрон плотность электрона | 1800 | 1,8 |
| Этилен плотность этилена | 1260 | 1,26 |
| Этиловый спирт плотность этилового спирта | 790 | 0,79 |
| Эфир плотность эфира | 720 | 0,72 |
Таблица плотности газов
| Вещество | Плотность, кг/м3 |
| Азот | 1,251 |
| Аммиак | 0,7714 |
| Аргон | 1,7839 |
| Ацетилен | 1,1709 |
| Водород | 0,08987 |
| Воздух | 1,2928 |
| Гелий | 0,1785 |
| Закись азота | 1,978 |
| Кислород | 1,429 |
| Криптон | 3,74 |
| Ксенон | 5,89 |
| Метан | 0,7168 |
| Неон | 0,8999 |
| Озон | 2,22 |
| Окись азота | 1,3402 |
| Пропан | 2,0037 |
| Радон | 9,73 |
| Триметиламин | 2,58 |
| Двуокись углерода | 1,9768 |
| Окись углерода | 1,25 |
| Сплав ВМЛ9 | 1850 |
| Сероокись углерода | 2,72 |
| Фтористый фосфор | 3,907 |
| Фтор | 1,695 |
| Фтороокись азота | 2,9 |
| Хлор | 3,22 |
| Двуокись хлора | 3,09 |
| Окись хлора | 3,89 |
| Этан | 1,356 |
Смотрите также:
— таблица насыпной плотности
— таблица плотности металлов
— таблица плотности воды
— таблица плотности воздуха
Таблица плотности газов необходима для физических расчетов.
Наша проектная организация готова разработать для Вас проекты водоснабжения и канализации для объектов любой сложности на любом этапе проектирования.
Таблица плотности. плотность — таблица (в т.ч. насыпная) материалов, веществ, продуктов, жидкостей и газов при атмосферном давлении. состояние вещества. английские наименования. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
Раздел недели: Плоские фигуры. Свойства, стороны, углы, признаки, периметры, равенства, подобия, хорды, секторы, площади и т.д. |  | ||
У газов низкая плотность?
Газ — это состояние вещества, которое не имеет фиксированной формы и фиксированного объема. Газы имеют более низкую плотность, чем другие состояния вещества., например твердые и жидкие. Между частицами, обладающими большой кинетической энергией, очень много пустого пространства.
Физика. таблица плотностей
Плотность — это скалярная физическая величина, которая определяется как отношение массы тела к занимаемому этим теломобъёму или площади (поверхностная плотность). Для обозначения плотности обычно используется символ  .
.
| Наименование | Плотность, кг/м3 |
| Алюминий | 2,7·103 |
| Барий | 3,5·103 |
| Бензин | 0.750 · 103 |
| Ванадий | 6,0·103 |
| Вольфрам | 19,1 ·103 |
| Вода дистилированая | 0.998 · 103 |
| Вода морская | 1.020 · 103 |
| Висмут | 9,8·103 |
| Дизельное топливо | 0.850 · 103 |
| Железо | 7,8·103 |
| Литий | 0,53·103 |
| Медь | 8,9·103 |
| Никель | 8,9·103 |
| Свинец | 11,3·103 |
| Серебро | 10,5·103 |
| Цезий | 1,9·103 |
| Цинк | 7,1·103 |
| Вода (при 40С) | 1,00·103 |
| Глицерин | 1,26·103 |
| Гранит | 2600 |
| Дерево (Дуб) | 810 |
| Ртуть | 13,6·103 |
| Спирт | 0,80·103 |
| Сероуглерод | 1,26·103 |
| Водород | 0,09 |
| Воздух | 1,29 |
| Гелий | 0,18 |
| Кислород | 1,43 |
| Керосин | 800 |
| Эфир | 0.720 · 103 |
| Нефть | изменяемая 730—1040 |
| Мрамор | 2700 |
| Керосин | 0.800 · 103 |
| Серная кислота | 1.830 · 103 |
| Сера | 2070 кг/м³ |
| Золото | 19320 |
| Гипс | 1500 |
| Бетон | 2000 |
| Молоко | 1050 |
| Стекло | 2500 |
| Чугун | 7000 |
Формула плотности
{rho = dfrac{m}{V}}, где a — ребро тетраэдра.
Химия 9 класс еремина в.в. кузьменко н.е. дроздова а.а. лунина в.в. §6 относительная плотность газов решебник ответы
ХИМИЯ 9 КЛАСС Еремина В.В. Кузьменко Н.Е. Дроздова А.А. Лунина В.В. §6 Относительная плотность газов РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1
Во сколько раз кислород тяжелее:
а) водорода;
DH2(O2)=M(O2):M(H2)=32 г/моль : 2 г/моль=16
Ответ: кислород тяжелее водорода в 16 раз.
б) воздуха?
Dвоздуха(O2)=M(O2):M(воздуха)=32 г/моль : 29 г/моль=1,1
Ответ: кислород тяжелее воздуха в 1,1 раза.
Задание 2
Найдите относительную плотность гелия и неона:
а) по водороду;
DH2(He)=M(He):M(H2)=4 г/моль : 2 г/моль=2
DH2(Ne)=M(Ne):M(H2)=20 г/моль : 2 г/моль=10
б) по воздуху.
Dвоздуха(He)=M(He):M(воздуха)=42 г/моль : 9 г/моль=0,14
Dвоздуха(Ne)=M(Ne):M(воздуха)=20 г/моль : 29 г/моль=0,69
Задание 3
Объясните, почему относительные плотности всех газов по водороду больше 1. Водород имеет наименьшую молярную массу среди всех элементов (является самым лёгким газом).
Задание 4
Найдите относительную плотность по гелию следующих газов: H2, CH4, N2, O2, SO2.
DHe(H2)=M(H2):M(He)=2 г/моль : 4 г/моль=0,5
DHe(CH4)=M(CH4):M(He)=16 г/моль : 4 г/моль=4
DHe(N2)=M(N2):M(He)=28 г/моль : 4 г/моль=7
DHe(O2)=M(O2):M(He)=32 г/моль : 4 г/моль=8
DHe(SO2)=M(SO2):M(He)=64 г/моль : 4 г/моль=16
Задание 5
Из таблицы 2 выпишите газы, которые:
а) легче воздуха; H2, N2, CH4, NH3
Легче воздуха ― газы, относительная плотность которых по воздуху меньше единицы.
Dвоздуха(H2)=M(H2):M(воздуха)=2 г/моль : 29 г/моль=0,07<1
Dвоздуха(N2)=M(N2):M(воздуха)=28 г/моль : 29 г/моль=0,96<1
Dвоздуха(CH4)=M(O2):M(воздуха)=16 г/моль : 29 г/моль=0,55<1
Dвоздуха(NH3)=M(SO2):M(воздуха)=17 г/моль : 29 г/моль=0,58<1
б) тяжелее воздуха. O2, F2, Cl2, Br2, CO2
Тяжелее воздуха ― газы, относительная плотность которых по воздуху больше единицы.
Dвоздуха(O2)=M(O2):M(воздуха)=32 г/моль : 29 г/моль=1,1>1
Dвоздуха(F2)=M(F2):M(воздуха)=38 г/моль : 29 г/моль=1,3>1
Dвоздуха(Cl2)=M(Cl2):M(воздуха)=71 г/моль : 29 г/моль=2,45>1
Dвоздуха(Br2)=M(Br2):M(воздуха)=160 г/моль : 29 г/моль=5,52>1
Dвоздуха(CO2)=M(CO2):M(воздуха)=44 г/моль : 29 г/моль=1,52>1
Какой газ из приведённых в ней самый лёгкий; самый тяжёлый? Самый лёгкий газ водород H2, а самый тяжёлый ― бром Br2.
Задание 6
Плотность некоторого газа по кислороду равна 2. Чему равна плотность этого газа по водороду?
Дано: DO2(газа)=2
Найти: DH2(газа)-?
Решение
По условию задачи DO2(газа)=2, поэтому M(газа)/M(O2)=2, отсюда M(газа)=2•M(O2)=2•32 г/моль=64 г/моль
DH2(газа)=M(газа)/M(H2)=64 г/моль : 2 г/моль=32
Ответ: DH2(газа)=32
Задание 7
Какой газ тяжелее азота, но легче кислорода? Воздух
Mr(N2)<Mr(газ)<Mr(O2)
Mr(N2)=2•Ar(N)=2•14=28
Mr(O2)=2•Ar(O)=2•16=32
Mr(воздуха)=29
28<29<32
Задание 8
Приведите формулы пяти газов, которые легче воздуха. H2, He, Ne, N2, CH4, NH3.
Легче воздуха ― газы, относительная плотность которых по воздуху меньше единицы.
Задание 9
Оксид углерода и оксид азота имеют одинаковую плотность при одних и тех же условиях. Определите формулы оксидов.
Существуют два оксида углерода CO (28 г/моль) и CO2(44 г/моль) и пять оксидов азота N2O (44 г/моль), NO (30 г/моль), N2O3(76 г/моль), NO2(46 г/моль) и N2O5(108 г/моль). Если оксид углерода и оксид азота имеют одинаковую плотность ― это значит они имеют одинаковые молярные массы, следовательно, формулы оксида углерода (IV) CO2 и оксида азота (I) N2O.
Задание 10
Углерод образует два газообразных оксида. Чему равна плотность более тяжёлого оксида по более лёгкому?
DCO(CO2)=M(CO2)/M(CO)=44 г/моль : 28 г/моль=1,57
Задание 11
Самый тяжёлый газ при комнатной температуре ― гексафторид теллура TeF6. Чему равна его относительная плотность:
а) по воздуху;
Dвоздуха(TeF6)=M(TeF6)/M(воздуха)=242 г/моль : 29 г/моль=8,35
б) по водороду?
DH2(TeF6)=M(TeF6)/M(H2)=242 г/моль : 2 г/моль=121
Задание 12
Трёхвалентный элемент образует газообразное соединение с водородом, которое в 2 раза тяжелее аммиака. Какова формула соединения?
Дано: E ― элемент V группы (8-5=3) и его формула имеет вид EH3, M(EH3)=2•M(NH3)
Найти: формулу соединения EH3 -?
По условию задачи Mr(EH3)=2•Mr(NH3), отсюда Mr(EH3)=2•Mr(NH3)=2•17=34
Mr(EH3)=Ar(E) 3•Ar(H)=Ar(E) 3•1=Ar(E) 3
Ar(E) 3=34
Ar(E)=34-3
Ar(E)=31 ― такую относительную атомную массу имеет элемент V группы фосфор Р, следовательно, формула имеет вид PH3.
Ответ: PH3
Задание 13
Хлор образует газообразные оксиды, в которых его валентность равна I и IV. Какой из оксидов легче хлора, а какой тяжелее?
Дано: оксиды Cl2O и ClO2
Найти: DCl2(Cl2O)-?, DCl2(ClO2)-?
Решение
DCl2(Cl2O)=M(Cl2O):M(Cl2)=87 г/моль : 71 г/моль=1,23
DCl2(ClO2)=M(ClO2):M(Cl2)=67,5 г/моль : 71 г/моль=0,95
Ответ: оксид хлора (IV) легче хлора, а оксид хлора (I) ― тяжелее.