Газообмен в тканях. парциальное напряжение кислорода и углекислого газа в тканевой жидкости и клетках. — киберпедия
В тканях кровь отдает кислород и поглощает углекислоту. Газообмен в капиллярах тканей большого круга, так же как и в легочных капиллярах, обусловлен диффузией вследствие разности парциальных напряжений газов в крови и в тканях.
Напряжение углекислого газа в клетках может достигать 60 мм, в тканевой жидкости оно весьма изменчиво и в среднем составляет 46 мм, а в притекающей к тканям артериальной крови — 40 мм рт. ст. Диффунтируя по направлению более низкого напряжения, углекислый газ переходит из клеток в тканевую жидкость и далее в кровь, делая ее венозной. Напряжение углекислого газа в крови при прохождении ее по капиллярам становится равным напряжению углекислого газа в тканевой жидкости.
Клетки весьма энергично потребляют кислород, поэтому его парциальное напряжение в протоплазме клеток очень низко, а при усилении их активности может быть равно нулю. В тканевой жидкости напряжение кислорода колеблется между 20 и 40 мм. Вследствие этого кислород непрерывно поступает из артериальной крови, приносимой к капиллярам большого круга кровообращения (здесь напряжение кислорода равно 100 мм рт. ст.), в тканевую жидкость. В результате в оттекающей от тканей венозной крови напряжение кислорода значительно ниже, чем в артериальной, составляя 40 мм.
Кровь, проходя по капиллярам большого круга, отдает не весь свой кислород. Артериальная кровь содержит около 20 об.% кислорода, венозная же кровь — примерно 12 об. % кислорода. Таким образом, из 20 об. % кислорода ткани получают 8 об. %, т. е. 40% всего кислорода, содержащегося в крови.
То количество кислорода в процентах от общего содержания его в артериальной крови, которое получают ткани, носит название коэффициента утилизации кислорода. Его вычисляют путем определения разности содержания кислорода в артериальной и венозной крови. Эту разность делят на содержание кислорода в артериальной крови и умножают на 100.
Коэффициент утилизации кислорода меняется в зависимости от ряда физиологических условий. В покое организма он равен 30—40%. При тяжёлой же мышечной работе содержание кислорода в оттекающей от мышц венозной крови уменьшается до 8—10 об. % и, следовательно, утилизация кислорода повышается до 50—60%.
Более быстрый переход кислорода в ткани обеспечивается раскрытием нефункционировавших капилляров в работающей ткани. Повышению коэффициента утилизации способствует также усиленное образование кислот — молочной и угольной, что понижает сродство гемоглобина к кислороду и обеспечивает более быструю диффузию кислорода из крови. Наконец, увеличению утилизации кислорода содействуют повышение температуры работающих мышц и усиление ферментативных и энергетических процессов, протекающих в клетках. Таким образом, доставка кислорода к тканям регулируется в соответствии с интенсивностью окислительных процессов.
Газообмен и транспорт О2
Транспорт О2 осуществляется в физически растворенном и химически связанном виде. Физические процессы, т. е. растворение газа, не могут обеспечить запросы организма в О2. Подсчитано, что физически растворенный О2 может поддерживать нормальное потребление О2 в организме (250 мл*мин-1), если минутный объем кровообращения составит примерно 83 л*мин-1 в покое. Наиболее оптимальным является механизм транспорта О2 в химически связанном виде.
Согласно закону Фика, газообмен О2 между альвеолярным воздухом и кровью происходит благодаря наличию концентрационного градиента О2 между этими средами. В альвеолах легких парциальное давление О2 составляет 13,3 кПа, или 100 мм рт.ст., а в притекающей к легким венозной крови парциальное напряжение О2 составляет примерно 5,3 кПа, или 40 мм рт.ст. Давление газов в воде или в тканях организма обозначают термином «напряжение газов» и обозначают символами Ро2, Рсo2. Градиент О2 на альвеолярно-капиллярной мембране, равный в среднем 60 мм рт.ст., является одним из важнейших, но не единственным, согласно закону Фика, факторов начальной стадии диффузии этого газа из альвеол в кровь.
Транспорт О2 начинается в капиллярах легких после его химического связывания с гемоглобином.
Гемоглобин (Нb) способен избирательно связывать О2 и образовывать оксигемоглобин (НbО2) в зоне высокой концентрации О2 в легких и освобождать молекулярный О2 в области пониженного содержания О2 в тканях. При этом свойства гемоглобина не изменяются и он может выполнять свою функцию на протяжении длительного времени.
Гемоглобин переносит О2 от легких к тканям. Эта функция зависит от двух свойств гемоглобина: 1) способности изменяться от восстановленной формы, которая называется дезоксигемоглобином, до окисленной (Нb О2 à НbО2) с высокой скоростью (полупериод 0,01 с и менее) при нормальном Рог в альвеолярном воздухе; 2) способности отдавать О2 в тканях (НbО2 à Нb О2) в зависимости от метаболических потребностей клеток организма.
Зависимость степени оксигенации гемоглобина от парциального давления Ог в альвеолярном воздухе графически представляется в виде кривой диссоциации оксигемоглобина, или сатурационной кривой (рис. 8.7). Плато кривой диссоциации характерно для насыщенной О2 (сатурированной) артериальной крови, а крутая нисходящая часть кривой — венозной, или десатурированной, крови в тканях.
На сродство кислорода к гемоглобину влияют различные метаболические факторы, что выражается в виде смещения кривой диссоциации влево или вправо. Сродство гемоглобина к кислороду регулируется важнейшими факторами метаболизма тканей: Ро2 pH, температурой и внутриклеточной концентрацией 2,3-дифосфоглицерата. Величина рН и содержание СО2 в любой части организма закономерно изменяют сродство гемоглобина к О2: уменьшение рН крови вызывает сдвиг кривой диссоциации соответственно вправо (уменьшается сродство гемоглобина к О2), а увеличение рН крови — сдвиг кривой диссоциации влево (повышается сродство гемоглобина к О2) (см. рис. 8.7, А). Например, рН в эритроцитах на 0,2 единицы ниже, чем в плазме крови. В тканях вследствие повышенного содержания СО2 рН также меньше, чем в плазме крови. Влияние рН на кривую диссоциации оксигемоглобина называется «эффектом Бора».
Рост температуры уменьшает сродство гемоглобина к О2. В работающих мышцах увеличение температуры способствует освобождению О2. Уменьшение температуры тканей или содержания 2,3-дифосфоглицерата вызывает сдвиг влево кривой диссоциации оксигемоглобина (см. рис. 8.7, Б).
Метаболические факторы являются основными регуляторами связывания О2 с гемоглобином в капиллярах легких, когда уровень O2, рН и СО2 в крови повышает сродство гемоглобина к О2 по ходу легочных капилляров. В условиях тканей организма эти же факторы метаболизма понижают сродство гемоглобина к О2 и способствуют переходу оксигемоглобина в его восстановленную форму — дезоксигемоглобин. В результате О2 по концентрационному градиенту поступает из крови тканевых капилляров в ткани организма.
Оксид углерода (II) — СО, способен соединяться с атомом железа гемоглобина, изменяя его свойства и реакцию с О2. Очень высокое сродство СО к Нb (в 200 раз выше, чем у О2) блокируют один или более атомов железа в молекуле гема, изменяя сродство Нb к О2.
Под кислородной емкостью крови понимают количество Ог, которое связывается кровью до полного насыщения гемоглобина. При содержании гемоглобина в крови 8,7 ммоль*л-1 кислородная емкость крови составляет 0,19 мл О2 в 1 мл крови (температура 0oC и барометрическое давление 760 мм рт.ст., или 101,3 кПа). Величину кислородной емкости крови определяет количество гемоглобина, 1 г которого связывает 1,36—1,34 мл О2. Кровь человека содержит около 700—800 г гемоглобина и может связать таким образом почти 1 л О2. Физически растворенного в 1 мл плазмы крови О2 очень мало (около 0,003 мл), что не может обеспечить кислородный запрос тканей. Растворимость О2 в плазме крови равна 0,225 мл*л-1*кПа-1.
Обмен О2 между кровью капилляров и клетками тканей также осуществляется путем диффузии. Концентрационный градиент О2 между артериальной кровью (100 мм рт.ст., или 13,3 кПа) и тканями (около 40 мм рт.ст., или 5,3 кПа) равен в среднем 60 мм рт.ст. (8,0 кПа). Изменение градиента может быть обусловлено как содержанием О2 в артериальной крови, так и коэффициентом утилизации О2, который составляет в среднем для организма 30— 40%. Коэффициентом утилизации кислорода называется количество О2, отданного при прохождении крови через тканевые капилляры, отнесенное к кислородной емкости крови.
С другой стороны, известно, что при напряжении О2 в артериальной крови капилляров, равном 100 мм рт.ст. (13,3 кПа), на мембранах клеток, находящихся между капиллярами, эта величина не превышает 20 мм рт.ст. (2,7 кПа), а в митохондриях равна в среднем 0,5 мм рт.ст. (0,06 кПа).
Газообмен и транспорт СО2
Поступление СО2 в легких из крови в альвеолы обеспечивается из следующих источников: 1) из СО2, растворенного в плазме крови (5—10%); 2) из гидрокарбонатов (80—90%); 3) из карбаминовых соединений эритроцитов (5—15%), которые способны диссоциировать.
Для СО2 коэффициент растворимости в мембранах аэрогематического барьера больше, чем для О2, и составляет в среднем 0,231 ммоль*л-1 кПа-1 поэтому СО2 диффундирует быстрее, чем O2. Это положение является верным только для диффузии молекулярного СО2. Большая часть СО2 транспортируется в организме в связанном состоянии в виде гидрокарбонатов и карбаминовых соединений, что увеличивает время обмена СО2, затрачиваемое на диссоциацию этих соединений.
В венозной крови, притекающей к капиллярам легких, напряжение СО2 составляет в среднем 46 мм рт.ст. (6,1 кПа), а в альвеолярном воздухе парциальное давление СО2 равно в среднем 40 мм рт.ст. (5,3 кПа), что обеспечивает диффузию СО2 из плазмы крови в альвеолы легких по концентрационному градиенту.
Эндотелий капилляров проницаем только для молекулярного СО2 как полярной молекулы (О — С — О). Из крови в альвеолы диффундирует физически растворенный в плазме крови молекулярный СО2. Кроме того, в альвеолы легких диффундирует СО2, который высвобождается из карбаминовых соединений эритроцитов благодаря реакции окисления гемоглобина в капиллярах легкого, а также из гидрокарбонатов плазмы крови в результате их быстрой диссоциации с помощью фермента карбоангидразы, содержащейся в эритроцитах.
Молекулярный СО2 проходит аэрогематический барьер, а затем поступает в альвеолы.
В норме через 1 с происходит выравнивание концентраций СО2 на альвеолярно-капиллярной мембране, поэтому за половину времени капиллярного кровотока происходит полный обмен СО2 через аэрогематический барьер. Реально равновесие наступает несколько медленнее. Это связано с тем, что перенос СО2, так же как и О2, ограничивается скоростью перфузии капилляров легких.
Диффузия СО2 из тканей в кровь. Обмен СО2 между клетками тканей с кровью тканевых капилляров осуществляется с помощью следующих реакций: 1) обмена С1- и НСО3- через мембрану эритроцита; 2) образования угольной кислоты из гидрокарбонатов; 3) диссоциации угольной кислоты и гидрокарбонатов.
В ходе газообмена СО2 между тканями и кровью содержание НСОз- в эритроците повышается и они начинают диффундировать в кровь. Для поддержания электронейтральности в эритроциты начнут поступать из плазмы дополнительно ионы С1- Наибольшее количество бикарбонатов плазмы крови образуется при участии карбоангидразы эритроцитов.
Карбаминовый комплекс СО2 с гемоглобином образуется в результате реакции СО2 с радикалом NH2 глобина. Эта реакция протекает без участия какого-либо фермента, т. е. она не нуждается в катализе. Реакция СО2 с Нb приводит, во-первых, к высвобождению Н ; во-вторых, в ходе образования карбаминовых комплексов снижается сродство Нb к О2. Эффект сходен с действием низкого рН. Как известно, в тканях низкое рН потенцирует высвобождение О2 из оксигемоглобина при высокой концентрации СО2 (эффект Бора). С другой стороны, связывание О2 гемоглобином снижает сродство его аминогрупп к СО2 (эффект Холдена).
Каждая реакция в настоящее время хорошо изучена. Например, полупериод обмена С1-и НСО3- равен 0,11—0,16 с при 37 oС. В условиях in vitro образование молекулярного СО2 из гидрокарбонатов происходит чрезвычайно медленно и диффузия этого газа занимает около 5 мин, тогда как в капиллярах легкого равновесие наступает через 1 с. Это определяется функцией фермента карбоангидразы угольной кислоты. В функции карбоангидразы выделяют следующие типы реакций:
СО2 Н2Оß> H2СО3 ß> H НСО3-
Процесс выведения СО2 из крови в альвеолы легкого менее лимитирован, чем оксигенация крови. Это обусловлено тем, что молекулярный СО2 легче проникает через биологические мембраны, чем О2. По этой причине он легко проникает из тканей в кровь. К тому же карбоангидраза способствует образованию гидрокарбоната. Яды, которые ограничивают транспорт О2 (такие как СО, метгемоглобинобразующие субстанции — нитриты, метиленовый синий, ферроцианиды и др.) не действуют на транспорт СО2. Блокаторы карбоангидразы, например диакарб, которые используются нередко в клинической практике или для профилактики горной или высотной болезни, полностью никогда не нарушают образование молекулярного СО2. Наконец, ткани обладают большой буферной емкостью, но не защищены от дефицита О2. По этой причине нарушение транспорта О2 наступает в организме гораздо чаще и быстрее, чем нарушения газообмена СО2. Тем не менее при некоторых заболеваниях высокое содержание СО2 и ацидоз могут быть причиной смерти.
Измерение напряжения О2 и СО2 в артериальной или смешанной венозной крови производят полярографическими методами с использованием очень небольшого количества крови. Количество газов в крови измеряют после их полного извлечения из пробы крови, взятой для анализа.
Такие исследования выполняют с помощью манометрических приборов типа аппарата Ван-Слайка, или гемоалкариметра (необходимо 0,5—2,0 мл крови) или на микроманометре Холандера (необходимо около 50 мкл крови).
§
Принцип. Микроскопия сухих фиксированных и окрашенных мазков крови с дифференцированием различных форм лейкоцитов.
Подготовка предметных стекол, приготовление мазков крови, их фиксация и окраска изложены ранее при исследовании морфологии эритроцитов.
Реактивы.
1. Иммерсионное масло.
2. Диэтиловый эфир.
Специальное оборудование.
1. Микроскоп.
2. 11-клавишный счетчик для подсчета лейкоцитарной формулы.
Ход работы.
1).Предметное стекло с окрашенным, высохшим на воздухе мазком крови помещают на столик микроскопа и с помощью малого увеличения находят край мазка.
2).Не меняя положения стекла, наносят каплю иммерсионного масла на край мазка на место, расположенное под объективом. Переводят иммерсионный объектив в вертикальное по отношению к мазку положение, при этом объектив погружается в каплю масла.
3).Осторожно слегка вращают макровинт до появления в поле зрения микроскопа изображения. Затем с помощью микровинта устанавливают четкую видимость препарата. Критерием правильно подобранного для каждого глаза фокусного расстояния будет ясное изображение клеток с четкими границами и внутриклеточной структурой.
4). Необходимо просчитывать не менее 100 лейкоцитов. Если при исследовании выявляется какой-либо патологический процесс, то изучению подлежат 200—400 и даже более лейкоцитов.
В связи с тем, что более крупные виды клеток (моноциты, нейтрофилы, миелобласты и др.) располагаются больше по периферии, вдоль верхнего и нижнего краев мазка, а более мелкие (лимфоциты, микромиелобласты и др.) находятся ближе к его центру, подсчет клеток производят всегда по одной и той же схеме: половину клеток считают на одном конце мазка, а другую — на противоположном. Счет ведут по зигзагу (линия “меандра”): отступив 3—4 поля зрения по краю мазка, затем 3—5 полей зрения под прямым углом к середине мазка, затем проводят счет в 3—5 полях зрения параллельно краю мазка и возвращаются к краю мазка, где просчитывают 3—5 полей зрения. Такое движение при счете продолжают до тех пор, пока не сосчитают половину клеток, а затем переходят на противоположный край, где подсчитывают вторую половину клеток.
В современных автоанализаторах Культер «ДИФФЗ» и техникон «Гемалог Д» подсчет лейкоцитарной формулы производится автоматически с помощью специальных систем.
Нормальная лейкоформула.
| Гранулоциты | Агранулоциты | |||||
| нейтрофилы | ||||||
| юные | палочко- ядерные | сегментоя- дерные | базофилы | эозинофилы | лимфоциты | моно- циты |
| Относ.0-1% | 2-4% | 45-65% | 0-1% | 1-4% | 26-40% | 2-6% |
| Абсол — | 80-320 | 2200-4800 | 0-40 | 40-320 | 1040-3200 | 80-480 |
При появлении в ОАК молодых форм( юные, палочкоядерные) говорят о сдвиге влево, появление зрелых (сегментоядерных нейтрофилов) – вправо.
ТАБЛИЦА, КОТОРУЮ НАМ ДАВАЛА АННА АНАТОЛЬЕВНА:
| Кол-во лейкоцитов | Б | Э | НЕЙТРОФИЛЫ | Л | М | |||
| М | Ю | П | С | |||||
4-8*  | 0-1% | 2-4% | — | — | 3-5% | 55-65% | 25-35% | 3-8% |
Абсолютное кол-во разл. Видов лейкоцитов *  | 0-0,08 | 0,08-0,32 | — | — | 0,12-0,4 | 2,2-5,2 | 1-2,8 | 0,12-0,64 |
БИЛЕТ 34
Мозжечок
Мозжечок состоит из 2-х полушарий и червя между ними. Серое вещество образует кору и ядра. Белое образовано отростками нейронов. Мозжечок получает афферентные нервные импульсы от тактильных рецепторов, рецепторов вестибулярного аппарата, проприорецепторов мышц и сухожилий, а также двигательных зон коры. Эфферентные импульсы от мозжечка идут к красному ядру среднего, ядру Дейтерса продолговатого мозга, к таламусу, а затем моторным зонам КБП и подкорковым ядрам.
Общей функцией мозжечка является регуляция позы и движений. Эту функцию он осуществляет путем координации активности других двигательных центров: вестибулярных ядер, красного ядра, пирамидных нейронов коры. Поэтому он выполняет следующие двигательные функции:
1. Регуляцию мышечного тонуса и позы.
2. Коррекцию медленных целенаправленных движений в ходе их выполнения, а также координацию этих движений с рефлексами положения тела.
3. Контроль за правильным выполнением быстрых движений, осуществляемых корой.
В связи с тем, что мозжечок выполняет данные функции, при его удалении у животного развивается комплекс двигательных нарушений, называемый триадой Лючиани. Он включает:
1. Атония и дистония — снижение и неправильное распределение тонуса скелетных мышц.
2. Астазия — невозможность слитного сокращения мышц, а как следствие, сохранения устойчивого положения тела при стоянии, сидении (покачивание).
3. Астения — быстрая утомляемость мышц.
4. Атаксия — плохая координация движений при ходьбе. Неустойчивая «пьяная» походка.
5. Адиадохокинез — нарушение правильной последовательности быстрых целенаправленных движений.
В клинике умеренные поражения мозжечка проявляются триадой Шарко:
1. Нистагм глаз в состоянии покоя.
2. Тремор конечностей, возникающий при их движениях.
3. Дизартрия — нарушения речи.
Л.А.Орбели установил, что мозжечок влияет и на различные вегетативные функции. Эти влияния могут быть возбуждающими и тормозящими. Например, при раздражении мозжечка увеличивается или снижается кровяное давление, изменяется частота сердцебиений, дыхание, пищеварение. Мозжечок влияет на обмен веществ. На эти функции он воздействует через вегетативные нервные центры, координируя их активность с движением. Функции внутренних органов изменяются в связи с изменением обменных процессов в них. Поэтому мозжечок оказывает на них адаптационно-трофическое влияние.
Теплоотдача
Теплоотдача (физическая терморегуляция) – переход теплоты, освобождаемой в процессе жизнедеят-сти из организма в окружающую среду.
Пути отдачи тепла:
1) Теплопроведение
2) Излучение
3) Конвекция
4) Испарение
Теплопроведение – способ отдачи тепла, имеющий место при контакте, соприкосновении тела человека с другими физическими телами. (Количество тепла, отдаваемого организмом в окр. среду пропорционально разнице средних температур контактирующих тел, площади контактирующих поверхностей, времени теплового контакта)
Излучение – способ отдачи тепла в окр.среду поверхностью тела человека в виде электромагнитных волн инфракрасного диапазона. Количество тепла излучением пропорционально площади поверхности излучения и разности средних значений температуры кожи и окр. среды. Если средняя температура поверхности кожи о окр. среды выравнивается, то отдача тепла невозможна.
Конвекция – способ теплоотдачи путём переноса тепла движущимися частицами воздуха или воды (ветер, дождь, душ, вентиляция). Для рассеивания тепла требуется обтекание поверхности тела потоком воздуха с более низкой температурой, чем температура кожи. При этом контактирующий с кожей слой воздуха нагревается, снижает свою плотность, поднимается и замещается более холодным и плотным воздухом.
Эти 3 пути – сухая теплоотдача и становится неэффективной при выравнивании средних температур поверхности тела и окружающей среды.
Испарение – способ рассеивания организмом тепла в окружающую среду за счёт испарения пота или влаги с поверхности кожи и слизистых оболочек дыхательных путей. Ощутимая потеря воды осуществляемся потовыми железами, неощутимая – слизистыми оболочками дыхательных путей. При интенсивном потоотделении, высокой влажности и малой скорости движения воздуха капли пота не успевают испариться, сливаются и стекают с поверхности тела, теплоотдача становится не эффективной.
§
Мочевыделение – рефлекторный акт выделения мочи.
Процессы, лежащие в основе образования мочи:
1) Фильтрация – это выход части жидкости из кровеносных сосудов в полость внутрипочечных мочевых путей, т.е. фильтруется плазма крови. Образовавшийся фильтрат – первичная моча, по составу близка плазме крови. За сутки образуется 180-200 л.
2) Реабсорбция – обратное всасывание из первичной мочи больших количеств воды т растворённых веществ, которые возвращаются в кровь и лимфу.
3) Секреция.
Образующаяся в почечных канальцах моча выделяется в почечную чашечку, а затем в фазе систолы почечной чашечки происходит опорожнение в почечную лоханку, которая постепенно заполняется мочой, и по достижении порога раздражения возникают импульсы от барорецепторов, сокращается мускулатура почечной лоханки, раскрывается просвет мочеточника, и моча благодаря сокращениям его стенки продвигается в мочевой пузырь. Объем мочи постепенно увеличиватся и стенки мочевого пузыря растягиваются.
В процессе мочеиспускания моча выводится из мочевого пузыря в результате рефлекторного акта. Наступают гладкой мышцы стенки мочевого пузыря, расслабление внутреннего и наружного сфинктеров мочеиспускательного канала, сокращение мышц брюшной стенки и дна таза; в это же время происходит фиксация грудной стенки и диафрагмы. В результате моча, находящаяся в мочевом пузыре, выодится из него.
Почки в процессе старенияподвергаются изменениям в соответствии со сдвигами в системе кровообращения. Вследствие склеротических изменений в сосудах, значительные зоны почек в старости оказываются ишеминизированными, и у 80-летнего человека от 30 до 40% нефронов склерозированы. У стариков объем гломеруллярной фильтрации, плазменный почечный кровоток, концентрационная способность почек снижаются почти
до 50%. Например, уменьшение эффективного почечного кровотока после 40 лет выражается следующим образом: эффективный почечный кровоток =8406,44 • число лет; уменьшение клубочковой фильтрации после 40 лет: клубочковая фильтрация =153,2-0,96число лет. Однако, порог плазменной концентрации глюкозы для экскреции в почках может даже повышаться, так что у пожилых с диабетом глюкозурия может быть недостаточно выражена.
Лекарственные вещества, которые у молодых экскретируются с мочой, могут накапливаться в организме стариков из-за недостаточности экскреторной функции почек. Из 185 продуктов метаболизма, определяемых в моче человека, не менее 60 изменяют концентрацию при старении. Многие старики страдают от никтурии (выделение ночью большой части суточного количества мочи), что соотносится с вышеотмеченной недостаточностью концентрационной способности почек.
Уменьшение способности почек концентрировать мочу связано с тем, что склерозирование артерий и сосудов клубочков в корковом слое почек сопровождается усилением кровотока в мозговом слое, в прямых артериолах и образуемой ими сети капилляров. Нарастание кровотока в мозговом веществе почек усиливает вымывание осмотически активных веществ из интерстициального пространства мозгового вещества, снижая реабсорбцию воды и эффективность противоточно-поворотной системы. Уменьшение способности поче задерживать воду в организме компенсируется усиливающейся секрецией АДГ гипоталамо-гипофизарной системой. Повышенная секреция АДГ связана с возрастающей чувствительностью осморецепторов к осмотически активным веществам в крови и тканевой жидкости у человека после 50 лет. Благодаря указанным компенсаторным механизмам, внутрисосудистый и внеклеточный объемы жидкостей организма и их состав у пожилых изменены мало.
Вегетативный индекс Кердо
Для определения вегетативного индекса Кердо необходимо определить частоту сердечных сокращений в 1 минуту (ЧСС) и величину диастолического артериального давления в мм.рт.ст. (ДД) и по формуле:
(ВИК)=(1—(ДД/ЧСС)*100
Положительное значение индекса отражает преобладание симпатической регуляции. Отрицательное — преобладание парасимпатической регуляции.
Билет № 35.
Ретикулярная формация.
Ретикулярная формация(formatio reticularis; РФ) мозга представлена сетью нейронов с многочисленными диффузными связями между собой и практически со всеми структурами центральной нервной системы. РФ располагается в толще серого вещества продолговатого, среднего, промежуточного мозга и изначально связана с РФ спинного мозга. В связи с этим целесообразно ее рассмотреть как единую систему. Сетевые связи нейронов РФ между собой позволили Дейтерсу назвать ее ретикулярной формацией мозга.
РФ имеет прямые и обратные связи с корой большого мозга, базальными ганглиями, промежуточным мозгом, мозжечком, средним, продолговатым и спинным мозгом.
Основной функцией РФ является регуляция уровня активности коры большого мозга, мозжечка, таламуса, спинного мозга.
С одной стороны, генерализованный характер влияния РФ на многие структуры мозга дал основание считать ее неспецифической системой. Однако исследования с раздражением РФ ствола показали, что она может избирательно оказывать активирующее или тормозящее влияние на разные формы поведения, на сенсорные, моторные, висцеральные системы мозга. Сетевое строение обеспечивает высокую надежность функционирования РФ, устойчивость к повреждающим воздействиям, так как локальные повреждения всегда компенсируются за счет сохранившихся элементов сети. С другой стороны, высокая надежность функционирования РФ обеспечивается тем, что раздражение любой из ее частей отражается на активности всей РФ данной структуры за счет диффузности связей.
Большинство нейронов РФ имеет длинные дендриты и короткий аксон. Существуют гигантские нейроны с длинным аксоном, образующие пути из РФ в другие области мозга, например в нисходящем направлении, ретикулоспинальный и руброспинальный. Аксоны нейронов РФ образуют большое число коллатералей и синапсов, которые оканчиваются на нейронах различных отделов мозга. Аксоны нейронов РФ, идущие в кору большого мозга, заканчиваются здесь на дендритах I и II слоев.
Активность нейронов РФ различна и в принципе сходна с активностью нейронов других структур мозга, но среди нейронов РФ имеются такие, которые обладают устойчивой ритмической активностью, не зависящей от приходящих сигналов.
В то же время в РФ среднего мозга и моста имеются нейроны, которые в покое «молчат», т. е. не генерируют импульсы, но возбуждаются при стимуляции зрительных или слуховых рецепторов. Это так называемые специфические нейроны, обеспечивающие быструю реакцию на внезапные, неопознанные сигналы. Значительное число нейронов РФ являются полисенсорными.
РФ контролирует передачу сенсорной информации, идущей через ядра таламуса, за счет того, что при интенсивном внешнем раздражении нейроны неспецифических ядер таламуса затормаживаются, тем самым снимается их тормозящее влияние с релейных ядер того же таламуса и облегчается передача сенсорной информации в кору большого мозга.
В РФ моста, продолговатого, среднего мозга имеются нейроны, которые реагируют на болевые раздражения, идущие от мышц или внутренних органов, что создает общее диффузное дискомфортное, не всегда четко локализуемое, болевое ощущение «тупой боли».
РФ ствола мозга имеет прямое отношение к регуляции мышечного тонуса, поскольку на РФ ствола мозга поступают сигналы от зрительного и вестибулярного анализаторов и мозжечка. От РФ к мотонейронам спинного мозга и ядер черепных нервов поступают сигналы, организующие положение головы, туловища и т. д.
РФ ствола мозга участвует в передаче информации от коры большого мозга, спинного мозга к мозжечку и, наоборот, от мозжечка к этим же системам. Функция данных связей заключается в подготовке и реализации моторики, связанной с привыканием, ориентировочными реакциями, болевыми реакциями, организацией ходьбы, движениями глаз.
Влияния РФ можно разделить в целом на нисходящие и восходящие. В свою очередь каждое из этих влияний имеет тормозное и возбуждающее действие. Восходящие влияния РФ на кору большого мозга повышают ее тонус, регулируют возбудимость ее нейронов, не изменяя специфику ответов на адекватные раздражения. РФ влияет на функциональное состояние всех сенсорных областей мозга, следовательно, она имеет значение в интеграции сенсорной информации от разных анализаторов.
РФ имеет прямое отношение к регуляции цикла бодрствование—сон. Стимуляция одних структур РФ приводит к развитию сна, стимуляция других вызывает пробуждение. Г. Мэгун и Д. Моруцци выдвинули концепцию, согласно которой все виды сигналов, идущих от периферических рецепторов, достигают по коллатералям РФ продолговатого мозга и моста, где переключаются на нейроны, дающие восходящие пути в таламус и затем в кору большого мозга.
Возбуждение РФ продолговатого мозга или моста вызывает синхронизацию активности коры большого мозга, появление медленных ритмов в ее электрических показателях, сонное торможение.
Возбуждение РФ среднего мозга вызывает противоположный эффект пробуждения: десинхронизацию электрической активности коры, появление быстрых низкоамплитудных β-подобных ритмов в электроэнцефалограмме.
РФ ствола мозга может оказывать не только возбуждающее, но и тормозное влияние на активность коры мозга.
Образование белой крови.
Постоянное количество лейкоцитов в крови поддерживается костномозговой продукцией этих клеток, а также рециркуляцией гранулоцитов, депонированных в капиллярной сети различных органов и тканей организма.
Патологические изменения лейкоцитов проявляются в нарушении их образования в кроветворной ткани и количественных и качественных сдвигах лейкоцитов крови.
Выделяют следующие нарушения лейкопоэза:
1) усиление или угнетение образования лейкоцитов в гемопоэтической ткани.
2) нарушение созревания лейкоцитов в кроветворных органах.
3) продукция патологически изменённых лейкоцитов.
Нарушение лейкопоэза возникает при действии биологических (бактерии, вирусы), физических (УФ лучи, радиация) и химических факторов.
К эндогенным факторам нарушения лейкопоэза относятся генетические дефекты образования и дифференцирования лейкоцитов.
Усиление лейкопоэза проявляется в виде повышения пролиферативной активности лейкопоэтической ткани реактивного, временного характера, корда продуцируется увеличенное количество нормальных лейкоцитов, и в виде опухолевой гиперплазии, при которой резко возрастает образование патологически изменённых лейкоцитов. В свою очередь реактивное усиление лейкопоэза может протекать как с сохранением, так и с нарушением способности лейкоцитов к дифференцировке, что определяет поступление зрелых или же незрелых клеток в кровеносное русло.
Усиление лейкопоэза реактивного характера обусловлено повышением выработки гуморальных стимуляторов лейкопоэза — лейкопоэтинов, колониестимулирующего фактора и уменьшением продукции ингибиторов этих факторов. При этом отмечается пролиферация лейкопоэтин-чувствительных клеток костного мозга с ускорением их последующей дифференцировки в зрелые лейкоциты.
Усиление лейкопоэза опухолевой природы происходит под влиянием факторов канцерогенеза вследствие мутации генов или эпигеномного нарушения регуляции размножения и дифференцировки кроветворных клеток II — IV классов. Это ведёт к беспредельному размножению атипических клеток с пониженной способностью к созреванию.
Угнетение лейкопоэза может быть связано с нарушением нейрогуморальной регуляции образования лейкоцитов (при уменьшении выработки лейкопоэтинов), с дефицитом пластических факторов, необходимых для лейкопоэза (при белковом голодании, недостатке цианокобаламина и фолиевой кислоты).
Лейкопоэз снижается при наследственном или приобретённом поражении клеток-предшественников грануло- и агранулоцитов и стромальных клеток, определяющих в норме6 дифференцировку стволовых клеток в направлении миело- и лимфоцитопоэза или же при генерализованном поражении всей лейкопоэтической ткани.
Такое уменьшение лейкопоэза наблюдается при наследственной нейтропении, действии ионизирующей радиации, при опухолевых метастазах, вытесняющих нормальных продуцентов лейкоцитов, при повышенном разрушении клеток лейкопоэтического ряда в кроветворных органах при лекарственной аллергии.
Угнетение лейкопоэза в определённых случаях захватывает либо все ряды лейкоцитов, либо преимущественно один из них. Так, в период разгара острой лучевой болезни под действием ионизирующей радиации происходит гибель всех делящихся клеток кроветворной ткани, тогда как при иммунном агранулоцитозе, возникшем при длительном приёме амидопирина, в следствие аутоаллергических реакций поражается преимущественно гранулоцитарный ряд.
Нарушение созревания лейкоцитов вызывается блоком дифференцировки на том или ином уровне развития клеток. Этот процесс регулируется генетически и обеспечивается определёнными метаболическими реакциями. Очень часто нарушением созревания лейкоцитов сопутствует их увеличенной продукции при реактивной и опухолевой гиперплазии клеток гемопоэтического ряда, но может возникнуть и при угнетении лейкопоэза.
§
После 25 лет максимальное потребление кислорода организмом постоянно уменьшается и к 55 годам оно уже почти на 27% ниже величин, отмеченных у 20-летних. Вместе с тем, физически активные люди сохраняют относительно высокое максимальное потребление кислорода во всех возрастных группах. Отсюда следует, что уровень максимального потребления кислорода больше отражает уровень физической активности, чем хронологию возраста. Так, постепенное снижение максимального потребления кислорода после 25 лет у остающихся физически активными мужчин составляет около 0,4 мл О2 кг мин1 на каждый год жизни. У мужчин же ведущих малоподвижный образ жизни темп его
снижения оказывается вдвое быстрее. Указанное снижение аэробных способностей организма при старении находит объяснение в изменениях функции сердечно-сосудистой системы, в частности, в уменьшении с возрастом максимальной частоты сердечных сокращений у мужчин и женщин. Эти отношения могут быть выражены следующим образом.
Максимальное число сердечных сокращений = 220 -возраст (к-во лет).
Как следствие снижения максимального числа сердечных сокращений минутный объем и сердечный индекс также уменьшаются с возрастом. Величина последнего уменьшается на 20-30% от 30 к 80 годам.
Отложение жиров в коронарных артериях ухудшает обеспечение кровью сердечной мышцы. Гипоксия миокарда приводит к инфильтрации его коллагеном, что уменьшает сократительную активность сердца, лимитирует его работу. В связи с этим, имеет место уменьшение ударного объема крови, индекса сократимости, систолического давления
в левом желудочке, максимальной скорости укорочения волокон миокарда. С возрастом уменьшаются и возможности снабжения кровью тканей. Так, во внутренних органах, скелетных мышцах уменьшается плотность капилляров, увеличивается радиус диффузии, расширяется базальный слой стенок капилляров, уменьшается площадь суммарного артериального сечения. В ходе старения в кровеносных сосудах возникают атеросклеротические изменения, которые могут уменьшать кровоток в органах. В свою очередь, это оказывается причиной многих симптомов, таких как слабоумие, нарушения психических функций, изменения функций почек.
Потеря эластичности сосудистой стенки и увеличение сопротивления кровотоку в мелких артериях повышает общее периферическое сосудистое сопротивление. В результате, общее периферическое сосудистое сопротивление (в дин-с-см 5), равное 1323 62 в возрасте 20-49 лет, в 60-69 лет достигает 2075 122,9, в 70-79 лет — 2286±139, в 80-89 лет -2324±108,3, у долгожителей -2746±212. Это приводит к закономерному повышению системного артериального давления. Так, к 60 годам систолическое артериальное давление возрастает до 140 мм рт.ст., а диастолическое — до 90 мм рт.ст. У лиц старше 60 лет (включая и долгожителей) уровень артериального давления не превышает в среднем 150/90 мм рт.ст. Росту величин артериального давления препятствует как увеличение объема аорты, так и снижение сердечного выброса. Контроль кровяного давления с помощью барорецепторного механизма аорты и синокаротидной зоны с возрастом оказывается нарушен, что может быть причиной тяжелой гипотензии стариков при переходе в вертикальное положение. Гипотензия, в свою очередь, может вызывать ишемию мозга. Отсюда многочисленные падения у стариков, вызванные потерей равновесия и обмороком при быстром вставании.
В венах с возрастом развиваются явления флебосклероза, выражающиеся в распаде эластических волокон и замене их коллагеновыми, дегенерация эндотелия и основного вещества. В результате, у пожилых и стариков имеет место снижение тонуса и эластичности венозной стенки, что влечет за собой расширение венозного русла, снижение давления в венах. Присасывающее действие грудной клетки снижается, уменьшается величина венозного возврата, возникает явление венозного стаза.
Нарастание емкости сосудистого русла при одновременном снижении сердечного выброса увеличивает время общего кругооборота крови — от 47,8±2,7 с у 20-39-летних людей до 60,6±3,2 с у 60-69-летних и до 65,4±3,1 с в 70-79 лет. Замедление капиллярного кровотока способствует более полному насыщению крови кислородом в легких и более полной его отдачи в тканях, что, в известной мере, компенсирует как нарушение диффузионной способности легких, так и ухудшение тканевого кровотока с возрастом.
Флебосклероз повышает риск венозного тромбоза у пожилых. Вместе с тем, регулярные занятия физическими упражнениями улучшают показатели функций сердечно-сосудистой системы в большей мере, чем у людей того же возраста, но ведущих малоподвижный образ жизни. Например, у мужчин в возрасте 50 и 70 лет, в течение 20 лет бывших неактивными физически, 8-недельная тренировка продолжительностью от 1 до 2 часов по 3-5 раз в неделю повышает максимальное потребление кислорода в среднем на 20%.
После 35 лет у мужчин и после 45 лет у женщин резко возрастает вероятность развития ишемической болезни сердца. В возрасте от 55 до 65 лет 13 из 100 мужчин и 6 из 100 женщин в США погибали от это болезни, хотя национальная программа борьбы за здоровый образ жизни в последние годы значительно снизила число этих заболеваний.
Нарастание риска развития ишемической болезни сердца при старении во многом связывают с нарушением липидного состава крови (с гиперлипидемией), т.е. увеличением в ней уровня холестерина и триглицеридов. Но эти вещества не циркулируют свободно в плазме крови, а транспортируются ею в форме липопротеинов, поэтому точнее говорить о гиперлипопротеинемии.
Количество холестерина, оседающего в мембранах клеток, и, в том числе, в сосудистой стенке, зависит от соотношения в плазме крови липопротеинов, экстрагирующих холестерин из мембран (липопротеины высокой плотности — ЛПВП) и способствующих его внедрению в мембрану (липопротеины особо низкой плотности — ЛПОНП и липопротеины низкой плотности — ЛПНП).
Уровень ЛПВП отражает динамику движения холестерина из периферических тканей (включая сосудистую стенку) к печени, где он окисляется до желчных кислот и секретируется с желчью. ЛПНП и ЛПОНП — это средство транспорта жиров в организме к клеткам, в том числе, к гладким мышцах стенок артерий. В норме отношение липопротеинов, повышающих или понижающих уровень холестерина в мембранах, сбалансировано и коэффициент (ЛПНП ЛПОНП)/ЛПВП, отражающий избыток холестерина в мембранах, низкий, но с возрастом он нарастает. Нарастание холестерина в мембранах клеток сосудов становится характерной чертой артериосуживающего процесса — артериосклероза. Этому способствует уменьшающаяся липолитическая и АТФ-азная активность в гладкомышеч-ных клетках сосудов. Отложение липидов в стенке сосудов вызывает кальцификацию и фиброзные изменения, в результате, артериальные стенки становятся суженными, ригидными и жесткими, делая кровоток в тканях более затрудненным. Этот процесс ускоряется употреблением пищи, богатой холестерином и ненасыщенными кислотами. Ряд факторов, например, физическая активность, могут увеличивать производство ЛПВП. Так, их уровень оказывается повышенным у стариков, использующих энергичные аэробные тренировки.
Атерогенное сужение сосудов сердца, ухудшающее кровоснабжение миокарда, может длительно не давать клинических признаков заболеваний. Но недостаточность снабжения миокарда кислородом может быть выявлена по изменениям электрической активности сердца при умеренной физической нагрузке. Наиболее выраженным признаком этого является горизонтальная депрессия S-T сегмента на ЭКГ. Оказалось, что в группе лиц с выраженной депрессией комплекса S-T до 1 мм во время физической нагрузки имеет место увеличение смертности в 4,6 раза чаще, чем у лиц того же возраста, но с нормальным сегментом S-T. Появление желудочковых экстрасистол во время физической нагрузки является другим признаком тяжелого ишемического атеросклероза сосудов сердца. Эта форма электрической нестабильности миокарда имеет большое прогностическое значение для ишемической болезни сердца.
Измерение температуры тела.
Температура тела человека постоянно поддерживается на определенном уровне и ее изменения часто являются важным показателем состояния здоровья человека. Измерение температуры тела человека производят в различных точках. Обычно ее производят в подмышечной впадине, ротовой полости и ректально ртутным термометром. Все показания зависят от времени измерения температуры.
Для работы необходимо: ртутные медицинские термометры и электротермометры, антисептические растворы для дезинфекции медицинских термометров и датчиков электротермометра, секундомер. Объект исследования – человек.
Ход работы. Медицинский термометр встряхивают и помещают в подмышечную впадину на 30 с, записывают показания и встряхивают снова. Продолжают регистрацию температуры таким образом через 1; 1.5; 2; 2.5 мин и так до тех пор, пока показания термометра не будут постоянны.
Определив необходимое время измерения температуры в подмышечной впадине, дезинфицируют термометр в антисептическом растворе и измеряют температуру в ротовой полости. Для этого коней термометра, заполненный ртутью помещают под язык и закрывают рот. После этого несколько раз (3-4 раза) прополаскивают рот холодной водой и повторяют измерение температуры в ротовой полости.
Закончив работу с ртутным термометром, переходят к измерению температуры электротермометром. Поместив датчик электротермометра в подмышечную впадину, регистрируют показания термометра через каждые 10 с до тех пор, пока не будут получены постоянные результаты.
Рекомендации к оформлению работы. По результатам опыта постройте график показаний ртутного термометра в зависимости от времени измерения. Сравните время измерения температуры ртутным и электрическим. Объясните различия.
Билет №36.
Лимбическая система
Лимбическая система после получения информации о внешней и внутренней среде организма, сравнения и обработки этой информации, запускает через эфферентные выходы вегетативные, соматические и поведенческие реакции, обеспечивая приспособление организма к внешней среде и сохранения внутренней среды на определённом уровне.
Функции (основные):
1. Регуляция висцеральных функций (в большинстве через гипоталамус)
2. Формирование эмоций (эмоции являются субъективным компонентом мотиваций – состояний, запускающих и реализующих поведение)
Ключевой структурой для возникновения эмоций является гипоталамус. Выделяют собственно эмоциональное переживание и его вегетативные и соматические проявления. Эти компоненты могут носить как самостоятельный характер, т.е. проявляться в виде субъективных переживаний, либо сопровождаться небольшими соматическими и вегетативными проявлениями.
Важную роль в возникновении эмоций играют поясная извилина и миндалина. Электрическая стимуляция миндалины у человека вызывает отрицательные эмоции (страх, гнев, ярость), двустороннее удаление миндалин в эксперименте на обезьянах резко снижает их агрессивность, повышает тревожность и неуверенность.
3.Участие в процессах памяти и обучения
Важную роль играет гипокамп и связанные с ним задние зоны лобной коры. Их деятельность необходима для консолидации памяти, перехода кратковременной памяти в долговременную.
Медиаторы иммунной системы.
Медиаторы иммунной системы – макромолекулярные вещества, вырабатываемые иммунной системой и участвующие в реализации реакций клеточного и гуморального иммунитета. К ним относятся цитокины (интерлейкины), интерфероны.
Интерлейкины (ИЛ) обеспечивают взаимосвязь отдельных видов лейкоцитов в иммунном ответе. Они представляют собой малые белковые молекулы с молекулярной массой 15000-30000.
ИЛ-1 – соединение выделяемое при антигенной стимуляции моноцитами, макрофагами и другими антигенпрезентирующими клетками. Его действие направлено в основном на Т-хелперы и макрофаги-эффекторы. ИЛ-1 стимулирует гепатоциты, благодаря чему в крови возрастает концентрация белков, получивыших название реактантов острой фазы, т.к. их содержание всегда увеличивается в острую фазу воспаления. К таким белкам относятся фибриноген, С-реактивный белок, а1-антитрипсин и др. Эти белки играют важную роль в репарации тканей, связывают протеолитические ферменты, регулируют клеточный и гуморальный иммунитет.
ИЛ-1 усиливает фагоцитоз, а также ускоряет рост кровеносных сосудов в зонах повреждения.
ИЛ-2 выделяется Т-хелперами под воздействием ИЛ-1 и АГ; является стимулятором роста для всех видов Т-лимфоцитов и активатором НК-клеток.
ИЛ-3 выделяется стимулированными Т-хелперами, моноцитами и макрофагами. Его действие направлено на рост и развитие тучных клеток и базофилов, а также предшественников Т- и В-лимфоцитов.
ИЛ-4 продуцируется стимулированными Т-хелперами, способствует росту и дифференцировке В-лимфоцитов, активирует макрофаги, Т-лимфоциты и тучные клетки, индуцирует продукцию иммуноглобулинов.
ИЛ-5 выделяется стимулированными Т-хелперами и является фактором пролиферации и дифференцировки эозинофилов, а также В-лимфоцитов.
ИЛ-6 продуцируется стимулированными моноцитами, макрофагами, эндотелием, Т-хелперами и фибробластами; вместе с ИЛ-4 способствует росту и дифференцировке В-лимфоцитов, обеспечивая их переход в антителопродуценты, т.е. плазматические клетки.
ИЛ-7 усиливает рост и пролиферацию Т- и В-лимфоцитов, а также влияет на развитие тимоцитов в тимусе.
ИЛ-8 образуется стимулированными моноцитами и макрофагами. Его назначение сводится к усилению хемотаксиса и фагоцитарной активности нейтрофилов.
ИЛ-9 продуцируется Т-лимфоцитами и тучными клетками. Усиливает рост Т-лимфоцитов, стимулирует развитие эритроидных колоний в костном мозге.
ИЛ-10 образуется макрофагами и усиливает пролиферацию зрелых и незрелых тимоцитов, а также способствует дифференцировке Т-киллеров.
ИЛ-11 продуцируется стромальными клетками костного мозга. Играет важную роль в гемопоэзе, особенно тромбоцитопоэзе.
ИЛ-12 усиливает цитотоксичность Т-киллеров и НК-клеток.
Интерфероны — общее название, под которым в настоящее время объединяют ряд белков со сходными свойствами, выделяемых клетками организма в ответ на вторжение вируса. Благодаря интерферонам клетки становятся невосприимчивыми по отношению к вирусу.
Интерфероны человека подразделяют на три антигенных типа: лейкоцитарный (α-интерферон), фибробластный (β-интерферон) и иммунный (γ-интерферон). Лейкоцитарный И. продуцируется лейкоцитами, фибробластный — фибробластами, иммунный — Т-лимфоцитами.
§
Созревание эритроцитов занимает около 5 дней. Из костного мозга в кровь поступают ретикулоциты, дозревающие до эритроцитов в течение суток. По их количеству в крови судят об интенсивности эритропоэза. В сутки образуется 60-80 тысяч эритроцитов на каждый микролитр крови. Т.е. ежесуточно обновляется около 1,5% эритроцитов.
Основным гуморальным регулятором эритропоэза является гормон эритропоэтин. В основном он образуется в почках. Небольшое его количество синтезируется макрофагами. Интенсивность синтеза эритропоэтина зависит от содержания кислорода в тканях почек. При их достаточной оксигенации ген, регулирующий синтез эритропоэтина, блокируется. При недостатке кислорода, он активируется ферментами. Начинается усиленный синтез эритропоэтина. Стимулируют его синтез в почках адреналин, норадреналин, глюкокортикоиды, андрогены. Поэтому количество эритроцитов в крови возрастает в горах, при кровопотерях, стрессе и т.д. Торможение эритропоэза осуществляется его ингибиторами. Они образуются при увеличении количества эритроцитов выше нормы, повышенном содержании кислорода в крови. Эстрогены также тормозят эритропоэз. Поэтому в крови женщин эритроцитов меньше, чем у мужчин. Важное значение для эритропоэза имеют витамины В6, В12 и фолиевая кислота. Витамин В12 называют внешним фактором кроветворения. Однако для его всасывания в кишечнике необходим внутренний фактор Кастла, вырабатываемый слизистой желудка. При его отсутствии развивается злокачественная анемия.
Гранулоциты и моноциты образуются из миелобластов через стадии промиелоцита, эозинофильных, нейтрофильных, базофильных миелоцитов или монобластов. Из монобластов сразу образуется моноциты, а из мелоцитов метамиелоциты, затем палочкоядерные гранулоциты и, наконец, сегментоядерные клетки. Гранулоцитопоэз стимулируют гранулоцитарные колониестимуцлирующие факторы (КСФ-Г), а моноцитопоэз — моноцитарный колониестимулирующий фактор (КСФ-М). Угнетают гранулоцитопоэз кейлоны, выделяющиеся зрелыми нейтрофилами. Кейлоны тормозят синтез ДНК в стволовых клетках белого ростка костного мозга. Задерживают созревание гранулоцитов и моноцитов простагландины Е, интерфероны
Речь
Речь
И.П. Павлов считал, что специфика внд человека возникла в результате нового способа взаимодействия с внешним миром, который выразился в речи. Речь возникла как средство общения между людьми в процессе труда. Интегративная деятельность нервной системы человека осуществляется не только на основе непосредственных ощущений и впечатлений, но и путем оперирования словами. При этом слово выступает не только как средство выражения мысли. Слово перестраивает мышление и интеллектуальные функции человека, так как сама мысль совершается и формируется с помощью слова. Суть мышления в выполнении некоторых внутренних операций с образами во внутренней картине мира. Благодаря слову, картина мира становится более совершенной, с одной стороны, с другой стороны- более обобщенной, более дифференцированной. Присоединяясь непосредственному образу предмета, слово выделяет его существенные признаки, вносит в него формы анализа и синтеза, которые непосредственно недоступны субъекту. Слово переводит субъективный смысл образа в систему значений, что делает его более понятным как субъекту, так и любому слушателю.
РЕЧЕВЫЕ ФУНКЦИИ ПОЛУШАРИЙ
Понимание речи связано с деятельностью доминантных полушарий. К передним отделам речевых зон относят центр Брока. Он располагается в нижнем отделе третьей лобной извилины ( в левом полушарие). Эта зона контролирует осуществление речевых реакций. Ее поражение вызывает эфферентную моторную афазию (нарушение собственной речи, но сохр. понимание чужой-нар. кинест. мелодии слов за счет невозм. перекл. с одного элемента высказывания на др.) Пр пораж ниж. отд. премоторн. коры- динам.. афазия (исчез. спос. формулир. высказ. перев. свои слова в разверн. речь). Центр Вернике относ. к задн. отд. речев. з . коры. Расп. в височн. доле и обесп. поним. речи. При пораж.- сенс. афазия (затр. в поним. устной речи), аа также оптико
С лингв.. способ. связ. лев. полушарие, но пр. вып. тоже некот. язык. функции (понимание письменой речи) . Использ. метод, позв. избират. подавать инф. только в одно полушарие позв. выяв. разл. в деят. полушарий (введение амитал-натрия в сон. артерию) Левое уч. в основном в аналит. проц., обесп. речев. деят. (ее понимание, построение, работу со словестными символами). Правое- конкретно-образное мышление, им. дело с неверб. материалом, отв. за опред.. навыки обраш. с простр. сигналами, за структурно-прорстранств преобразов., способн. к зрит. и тактильному распозн. предметов. Исследование функцональн. асимметрий у детей показало, что первонач. обраб. речев. сигналов осущ. двумя полушариями. Специализация пр. полушария осуш. от 6 до 13 лет. Лев. полушарие. превосх. правое не только в опред.типах движ .(например > точн. движ пр. руки), но и в способн к пониманию речи.
§
Исследователи выделяют три функции речи:
1. Коммуникативная функция- осуществление общения между людьми с помощью языка. В коммуникативной функции выделяют функцию сообщения и функцию побуждения. Побудительная сила речи зависит от ее эмоциональной выразительности.
2. Регулирующая функция речи реализует себя в высших психических функциях. Первоначально высшая психическая функция, как бы разделена между двумя людьми. Один человека регулирует поведение другого с помощью специальных раздражителей, среди которых наибольшее значение имеет речь.
3. Программирующая функция выражается в построении смысловых схем речевого высказывания, грамматических структур предложений, в переходе от замысла к внешнему развернутому высказыванию.
У ребенка слово становится сигналом сигналов не сразу. Это качество приобретается постепенно, по мере созревания мозга и формирования новых и все более сложных временных связей. В процессе онтогенеза выделяют несколько фаз развития совместной деятельности двух сигнальных систем. Первоначально условные рефлексы ребенка осуществляются на уровне первой сигнальной системы. Т.е. непосредственный раздражитель вступает в связь с непосредственными вегетативными и соматическими реакциями. Условные рефлексы на словесные раздражители появляются лишь во второй половине года жизни. Ребенок начинает реагировать на словесные раздражители непосредственными вегетативными и соматическими реакциями ( добавляются условные связи СР-НР). Слово обычно выступает в сочетании с другими непосредственными раздражителями (“Где мама?”) Стоит изменить один из компонентов комплекса и слово исчезает. Постепенно слово начинает приобретать ведущее значение вытесняя другие компоненты комплекса. К концу первого года жизни ребенок начинает подражать речи взрослого. Т.е. слово на этом этапе выступает как интегратор первого порядка. Превращение слова в интегратор второго порядка происходит в конце второго года жизни. Для этого необходимо чтобы у него было выработано не менее 15 различных условных связей ( НР-СР). Ребенок начинает произносить слова. На втором году жизни он начинает объединять слова в простейшие речевые цепи. Между 3 и 4 годами жизни появляются слова интеграторы третьего порядка.. Словесные реакции вызываются не только непосредственными раздражителями, но и словами. Ребенок научается говорить. (СР-СР).
Диеты
Лечебные диеты
Диета является одним из важных методов лечения при многих заболеваниях, а при таких, как сахарный диабет легкого течения, алиментарное ожирение — единственным. При лечебном питании имеет значение не только правильный подбор продуктов, но и соблюдение технологии кулинарной обработки, температура потребляемой больным пищи, кратность и время приема пищи.
Обострения многих заболеваний связаны с различными нарушениями в питании: нарушения в диете при сахарном диабете приводят к резкому повышению сахара в крови, к сухости во рту, усилению жажды, прогрессирует жировая инфильтрация печени и поджелудочной железы; хронического панкреатита после употребления жирной сметаны, блинов, алкогольных напитков, жареных блюд; повышение артериального давления у больных, страдающих гипертонической болезнью, наблюдается при употреблении соленой пищи, назначаемое при этом лечение мало эффективно.
Во всех лечебно-профилактических и санаторно-курортных учреждениях пользуются номерной системой диет. Многие из них имеют несколько вариантов, например: N 1а, 16, N 7а, 76, 7в, 7г. Так как эти диеты встречаются в стационарах и санаториях, мы знакомим вас с ними, сохранив нумерацию с указанием тех заболеваний, при которых они назначаются.
Если обострение заболевания прошло и больной вернулся к активному образу жизни, общие принципы диеты не должны меняться: прежде всего это касается продуктов, исключаемых из питания, но можно расширить способы кулинарной обработки (тушить, запекать после отваривания), включить овощи домашнего консервирования. Недостаток витаминов можно компенсировать готовыми аптечными формами (гексавит, декамевит, гентавит и т.д.), отваром шиповника, пшеничных отрубей. Во всех диетах запрещены алкогольные напитки, в индивидуальных случаях вопрос об их употреблении решает лечащий врач.
При сочетании у одного больного двух заболеваний, требующих диетического питания, назначается питание с соблюдением принципов обеих диет. Так, при обострении язвенной болезни у больного с сахарным диабетом, назначается диета N1, но с исключением всех продуктов, противопоказанных при сахарном диабете.
• Диета №1, №1а, №1б — язвенная болезнь желудка и 12-перстной кишки
• Диета №2 — хронический гастрит, острые гастриты, энтериты и колиты, хр. энтероколиты
• Диета №3 — запоры
• Диета №4, №4а, №4б, №4в — заболевания кишечника с поносами
• Диета №5, №5а — заболевания печени и желчных путей
• Диета № 6 — подагра, мочекаменная болезнь с образованием камней из солей мочевой кислоты
• Диета №7, №7а, №7б — острый и хронический нефрит (пиелонефрит, гломерулонефрит)
• Диета №8 — ожирение
• Диета №9 — сахарный диабет
• Диета №10 — заболевания сердечно-сосудистой системы с недостаточностью кровообращения
• Диета №11 — туберкулез
• Диета №12 — функциональные заболевания нервной системы
• Диета №13 — острые инфекционные заболевания
• Диета №14 — почечнокаменная болезнь с отхождением камней, состоящих преимущественно из оксалатов
• Диета №15 — различные заболевания, не требующие специальных диет
Стол 1
§
Общая характеристика: — уменьшение энергоценности рациона за счет углеводов, особенно легкоусвояемых, частично жиров, при нормальном содержании белка, — ограничение свободной жидкости, хлористого натрия и возбуждающих аппетит продуктов и блюд.
Химический состав и энергоценность (суточный рацион):
— белки — 90-110 г
— жиры — 80 г
— углеводы — 150 г
— энергоценность — 1700-1800 ккал
Рекомендуемые продукты и блюда:
ржаной, белково-пшеничный и белково-отрубяной хлеб (100-150 г в день);
овощные супы с небольшим добавлением крупы, щи, борщи, окрошка, свекольник;
2-3 раза в неделю супы на слабом мясном или рыбном бульоне с фрикадельками (до 250-300г за прием);
нежирные сорта мяса, птицы, рыбы — в отварном, запеченом или тушеном виде, говяжьи сардельки или студень;
продукты моря (паста <Океан>, мидии, креветки и т.п.) — до 150-200 г в день;
молоко и кисломолочные продукты, творог, сыр — нежирные виды и сорта.
Овощи и фрукты используются широко, во всех видах, частью обязательно сырыми.
Исключаемые продукты и блюда:
изделия из пшеничной муки высшего и 1-го сорта, сдобного теста;
картофельные, крупяные, бобовые, макаронные супы;
жирные сорта мяса, птицы, рыбы;
колбасы, копчености, мясные и рыбные консервы;
жирный творог, сыры, сливки, рис, манная и овсяная крупы, макаронные изделия, бобовые, сладкие сорта плодов и ягод;
сахар, кондитерские изделия, варенье, мед, сладкие соки, какао;
мясные и кулинарные жиры;
жирные и острые закуски, соусы, майонез, все пряности и специи.
Стол 9
Стол N 9. Сахарный диабет средней и легкой тяжести.
Общая характеристика: — диета с энергоценностью, умеренно сниженной за счет легкоусвояемых углеводов и животных жиров, с исключением сахара и сладостей и применением сорбита и ксилита.
Химический состав и энергоценность (суточный рацион):
— белки — 90-100 г
— жиры — 75-80 г (30% растительные)
— углеводы — 300-350 г (полисахариды)
— энергоценность — 2300-2500 ккал
Рекомендуемые продукты и блюда:
ржаной, пшеничный, белково-отрубяной хлеб, не сдобные мучные изделия;
любые овощные супы, нежирные мясные и рыбные бульоны;
нежирные сорта мяса, птицы и рыбы;
молоко, кисломолочные продукты, нежирный творог и сыры;
крупы, гречневая, ячневая, пшенная, овсяная, перловая; бобовые, картофель и овощи;
свежие фрукты и ягоды кисло-сладких сортов
Исключаемые продукты и блюда:
изделия из сдобного теста;
крепкие и жирные бульоны;
нежирные сорта мяса, рыбы, птицы, колбасы, соленая рыба;
соленые сыры, сливки, сладкие творожные сырки;
рис, манная крупа, макаронные изделия;
соленые и маринованные овощи;
виноград, изюм, сахар, варенье, конфеты, сладкие соки, лимонады на сахаре;
мясные и кулинарные жиры
Стол 10
Стол N 10. Заболевания сердечно-сосудистой системы с недостаточностью кровообращения степени I-IIA.
Общая характеристика: — небольшое снижение энергоценности за счет жиров и углеводов, ограничение хлорида и веществ, возбуждающих сердечно-сосудистую и нервную системы.
Химический состав и энергоценность (суточный рацион):
— белки — 90 г (55-60% животные)
— жиры — 70 г (25-30% растительные)
— углеводы — 350-400 г
— энергоценность 2500-2600 ккал
Рекомендуемые продукты и блюда:
хлеб вчерашней выпечки, не сдобные печенья и бисквит;
любые вегетарианские супы;
нежирные сорта мяса, рыбы, птицы;
молоко, кисломолочные напитки и творог;
блюда из различных круп; отварные макаронные изделия;
овощи в отваренном и запеченном виде;
мягкие спелые фрукты и ягоды, мед, варенье.
Исключаемые продукты и блюда:
свежий хлеб, изделия из сдобного теста;
супы из бобовых, мясные, рыбные и грибные бульоны;
жирные сорта мяса, рыбы, птицы;
почки, копчености, колбасы;
соленая рыба, соленые и жирные сыры;
бобовые;
соленые, маринованные и квашеные овощи; плоды с грубой клетчаткой;
шоколад, крепкий чай, кофе и какао.
Стол 11
Стол N 11. Туберкулез легких, костей, лимфатических узлов, суставов при нерезком обострении или затухании, истощение после инфекционных болезней, операций, травм.
Общая характеристика:
— диета повышенной энергоценности с преимущественным увеличением белков, особенно молочных, витаминов и минеральных веществ
Химический состав и энергоценность (суточный рацион):
— белки — 110-130 г (60% животные)
— жиры — 100-120 г
— углеводы — 400-450 г
— энергоценность — 3000-3400 ккал
Рекомендуемые и исключаемые продукты и блюда:
используются практически любые пищевые продукты и блюда за исключением очень жирных сортов мяса и птицы, бараньего, говяжьего и кулинарного жиров, а также тортов и пирожных с большим количеством крема
Стол 12
§
Высшим отделом ЦНС является кора больших полушарий. Она обеспечивает совершенную организацию поведения человека и животных на основе приобретенных в онтогенгезе функций.
Кора БП делится на древнюю (обонятельная система – луковица, тракт и бугорок), старую (часть лимбической системы мозга) и новую кору. Новая кора занимает 95-96% общей площади и является высшим отделом соматической нервной системы, интегрирующей и интерпретирующей сенсорную информацию, управляющей произвольной двигательной активностью, обеспечивающей возможность осмысленного восприятия мира. Деятельность новой коры осознается человеком, тогда как функции других отделов ЦНС не отражаются сознанием.
В процессе филогенетического развития кора головного мозга не только увеличивалась в размерах, но и усложнялась в морфологическом строении. У человека новая кора состоит из 6 слоев специализированных нервных клеток, старая кора состоит всего из 3х слоев клеток. По функциональному признаку корковые клетки делят на сенсорные (афферентные), двигательные (эфферентные) и ассоциативные. К сенсорным клеткам относятся звездчатые нейроны, входящие в состав 3 и 4 слоев сенсорных областей коры. К эфферентным клеткам – нейроны 5 слоя моторной зоны коры – гигантские пирамидные клетки Беца. К ассоциативным нейронам относятся веретенообразные и пирамидные клетки 3 слоя. Нейроны окружены нейроглией, клетки нейроглии осуществляют трофическую, опорную и другие функции.
Системная интегративная функция коры БП обеспечивается четкой вертикальной анатомической связью корковых клеток с периферическими рецепторами, а также обширными горизонтальными связями центральных корковых проекций сенсорных систем со всеми областями коры. Афферентные импульсы по проводниковым путям через таламус (за исключением обонятельных) поступают в центральные корковые проекции. Центральные корковые проекции сенсорных систем – первичные зоны – воспринимают только специфическую информацию (например, центральные  проекции зрительной сенсорной системы – только зрительную информацию. Во вторичные проекционные зоны, находящиеся рядом с первичными, поступает как специфическая информация, так и отличная от нее. Наконец, в третичные (ассоциативные) зоны поступает и специфическая информация от рецепторов, и сигналы от всех проекционных зон коры. Ассоциативные зоны коры занимают около 1/3 всей ее площади и обеспечивают сложную интегративную функцию: речь, письмо, интеллектуальные операции, и, наконец, сознательное отражение реальной действительности.
проекции зрительной сенсорной системы – только зрительную информацию. Во вторичные проекционные зоны, находящиеся рядом с первичными, поступает как специфическая информация, так и отличная от нее. Наконец, в третичные (ассоциативные) зоны поступает и специфическая информация от рецепторов, и сигналы от всех проекционных зон коры. Ассоциативные зоны коры занимают около 1/3 всей ее площади и обеспечивают сложную интегративную функцию: речь, письмо, интеллектуальные операции, и, наконец, сознательное отражение реальной действительности.
В коре головного мозга располагаются центры, регулирующие выполнение тех или иных функций. Локализация функций в коре полушарий представлена в виде цитоархитектонических полей (их 53), которые могут наслаиваться и частично перекрывать друг друга.
В коре выделяют сенсорные, моторные и ассоциативные области.
Сенсорные:
Кожная рецептирующая система – проецируется на заднюю центральную извилину – тактильная, болевая и температурная чувствительность.
Кора теменной доли – осуществление сложного анализа (локализация раздражения, стереогноз).
Зрительная система – затылочная доля. Там же расположены ассоциативные зоны, с помощью которых возможен анализ цвета, формы, размеров, качества предметов; при поражении – неузнавание предметов.
Слуховая система – височные извилины.
Обонятельная, вкусовая системы – гиппокамп.
Моторные:
Моторные области расположены в передней центральной извилине, раздражение ее вызывает двигательную реакцию. Спереди расположены пермоторные поля – организуют комплексные, координированные, стереотипные движения.
Ассоциативные:
80% поверхности коры БП.
Основная функция – ассоциация разносенсорной информации, необходимой для формирования сложных элементов сознания. Расположены в лобной, теменной и височных долях. Разрушение ассоциативных областей приводит к грубым нарушениям обучения, памяти и речи.
Лобные ассоциативные поля имеют связь с лимбическим отделом мозга и реализуют сложные двигательные поведенческие акты. При повреждении развивается апраксия – нарушение выполнения целенаправленных движений (бытовых, производственных)
При поражении моторного центра речи (центра Брока) — сохраняется понимание, но нарушается воспроизведение.
При поражении сенсорного центра речи (центра Вернике) – нарушается понимание речи как окружающих, так и своей.
Апраксия – нарушение чтения и понимания прочитанного.
Аграфия – утрата способности правильно писать при сохраненной функции верхней конечности.
Одна из особенностей мозга человека – так называемая функциональная специализация полушарий головного мозга. Левое полушарие ответственно за логическое, абстрактное мышление, правое – за конкретное, образное. От того, какое из полушарий наиболее морфологически развито и доминирует у человека, зависит его индивидуальность, особенности восприятия (художественный или мыслительный тип характера). При выключении правого полушария больные становятся многословными (даже болтливыми), разговорчивыми, однако речь их теряет интонационную выразительность, она монотонна, бесцветна, тускла, приобретает гнусавый оттенок. Кроме того, такой больной теряет способность понимать значение речевых интонаций собеседника. При сохранении словарного запаса речи и повышенной речевой активности «правополушарный» человек теряет ту образность и конкретность речи, которую ей придает интонационно-голосовая выразительность. Нарушается восприятие сложных звуков, человек перестает узнавать знакомые мелодии, затрудняется в распознавании мужских и женских голосов (нарушается образное слуховое восприятие). Неполноценность образного восприятия выявляется и в зрительной сфере, не замечает недостающую деталь в незаконченных рисунках, больной затрудняется выполнять задания, требующие ориентировки в наглядной, образной ситуации. Таким образом при выключении правого полушария страдают те виды психической деятельности, которые лежат в основе абстрактного мышления. Такое состояние психики сопровождается положительным эмоциональным тонусом (оптимистичность, склонность к шуткам, вера в выздоровление и т.д.)
При поражении левого полушария резко ограничиваются речевые возможности человека, обедняется словарный запас, больной не помнит названия предметов, хотя и узнает их. Речевая активность резко снижается, но интонационный рисунок речи сохранен. Зато такой больной хорошо узнает мелодии песен, может их воспроизводить, у него сохраняются все виды образного восприятия. Нарушается способность запоминать слова, он дезориентирован в месте и времени, но подмечает детали обстановки, сохраняется наглядная конкретная ориентировка. При этом возникает отрицательный эмоциональный фон (у больного ухудшается настроение, он пессимистичен, трудно отвлекается от печальных мыслей и жалоб)
Дыхание что то.. .
| Анатомия и физиология органов дыхания Что нужно знать об анатомии и физиологии органов дыхания? Газообмен Задача органов дыхания — обеспечение органов жизненно необходимым кислородом и выделение в окружающую среду углекислого газа как конечного продукта обмена веществ . В результате той роли, которую играют лёгкие в процессе газообмена, лёгкие становятся важным регулирующим органом и в кислотно-щелочном балансе. Так при кислородной недостаточности наступает переокисление крови и тем самым нарушается обмен веществ в клетках, — процесс, который наблюдается в продвинутой стадии в лёгких при данной патологии. Дыхательные пути, прежде всего нос, служат и для обогрева, увлажнения и очищения вдыхаемого воздуха. | ||
| Дыхательные пути Дыхательные пути — это путь воздуха от ротового и носового отверстий до лёгочных пузырьков (альвеол). Воздухоносные пути расположены вне грудной полости (внеторакально) и в грудной полости (внутриторакально). К дыхательным путям, расположенным вне грудной полости, относятся рот, носо- и ротоглотка, гортань, трахея. Трахея делится на два ствола бронхов, ведущих к левому и правому лёгкому. Отсюда бронхи разветвляются справа на три, слева — на два долевых бронха, потому что правое лёгкое состоит из трёх, левое — из двух долей. От них отходят сегментарные бронхи, снабжающие более мелкие участки лёгких (сегменты). | ||
 |  | |
| После последующего 22-разового деления (разветвления бронхиального дерева) терминальный бронх впадает в лёгочные пузырьки (альвеолы). Они состоят из тонкого клеточного слоя, под которым находятся кровеносные сосуды (капилляры), с помощью которых происходит газообмен. Большие и мелкие бронхи выстланы слизистой оболочкой, покрытой ресничками (цилии), которые отсутствуют в концевых бронхах и в альвеолах. | ||
 Рис. 1-3. Строение стенки: бронх, бронхиола, альвеола (бронхиальные клетки с ресничками, мускулатура, бронхиальный лимфоузел, хрящ) Бронхи окружены слоем мышц и стабилизированы хрящевыми кольцами, препятствующими спаданию бронхов при выдохе. И только»после 12-го деления (это уже бронхиолы) — без хрящей. С помощью мускулатуры бронхи могут сужаться (например, при астме) или расширяться (лекарства, стимулирующие дыхание, воздействие адреналина при чувстве радости). | ||
 Рис. 1-4 Нормальный бронх Спазматически суженный бронх | ||
| Мелкие дыхательные пути заканчиваются в лёгочных пузырьках. Мелкие пустые мешочки, имеющие форму сот или шариков диаметром от 0,1 до 0,3 мм, покрыты поверхностно-активным веществом ( сурфактант). Вместе с эластичными волокнами, окружающими альвеолы, оно предотвращает спадание ткани. |  Рис. 1-5 От бронха к лёгочным пузырькам (по Netter) Рис. 1-5 От бронха к лёгочным пузырькам (по Netter) | |
| Примерно через два месяца после рождения ребёнка альвеолы в функциональном отношении достаточно развиты. Новые альвеолы лёгких наиболее интенсивно образуются примерно до трёх лет. После этого прекращается образование новых альвеол, увеличивается только их размер пока грудная клетка не достигнет окончательного объёма. | ||
Рис. 1-6 Капиллярная система артерий и вен, окружающая альвеолы (по Cegla)
|  | |
| Альвеолы лёгких покрыты тончайшими кровеносными сосудами (капиллярами). Кислород, вдыхаемый с воздухом, в альвеолах поглощается эритроцитами, углекислый газ попадает из крови в альвеолы. | углекислый газ кислород кровь течет в капиллярах кислород насыщает эритроциты | |
ЛЁГКИЕ И ГРУДНАЯ КЛЕТКА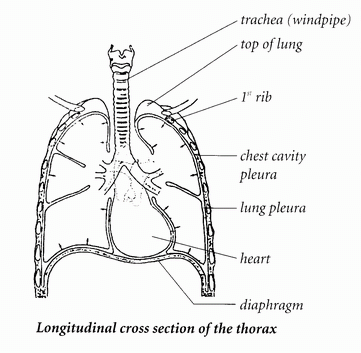 Грудная или торакальная полость состоит из костного каркаса, рёбер и позвоночного столба. Рёбра подвижно соединены с позвоночным столбом. Внизу грудная полость заканчивается куполообразной мышечной перегородкой — диафрагмой. Грудная или торакальная полость состоит из костного каркаса, рёбер и позвоночного столба. Рёбра подвижно соединены с позвоночным столбом. Внизу грудная полость заканчивается куполообразной мышечной перегородкой — диафрагмой.Рёбра связаны между собой мышцами и активно участвуют в процессе дыхания. Лёгкие покрыты висцеральной плеврой (Pleura pulmonalis или visceralis), и с внутренней стороны плотно прилегают к грудной полости. Грудная полость тоже покрыта тонкой слизистой плёнкой — (Pleura parietalis) -пристеночной или париетальной плеврой. Слой жидкости, находящийся в узкой щели между двумя слизистыми оболочками, препятствует образованию трения при движении лёгких, и способствует прочному сцеплению висцеральной плевры с рёберной плеврой. Таким образом лёгкие подвешены в грудной полости и следуют движениям грудной клетки, и наоборот, грудная клетка следует эластичной тяге лёгких при выдохе. | ||
| Как мы дышим ? Вдох и выдох воздуха происходят благодаря ритмичным движениям органов дыхания. Это лёгкие, грудная клетка с относящейся к ней мускулатурой, диафрагма и брюшная стенка.  Грудная полость при вдохе Грудная полость при вдохеЭластичная ткань лёгких обладает свойством сокращаться, в то время как грудная клетка скорее тяготеет к тому, чтобы оставаться в положении вдоха. Вдох происходит благодаря тому, что дыхательная мускулатура поднимает и расширяет грудную клетку, диафрагма опускается; при этом должно быть преодолено эластичное сопротивление грудной клетки и лёгких. При потоке воздуха во время вдоха и выдоха через систему труб дыхательных путей различного диаметра возникает сопротивление, так называемое противодействие току воздуха. Итак, вдох — это активный процесс. При вдохе в дыхательных путях возникает более низкое давление по сравнению с атмосферным давлением. Благодаря этому воздух может пройти в дыхательные пути. Выдох происходит потому, что лёгкое, расширенное во время вдоха, сжимается. Следовательно, при дыхании в покое вдох активный, выдох — пассивный процесс. Во время выдоха в результате сжатия лёгких поднимается давление в бронхах и альвеолах по сравнению с атмосферным давлением и воздух устремляется наружу. Самая главная дыхательная мышца — диафрагма. Она движется вниз в направлении живота, как поршень с возвратно-поступательным движением в автомашине, и расширяет при этом лёгкие. Движение диафрагмы изображено на рисунке, данном выше. При выдохе диафрагма движется вверх. При напряжённом дыхании или сильном выдохе (например, FET) выдох поддерживается мышцами живота. При дыхании в покое у взрослых 2/3 воздуха перекачивается в лёгкие диафрагмой и только 1/3 — грудной клеткой. | ||
3. старение печени. желчеобразование.
§
Обмен газов в легких
В состав атмосферного воздуха входит 20,93% кислорода, 0,03% углекислого газа, 79,03% азота. В альвеолярном воздухе содержится 14% кислорода, 5,5% углекислого газа и около 80% азота. При выдохе альвеолярный воздух смешивается с воздухом мертвого пространства, состав которого соответствует атмосферному. Поэтому в выдыхаемом воздухе 16% кислорода, 4,5% углекислого газа и 79,4% азота. Дыхательные газы обмениваются в легких через альвеоло — капиллярную мембрану. Это область контакта альвеолярного эпителия и эндотелия капилляров. Переход газов через мембрану происходит по законам диффузии. Скорость диффузии прямо пропорциональна разнице парциального давления газов. Согласно закону Дальтона, парциальное давление каждого газа в их смеси, прямо пропорционально его содержанию в ней. Поэтому парциальное давление кислорода в альвеолярном воздухе 100 мм.рт.ст., а углекислого газа 40 мм.рт.ст. Напряжение (термин применяемый для газов растворенных в жидкостях) кислорода в венозной крови капилляров легких 40 мм.рт.ст., а углекислого газа — 46 мм.рт.ст. Поэтому градиент давления по кислороду направлен из альвеол в капилляры, а для углекислого газа в обратную сторону. Кроме того скорость диффузии зависит от площади газообмена, толщины мембраны и коэффициента растворимости газа в тканях. Общая поверхность альвеол составляет 50-80 м2, а толщина альвеоло -капиллярной
мембраны всего 1 мкм. Это обеспечивает высокую эффективность газообмена. Показателем проницаемости мембраны является коэффициент диффузии Крога. Для углекислого газа он в 25 раз больше, чем для кислорода. Т.е. он диффундирует в 25 раз быстрее. Высокая скорость диффузии компенсирует более низкий градиент давления углекислого газа. Диффузионная способность легких для газа (л) характеризуется его количеством, которое обменивается за 1 минуту на 1 мм.рт.ст. градиента давления. Для кислорода в норме она равна 30 мл*мин-1*мм.рт.ст.-1 У здорового человека напряжение дыхательных газов в альвеолярной крови, становится практически таким же, как их парциальное давление в альвеолярном воздухе. При нарушениях газообмена в альвеолах в крови повышается напряжение углекислого газа и снижается кислорода (пневмония, туберкулез, пневмосклероз).
Транспорт газов кровью
Напряжение кислорода в артериальной крови 95 мм.рт.ст. В растворенном состоянии кровью переносится всего 0,3 об.% кислорода. Основная его часть транспортируется в виде HBO2. Максимальное количество кислорода, которое может связать гемоглобин при его полном насыщении, называется кислородной емкостью крови. В норме она составляет 18 — 24 об.% Образование оксигемоглобина в легких и его распад в капиллярах тканей в основном обусловлены изменениями напряжения кислорода. В капиллярах легких, где напряжение его велико, происходит его образование. В тканях напряжение кислорода падает. Поэтому там оксигемоглобин диссоциирует на восстановленный гемоглобин и кислород. В норме связывание гемоглобина с кислородом определяется его парциальным давлением в альвеолярном воздухе, а следовательно напряжением в крови легочных капилляров. Зависимость концентрации оксигемоглобина от напряжения кислорода в крови называется кривой диссоциации оксигемоглобина. Она не является прямо пропорциональной. При низком напряжении кислорода рост концентрации оксигемоглобина замедлен. При напряжении от 10 до 40 мм.рт.ст. он практически прямо пропорционален. А выше снова замедляется. Поэтому кривая имеет S-образную форму. Кроме напряжения кислорода, на образование и распад оксигемоглобина влияют и другие факторы. При сдвиге реакции крови в кислую сторону, его диссоциация ускоряется. Ее ускоряет повышение напряжения углекислого газа и температуры. Эти изменения крови имеют место в капиллярах тканей. Поэтому там они способствуют ускоренной диссоциации оксигемоглобина и освобождению кислорода.
Напряжение углекислого газа в венозной крови 46 мм. рт. ст. Его перенос от тканей к легким также происходит несколькими путями. Всего в крови
находится около 50 об% углекислого газа. В плазме растворяется 2,5 об.%. В виде карбгемоглобина, в соединении с глобином, переносится около 5 об%. Остальное количество транспортируется в виде гидрокарбонатов, находящихся в плазме и эритроцитах. В капиллярах тканей углекислый газ поступает в эритроциты. Там под влиянием фермента карбоангидразы он соединяется с катионами водорода и превращается в угольную кислоту. Она диссоциирует и большая часть гидрокарбонат анионов выходит в плазму. Там они образуют с катионами натрия гидрокарбонат натрия. Меньшая их часть соединяется в эритроцитах с катионами калия, образуя гидрокарбонат калия. В капиллярах легких напряжение углекислого газа падает, а напряжение кислорода возрастает. Образующийся в эритроцитах оксигемоглобин является более сильной кислотой, чем угольная. Поэтому он вытесняет из гидрокарбоната калия анионы угольной кислоты и образует с калием калиевую соль оксигемоглобина. Освобождающиеся анионы угольной кислоты соединяются с катионами водорода. Синтезируется свободная угольная кислота. При низком напряжении углекислого газа карбоангидраза действует противоположным образом, т.е. расщепляет ее на углекислый газ и воду, которые выдыхаются. Одновременно из плазмы в эритроциты поступают анионы угольной кислоты, образующиеся в ходе диссоциации гидрокарбоната натрия. Они также образуют с катионами водорода угольную кислоту, которая расщепляется карбоангидразой на углекислый газ и воду. При дыхании из организма выводится около 200 мл углекислого газа в минуту. Это важный механизм поддержания кислотно-щелочного равновесия крови.
Обмен дыхательных газов в тканях
Обмен газов в капиллярах тканей происходит путем диффузии. Этот процесс осуществляется за счет разности их напряжения в крови, тканевой жидкости и цитоплазме клеток. Как и в легких для газообмена большое значение имеет величина обменной площади, т.е. количество функционирующих капилляров. В артериальной крови напряжение кислорода 96 мм.рт.ст., в тканевой жидкости около 20 мм.рт.ст., а работающих мышечных клетках близко к 0. Поэтому кислород диффундирует из капилляров в межклеточное пространство, а затем клетки. Для нормального протекания окислительно-восстановительных процессов в митохондриях необходимо, чтобы напряжение кислорода в клетках было не менее 1 мм.рт.ст. Эта величина называется критическим напряжением кислорода в митохондриях. Ниже ее развивается кислородное голодание тканей. В скелетных мышцах кислород накапливает белок миоглобин, по строению близкий к гемоглобину. Напряжение углекислого газа в артериальной крови 40 мм.рт.ст., в межклеточной жидкости 46 мм.рт.ст., в цитоплазме 60 мм.рт.ст. Поэтому он выходит в кровь. Количество кислорода, которое используется тканями называется коэффициентом его утилизации. В состоянии покоя ткани используют около 40% кислорода или 8-10 об%/
§
Почки в процессе старения подвергаются изменениям в соответствии со сдвигами в системе кровообращения. Вследствие склеротических изменений в сосудах, значительные зоны почек в старости оказываются ишеминизированными, и у 80-летнего человека от 30 до 40% нефронов склерозированы. У стариков объем гломеруллярной фильтрации, плазменный почечный кровоток, концентрационная способность почек снижаются почти
до 50%. Например, уменьшение эффективного почечного кровотока после 40 лет выражается следующим образом: эффективный почечный кровоток =8406,44 • число лет; уменьшение клубочковой фильтрации после 40 лет: клубочковая фильтрация =153,2-0,96число лет. Однако, порог плазменной концентрации глюкозы для экскреции в почках может даже повышаться, так что у пожилых с диабетом глюкозурия может быть недостаточно выражена.
Лекарственные вещества, которые у молодых экскретируются с мочой, могут накапливаться в организме стариков из-за недостаточности экскреторной функции почек. Из 185 продуктов метаболизма, определяемых в моче человека, не менее 60 изменяют концентрацию при старении. Многие старики страдают от никтурии (выделение ночью большой части суточного количества мочи), что соотносится с вышеотмеченной недостаточностью концентрационной способности почек.
Уменьшение способности почек концентрировать мочу связано с тем, что склерозирование артерий и сосудов клубочков в корковом слое почек сопровождается усилением кровотока в мозговом слое, в прямых артериолах и образуемой ими сети капилляров. Нарастание кровотока в мозговом веществе почек усиливает вымывание осмотически активных веществ из интерстициального пространства мозгового вещества, снижая реабсорбцию воды и эффективность противоточно-поворотной системы. Уменьшение способности поче задерживать воду в организме компенсируется усиливающейся секрецией АДГ гипоталамо-гипофизарной системой. Повышенная секреция АДГ связана с возрастающей чувствительностью осморецепторов к осмотически активным веществам в крови и тканевой жидкости у человека после 50 лет. Благодаря указанным компенсаторным механизмам, внутрисосудистый и внеклеточный объемы жидкостей организма и их состав у пожилых изменены мало.
ОЗНАКОМЛЕНИЕ С РАБОТОЙ ИСКУССТВЕННОЙ ПОЧКИ И ЕЕ ИСПОЛЬЗОВАНИЕ В КЛИНИКЕ.
Аппараты “искусственные почки” заменяют функцию не целых нефронов, а только их клубочков. Таким образом, принцип работы искусственной почки основан на применении искусственных, синтетических полупроницаемых мембран, по одну сторону которых протекает кровь больного, насыщенная шлаками, а по другую сторону — диализирующая жидкость, состоящая из различных солей и воды. Для того, чтобы предотвратить свертывание крови при прохождении через диализатор, в организм больного вводят специальное биологическое вещество — гепарин, снижающее свертываемость крови.
Между кровью и диализатором имеется разность давлений, обеспечивающая ультрафильтрацию крови. Кроме того, наличие в крови высокой концентрации веществ, подлежащих выведению и отсутствие их в диализаторе приводит к диализу этих веществ в крови. При необходимости уменьшить выведение каких-то веществ из крови или в кровь, их соответственно вводят в диализатор и во время работы аппарата «искусственная почка”, они попадают в организм больного.
Таким образом, с помощью искусственной почки можно очищать организм больного от шлаков, удалять из него избыток воды и в тоже время при необходимости вводить некоторые недостающие вещества.
В настоящее время имеется большое количество различных моделей искусственной почки.
Аппарат “искусственная почка” состоит из следующих основных узлов. В первую очередь это диализатор — устройство, где происходит очищение больного от шлаков. Далее емкость с диализирующим раствором. Кроме того, имеется насос для перекачивания диализирующего раствора, и во всех моделях аппарата есть насос для прокачивания крови больного через диализатор. Во всех современных аппаратах “искусственная почка” имеются приборы, контролирующие правильность работы, а иногда и система непрерывного слежения за состоянием больного во время сеанса гемодиализа (очищение крови от шлаков).
Типы диализаторов
1. Пластинчатые модели.
2. Спиралевидные.
В спиралевидных (катушечных) используют трубочки тонкого целлофана, намотанные на тонкостенный сплошной цилиндр или цилиндр из металлической сетки. Трубки сжимаются между двумя цилиндрами. Это создает тонкий просвет для протока крови и уменьшает объем наполнения трубок, что создает и способствует более эффектному удалению шлаков из крови. Трубки омывают постоянно циркулирующим снаружи диализирующим раствором. Таких спиралевидных катушек может быть несколько. В некоторых моделях спиралевидных диализаторов целлофановая трубка, по которой идет кровь, наматывается на медленно вращающийся барабан.
В последние годы появились новые, принципиально отличительные от традиционных конструкций аппараты “искусственной почки”. Многие из них более компактны и просты в эксплуатации. Например, интенсивно разрабатываются диализатора! из так называемых “полых волокон”. Этот диализатор представляет собой пластмассовый цилиндр, концы которого закрыты специальными распределительными устройствами, на которых по оси цилиндра закреплены параллельно друг другу полые трубочки микронной толщины, приготовленные из специально обработанной целлюлозы (полупроницаемая мембрана). По этим трубочкам через распределительное устройство поступает кровь больного. Через сборник на другом конце цилиндра кровь поступает в шланг, идущий к больному. Между трубочками диализатора циркулирует диализирующий раствор. Такие предварительно стерилизованные диализаторы предназначены для одноразового использования. Они значительно меньше и легче других типов диализаторов.
Расчет цветного показателя.
Цветовой показатель – это соотношение между количеством гемоглобина крови и числом эритроцитов носит название. Цветовой показатель позволяет определить степень насыщения эритроцитов гемоглобином.
В 1 мкл крови в норме содержится 166*10-6 г гемоглобина и 5,00*106 эритроцитов, следовательно содержание гемоглобина в 1 эритроците в норме равно:
| 166 · 10-6 | = 33 · 10 -12 пг (пикограмм). |
| 5,00 · 106 |
Величину в 33 пг, составляющую норму содержания гемоглобина в 1 эритроците, принимают за 1 (единицу) и обозначают как Цветовой показатель.
Практически вычисление Цветового показателя (ЦП) производят путем деления количества гемоглобина (Hb) в 1 мкл (в г/л), на число, состоящее из первых 3-х цифр количества эритроцитов с последующим умножением полученного результата на коэффициент 3.
| ЦП= | Hb (гемоглобин), г/л | · 3 |
| число эритроцитов (первые 3 цифры) |
Например, Hb=167 г/л, Количество эритроцитов — 4,8·1012 (или 4,80·1012). Первые три цифры количества эритроцитов — 480.
ЦП=167 / 480 · 3 = 1,04
В норме цветовой показатель находится в пределах 0,86—1,05 (Меньшиков В. В., 1987); 0,82—1,05 (Воробьев А. И., 1985); 0,86—1,1 (Козловская Л. В., 1975).
В практической работе удобно пользоваться для подсчета цветового показателя пересчетными таблицами и номограммами. По величине цветового показателя принято делить анемии на гипохромные (ниже 0,8); нормохромные (0,8—1,1) и гиперхромные (выше 1,1).
Клиническое значение. Гипохромные анемии — это чаще железодефицитные анемии, обусловленные длительными хроническими кровопотерями. В данном случае гипохромия эритроцитов обусловлена дефицитом железа. Гипохромия эритроцитов имеет место при анемии беременных, инфекциях, опухолях. При талассемии и отравлениях свинцом гипохромные анемии обусловлены не дефицитом железа, а нарушением синтеза гемоглобина.
Наиболее частой причиной гиперхромной анемии является дефицит витамина В12, фолиевой кислоты.
Нормохромные анемии наблюдаются чаще при гемолитических анемиях, острой кровопотере, апластической анемии.
Однако цветовой показатель зависит не только от насыщения эритроцитов гемоглобином, но и от величины эритроцитов. Поэтому морфологические понятия о гипо-, нормо- и гиперхромной окраске эритроцитов не всегда совпадают с данными цветового показателя. Макроцитарная анемия с нормо- и гипохромными эритроцитами может иметь цветовой показатель выше единицы, и наоборот, нормохромная микроцитарная анемия дает всегда цветовой показатель ниже.
Поэтому при различных анемиях важно знать, с одной стороны, как изменилось общее содержание гемоглобина в эритроцитах, и с другой,— их объем и насыщенность гемоглобином.
БИЛЕТ№40
§
У позвоночных животных в автономной нервной системе имеется три вида синаптической передачи: электрическая, химическая и смешанная. Органом с типичными электрическими синапсами является цилиарный ганглий птиц, лежащий в глубине глазницы у основания глазного яблока. Передача возбуждения здесь осуществляется практически без задержки в обоих направлениях. К редко встречающимся можно отнести и передачу через смешанные синапсы, в которых одновременно соседствуют структуры электрических и химических синапсов. Этот вид также характерен для цилиарного ганглия птиц. Основным же способом передачи возбуждения в автономной нервной системе является химический. Он осуществляется по определенным закономерностям, среди которых выделяют два принципа. Первый (принцип Дейла) заключается в том, что нейрон со всеми отростками выделяет один медиатор. Как стало теперь известно, наряду с основным в этом нейроне могут присутствовать также другие передатчики и участвующие в их синтезе вещества. Согласно второму принципу, действие каждого медиатора на нейрон или эффектор зависит от природы рецептора постсинаптической мембраны.
В автономной нервной системе насчитывают более десяти видов нервных клеток, которые продуцируют в качестве основных разные медиаторы: ацетилхолин, норадреналин, серотонин и другие биогенные амины, аминокислоты, АТФ. В зависимости от того, какой основной медиатор выделяется окончаниями аксонов автономных нейронов, эти клетки принято называть холинергическими, адренергическими, серотоиинергическими, пуринергическими и т. д. нейронами.
Каждый из медиаторов выполняет передаточную функцию, как правило, в определенных звеньях дуги автономного рефлекса. Так, ацетилхолин выделяется в окончаниях всех преганглионарных симпатических и парасимпатических нейронов, а также большинства постганглионарных парасимпатических окончаний. Кроме того, часть постганглионарных симпатических волокон, иннервирующих потовые железы и, по-видимому, вазодилататоры скелетных мышц, также осуществляют передачу с помощью ацетилхолина. В свою очередь норадреналин является медиатором в постганглионарных симпатических окончаниях (за исключением нервов потовых желез и симпатических вазодилататоров) — сосудов сердца, печени, селезенки.
Медиатор, освобождающийся в пресинаптических терминалах под влиянием приходящих нервных импульсов, взаимодействует со специфическим белком-рецептором постсинаптической мембраны и образует с ним комплексное соединение. Белок, с которым взаимодействует ацетилхолин, носит название холинорецептора, адреналин или норадреналин — адренорецептора и т. д. Местом локализации рецепторов различных медиаторов является не только постсинаптическая мембрана. Обнаружено существование и специальных пресинаптических рецепторов, которые участвуют в механизме обратной связи регуляции медиаторного процесса в синапсе.
Помимо холино-, адрено-, пуринорецепторов, в периферической части автономной нервной системы имеются рецепторы пептидов, дофамина, простагландинов. Все виды рецепторов, вначале обнаруженные в периферической части автономной нервной системы, были найдены затем в пре- и постсинаптических мембранах ядерных структур ЦНС.
Характерной реакцией автономной нервной системы является резкое повышение ее чувствительности к медиаторам после денервации органов. Например, после ваготомии орган обладает повышенной чувствительностью к ацетилхолину, соответственно после симпатэктомии — к норадреналину. Полагают, что в основе этого явления лежит резкое возрастание числа соответствующих рецепторов постсинаптической мембраны, а также снижение содержания или активности ферментов, расщепляющих медиатор (ацетилхолин-эстераза, моноаминоксидаза и др.).
В автономной нервной системе, помимо обычных эффекторных нейронов, существуют еще специальные клетки, соответствующиепостганглионарным структурам и выполняющие их функцию. Передача возбуждения к ним осуществляется обычным химическим путем, а отвечают они эндокринным способом. Эти клетки получили название трансдукторов. Их аксоны не формируют синаптических контактов с эффекторными органами, а свободно заканчиваются вокруг сосудов, с которыми образуют так называемые гемальные органы. К трансдукторам относят следующие клетки: 1) хромаффинные клетки мозгового слоя надпочечников, которые на холинергический передатчик преганглионарного симпатического окончания отвечают выделением адреналина и норадреналина; 2) юкста-гломерулярные клетки почки, которые отвечают на адренергический передатчик постганглионарного симпатического волокна выделением в кровяное русло ренина; 3) нейроны гипоталамических супраоптического и паравентрикулярного ядер, реагирующие на синаптический приток разной природы выделением вазопрессина и окситоцина; 4) нейроны ядер гипоталамуса.
Действие основных классических меадиаторов может быть воспроизведено с помощью фармакологических препаратов. Например, никотин вызывает эффект, подобный эффекту ацетилхолина, при действии на постсинаптическую мембрану постганглионарного нейрона, в то время как сложные эфиры холина и токсин мухомора мускарин — на постсинаптическую мембрану эффекторной клетки висцерального органа. Следовательно, никотин вмешивается в межнейронную передачу в автономном ганглии, мускарин — в нейро-эффекторную передачу в исполнительном органе. На этом основании считают, что имеется соответственно два типа холинорецепторов: никотиновые (Н-холинорецепторы) и мускариновые (М-холинорецепторы). В зависимости от чувствительности к различным катехоламинам адренорецепторы делят на α-адренорецепторы и β-адренорецепторы. Их существование установлено посредством фармакологических препаратов, избирательно действующих на определенный вид адренорецепторов.
В ряде висцеральных органов, реагирующих на катехоламины, находятся оба вида адренорецепторов, но результаты их возбуждения бывают, как правило, противоположными. Например, в кровеносных сосудах скелетных мышц имеются α- и β-адренорецепторы. Возбуждение α-адренорецепторов приводит к сужению, а β-адренорецепторов — к расширению артериол. Оба вида адренорецепторов обнаружены и в стенке кишки, однако реакция органа при возбуждении каждого из видов будет однозначно характеризоваться торможением активности гладких мышечных клеток. В сердце и бронхах нет α-адренорецепторов и медиатор взаимодействует только с β-адренорецепторами, что сопровождается усилением сердечных сокращений и расширением бронхов. В связи с тем что норадреналин вызывает наибольшее возбуждение β-адренорецепторов сердечной мышцы и слабую реакцию бронхов, трахеи, сосудов, первые стали называть β1-адренорецепторами, вторые — β2-адренорецепторами.
При действии на мембрану гладкой мышечной клетки адреналин и норадреналин активируют находящуюся в клеточной мембране аденилатциклазу. При наличии ионов Mg2 этот фермент катализирует образование в клетке цАМФ (циклического 3′ ,5′ -аденозинмонофосфата) из АТФ. Последний продукт в свою очередь вызывает ряд физиологических эффектов, активируя энергетический обмен, стимулируя сердечную деятельность.
Особенностью адренергического нейрона является то, что он обладает чрезвычайно длинными тонкими аксонами, которые разветвляются в органах и образуют густые сплетения. Общая длина таких аксонных терминалей может достигать 30 см. По ходу терминалей имеются многочисленные расширения — варикозы, в которых синтезируется, запасается и выделяется медиатор. С приходом импульса норадреналин одновременно выделяется из многочисленных расширений, действуя сразу на большую площадь гладкомышечной ткани. Таким образом, деполяризация мышечных клеток сопровождается одновременным сокращением всего органа.
Различные лекарственные средства, оказывающие на эффекторный орган действие, аналогичное действию постганглионарного волокна (симпатического, парасимпатического и т.п.), получили название миметиков (адрено-, холиномиметики). Наряду с этим имеются и вещества, избирательно блокирующие функцию рецепторов постсинаптической мембраны. Они названы ганглиоблокаторами. Например, аммониевые соединения избирательно выключают Н-холинорецепторы, а атропин и скополамин — М-холинорецепторы.
Классические медиаторы выполняют не только функцию передатчиков возбуждения, но обладают и общебиологическим действием. К ацетилхолину наиболее чувствительна сердечнососудистая система, он вызывает и усиленную моторику пищеварительного тракта, активируя одновременно деятельность пищеварительных желез, сокращает мускулатуру бронхов и понижает бронхиальную секрецию. Под влиянием норадреналина происходит повышение систолического и диастолического давления без изменения сердечного ритма, усиливаются сердечные сокращения, снижается секреция желудка и кишки, расслабляется гладкая мускулатура кишки и т. д. Более разнообразным диапазоном действий характеризуется адреналин. Посредством одновременной стимуляции ино-, хроно- и дромотропной функций адреналин повышает сердечный выброс. Адреналин оказывает расширяющее и антиспазматическое действие на мускулатуру бронхов, тормозит моторику пищеварительного тракта, расслабляет стенки органов, но тормозит деятельность сфинктеров, секрецию желез пищеварительного тракта.
В тканях всех видов животных обнаружен серотонин (5-окситриптамин). В мозге он содержится преимущественно в структурах, имеющих отношение к регуляции висцеральных функций, на периферии продуцируется энтерохромаффинными клетками кишки. Серотонин является одним из основных медиаторов метасимпатической части автономной нервной системы, участвующей преимущественно в нейроэффекторной передаче, и выполняет также медиаториую функцию в центральных образованиях. Известно три типа серотонинергических рецепторов — Д, М, Т. Рецепторы Д-типа локализованы в основном в гладких мышцах и блокируются диэтиламидом лизергиновой кислоты. Взаимодействие серотонина с этими рецепторами сопровождается мышечным сокращением. Рецепторы М-типа характерны для большинства автономных ганглиев; блокируются морфином. Связываясь с этими рецепторами, передатчик вызывает ганглиостимулирующий эффект. Рецепторы Т-типа, обнаруженные в сердечной и легочной рефлексогенных зонах, блокируются тиопендолом. Действуя на эти рецепторы, серотонин участвует в осуществлении коронарных и легочных хеморефлексов. Серотонин способен оказывать прямое действие на гладкую мускулатуру. В сосудистой системе оно проявляется в виде констрикторных или дилататорных реакций. При прямом действии сокращается мускулатура бронхов, при рефлекторном — изменяются дыхательный ритм и легочная вентиляция. Особенно чувствительна к серотонину пищеварительная система. На введение серотонина она реагирует начальной спастической реакцией, переходящей в ритмические сокращения с повышенным тонусом и завершающейся торможением активности.
Для многих висцеральных органов характерной является пуринергическая передача, названная так вследствие того, что при стимуляции пресинаптических терминален выделяются аденозин и инозин — пуриновые продукты распада. Медиатором же в этом случае является А Т Ф. Местом его локализации служат пресинаптические терминалы эффекторных нейронов метасимпатической части автономной нервной системы.
Выделившийся в синаптическую щель АТФ взаимодействует с пуринорецепторами постсинаптической мембраны двух типов. Пуринорецепторы первого типа более чувствительны к аденозину, второго — к АТФ. Действие медиатора направлено преимущественно на гладкую мускулатуру и проявляется в виде ее релаксации. В механизме кишечной пропульсии пуринергические нейроны являются главной антагонистической тормозной системой по отношению к возбуждающей холинергической системе. Пуринергические нейроны участвуют в осуществлении нисходящего торможения, в механизме рецептивной релаксин желудка, расслабления пищеводного и анального сфинктеров. Сокращения кишечника, возникающие вслед за пуринергически вызванным расслаблением, обеспечивают соответствующий механизм прохождения пищевого комка.
В числе медиаторов может быть гистамин. Он широко распространен в различных органах и тканях, особенно в пищеварительном тракте, легких, коже. Среди структур автономной нервной системы наибольшее количество гистамина содержится в постганглионарных симпатических волокнах. На основании ответных реакций в некоторых тканях обнаружены и специфические гистаминовые (Н-рецепторы) рецепторы: Н1- и Н2-рецепторы. Классическим действием гистамина является повышение капиллярной проницаемости и сокращение гладкой мускулатуры. В свободном состоянии гистамин снижает кровяное давление, уменьшает частоту сердечных сокращений, стимулирует симпатические ганглии.
На межнейронную передачу возбуждения в ганглиях автономной нервной системы тормозное влияние оказывает ГАМК. Как медиатор она может принимать участие в возникновении пресинаптического торможения.
Большие концентрации различных пептидов, особенно субстанции Р, в тканях пищеварительного тракта, гипоталамуса, задних корешков спинного мозга, а также эффекты стимуляции последних и другие показатели послужили основанием считать субстанцию Р медиатором чувствительных нервных клеток.
Помимо классических медиаторов и «кандидатов» в медиаторы, в регуляции деятельности исполнительных органов участвует еще большое число биологически активных веществ — местных гормонов. Они регулируют тонус, оказывают корригирующее влияние на деятельность автономной нервной системы, им принадлежит существенная роль в координации нейрогуморальной передачи, в механизмах выделения и действия медиаторов.
В комплексе активных факторов видное место занимают простагландины, которых много содержится в волокнах блуждающего нерва. Отсюда они выделяются спонтанно либо под влиянием стимуляции. Существует несколько классов простагландинов: Е, G, А, В. Их основное действие — возбуждение гладких мышц, угнетение желудочной секреции, релаксация мускулатуры бронхов. На сердечно-сосудистую систему они оказывают разнонаправленное действие: простагландины класса А и Е вызывают вазодилатацию и гипотензию, класса G — вазоконстрикцию и гипертензию.
Синапсы ВНС имеют в целом такое же строение, что и центральные. Однако отмечается значительное разнообразие хеморецепторов постсинаптических мембран. Передача нервных импульсов с преганглионарных волокон на нейроны всех вегетативных ганглиев осуществляется Н-холинергическими синапсами, т.е. синапсами на постсинаптической мембране которых расположены никотинчувствительные холинорецепторы. Постганглионарные холинергические волокна образуют на клетках исполнительных органов (желез, ГМК органов пищеварения, сосудов и т.д.) М-холинергические синапсы. Их постсинаптическая мембрана содержит мускаринчувствительные рецепторы (блокатор-атропин). И в тех и других синапсах передача возбуждения осуществляется ацетилхолином. М-холинергические синапсы оказывают возбуждающее влияние на гладкие мышцы пищеварительного канала, мочевыводящей системы (кроме сфинктеров), железы ЖКТ. Однако они уменьшают возбудимость, проводимость и сократимость сердечной мышцы и вызывают расслабление некоторых сосудов головы и таза.
Постганглионарные симпатические волокна образуют 2 типа адренергических синапсов на эффекторах – a-адренергические и b-адренергические. Постсинаптическая мембрана первых содержит a1-и a2 – адренорецепторы. При воздействии НА на a1-адренорецепторы происходит сужение артерий и артериол внутренних органов и кожи, сокращение мышц матки, сфинктеров ЖКТ, но одновременно расслабление других гладких мышц пищеварительного канала. Постсинаптические b-адренорецепторы также делятся на b1 – и b2 – типы. b1-адренорецепторы расположены в клетках сердечной мышцы. При действии на них НА повышается возбудимость, проводимость и сократимость кардиомиоцитов. Активация b2-адренорецепторов приводит к расширению сосудов легких, сердца и скелетных мышц, расслаблению гладких мышц бронхов, мочевого пузыря, торможению моторики органов пищеварения.
Кроме того, обнаружены постганглионарные волокна, которые образуют на клетках внутренних органов гистаминергические, серотонинергические, пуринергические (АТФ) синапсы.
2. учение Павлова о 1 и 2 сигнальной системах.
Сигнальная система — система условно- и безусловнорефлекторных связей высшей нервной системы животных (включая человека) и окружающего мира. Различаютпервую и вторую сигнальные системы.
Термин введен академиком И. П. Павловым.
Первая сигнальная система развита практически у всех животных, тогда как вторая система присутствует только у человека и, возможно, у некоторых китообразных. Это связано с тем, что только человек способен формировать отвлечённый от обстоятельств образ. После произнесения слова «лимон» человек может представить, какой он кислый и как обычно морщатся, когда едят его, то есть произнесение слова вызывает в памяти образ (срабатывает вторая сигнальная система); если при этом началось повышенное отделение слюны, то это работа первой сигнальной системы.
Является предметом изучения физиологии высшей нервной деятельности человека.
Вторая сигнальная система — специальный тип высшей нервной деятельности человека, система «сигналов сигналов», идущих от общей (но не одинаковой) с животными первой сигнальной системы — ощущений, представлений, относящихся к окружающему миру. Речь, как вторая сигнальная система, как семиотическая система значимостей — это «идущие в кору от речевых органов есть вторые сигналы, сигналы сигналов. Они представляют собой отвлечение от действительности и допускают обобщение, что и составляет наше личное, специально человеческое, высшее мышление, создающее сперва общечеловеческий эмпиризм, а, наконец, и науку — орудие высшей ориентировки человека в окружающем мире и в самом себе». И. П. Павлов (1932).
Мозг животного отвечает лишь на непосредственные зрительные, звуковые и другие раздражения или их следы; возникающие ощущения составляют первую сигнальную систему действительности.[1]
В процессе эволюции животного мира на этапе становления и начального развития вида Homo sapiens произошло качественное видоизменение системы сигнализации, обеспечивающее активное и коллективное адаптивное приспособительное поведение, создавшее многообразные, принятые в группе системы сигнализации и языки: слово, по выражению И. П. Павлова, становится «сигналом сигналов». Появление второй сигнальной системы — возникновение речи и языков, сигнальных систем человека с сородичами, где условные (произвольные) сигналы индивида приобретают определенные, принятые группой значения и значимости, преобразуются в знаки языка в прямом смысле этого слова — это один из важнейших результатов многомиллионнолетней эволюции социальной жизни рода Homo, передающиеся через речевую деятельность из поколения в поколение.
В изучении В. с. с. вначале преобладало накопление фактов, характеризующих значение обобщающей функции словесных сигналов, а затем — вскрытие нервных механизмов действия слова. Установлено, что процесс обобщения словом развивается как результат выработки системы условных связей (см. Условные рефлексы); при этом имеет значение не только количество связей, но и их характер: связи, выработанные во время деятельности ребёнка, облегчают процесс обобщения. При воздействии словесных сигналов наблюдаются стойкие изменения возбудимости, большая сила, частота и длительность электрических разрядов в нервных клетках определённых пунктов коры мозга. Развитие В. с. с. — результат деятельности всей коры больших полушарий; связать этот процесс с функцией какого-то ограниченного отдела мозга невозможно. В исследованиях В.с.с. в лаборатории высшей нейродинамики и психологии высших когнитивных процессов Е. И. Бойко [1]показана плодотворность учения И. П. Павлова о динамических временных связях В.с.с.[3] В развитие идей И. П. Павлова и Е. А. Бойко в школе Е. А. Бойко разработана общая когнитивистская модель целостного рече-мысле-языкового процесса, найдены решения сложнейших теоретических проблем психологии в ее взаимосвязях с лингвистикой, такие как вопросы соотношения языка и речи в процессах речепроизводства и речепонимания; характер связей речи с мыслью, речи с личностью говорящего; особенности развития детской речи и др. Здесь разработаны новые методы анализа публичных выступлений (интент-анализ), позволяющий в известной мере реконструировать «картину мира» говорящего — его целевые и предметные направленности, их динамику, особенности в конфликтной ситуации, в свободных условиях общения, в публичных выступлениях и др.
Существенным резервом для дальнейших исследований остаются проблемы типологии колоссальных индивидуальных различий во взаимосвязях общего и специального типов ВНД, неокортекса и эмоционально-волевой и непроизвольной регуляции деятельности и общения, пока что слабо представленных как в физиологии ВНД, так и в психолингвистических исследованиях и в антропологической лингвистике.
§
Почки в процессе старения подвергаются изменениям в соответствии со сдвигами в системе кровообращения. Вследствие склеротических изменений в сосудах, значительные зоны почек в старости оказываются ишеминизированными, и у 80-летнего человека от 30 до 40% нефронов склерозированы. У стариков объем гломеруллярной фильтрации, плазменный почечный кровоток, концентрационная способность почек снижаются почти до 50%. Например, уменьшение эффективного почечного кровотока после 40 лет выражается следующим образом: эффективный почечный кровоток =8406,44 • число лет; уменьшение клубочковой фильтрации после 40 лет: клубочковая фильтрация =153,2-0,96число лет. Однако, порог плазменной концентрации глюкозы для экскреции в почках может даже повышаться, так что у пожилых с диабетом глюкозурия может быть недостаточно выражена.
Лекарственные вещества, которые у молодых экскретируются с мочой, могут накапливаться в организме стариков из-за недостаточности экскреторной функции почек. Из 185 продуктов метаболизма, определяемых в моче человека, не менее 60 изменяют концентрацию при старении. Многие старики страдают от никтурии (выделение ночью большой части суточного количества мочи), что соотносится с вышеотмеченной недостаточностью концентрационной способности почек.
Уменьшение способности почек концентрировать мочу связано с тем, что склерозирование артерий и сосудов клубочков в корковом слое почек сопровождается усилением кровотока в мозговом слое, в прямых артериолах и образуемой ими сети капилляров. Нарастание кровотока в мозговом веществе почек усиливает вымывание осмотически активных веществ из интерстициального пространства мозгового вещества, снижая реабсорбцию воды и эффективность противоточно-поворотной системы. Уменьшение способности почек задерживать воду в организме компенсируется усиливающейся секрецией АДГ гипоталамо-гипофизарной системой. Повышенная секреция АДГ связана с возрастающей чувствительностью осморецепторов к осмотически активным веществам в крови и тканевой жидкости у человека после 50 лет. Благодаря указанным компенсаторным механизмам, внутрисосудистый и внеклеточный объемы жидкостей организма и их состав у пожилых изменены мало.
Анализ электрокардиограммы
Одним из наиболее распространенных методов диагностики заболеваний сердечно-сосудистой системы является метод анализа электрокардиограммы.
Правильная диагностика заболеваний сердечно-сосудистой системы по электрокардиограмме возможна при условии твердого знания физиологической характеристики «нормальной» электрокардиограммы. Поиск патологических изменений в электрокардиограмме возможен путем сравнения изучаемой электрокардиограммы с патологически измененными зубцами и интервалами в соответствующих руководствах. Но такой способ во многом механический и не позволяет проводить дифференциальную диагностику заболевания целенаправленно.
Единственно правильной основой анализа электрокардиограммы является понимание происхождения, направленности и формы зубцов электрокардиограммы в каждом отведении. Анализ соответствия направления электрической и анатомической осей сердца позволяет определить не только наличие, но и место патологии, что затем подтверждается целенаправленным анализом усиленных отведений.
АЛГОРИТМ АНАЛИЗА ЭКГ
ЭКГ — СХЕМА I
1. ЭКГ — Электрокардиограмма — кривая, отражающая направление распространения возбуждения по сердцу.
2. Функции миокарда, состояние которых можно определить по ЭКГ — возбудимость, проводимость, автоматия.
-Возбудимость — способность сердечной мышцы отвечать на раздражения. В нормальных физиологических условиях сердечная мышца во время электрической систолы сердца в течение 0,27 сек. находится в состоянии абсолютной рефрактерности. Это исключает очередное возбуждение сердца — экстрасистолы. В условиях измененной сердечной мышцы возбудимость ее повышается и возможно возникновение экстрасистолы. Если экстрасистолы отсутствуют, говорят о нормальной функции возбудимости. Если регистрируются экстрасистолы, следует говорить о нарушении функции возбудимости.
-Проводимость — скорость проведения возбуждения по разным отделам сердца. В норме РQ= от 0,12 до 0,18 с. При брадикардии допускается PQ= 0,20 сек, QRS =0,08 — 0,1 сек. У детей интервал PQ = 0,11 — 0,14 сек., QRS = 0,04 — 0,06 сек.
-Автоматия — способность сердца самостоятельно возбуждаться без каких-либо экстракардиальных воздействий. О функции автоматии судят на основании водителя ритма. Ритм свыше 40 импульсов в I минуту и изменяется при физической нагрузке — водитель ритма синусовый узел Кисс-Фляка. Ритм 40 и менее, но не изменяется при физической нагрузке — водитель ритма — атриовентрикулярный узел Ашофф-Товара.
3. Тип ЭКГ — Положение электрической оси сердца — суммарный вектор ЭДС сердца, определяется по стандартным отведениям.
— Нормограмма — нормальный тип ЭКГ. Направление электрической оси сердца по отношению к горизонтальной плоскости составляет от 40 до 700. При этом RII > R I > RIII (то есть амплитуда зубца R во II отведении больше зубца R в I отведении и больше зубца R в III отведении) и амплитуды зубцов R больше зубцов Q и S. Нормограмма считается физиологической, если сохранены все функции, и направление ведущих зубцов соответствует стандартам.
— Правограмма — правый тип ЭКГ. Направление электрической оси сердца относительно горизонтальной плоскости составляет от 70 до 900 при этом RIII > RI, RI = SI, или SI > RI. Правограмма считается физиологической, если все функции миокарда сохранены и направление ведущих зубцов ЭКГ соответствует стандартам.
— Левограмма — левый тип ЭКГ. Направление электрической оси сердца по отношению к горизонтальной плоскости составляет от 0 до 300 при этом R I > RIII , RIII = SIII или SIII >RIII.
Левограмма считается физиологической, если сохранены все функции миокарда и направление ведущих зубцов ЭКГ соответствует стандартам.
4. Позиция сердца — направление анатомической оси сердца в грудной клетке определяется по усиленным отведениям от конечностей.
— Срединная позиция — анатомическая ось занимает положение от 40 до 700 по отношению к горизонтальной плоскости, при этом зубцы: R AVL = R AVF ; R AVL > S AVL ; R AVL > S AVF .
— Вертикальная позиция — вертикальное положение анатомической оси сердца — анатомическая ось занимает положение от 70 до 900 по отношению к горизонтальной плоскости, при этом зубцы:
R AVF > R AVL ; (висячее сердце) R AVL = S AVL или S AVL > R AVL.
— Горизонтальная позиция — горизонтальное положение анатомической оси сердца — анатомическая ось занимает положение от 0 до 300 по отношению к горизонтальной плоскости при этом зубцы:
R AVL > R AVF ; R AVF = S AVF или S AVF > R AVF
5. Переходная зона регистрируется в грудных отведениях V 3, V 4, когда амплитуда зубца R = амплитуде зубца S, т.е. проекция активного электрода лежит на уровне межжелудочковой перегородки. В норме направление электрической и анатомической осей сердца должно совпадать.
Если ТИП ЭКГ (электрическая ось) не соответствует позиции сердца(анатомической оси), то определяют направление отклонения электрической оси от анатомической, это возможно за счет гипертрофии левой или правой половины сердца.
ТИП ЭКГ (электрическая ось сердца)
R II > R I > R III — НОРМОГРАММА
R II > R I , R I = S I , S I > R I — ПРАВОГРАММА
R I > R III , R III = S III , S III > R III — ЛЕВОГРАММА
ПОЗИЦИИ СЕРДЦА:
СРЕДИННАЯ- R avl = R avf
ВЕРТИКАЛЬНАЯ —
Ravf>Ravl ;
R avl = S avl ;
S avl > R avl .
ГОРИЗОНТАЛЬНАЯ —
Ravl>Ravf ;
R avf = S avf ;
S avf > R avf .
Измерение зубцов производится в тех отведениях, где зубцы и интервалы лучше всего выражены. Следует отметить, что при скорости записи 50 мм/сек цена одного мм на ЭКГ равна 0,02 сек.
Измерить:
1. Продолжительность интервалов (RR, PQ, QRS, Q — T )
2. Продолжительность зубца Р.
3. Определить положение интервала S-Т.
4. Определить соотношение направления зубцов Т и комплекса QRS.
5. Соотношение зубцов RI, RII, RIII.
6. Соотношение зубцов RI-SI, RIII-SIII.
На основании анализа ЭКГ определить:
1. Ритм работы сердца, Ритм = (60 сек.) : (R-R сек.)
Ритм может быть – по происхождению — синусовый, атриовентрикулярный. По правильности — правильный, аритмия. Аритмия устанавливается в том случае, если интервалы R-R отличаются друг от друга более чем на 0,25 сек (10%).
2. Тип ЭКГ (положение электрической оси сердца) по I, II, III стандартным отведениям.
3. Позиция сердца в грудной клетке (положение анатомической оси сердца) по усиленным отведениям avR, avL, avF.
4. Определить соответствует ли тип ЭКГ позиции сердца в грудной клетке. Правограмма должна соответствовать вертикальной позиции сердца в грудной клетке, левограмма должна соответствовать горизонтальной позиции сердца в грудной клетке. Нормограмма должна соответствовать срединной позиции сердца в грудной клетке.
5. Положение переходной зоны (R = S) в грудных отведениях.
6. Правило нарастания амплитуды зубца Т в грудных отведениях.
7. Отсутствие зубца Q в грудных отведениях до переходной зоны и наличие его после переходной зоны.
8. Изоэлектричность сегмента ST.
Билет № 41
§
Условные рефлексы (У.Р.) — это индивидуально приобретённые в процессе жизнедеятельности реакции организма на раздражение. Создатель учения об условных рефлексах И.П. Павлов называл их временной связью раздражителя с ответной реакцией, которая образуется в организме при определённых условиях.
Свойства условных рефлексов:
1. Формируются в течение всей жизни в результате взаимодействия индивида с внешней средой.
2. Не отличаются постоянством и без подкрепления могут исчезать
3. Не имеют постоянного рецептивного поля
4. Не имеют постоянной рефлекторной дуги
5. Для возникновения условнорефлекторной реакции не требуется действие специфического раздражителя.
Пример условного рефлекса — выработка слюноотделения у
собаки на звонок.
Условные рефлексы образуются только при определённом сочетании свойств раздражителя и внешних условий. Для выработки условного рефлекса используется сочетание индифферентного или условного раздражителя и подкрепляющего безусловного. Индифферентным называется такой раздражитель, который в естественных условиях не может вызвать данную рефлекторную реакцию, а безусловным — специфический раздражитель, который всегда вызывает возникновение этого рефлекса.
Для выработки условных рефлексов необходимы следующие условия:
1.Действие условного раздражителя должно предшествовать воздействию безусловного.
2.Необходимо многократное сочетание условного и безусловного раздражителей.
3.Индифферентный и безусловный раздражители должны иметь сверхпороговую силу.
4.В момент выработки условного рефлекса должны отсутствовать посторонние внешние раздражения.
5.Ц.Н.С. должна быть в нормальном функциональном состоянии.
Все условные рефлексы в зависимости от возникающего поведения делятся на классические и инструментальные.
1.Классические это такие, которые вырабатываемые в соответствии с вышеприведёнными условиями Пример — слюноотделение, выработанное на звонок.
2.Инструментальные — это рефлексы, способствующие достижению или избеганию раздражителя. Например, при включении звонка, предшествующего безусловнорефлекторному болевому раздражению, собака совершает комплекс движений, чтобы освободиться от электродов. При звонке, предшествующем пище виляет хвостом, облизывается, тянется к чашке и т.д.
По афферентному звену условнорефлекторной дуги, т.е. рецепторам выделяют экстерорецептивные и интерорецептивные условные рефлексы. Экстерорецептивные возникают в ответ на раздражение внешних рецепторов и служат для связи организма с внешней средой. Интерорецептивные — на раздражение рецепторов внутренней среды. Они необходимы для поддержания постоянства внутренней среды.
По эфферентному звену условнорефлекторной дуги выделяют двигательные и вегетативные условные рефлексы. Пример двигательного — отдёргивание лапы собакой на звук метроном, если последний предшествует болевому раздражения лапы. Пример вегетативного — слюноотделение на звонок у собаки.
Отдельно выделяются условные рефлексы высших порядков. Это условные рефлексы, которые вырабатываются не путём подкрепления условного раздражителя безусловным, а при подкреплении одного условного раздражителя другим. В частности, на сочетание зажигания лампы с дачей пищи вырабатывается условный слюноотделительный рефлекс I — го порядка. Если после этого подкреплять звонок зажиганием лампы, то выработается условнорефлекторное слюноотделение на звонок. Это будет рефлексом II — го порядка. У собаки можно выработать условные рефлексы лишь IV — го порядка, а у человека до XX — го порядка. Условные рефлексы высших порядков нестойкие и быстро угасают.
У млекопитающих и человека основная роль в формировании условных рефлексов принадлежит коре. При их выработке от периферических рецепторов, воспринимающих условный и безусловный раздражители, нервные импульсы по восходящим путям поступают в подкороковые центры, а затем те зоны коры, где находится представительство данных рецепторов. В нейронах этих 2-х участков коры возникают биопотенциалы, Они совпадают по времени, частоте и фазе. По межкортикальным путям происходит циркуляция, т.е. реверберация нервных импульсов. В результатет синаптической потенциации активизируются синаптические связи, расположенные между нейронами той и другой зоны коры. Улучшение проведения закрепляется, возникает временная или условнорефлекторная связь (схема дуги усл. слюноотделительного рефлекса).
§
Из всех органов печень играет ведущую роль в обмене белков, жиров, углеводов, витаминов, гормонов и других веществ. Ее основные функции:
1. Антитоксическая. В ней обезвреживаются токсические продукты, образующиеся в толстом кишечнике в результате бактериального гниения белков — индол, скатол и фенол. Они, а также экзогенные токсические вещества (алкоголь), подвергаются биотрансформации. (Экк-Павловское соустье).
2. Печень участвует в углеводном обмене. В ней синтезируется и накапливается гликоген, а также активно протекают процессы гликогенолиза и неоглюкогенеза. Часть глюкозы используется для образования жирных кислот и гликопротеинов.
3. В печени происходит дезаминирование аминокислот, нуклеотидов и других азотсодержащих соединений. Образующийся при этом аммиак нейтрализуется путем синтеза мочевины.
4. Печень участвует в жировом обмене. Она преобразует короткоцепочечные жирные кислоты в высшие. Образующийся в ней холестерин используется для синтеза ряда гормонов.
5. Она синтезирует ежесуточно около 15 г альбуминов, a1— и a2-глобулины, b2-глобулины плазмы.
6. Печень обеспечивает нормальное свертывание крови. a2-глобулинами являются протормбин, Ас-глобулин, конвертин, антитромбины. Кроме того ею синтезируется фибриноген и гепарин.
7. В ней инактивируются такие гормоны, как адреналин, норадреналин, серотонин, андрогены и эстрогены.
8. Она является депо витаминов А, В, D, E, K.
9. В ней депонируется кровь, а также происходит разрушение эритроцитов с образованием из гемоглобина билирубина.
10. Экскреторная. Ею выделяются в желудочно-кишечный тракт холестерин, билирубин, мочевина, соединения тяжелых металлов.
В печени образуется важнейший пищеварительный сок — желчь.
Желчь вырабатывается гепатоцитами путем активного и пассивного транспорта в них воды, холестерина, билирубина, катионов. В гепатоцитах из холестерина образуются первичные желчные кислоты — холевая и дезоксихолевая. Из билирубина и глюкуроновой кислоты синтезируется водорастворимый комплекс. Они поступают в желчные капилляры и протоки, где желчные кислоты соединяются с глицином и таурином. В результате образуются гликохолевая и таурохолевая кислоты. Гидрокарбонат натрия образуется с помощью тех же механизмов, что и в поджелудочной железе.
Желчь вырабатывается печенью постоянно. В сутки ее образуется около 1 литра. Гепатоцитами выделяется первичная или печеночная желчь. Это жидкость золотисто-желтого цвета щелочной реакции. Ее рН = 7,4 — 8,6. Она состоит из 97,5% воды и 2,5% сухого остатка. В сухом остатке содержатся:
1. Минеральные вещества. Катионы натрия, калия, кальция, гидрокарбонат, фосфат анионы, анионы хлора.
2. Желчные кислоты — таурохолевая и гликохолевая.
3. Желчные пигменты — билирубин и его окисленная форма биливердин. Билирубин придает желчи цвет.
4. Холестерин и жирные кислоты.
5. Мочевина, мочевая кислота, креатинин.
6. Муцин
Поскольку вне пищеварения сфинктер Одди, расположенный в устье общего желчного протока, закрыт, выделяющаяся желчь накапливается в желчном пузыре. Здесь из нее реабсорбируется вода, а содержание основных органических компонентов и муцина возрастает в 5-10 раз. Поэтому пузырная желчь содержит 92% воды и 8% сухого остатка. Она более темная, густая и вязкая, чем печеночная. Благодаря этой концентрации пузырь может накапливать желчь в течение 12 часов. Во время пищеварения открывается сфинктер Одди и сфинктер Люткенса в шейке пузыря. Желчь выходит в двенадцатиперстную кишку.
Значение желчи:
1. Желчные кислоты эмульгируют часть жиров, превращая крупные жировые частицы в мелкодисперсные капли.
2. Она активирует ферменты кишечного и поджелудочного сока, особенно липазы.
3. В комплексе с желчными кислотами происходит всасывание длинноцепочечных жирных кислот и жирорастворимых витаминов через мембрану энтероцитов.
4. Желчь способствует ресинтезу триглицеридов в энтероцитах.
5. Инактивирует пепсины, а также нейтрализует кислый химус, поступающий из желудка. Этим обеспечивается переход от желудочного к кишечному пищеварению.
6. Стимулирует секрецию поджелудочного и кишечного соков, а также пролиферацию и слущивание энтероцитов.
7. Усиливает моторику кишечника.
8. Оказывает бактериостатическое действие на микроорганизмы кишечника и таким образом препятствует развитию гнилостных процессов в нем.
Регуляция желчеобразования и желчевыделения в основном осуществляется гуморальными механизмами, хотя некоторую роль играют и нервные. Самым мощным стимулятором желчеобразования в печени являются желчные кислоты, всасывающиеся в кровь из кишечника. Его также усиливает секретин, который способствует увеличению содержания в желчи гидрокарбоната натрия. Блуждающий нерв стимулирует выработку желчи, симпатические тормозят.
При поступлении химуса в двенадцатиперстную кишку начинается выделение I-клетками ее слизистой холецистокинина-панкреозимина. Особенно этот процесс стимулируют жиры, яичный желток и сульфат магния. ХЦК-ПЗ усиливает сокращения гладких мышц пузыря, желчных протоков, но расслабляет сфинктеры Люткенса и Одди. Желчь выбрасывается в кишку. Рефлекторные механизмы играют небольшую роль. Химус раздражает хеморецепторы тонкого кишечника. Импульсы от них поступают в пищеварительный центр продолговатого мозга. От него они по вагусу к желчевыводящим путям. Сфинктеры расслабляются, а гладкие мышцы пузыря сокращается. Это способствует желчевыведению.
В эксперименте желчеобразование и желчевыведение исследуются в хронических опытах путем наложения фистулы общего желчного протока или пузыря. В клинике для исследования желчевыделения используют дуоденальное зондирование, рентгенографию с введением в кровь рентгеноконтрастного вещества билитраста, ультразвуковые методы. Белковообразовательную функцию печени, ее вклад в жировой, углеводный, пигментный обмены изучают путем исследования различных показателей крови. Например определяют содержание общего белка, протромбина, антитромбина, билирубина, ферментов.
Наиболее тяжелыми заболеваниями являются гепатиты и цирроз печени. Чаще всего гепатиты являются следствием инфекции (инфекционные гепатиты А, В, С) и воздействия токсических продуктов (алкоголь). При гепатитах поражаются гепатоциты и нарушаются все функции печени. Цирроз это исход гепатитов. Самым частым нарушением желчевыделения является желчно-каменная болезнь. Основная масса желчных камней образована холестерином, так как желчь таких больных перенасыщена ими.
§
Гипотермия – состояние, при котором температура тела ниже 35 (снижается АД, ЧСС, обмен веществ)
В последующие годы искусственно создаваемая гипотермия (до 34-38) применяется в хирургии при операциях на сердце, печень, продолговатый мозг; в клинике для продления жизнеспособности организма или мозга человека при проведении реанимационных мероприятий
4. Метод определения осмотической резистентности эритроцитов.
В клинической и научной практике широко используются такие понятия как изотонические, гипотонические и гипертонические растворы. Изотонические растворы : 0,85% хлористого натрия («физиологический»), 1,1% хлористого калия, 1,3% раствор бикарбоната натрия, 5,5% глюкозы и т.д. Эритроциты, как известно, в изотоническом растворе не изменяют свой объем, в гипертоническом – уменьшают его, а в гипотоническом – увеличивают пропорционально степени гипотонии, вплоть до разрыва эритроцита (гемолиза). Явления осмотического гемолиза эритроцитов используется в клинической и научной практике с целью определения качественных характеристик эритроцитов (метод определения осмотической резистентности эритроцитов).
Различают минимальную и максимальную резистентность. Минимальная резистентность эритроцитов определяется максимальной концентрацией гипотонического (менее 0,85%) раствора хлорида натрия (в серии постепенно уменьшающихся концентраций), при которой начинается гемолиз наименее устойчивых эритроцитов, находящихся в растворе 3 ч. Максимальная резистентность эритроцитов определяется максимальной концентрацией гипотонического раствора хлорида натрия, вызывающего в течение 3 ч гемолиз всех эритроцитов.
Метод определения осмотической резистентности эритроцитов.
Ход работы. В штативе устанавливают 9 чистых сухих пробирок. Пипетку несколько раз промывают тем реактивом, который предстоит отмерить. Сначала вносят в пробирки 1% раствор хлорида натрия, затем дистиллированную воду, как указано в таблице. После этого перемешивают растворы, встряхивая пробирки.
| Номер пробирки | |||||||||
| Кол-во мл 1% р-ра хлорида натрия | |||||||||
| Количество мл воды | |||||||||
| Концентрация р-ра хлорида натрия, % | 0,9 | 0,8 | 0,7 | 0,6 | 0,5 | 0,4 | 0,3 | 0,2 | 0,1 |
В каждую пробирку вносят по капле цитратной крови. Перемешав кровь, оставляют пробирки на один час, затем смотрят результат. Если гемолиза не произошло, эритроциты осядут на дно пробирки, а над ними будет чистый раствор. Если произошел частичный гемолиз, излившийся гемоглобин придает раствору красный оттенок. При полном гемолизе жидкость в пробирке будет однородного красного цвета, а на дне ее не окажется эритроцитов. Отмечают, в какой пробирке гемолиз только начался (обычно при 0,5%), а в какой он произошел полностью (обычно при 0,4%).
Билет №43.
Температурный анализатор.
Температурная сенсорная система (температурный анализатор), как и любой анализатор состоит из трех звеньев: периферического, проводникового и центрального отделов.
Периферический отдел представлен терморецепторами двух видов: тепловыми и холодовыми. Ощущение холода более интенсивно, но кратковременно, чем ощущение тепла. Это связано с тем, что холодовые рецепторы располагаются в коже более поверхностно.
Проводниковый отдел: холодовые рецепторы передают импульсы по быстропроводящим миелиновым волокнам группы А; тепловые – по медленнопроводящим безмиелиновым волокнам группы С. Первая группа нейронов анализатора располагается в спинальном ганглии (термочувствительные нейроны, реагируют на изменение температуры крови, проходящей через мозг), вторая – в задних рогах спинного мозга (интернейроны, они получают информацию от периферических температурных рецепторов и терморецепторных нейронов. Эта группа нейронов служат для поддержания установочной точки, т.е. определенной температуры тела. Одна часть данных нейронов получает информацию от холодовых, другая от тепловых периферических рецепторов и терморецепторных нейронов), третья – в гипоталамусе (эфферентные, обеспечивают регуляцию механизмов теплообразования).
Центральный отдел температурного анализатора располагается в гипоталамусе.
2. эритроциты. Гемоглобин. Виды. Формы.
Эритроциты (Э)- это высокоспециализированные безъядерные клетки крови. Ядро у них утрачивается в процессе созревания. Эритроциты имеют форму двояковогнутого диска. В среднем их диаметр около 7,5 мкм, а толщина на периферии 2,5 мкм. Благодаря такой форме увеличивается поверхность эритроцитов для диффузии газов. Кроме того, это возрастает их пластичность. За счет высокой пластичности, они деформируются и легко проходят по капиллярам. У старых и патологических эритроцитов пластичность низкая. Поэтому они задерживаются в капиллярах ретикулярной ткани селезенки и разрушаются там. Мембрана эритроцитов и отсутствие ядра обеспечивают их главную функцию — перенос кислорода и участие в переносе углекислого газа. Мембрана эритроцитов непроницаема для катионов, кроме калия, а ее проницаемость для анионов хлора, гидрокарбонат анионов и гидроксил анионов в миллион раз больше. Кроме того она хорошо пропускает молекулы кислорода и углекислого газа. В мембране содержится до 52% белка. В частности, гликопротеины определяют групповую принадлежность крови и обеспечивают ее отрицательный заряд. В нее встроена Nа/К-АТФаза, удаляющая из цитоплазмы натрий и закачивающая ионы калия. Основную массу эритроцитов составляет хемопротеин гемоглобин. Кроме того в цитоплазме содержатся ферменты карбоангидраза, фосфатазы, холинэстераза и другие ферменты.
Функции эритроцитов:
1. Перенос кислорода от легких к тканям.
2. Участие в транспорте СО2 от тканей к легким.
3. Транспорт воды от тканей к легким, где она выделяется в виде пара.
4. Участвуют в свертывании крови, выделяя эритроцитарные факторы свертывания.
5. Переносят аминокислоты на своей поверхности.
6. Участвуют в регуляции вязкости крови, вследствие пластичности. В результате их способности к деформации, вязкость крови в мелких сосудах меньше, чем крупных.
В одном микролитре крови мужчин содержится 4,5-5,0 млн. эритроцитов (4,5-5,0 * 1012 л). Женщин — 3,9-4,7 млн. (3,9-4,7 * 1012 л).
Классификация отклонений от N эритроцитов:
1.По величине (анизоцитоз):
=Уменьшение диаметра эритроцитов, микроцитоз(< 6,5 мкм), наблюдается при железодефицитных и гемолитических анемиях.
=Увеличение диаметра эритроцитов, макроцитоз(>8 мкм), наблюдается при В12— и фолиеводефицитных анемиях (витаминодефицитные анемии), при гипопластических анемиях.
=мегалоциты (>12 мкм).
2. По форме (пойкилоцитоз — эритроциты имеют разную форму) может наблюдаться при железодефицитной анемии, некоторых гемоглобинопатиях (серповидно-клеточная анемия, талассемия) с заостренными краями — микросфероцитоз, овальной формы -овалоцитоз, при серповидно-клеточной анемии — трепаноциты, или серповидные эритроциты.
3. По интенсивности окраски – гипохромные, нормохромные, гиперхромные.
Изменение формы, размеров, окраски эритроцитов лежит в основе классификации анемий.
Гемоглобин- сложный белокв составе эритроцитов, состоящий из 2х частей: белка (глобин) и соединения железа (гема). Именно атомы железа (гема) делает кровькрасной.
Виды гемоглобина: HbС (мутантный вид гемоглобина), HBF (гемоглобин плода – фетальный), HbA (нормальный гемоглобин взрослого человека)
Соединения гемоглобина:
Физиологические – оксигемоглобин, карбогемоглобин, восстановленный гемоглобин.
Миоглобин – гемоглобин мышц.
Патологические – карбоксигемоглобин, метгемоглобин
- Гемоглобин А — (95-98%)
- Гемоглобин А2 — (2-3%)
- Гемоглобин F — (1-2%)
- Оксигемоглобин (HbO2)
- Восстановленный гемоглобин (HHb)
- Карбогемоглобин (HbCO2)
- Карбоксигемоглобин (HbCO)
- Метгемоглобин (Fe 3)
Соединение гемоглобина с кислородом, образующееся в капиллярах легких называется оксигемоглобином (HbO2). Он имеет ярко алый цвет. Гемоглобин, отдавший кислород в капиллярах тканей, называется дезоксигемоглобином или восстановленным (Hb). У него темно-вишневая окраску. От 10 до 30% углекислого газа, поступающего из тканей в кровь, соединяются с амидной группировкой гемоглобина. Образуется легко диссоциирующее соединение карбгемоглобин (HbCO2). В этом виде часть углекислого газа транспортируется к легким.
В некоторых случаях гемоглобин образует патологические соединения. При отравлении угарным газом образуется карбоксигемоглобин (HbCO). Сродство гемоглобина с окисью углерода значительно выше, чем с кислородом, а скорость диссоциации карбоксигемоглобина в 200 раз меньше, чем оксигемоглобина. Поэтому присутствие в воздухе даже 1% угарного газа приводит к прогрессирующему увеличению количества карбоксигемоглобина и опасному угарному отравлению. Кровь теряет способность переносить кислород. Развивается гипоксия мозга и других тканей. Угарное отравление сопровождается сильной головной болью, тошнотой, рвотой, судорогами, потерей сознания и смертью.
При отравлении сильными окислителями, например нитритами, марганцевокислым калием, красной кровяной солью, образуется метгемоглобин (MetHb). В этом соединении гемоглобина железо становится трехвалентным. Поэтому метгемоглобин очень слабо диссоциирующее соединение. Он не отдает кислород тканям.
В норме в крови мужчин содержится 132-164 г/л (13,2-16,4 г %) гемоглобина. У женщин — 115-145 г/л (11,5-14,5 г %). Количество гемоглобина снижается при кровопотерях, интоксикациях, нарушениях эритропоэза, недостатке железа, витамина В12 и т.д.
Цветовой показатель. Он отражает степень насыщения эритроцитов гемоглобином. Это отношение содержания гемоглобина в крови к количеству эритроцитов.
цветовой показатель = 0,3* Hb(г/л) / две первые цифры числа эритроцитов (в млн.). Пример: гемоглобин 130 г/л, Er 4,70 х10^12/л; ЦП = 0,3х130/47=0,83( норма)
В качестве нормы цветового показателя обычно принимается диапазон 0,85 — 1,05 или близкий к тому (зависит от конкретной лаборатории).
§
Электроэнцефалография (ЭЭГ)-это регистрация электрической активности мозга с поверхности кожи головы. Впервые ЭЭГ человека зарегистрировал в 1929 г. немецкий психиатр Г.Бергер. При снятии ЭЭГ на кожу накладывают электроды, сигналы от которых усиливаются и подаются на осциллограф и пишущее устройство.
В норме регистрируются следующие типы спонтанных колебаний:
1. a-ритм. Это волны с частотой 8-13 Гц. Наблюдается в состоянии бодрствования, полного покоя и при закрытых глазах. Если человек открывает глаза a-ритм сменяется b-ритмом. Это явление называется блокадой a-ритма.
2. b-ритм. Его частота от 14 до 30 Гц. Наблюдается при деятельном состоянии мозга и учащается по мере повышения интенсивности умственной работы.
3. q-ритм. Колебания с частотой 4-8 Гц. Регистрируется во время засыпания, поверхностного сна и неглубоком наркозе.
4. d-ритм. Частота 0,5-3,5 Гц. Наблюдается при глубоком сне и наркозе.
Чем ниже частота ритмов ЭЭГ, тем больше их амплитуда. Помимо этих основных ритмов регистрируются и другие ЭЭГ феномены. Например, по мере углубления сна появляются сонные веретена. Это периодическое увеличение частоты и амплитуды тета- ритма. При ожидании команды к действию возникает отрицательная Е -волна ожидания и т.д.
В эксперименте ЭЭГ используют для определения уровня активности мозга, а в клинике для диагностики эпилепсии (особенно скрытых форм), а также для выявление смерти мозга (кора живет 3-5 мин., стволовые нейроны 7-10, сердце 90, почки 150).
Сон — это долговременное функциональное состояние, характеризующееся значительным снижением нервно — психической и двигательной активности, которое необходимо для восстановления способности мозга к аналитико — синтетической деятельности.
Виды сна:
1.Физиологический суточный сон.
2.Сезонный сон у животных (земляная белка 9 мес.)
3.Гипнотический сон.
4.Наркотический сон.
5.Патологический сон.
Продолжительность суточного сна у новорождённых около 20 часов, у годовалых детей 13-15 часов, у взрослых 6-9 часов.
В течение физиологического сна периодически друг друга сменяют 2 его формы: быстрый или парадоксальный сон, медленный сон. Быстрый сон возникает 4-5 раз за ночь и длится 1/4 всего времени сна. Во время быстрого сна мозг находится в длительном состоянии: об этом свидетельствует a-ритм ЭЭГ, быстрые движения глазных яблок, подёргивание век, конечностей, учащаются пульс и дыхание и т.д. Если человека разбудить во время быстрого сна, он расскажет о сновидениях. При медленном сне этих явлений нет, а на ЭЭГ регистрируется дельта- ритм, свидетельствующий о тормозных процессах в мозге. Долгое время считалось, что во время медленного сна сновидений нет, сейчас установлено, что сновидения в этот период сна менее яркие, длительные и реальные. Возникновение ночных кошмаров также связано с медленным сном. Более того, обнаружено, что сомнабулизм или снохождение возникает именно во время медленного сна.
Значение сна:
1.Очищение ЦНС от метаболитов, накопившихся в процессе бодрствования.
2.Удаление накопившейся за день ненужной информации и подготовка к приёму новой.
3.Переход информации кратковременной памяти в долговременную. Он происходит во время медленного сна. Поэтому заучивание материала перед сном способствует запоминанию и лучшему воспроизведению запомненного. Особенно под улучшается запоминание логически несвязанного материала.
4.Эмоциональная перестройка. Во время быстрого сна происходит снижение возбудимости очагов мотивационного возбуждения, которые возникли в результате неудовлетворённой потребности. Во время сна неудовлетворённые потребности находят своё отражение в сновидениях (З. Фрейд. О сновидении). У больных с депрессивными состояниями наблюдаются необычайно яркие сновидения. Таким образом во сне происходит психологическая стабилизация и личность в определенной мере защищается от нерешённых конфликтов. Обнаружено, что люди мало спящие, у которых продолжительность быстрого сна относительно больше, лучше приспособлены к жизни и спокойно переживают психологические проблемы. Долго спящие обременены психологическими и социальными конфликтами.
Проба Штанге и Генчи
Необходимо для работы — Секундомер.
Испытуемый делает максимальный вдох и задерживает дыхание. По секундомеру отмечают время наступления непроизвольного вдоха. Затем делается максимальный выдох и задерживается дыхание. Определяют время наступления непроизвольного вдоха. Опыт повторяют после выполнения физической нагрузки (10-15 приседаний). Это проба Генчи.
Испытуемый делает гипервентиляцию легких, делает глубокий вдох и задерживает дыхание. По секундомеру отмечается время наступления непроизвольного выдоха. Эта проба характеризует устойчивость организма к недостатку кислорода (проба Штанге). Средним показателем является способность задержать дыхание на вдохе для нетренированных людей на 40-55 секунд, для тренированных — на 60-90 с и более. С нарастанием тренированности время задержки дыхания возрастает, при заболевании или переутомлении это время снижается до 30-35 секунд.
Сравнивают полученные результаты. Заполнить таблицу. Сделать вывод.
| Без нагрузки | С нагрузкой (20 приседаний) | ||
| На вдохе | На выдохе | На вдохе | На выдохе |
Билет № 44
§
В поддержании упорядоченности, согласованности всех физиологических и метаболических процессов в организме участвует более 100 гормонов и нейромедиаторов. Их химическая природа различна (белки, полипептиды, пептиды, аминокислоты и их производные, стероиды, производные жирных кислот, некоторые нуклеотиды, эфиры и т. д.). У каждого класса этих веществ пути образования и распада разные.
Белково-пептидные гормоны. В эту группу входят все тропные гормоны, либерины и статины, инсулин, глюкагон, кальцитонин, гастрин, секретин, холецистокинин, ангиотензин II, антидиуретический гормон (вазопрессин), паратиреоидный гормон и др.
Эти гормоны образуются из белковых предшественников, называемых прогормонами. Как правило, сначала синтезируется препрогормон, из которого образуется прогормон, а затем гормон.
Синтез прогормонов осуществляется на мембранах гранулярной эндоплазматической сети (шероховатый ретикулум) эндокринной клетки. Большое значение для этих процессов имеет способность препрогормонов проникать через мембрану эндоплазматической сети в ее внутренние полости за счет того, что первые 20—25 аминокислотных остатков с N-конца у многих белковых предшественников являются одинаковыми, а на наружной мембране эндоплазматической сети имеются структуры, «узнающие» эту последовательность. В результате становится возможным внедрение молекулы препрогормона в липидный бислой мембраны и постепенное проникновение белкового предшественника во внутреннее пространство эндоплазматической сети.
Везикулы с образующимся прогормоном переносятся затем в пластинчатый комплекс (комплекс Гольджи), где под действием мембранной протеиназы от молекулы прогормона отщепляется определенная часть аминокислотной цепи. В результате образуется гормон, который поступает в везикулы, содержащиеся в комплексе Гольджи. В дальнейшем эти везикулы сливаются с плазматической мембраной и высвобождаются во внеклеточное пространство.
Поскольку многие полипептидные гормоны образуются из общего белкового предшественника, изменение синтеза одного из этих гормонов может приводить к параллельному изменению (ускорению или замедлению) синтеза ряда других гормонов. Так, из белка проопиокортина образуются кортикотропин и β-липотропин, из β-липотропина может образоваться еще несколько гормонов: γ-липотропин, β-меланоцитостимулирующий гормон, β-эндорфин, γ-эндорфин, α-эндорфин, метионин-энкефалин.
При действии специфических протеиназ из кортикотропина могут образовываться α-меланоцитостимулирующий гормон и АКТГ-подобный пептид средней доли гипофиза. Благодаря сходству структур кортикотропина и α-меланоцитостимулирующего гормона последний имеет слабую кортикотропную активность. Кортикотропин обладает незначительной способностью усиливать пигментацию кожи.
Концентрация белково-пептидных гормонов в крови обычно составляет 10-9—10-10 М. При стимуляции эндокринной железы концентрация соответствующего гормона возрастает в 2—5 раз.
Период полураспада белково-пептидных гормонов в крови составляет 10—20 мин. Они разрушаются протеиназами клеток-мишеней, крови, печени и почек.
Стероидные гормоны. В эту группу входят тестостерон, эстрадиол, эстрон, прогестерон, кортизол, альдостерон и др. Эти гормоны образуются из холестерина в корковом веществе надпочечников (кортикостероиды), а также в семенниках и яичниках (половые стероиды). В малом количестве половые стероиды могут образовываться в корковом веществе надпочечников, а кортикостероиды — в половых железах. Свободный холестерин поступает в митохондрии, где превращается в прегненолон, который затем попадает в эндоплазматическую сеть и после этого — в цитоплазму.
В корковом веществе надпочечников синтез стероидных гормонов стимулируется кортикотропином, а в половых железах — лютеинизирующим гормоном (ЛГ). Эти гормоны ускоряют транспорт эфиров холестерина в эндокринные клетки и активируют митохондриальные ферменты, участвующие в образовании прегненолона. Кроме того, тропные гормоны активируют процессы окисления сахаров и жирных кислот в эндокринных клетках, что обеспечивает стероидогенез энергией и пластическим материалом.
Кортикостероиды. Подразделяют на две группы. Глюкокортикоиды (типичный представитель — кортизол) индуцируют синтез ферментов глюконеогенеза в печени, препятствуют поглощению глюкозы мышцами и жировыми клетками, а также способствуют высвобождению из мышц молочной кислоты и аминокислот, тем самым ускоряя глюконеогенез в печени.
Минералокортикоиды (типичный представитель — альдостерон) задерживают натрий в крови. Снижение концентрации натрия в выделяемой моче, а также секретах слюнных и потовых желез приводит к меньшим потерям воды, так как вода движется через биологические мембраны в направлении высокой концентрации солей.
Стимуляция синтеза глюкокортикоидов осуществляется через систему гипоталамус—гипофиз—надпочечники. Стресс (эмоциональное возбуждение, боль, холод и т. п.), тироксин, адреналин и инсулин стимулируют секрецию кортиколиберина из аксонов гипоталамуса. Этот гормон связывается с мембранными рецепторами аденогипофиза и вызывает секрецию кортикотропина, который с током крови попадает в надпочечники и стимулирует там образование глюкокортикоидов — гормонов, повышающих устойчивость организма к неблагоприятным воздействиям.
Кортикотропин влияет слабо на синтез минералокортикоидов. Имеется дополнительный механизм регуляции синтеза минералокортикоидов, осуществляющийся через так называемую ренин-ангиотензиновую систему. Рецепторы, реагирующие на давление крови, локализованы в артериолах почек. При снижении давления крови эти рецепторы стимулируют секрецию ренина почками. Ренин является специфической эндопептидной, отщепляющей от α2-глобулина крови С-концевой декапептид, который называют «ангиотензин I». От ангиотензина I карбоксипептидаза (ангиотензинпревращающий фермент, расположенный на наружной поверхности эндотелия кровеносных сосудов) отщепляет два аминокислотных остатка и образует октапептид ангиотензин II — гормон, к которому на мембране клеток коркового вещества надпочечников имеются специальные рецепторы. Связываясь с этими рецепторами, ангиотензин II стимулирует образование альдостерона, который действует на дистальные канальцы почек, потовые железы, слизистую оболочку кишечника и увеличивает в них реабсорбцию ионов Na , Сl- и НСОз-. В результате в крови повышается концентрация ионов Na и снижается концентрация ионов Сl- и К . Эти эффекты альдостерона полностью блокируются ингибиторами синтеза белка.
Половые стероиды. Андрогены (мужские половые гормоны) продуцируются интерстициальными клетками (гландулоцитами) семенников и в меньшем количестве яичниками и корковым веществом надпочечников. Основным андрогеном является тестостерон. Этот гормон может претерпевать изменения в клетке-мишени — превращаться в дигидротестостерон, который обладает большей активностью, чем тестостерон. Следует отметить, что ЛГ, который стимулирует начальные этапы биосинтеза стероидов в эндокринной железе, активирует также превращение тестостерона в дигидротестостерон в клетке-мишени, тем самым, усиливая андрогенные эффекты.
Эстрогены (женские половые гормоны) в организме человека в основном представлены эстрадиолом. В клетках-мишенях они не метаболизируются.
Действие андрогенов и эстрогенов направлено в основном на органы воспроизведения, проявление вторичных половых признаков, поведенческие реакции. Андрогенам свойственны также анаболические эффекты — усиление синтеза белка в мышцах, печени, почках. Эстрогены оказывают катаболическое влияние на скелетные мышцы, но стимулируют синтез белка в сердце и печени. Таким образом, основные эффекты половых гормонов опосредуются процессами индукции и репрессии синтеза белка.
Стероидные гормоны легко проникают через клеточную мембрану, поэтому их секреция происходит параллельно с синтезом. Содержание стероидов в крови определяется соотношением скоростей их синтеза и распада. Регуляция этого содержания осуществляется главным образом путем изменения скорости синтеза. Тропные гормоны (кортикотропин, ЛГ и ангиотензин) стимулируют этот синтез. Устранение тропного влияния приводит к торможению синтеза стероидных гормонов.
Действующие концентрации стероидных гормонов составляют 10-11—10-9 М. Период их полураспада равен 1/2—11/2 ч.
Тиреоидные гормоны. В эту группу входят тироксин и трийодтиронин. Синтез этих гормонов осуществляется в щитовидной железе, в которой ионы йода окисляются при участии пероксидазы до йодиниумиона, способного йодировать тиреоглобулин — тетрамерный белок, содержащий около 120 тирозинов. Йодирование тирозиновых остатков происходит при участии пероксида водорода и завершается образованием монойодтирозинов и дийодтирозинов. После этого происходит «сшивка» двух йодированных тирозинов. Эта окислительная реакция протекает с участием пероксидазы и завершается образованием в составе тиреоглобулина трийодтиронина и тироксина. Для того чтобы эти гормоны освободились из связи с белком, должен произойти протеолиз тиреоглобулина. При расщеплении одной молекулы этого белка образуется 2—5 молекул тироксина (Т4) и трийодтиронина (Тз), которые секретируются в молярных соотношениях, равных 4:1.
Синтез и секреция тиреоидных гормонов находятся под контролем гипоталамо-гипофизарной системы. Тиреотропин активирует аденилатциклазу щитовидной железы, ускоряет активный транспорт йода, а также стимулирует рост эпителиальных клеток щитовидной железы. Эти клетки формируют фолликул, в полости которого происходит йодирование тирозина.
Выделение Тз и Т4 осуществляется с помощью пиноцитоза. Частички коллоида окружаются мембраной эпителиальной клетки и поступают в цитоплазму в виде пиноцитозных пузырьков. При слиянии этих пузырьков с лизосомами эпителиальной клетки происходит расщепление тиреоглобулина, который составляет основную массу коллоида, что приводит к выделению Т3 и Т4. Тиреотропин и другие факторы, повышающие концентрацию цАМФ в щитовидной железе, стимулируют пиноцитоз коллоида, процесс образования и движения секреторных пузырьков. Таким образом, тиреотропин ускоряет не только биосинтез, но и секрецию Т3 и Т4. При повышении уровня Т3 и Т4 в крови подавляется секреция тиреолиберина и тиреотропина.
Тиреоидные гормоны могут циркулировать в крови в неизменном виде в течение нескольких дней. Такая устойчивость гормонов объясняется, по-видимому, образованием прочной связи с Т4-свя-зывающими глобулинами и преальбуминами в плазме крови. Эти белки имеют в 10—100 раз большее сродство к Т4, чем к T3, поэтому в крови человека содержится 300—500 мкг Т4 и лишь 6—12 мкг Т3.
Катехоламины. В эту группу входят адреналин, норадреналин и дофамин. Источником катехоламинов, как и тиреоидных гормонов, служит тирозин, однако при синтезе катехоламинов метаболизму подвергается свободная аминокислота. Синтез катехоламинов происходит в аксонах нервных клеток, запасание — в синаптических пузырьках. Катехоламины, образующиеся в мозговом веществе надпочечников, выделяются в кровь, а не в синаптическую щель, т. е. являются типичными гормонами.
В некоторых клетках синтез катехоламинов заканчивается образованием дофамина, а адреналин и норадреналин образуются в меньшем количестве. Такие клетки есть в составе гипоталамуса. Предполагают, что пролактостатином, т. е. гормоном гипоталамуса, подавляющим секрецию пролактина, является дофамин. Известны и другие структуры мозга (например, стриарная система), которые находятся под влиянием дофамина и нечувствительны, например, к адреналину.
В симпатических нервных волокнах дофамин не накапливается, а быстро превращается в норадреналин, который хранится в синаптических пузырьках. Адреналина в этих волокнах значительно меньше, чем норадреналина. В мозговом слое надпочечников биосинтез завершается образованием адреналина, поэтому норадреналина образуется в 4—6 раз меньше, а дофамина сохраняются лишь следы.
Синтез катехоламинов в мозговом веществе надпочечников стимулируется нервными импульсами, поступающими по чревному симпатическому нерву. Выделяющийся в синапсах ацетилхолин взаимодействует с холинергическими рецепторами никотинового типа и возбуждает нейросекреторную клетку надпочечника. Благодаря существованию нервно-рефлекторных связей надпочечники отвечают усилением синтеза и выделения катехоламинов в ответ на болевые и эмоциональные раздражители, гипоксию, мышечную нагрузку, охлаждение и т. д. Существуют и гуморальные пути регуляции активности клеток мозгового вещества надпочечников: синтез и выделение катехоламинов могут возрастать под действием инсулина, глюкокортикоидов, при гипогликемии.
Катехоламины подавляют как собственный синтез, так и выделение. В адренергических синапсах на пресинаптической мембране есть α-адренергические рецепторы. При выбросе катехоламинов в синапс эти рецепторы активируются и начинают оказывать ингибирующее влияние на секрецию катехоламинов. Аутоингибирование секреции обнаружено практически во всех тканях, секретирующих эти гормоны или нейромедиаторы.
В отличие от холинергических синапсов, постсинаптическая мембрана которых содержит как рецепторы, так и ацетилхолинэстеразу, разрушающую медиатор, удаление катехоламинов из синапса происходит в результате обратного захвата медиатора нервными окончаниями. Поступающие в нервное окончание из синапса катехоламины вновь концентрируются в специальных гранулах и могут повторно участвовать в синаптической передаче.
Определенное количество катехоламинов может диффундировать из синапсов в межклеточное пространство, а затем в кровь, поэтому содержание норадреналина в крови больше, чем адреналина, несмотря на то, что мозговое вещество надпочечников секретирует в кровь адреналин, а норадреналин секретируется преимущественно в синапсах. При стрессе содержание катехоламинов повышается в 4—8 раз. Период полураспада катехоламинов в крови равен 1—3 мин.
Катехоламины могут инактивироваться в тканях-мишенях, печени и почках. Решающее значение в этом процессе играют два фермента — моноаминоксидаза, расположенная на внутренней мембране митохондрий, и катехол-О-метилтрансфераза, цитозольный фермент.
Эйкозаноиды. В эту группу входят простагландины, тромбоксаны и лейкотриены. Эйкозаноиды называют гормоноподобными веществами, так как они могут оказывать только местное действие, сохраняясь в крови в течение нескольких секунд. Образуются во всех органах и тканях практически всеми типами клеток.
Биосинтез большинства эйкозаноидов начинается с отщепления арахидоновой кислоты от мембранного фосфолипида или диацил-глицерина в плазматической мембране. Синтетазный комплекс представляет собой полиферментную систему, функционирующую преимущественно на мембранах эндоплазматической сети. Образующиеся эйкозаноиды легко проникают через плазматическую мембрану клетки, а затем через межклеточное пространство переносятся на соседние клетки или выходят в кровь и лимфу. Скорость синтеза эйкозаноидов увеличивается под влиянием гормонов и нейромедиаторов, активирующих аденилатциклазу или повышающих концентрацию ионов Са2 в клетке. Наиболее интенсивно образование простагландинов происходит в семенниках и яичниках.
Простагландины могут активировать аденилатциклазу, тромбоксаны увеличивают активность фосфоинозитидного обмена, а лейкотриены повышают проницаемость мембран для ионов Са2 . Поскольку цАМФ и ионы Са2 стимулируют синтез эйкозаноидов, замыкается положительная обратная связь в синтезе этих специфических регуляторов.
Во многих тканях кортизол тормозит освобождение арахидоновой кислоты, что приводит к подавлению образования эйкозаноидов, и тем самым оказывает противовоспалительное действие. Простагландин E1 является мощным пирогеном. Подавлением синтеза этого простагландина объясняют терапевтическое действие аспирина.
Период полураспада эйкозаноидов составляет 1—20 с. Ферменты, инактивирующие их, имеются практически во всех тканях, но наибольшее их количество содержится в легких.
Гормоны, имеющие гидрофильную природу (катехоламины, серотонин, белково-пептидные и др.), синтезируются «впрок» и выделяются в кровь определенными порциями за счет опустошения секреторных везикул. Уровень этих гормонов в крови возрастает при увеличении частоты выброса гормона из клеток эндокринной железы. В отличие от этого стероидные и тиреоидине гормоны, а также эйкозаноиды не накапливаются в специальных структурах клетки, а благодаря своей липофильности свободно проходят через плазматическую мембрану эндокринной клетки и попадают в кровь. Содержание этих гормонов в крови регулируется ускорением или замедлением их синтеза.
Поступая в кровь, гормоны связываются с белками плазмы. Обычно лишь 5—10% молекул гормонов находится в крови в свободном состоянии, и только они могут взаимодействовать с рецепторами. К числу специфических гормонсвязывающих белков относятся транскортин, связывающий кортикостероиды, тестостерон-эстрогенсвязывающий глобулин, тироксинсвязывающий глобулин и т. д. Альдостерон, по-видимому, не имеет специфических «транспортных» белков, поэтому находится преимущественно в связи с альбумином.
Сравним механизмы выделения и переноса к клеткам-мишеням гормонов и нейромедиаторов. Нервное окончание подходит к одной клетке, и возбуждение передается только на эту клетку. Гормон активирует всю популяцию клеток, имеющих рецепторы этого гормона. Передача возбуждения с нерва на другую клетку осуществляется путем диффузии нейромедиатора к постсинаптической мембране, что завершается его связыванием с рецепторами иннервируемой клетки. Это самый медленный процесс в проведении нервного сигнала, однако, и он проходит очень быстро по сравнению с гормональной регуляцией, поскольку расстояние от места выделения до места рецепции нейромедиатора (ширина синаптической щели) составляет всего 20—30 нм. Гормон проходит путь от места выделения до места рецепции в миллион раз больший (десятки сантиметров). При этом выделившееся количество гормона разбавляется кровью и поэтому концентрация гормона составляет всего 10-11 — 10-1 М. Кроме того, гормональные рецепторы, которых в тканях содержится очень мало, чаще всего не сконцентрированы в определенном участке, а распределены в клетке равномерно. В отличие от этого концентрация нейромедиатора в синаптической щели достигает 10-4 —10-3 М, а рецепторы в постсинаптической мембране сконцентрированы на очень маленькой площади, причем точно напротив тех мест пресинаптической мембраны, из которых выбрасывается нейромедиатор. От момента секреции до связывания с рецептором у гормона проходят минуты или десятки минут, а у нейромедиатора — миллисекунды. Нейромедиаторы устраняются из постсинаптической щели или ферментами, сконцентрированными на постсинаптической мембране (ацетилхолин), или специальными механизмами «обратного захвата» нейромедиатора нервным окончанием (катехоламины). Этот процесс занимает несколько миллисекунд или секунд.
Гашение гормонального сигнала происходит медленно, так как гормоны растворены во всем объеме крови или лимфы и для понижения их концентрации необходимо «прогнать» большое количество крови через ткани-мишени, печень или почки, где происходит разрушение гормонов.
§
Лейкоциты или белые кровяные тельца — это клетки крови, содержащие ядро. У одних лейкоцитов цитоплазма содержит гранулы, поэтому их называют гранулоцитами. У других зернистость отсутствует, их относят к агранулоцитам. Выделяют три формы гранулоцитов. Те из них, гранулы которых окрашиваются кислыми красителями (эозином), называют эозинофилами. Лейкоциты, зернистость которых восприимчива к основным красителям, базофилами. Лейкоциты, гранулы которых окрашиваются и кислыми и основными красителями, относят к нейтрофилам. Агранулоциты подразделяются на моноциты и лимфоциты. Все гранулоциты и моноциты образуются в красном костном мозге и называются клетками миелоидного ряда. Лимфоциты также образуются из стволовых клеток костного мозга, но размножаются в лимфатических узлах, миндалинах, апендиксе, селезенке, тимусе, лимфатических бляшках кишечника. Это клетки лимфоидного ряда.
Общей функцией всех лейкоцитов является защита организма от бактериальных и вирусных инфекций, паразитарных инвазий, поддержание тканевого гомеостаза и участие в регенерации тканей.
Нейтрофилынаходятся в сосудистом русле 6-8 часов, а затем переходят в слизистые оболочки. Они составляют подавляющее большинство гранулоцитов. Основная функция нейтрофилов заключается в уничтожении бактерий и различных токсинов. Они обладают способностью к хемотаксису и фагоцитозу. Выделяемые нейтрофилами вазоактивные вещества, позволяют проникать им через стенку капилляров и мигрировать к очагу воспаления. Важным свойством нейтрофилов является то, что они могут существовать в воспаленных и отечных тканях бедных кислородом.
Базофилы (Б) содержатся в количестве 0-1%. Они находятся в кровеносном русле 12 часов. Крупные гранулы базофилов содержат гепарин и гистамин. За счет выделяемого ими гепарина ускоряется липолиз жиров в крови. Гистамин базофилов стимулирует фагоцитоз, оказывает противовоспалительное действие. В базофилах содержится фактор активирующий тромбоциты, который стимулирует их агрегацию и высвобождение тромбоцитарных факторов свертывания крови. Выделяя гепарин и гистамин, они предупреждают образование тромбов в мелких венах легких и печени. Количество базофилов резко возрастает при лейкозах, стрессовых ситуациях.
Эозинофилы (Э) содержатся в количестве 1-5%. Их содержание значительно изменяется в течение суток. Утром их меньше, вечером больше. Эти колебания объясняются изменениями концентрации глюкокортикоидов надпочечников в крови. Эозинофилы обладают способностью к фагоцитозу, связыванию белковых токсинов и антибактериальной активностью. Их гранулы содержат белок, нейтрализующий гепарин, а также медиаторы воспаления и ферменты, препятствующие агрегации тромбоцитов. Эозинофилы принимают участие в борьбе с паразитарными инвазиями. Они продвигаются к местам скопления в тканях тучных клеток и базофилов, которые образуются вокруг паразита. Там они фиксируются на поверхности паразита. Затем проникают в его ткань и выделяют ферменты, вызывающие его гибель. Поэтому при паразитарных заболеваниях возникает эозинофилия — повышение содержания эозинофилов. При аллергических состояниях и аутоиммунных заболеваниях, эозинофилы накапливаются в тканях, где происходит аллергическая реакция.
Моноциты наиболее крупные клетки крови. Их 2-10%. Способность к макрофагов, т.е. вышедших из кровяного русла моноцитов, к фагоцитозу больше, чем у других лейкоцитов. Они могут совершать амебоидные движения. При эволюции моноцита в макрофаг увеличивается его размер, количество лизосом и ферментов. Макрофаги вырабатывают больше 100 биологически активных веществ. Это эритропоэтин, образующиеся из арахидоновой кислоты простагландины и лейкотриены. Выделяемый ими интерлейкин-I, стимулирует пролиферацию лимфоцитов, остеобластов, фибробластов, эндотелиальных клеток. Макрофаги фагоцитируют и уничтожают микроорганизмы, простейших паразитов, старые и поврежденные, в том числе опухолевые клетки. Кроме того, макрофаги участвуют в формировании иммунного ответа, воспаления, стимулируют регенерацию тканей.
Лимфоцитысоставляют 20-40% всех лейкоцитов. Они делятся на Т- и В-лимфоциты. Первые дифференцируются в тимусе, вторые в различных лимфатических узлах. Т-клетки делятся на несколько групп. Т-киллеры уничтожают чужеродные белки-антигены и бактерии. Т-хелперы участвуют в реакции антиген-антитело. Т-клетки иммунологической памяти запоминают структуру антигена и распознают его. Т-амплификаторы стимулируют иммунные реакции, а Т-супрессоры тормозят образование иммуноглобулинов. В-лимфоциты составляют меньшую часть. Они вырабатывают иммуноглобулины и могут превращаться в клетки памяти.
Общее количество лейкоцитов 4000-9000 в мкл крови или 4-9*109 л.
В отличие от эритроцитов, численность лейкоцитов колеблется в зависимости от функционального состояния организма. Понижение содержания лейкоцитов называется лейкопенией, повышение — лейкоцитозом. Небольшой физиологический лейкоцитоз наблюдается при физической и умственной работе, а также после еды — пищеварительный лейкоцитоз. Чаще всего лейкоцитоз и лейкопения возникают при различных заболеваниях. Лейкоцитоз наблюдается при инфекционных, паразитарных и воспалительных заболеваниях, болезнях крови лейкозах. В последнем случае лейкоциты являются малодифференцированными и не могут выполнять свои функции. Лейкопения возникает при нарушениях кроветворения, вызванных действием ионизирующих излучений (лучевая болезнь), токсических веществ, например бензола, лекарственных средств (левомицетин), а также при тяжелом сепсисе. Больше всего уменьшается содержание нейтрофилов.
Процентное содержание различных форм лейкоцитов называется лейкоцитарной формулой. В норме их соотношение постоянно и изменяется при заболеваниях. Поэтому исследование лейкоцитарной формулы необходимо для диагностики.
Нормальная лейкоцитарная формула имеет следующий вид:
| лейкоцитов общ. мкл. | Гранулоциты | агранулоциты | ||||||
| базофилы | эозинофилы | Нейтрофилы | моноциты | лимфоциты | ||||
| Юные | палочко ядерные | Сегментоядерные | ||||||
| 4000-9000 | 0-1 | 1-5 | — | 1-5 | 47-72 | 2-10 | 20-40 | |
Острые инфекционные заболевания сопровождаются нейтрофильным лейкоцитозом, снижением количества лимфоцитов и эозинофилов. Если затем возникает моноцитоз, это свидетельствует о победе организма над инфекцией. При хронических инфекциях возникает лимфоцитоз.
Подсчет общего количества лейкоцитов производится в камере Горяева. Кровь набирают в меланжер для лейкоцитов и разводят ее в 10 раз 5% раствором уксусной кислоты, подкрашенной метиленовой синью или генцианвиолетом. В течение нескольких минут встряхивают меланжер. За это время уксусная кислота. разрушает эритроциты и оболочку лейкоцитов, а их ядра прокрашиваются красителем. Полученной смесью заполняют счетную камеру и под микроскопом считают лейкоциты в 25 больших квадратах. Общее количество лейкоцитов рассчитывают по формуле:
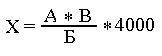
где а — число сосчитанных в квадратах лейкоцитов
б — число малых квадратов, в которых производился подсчет (400)
в — разведение крови (10)
4000 — величина обратная объему жидкости над малым квадратом
Для исследования лейкоцитарной формулы мазок крови на предметном стекле высушивают и красят смесью из кислого и основного красителей. Например по Романовскому-Гимзе. Затем под большим увеличением считают количество различных форм минимум из 100 сосчитанных.
3. Базилярный или сосудистый тонус, роль в организме. Методы определения.
Тонус сосудов во многом определяет параметры системной гемодинамики и регулируется миогенными, гуморальными и нейрогенными механизмами.
В основе миогенного механизма лежит способность гладких мышц сосудистой стенки возбуждаться и сокращаться при растяжении. Именно автоматия гладких мышц создает базальный тонус многих сосудов, т.е. поддерживает начальный уровень давления в сосудистой системе. В сосудах кожи, мышц, внутренних органов миогенная регуляция тонуса играет относительно небольшую роль. Но в почечных, мозговых и коронарных сосудах она является ведущей и поддерживает нормальный кровоток в широком диапазоне артериального давления.
Гуморальная регуляция осуществляется физиологически активными веществами, находящимися в крови или тканевой жидкости. Их можно разделить на следующие группы:
1. Метаболические факторы. Это несколько групп веществ.
а) Неорганические ионы. Ионы калия вызывают расширение сосудов, ионы кальция суживают их.
б) Неспецифические продукты метаболизма. Молочная кислота и другие кислоты цикла Кребса расширяют сосуды. в) Осмотическое давление тканевой жидкости. При его повышении сосуды расширяются.
2. Гормоны.
Нервная регуляция сосудистого тонуса осуществляется сосудосуживающими и сосудорасширяющими нервами. Сосудосуживающими являются симпатические нервы. Центры симпатических вазоконстрикторов находятся под контролем вышележащих, находящихся в состоянии постоянного тонуса. Поэтому по симпатическим нервам непрерывно поступают нервные импульсы к сосудам. За счет этого иннервируемые ими сосуды постоянно умеренно сужены.
Ортостатическая проба.
Ортостатическая проба служит для характеристики функциональной полноценности рефлекторных механизмов регуляции гемодинамики. У обследуемого после 5-минутного пребывания в положении лежа дважды подсчитывают ЧСС и измеряют артериальное давление. Затем по команде, обследуемый спокойно занимает положение стоя. Пульс подсчитывается на 1й и на 3й минутах пребывания в вертикальном положении, АД определяется на 3й и на 5й минутах. Оценка пробы осуществляется по трехбалльной системе.
Билет 45
1. эндокринная функция поджелудочной железы.
Относится к железам со смешанной секрецией. Эндокринной частью поджелудочной железы являются островки Лангерганса, расположенные преимущественно в хвостовой части железы. Бета-клетки островков Лангерганса образуют гормон инсулин, альфа-клетки синтезируют глюкагон.
Инсулин принимает участие в регуляции углеводного обмена. Под действием гормона происходит уменьшение концентрации сахара в крови – возникает гипогликемия. Образование инсулина регулируется уровнем глюкозы в крови. Гипергликемия приводит к увеличению поступления инсулина в кровь. Гипогликемия уменьшает образование и поступление гормона в сосудистое русло.
Недостаточность внутрисекреторной функции поджелудочной железы приводит к развитию сахарного диабета, основными проявлениями которого являются: гипергликемия, глюкозурия (сахар в моче), полиурия (увеличенное выделение мочи), полифагия (повышенный аппетит), полидипсия (повышенная жажда).
Глюкагон участвует в регуляции углеводного обмена. По характеру своего действия на обмен углеводов он является антагонистом инсулина. Под влиянием глюкагона происходит расщепление гликогена в печени до глюкозы. В результате этого концентрация глюкозы в крови повышается. Кроме того, глюкагон стимулирует расщепление жира в жировой ткани.
Регуляция секреции глюкагона. На образование глюкагона в альфа-клетках островков Лангерганса оказывает влияние количество глюкозы в крови. При повышенном содержании глюкозы в крови происходит торможение секреции глюкагона, при пониженном — увеличение. На образование глюкагона оказывает влияние и гормон передней доли гипофиза — соматотропин, он повышает активность альфа-клеток,
стимулируя образование глюкагона
§
Поддержание гомеостатических констант:
1. Поддержание кислотно-основного равновесия
2. Поддержание температурного гомеостаза
3. Участие в поддержании водно-солевого гомеостаза
4. ОЦК (объем циркулирующей крови)
5. Гуморальная и эндокринная регуляция
рН артериальной крови = 7,43,
рН венозной крови – 7,35.
Объем крови у человека 4,6 л или 6-8% от массы тела.
Физиологические основы гипнотических состояний.
Физиологические критерии гипноза .
Ученые до сих пор не смогли прийти к согласию относительно физиологических критериев состояния транса. Физиологические критерии, использовавшиеся до настоящего времени, свидетельствуют о состоянии релаксации (Godin, 1957). Электроэнцефалографические исследования недостаточно убедительны. Больше обнадеживают исследования дифференцированной деятельности мозговых полушарий (Watzlawick, 1978/1980). Возможно изучение вызванных потенциалов (Comas, 1.991). Зато предметом более углубленного изучения следовало бы сделать наблюдения клиницистов: действительно, врачи, пользующиеся гипнозом для обезболивания, свидетельствуют, что кровотечение при этом бывает менее обильным и заживление происходит быстрее (Quelet). Очень серьезные исследования проводятся в настоящее время во Франции в рамках C.N.R.S. 1991, стр. 16). Эсдайль отмечал, что в послеоперационный период было меньше инфекционных осложнений, если использовался гипноз, и это без специального внушения (Esdaile, 1850). Мы также знаем, что меняются процессы обусловливания (Rojnov, 1965).
2. Возможные физиологические изменения при гипнозе Возможность появления физиологических изменений «по команде», по-видимому, значительно увеличивается при гипнотическом функционировании. В нашу задачу не входит развивать здесь эту тему, которой в исследованиях по гипнозу уделяется достаточное внимание (Edmonston, 1979; Chertok, 1979). В качестве документального свидетельства достаточно упомянуть фликтену, полученную в результате внушения (Chertok, 1979). Терапевтическая параллель этого — лечение ожогов и кровотечений (Swirsky-Sacchetti et Margolis, 1986).
Резюмируя сказанное, можно сделать вывод, что гипноз позволяет развивать воздействие психики на тело. Этим объясняется возрождение интереса врачей к данной практике.
Определение резус-фактора.
Система резус (Rh-hr) была открыта в 1941 г. К. Ландштейнером и А. Винером при иммунизации кроликов кровью обезьяны макака-резус.
Антигены системы резус (Rh) — липопротеиды, известно шесть разновидностей антигенов этой системы, и наиболее важными из них являются: Rho (D), rh’ (С) и rh» (Е), самый сильный из которых — Rho (D). Он имеется в эритроцитах 85 % людей (резус-положительная кровь, Rh ). У остальных 15 % людей антиген Rho (D) отсутствует (резус-отрицательная кровь, Rh-). Однако у лиц, являющихся донорами, резус-принадлежность оценивают по трем антигенам: Rho (D), rh’ (С) и rh» (Е) — при наличии хотя бы одного из них кровь считается (Rh ).
Антирезус-агглютинины могут сформироваться только при попадании резус-отрицательному человеку резус-положительной крови (переливание крови, беременность). В этом случае при повторном переливании резус-отрицательному человеку (реципиенту) резус-положительной крови может произойти агглютинация, так как у реципиента уже выработаются иммунные антирезус-антитела.
Беременность и Rh-фактор. Если мать резус-отрицательна, а отец резус-положителен, то плод может быть резус-положительным. В конце беременности, особенно при нарушении гемато- плацентарного барьера, небольшое количество крови плода (0,1—0,2 мл) может проникать в кровь матери. В ответ в ее организме начинают вырабатываться антирезус-агглютинины. Первая беременность проходит сравнительно спокойно. При повторной беременности титр антирезус-антител у матери нарастает, они проникают в кровь плода (их размеры малы) и происходит агглютинация и гемолиз эритроцитов плода (гемолитическая желтуха) — в тяжелых случаях с летальным исходом. Резус-положительная кровь плода может попасть в кровь резус- отрицательной матери и во время родов. В этом случае опасность возникает для второй беременности, так как у женщины в крови заранее будут Rh-антитела.
Имеются и другие антигенные системы, наибольшее значение из которых имеют Келл-Челлано, Даффи и Кидд. Все они, как и Rh-hr, не имеют врожденных антител, но могут появиться иммунные антитела.
Билет№46
1 вопрос. Глотание
Глотание сложнорефлекторный акт, который начинается произвольно. Сформированный пищевой комок перемещается на спинку языка, языком прижимается к твердому небу и передвигается на корень языка. Здесь он раздражает механорецепторы корня языка и небных дужек. От них по афферентным нервам импульсы идут к центру глотания продолговатого мозга. От него, по эфферентным волокнам подъязычного, тройничного, языкоглоточного и блуждающего нерва, они поступают к мышцам полости рта, глотки, гортани, пищевода. Мягкое небо рефлекторно поднимается и закрывает вход в носоглотку. Одновременно гортань поднимается, а надгортанник опускается, закрывая вход в гортань. Пищевой комок проталкивается в расширившуюся глотку. Этим заканчивается ротоглоточная фаза глотания. Затем подтягивается пищевод и его верхний сфинктер расслабляется. Начинается пищеводная фаза. По пищеводу пищевой комок продвигается за счет его перистальтики. Циркулярные мышцы пищевода сокращаются выше пищевого комка и расслабляются ниже него. Волна сокращения-расслабления распространяется к желудку. Этот процесс называется первичной перистальтикой. При подходе пищевого комка к желудку расслабляется нижний пищеводный или кардиальный сфинктер, пропуская комок в желудок. Вне глотания он закрыт и служит для предотвращения заброса в пищевод желудочного содержимого. Если пищевой комок застревает в пищеводе, то от места его расположения начинается вторичная перистальтика, по механизмам идентичная первичной. Твердая пища продвигается по пищеводу 8-9 сек. Жидкая стекает пассивно, без перистальтики, за 1-2 сек. Расстройства глотания называют дисфагиями. Они возникают при нарушениях в центре глотания (водобоязнь), иннервации пищевода или спазмах мышц. Снижение тонуса кардиального сфинктера приводит к рефлюксу, т.е. забросу желудочного содержимого в пищевод (изжога). Если его тонус наоборот повышен пища, скапливается в пищеводе. Это явление называется ахалазией.
§
2 вопрос. Сердце, камеры, кардиоцикл.
Сердце разделено перегородками на 4 камеры: 2 предсердия и 2 желудочка. Предсердия соединяются с желудочками посредством атриовентрикулярных отверстий. В них находятся створчатые атриовентрикулярные клапаны. Правый клапан трехстворчатый (трикуспидальный), а левый двухстворчатый (митральный). К створкам клапанов присоединяются сухожильные нити. Другим концом эти нити соединены сосочковыми (папиллярными) мышцами. В начале систолы желудочков эти мышцы сокращаются и нити натягиваются. Благодаря этому не происходит выворота створок клапанов в полость предсердий и обратного движения крови — регургитации. В местах выхода аорты и легочной артерии из желудочков расположены аортальный и пульмональный клапаны. Они имеют вид карманов в форме полумесяцев. Поэтому их называют полулунными. Функцией клапанного аппарата сердца является обеспечение одностороннего тока крови по кругам кровообращения. В клинике функция клапанного аппарата исследуется такими косвенными методами, как аускультация, фонокардиография, рентгенография. Эхокардиография позволяет визуально наблюдать за деятельностью клапанов.
Цикл работы сердца. Давление в полостях сердца
в различные фазы сердечной деятельности
Сокращение камер сердца называется систолой, расслабление — диастолой. В норме частота сердечных сокращений 60-80 в минуту. Цикл работы сердца начинается с систолы предсердий. Однако в физиологии сердца и клинике для его описания используется классическая схема Уиггерса. Она делит цикл сердечной деятельности на периоды и фазы. Общая продолжительность цикла, при частоте 75 ударов в мин., составляет 0,8 сек. Длительность систолы желудочков равна 0,33 сек. Она включает 2 периода: период напряжения, продолжительностью 0,08 сек. и период изгнания — 0,25 сек. Период напряжения делится на две фазы: фазу асинхронного сокращения, длительностью 0,05 сек и фазу изометрического сокращения 0,03 сек. В фазе асинхронного сокращения происходит неодновременное т.е. асинхронное сокращение волокон миокарда межжелудочковой перегородки. Затем сокращение синхронизируется и охватывает весь миокард. Давление в желудочках нарастает и атриовентрикулярные клапаны закрываются. Однако его величина недостаточна для открывания полулунных клапанов. Начинается фаза изометрического сокращения. Т.е. во время нее мышечные волокна не укорачиваются, но сила их сокращений и давление в полостях желудочков нарастает. Когда оно достигает 120-130 мм.рт.ст. в левом и 25-30 мм.рт.ст. в правом, открываются полулунные клапаны — аортальный и пульмональный. Начинается период изгнания. Он длится 0,25 сек. и включает фазу быстрого и медленного изгнания. Фаза быстрого изгнания продолжается 0,12 сек., медленного — 0,13 сек. Во время фазы быстрого изгнания давление в желудочках значительно выше, чем в соответствующих сосудах, поэтому кровь из них выходит быстро. Но так как давление в сосудах нарастает, выход крови замедляется. После того, как кровь из желудочков изгоняется, начинается диастола желудочков. Ее продолжительность 0,47 сек. Она включает протодиастолический период, период изометрического расслабления, период наполнения и пресистолический период. Длительность протодиастолического периода 0,04 сек. Во время него начинается расслабление миокарда желудочков. Давление в них становится ниже, чем в аорте и легочной артерии, поэтому полулунные клапаны закрываются. После этого начинается период изометрического расслабления. Его продолжительность 0,08 сек. В этот период все клапаны закрыты и расслабление происходит без изменения длины волокон миокарда. Давление в желудочках продолжает снижаться. Когда оно уменьшается до 0, т.е. становится ниже, чем в предсердиях, открываются атриовентрикулярные клапаны. Начинается период наполнения, длительностью 0,25 сек. Он включает фазу быстрого наполнения, продолжительность которой 0,08 сек., и фазу медленного наполнения — 0,17 сек. После того, как желудочки пассивно заполнились кровью, начинается пресистолический период, во время которого происходит систола предсердий. Его длительность 0,1 сек. В этот период в желудочки закачивается дополнительное количество крови. Давление в предсердиях, в период их систолы, составляет в левом 8-15 мм. рт.ст., а правом 3-8 мм.рт.ст.
Отрезок времени от начала протодиастолического периода и до пресистолического, т.е. систолы предсердий, называется общей паузой. Ее продолжительность 0,4 сек. В момент общей паузы полулунные клапаны закрыты, а атриовентрикулярные открываются. Первоначально предсердия, а затем желудочки заполняются кровью. Во время общей паузы происходит пополнение энергетических запасов кардиомиоцитов, выведение из них продуктов обмена, ионов кальция и натрия, насыщение кислородом. Чем короче общая пауза, тем хуже условия работы сердца.
§
Функции крови при старении.
С возрастом снижается количество ядросодержащих клеток в костном мозге и в нем увеличивается объем, занимаемый жировыми клетками. Так, у людей, в возрасте до 65 лет около половины костного мозга занято жировой тканью, а позднее уже 2/3 его замещаются жиром. Вероятно, эти потери гемопоэтических клеток усиливают остеопороз.
При старении более всего выражены количественные изменения в показателях эритрона. Так, если у 20-летних мужчин среднее содержание эритроцитов в крови составляет 5,3 • 1012/л, то у 60-летних меньше — 5,051012/л; содержание гемоглобина у мужчин и женщин моложе 60 лет составляет соответственно 156 и 135 г/л, а у 96 и 106-летних — 124 г/л.
Снижение кислородной емкости крови ставят в причинную связь с возрастным снижением основного обмена, с часто обнаруживаемым у пожилых дефицитом железа, фолиевой кислоты и витамина В12. Так, почти у 30% пожилых людей в сыворотке крови снижено содержание витамина В12. Это объясняется уменьшением всасывания его в связи с атрофическим гастритом, выявляемым у 81% лиц старше 60 лет.
С возрастом увеличивается средний объем эритроцита. Например, у 20-летних мужчин он равен 89 мкм у 60-летних — 93 мкм3. К причинам, вызывающим увеличение среднего объема эритроцита у пожилых лиц, относят усиление перекисного окисления в мембранах клетки, курение и употребление алкоголя, воздействующие на цитоскелет эритроцитов.
Обмен железа плазмы за сутки несколько выше у лиц от 61 до 80 лет, чем у 19-50-летних, соответственно 125 47 мкмоль/л крови и 112 27 мкмоль/л. При этом, у пожилых людей, по сравнению с молодыми, увеличено использование железа неэритроидной тканью.
У лиц пожилого возраста проявляются выраженные сдвиги в структуре и регуляторных механизмах гемостаза. После 40 лет происходит сдвиг баланса гемостаза в сторону увеличения прокоагулянтной активности крови и увеличение интенсивности внутрисосудистого тромбообразования. Об этом свидетельствует повышение концентрации продуктов распада фибрина, фибриногена, активности фактора XIII, повышение толерантности плазмы к гепарину. В ответ на эту перестройку в системе прокоагулянтного гемостаза активируется антикоагулянтное звено — фибринолиз. Однако, нарастание фибринолитической активности крови отстает от роста ее прокоагулянтной активности. В результате, коагулянтные свойства крови при старении повышаются. Этому способствует также более выраженное у пожилых, по сравнению с молодыми, повышение активности прокоагулянтного звена в ответ на активацию симпатоадреналовой системы при стрессе (действие катехоламинов) на фоне мало меняющейся фибринолитической активности. С другой стороны, с возрастом в эндотелии артерий постепенно снижается выработка активаторов плазминогена, уменьшается продукция простагландинов, что снижает антиагрегационную активность сосудистой стенки и создает предрасположение к внутрисосудистому образованию тромба. Развивающаяся у пожилых гиперхолестеринемия, рост концентрации тромбоглобулина также повышают чувствительность тромбоцитов к агрегантам (веществам, стимулирующим агрегацию тромбоцитов).
Сказанное делает понятным резкое увеличение с возрастом риска тромбозов и эмболии.
4 вопрос. СУХОЖИЛЬНЫЕ РЕФЛЕКСЫ У ЧЕЛОВЕКА.
Для работы необходимо: неврологический молоточек.
1. Для определения коленного рефлекса испытуемому предлагают сесть на стул и положить ногу на ногу. Наносят легкий удар неврологическим молоточком по сухожилию четырехглавой мышцы. Сравнивают рефлексы на правой и левой ноге.
2. При определении локтевого рефлекса полусогнута и расслабленная рука испытуемого находится на ладони экспериментатора. Большой палец руки экспериментатора ложится на сухожилие двуглавой мышцы испытуемого. Удар молоточком наносится по большому пальцу испытуемого. Отметить, сгибается ли предплечье.
3. Определение ахиллова рефлекса производится у испытуемого стоящего коленями на стуле. Ступни ног свободно свисают. Неврологическим молоточком наносится легкий удар по ахиллову сухожилию. Отмечают, сгибается ли стопа.
4.При определении рефлекса с трехглавой мышцы плеча экспериментатор становится сбоку от испытуемого, отводит пассивно его плечо кнаружи до горизонтального уровня и поддерживает его левой рукой у локтевого сгиба так, чтобы предплечье свисало под прямым углом. Удар неврологическим молоточком наносится у самого локтевого сгибы. Отметить, разгибается ли предплечье.
Билет№47
1 вопрос. Физиологические основы питания. Режимы питания
В зависимости от возраста, пола и профессии, потребление белков, жиров и углеводов должно составлять:
| М I-IV групп | Ж I-IV групп | |
| Белки | 96-108 г | 82-92 г |
| Жиры | 90-120 г | 77-102 г |
| Углеводы | 382-552 г | 303-444 г |
В прошлом веке Рубнер сформулировал закон изодинамии, согласно которому пищевые вещества могут взаимозаменяться по своей энергетической ценности. Однако он имеет относительное значение, так как белки, выполняющие пластическую роль, не могут синтезироваться из других веществ. Это же касается незаменимых жирных кислот. Поэтому требуется питание сбалансированное по всем веществам. Кроме того необходимо учитывать усвояемость пищи. Это соотношение всосавшихся и выделившихся с калом питательных веществ. Наиболее легко усваиваются животные продукты. Поэтому животный белок должен составлять не менее 50% суточного белкового рациона, но жиры не более 70% жирового.
Под режимом питания подразумевается кратность приемов пищи и распределение ее калорийности на каждый прием. При трехразовом питании на завтрак должно приходится 30% калорийности суточного рациона, обед 50%, ужин 20%. Интервал между завтраком и обедом не должен превышать 5 часов. Ужин должен быть не менее чем за 3 часа до сна. Часы приема пищи должны быть постоянными.
§
Приспособление сердечной деятельности к изменяющимся потребностям организма осуществляется с помощью механизмов миогенной, нервной и гуморальной регуляции. Механизмами миогенной регуляции являются гетерометрический и гомеометрический. Гетерометрический механизм заключается в увеличении силы сердечных сокращений по мере растяжения сердечной мышцы. Первым эту зависимость обнаружил Старлинг, который сформулировал закон сердца: чем больше мышца сердца растягивается в диастолу, тем сильнее ее сокращение в период систолы. Следовательно, чем больше крови поступает в камеры сердца в диастолу, тем сильнее сокращение мышцы и количество выбрасываемой крови в систолу. Однако закон Старлинга соблюдается лишь при умеренном растяжении сердечной мышцы. При ее перерастяжении сила сокращений, а следовательно систолический объем крови падают. В состоянии покоя систолический объем крови, т.е. ее количество выбрасываемое из желудочков, составляет 60-70 мл. Но это лишь половина крови находящейся в желудочках. Остающаяся кровь называется резервным объемом. При физической нагрузке увеличивается венозный приток к сердцу, сила его сокращений. Поэтому систолический объем возрастает до 120-150 мл. Гетерометрический механизм наиболее чувствителен и включается раньше других. Увеличение силы сокращений сердца наблюдается при увеличении объема циркулирующей крови всего на 1%. Рефлекторные механизмы активируются лишь при возрастании ОЦК на 5-10%. Гомеометрические механизмы не связаны с растяжением миокарда. Наиболее важным из них является эффект Анрепа. Он состоит в том, что при увеличении давления в аорте систолический объем первоначально снижается. Затем сила сокращений и систолический выброс растут. Миогенные механизмы регуляции обеспечивают приспособление кровообращения к относительно кратковременным нагрузкам. При длительном повышении нагрузки возникает рабочая гипертрофия миокарда: увеличиваются длина и диаметр мышечных волокон. Например у спортсменов вес сердца может возрастать 1,5-2 раза. При постоянной перегрузке одного отдела сердца также возникает его гипертрофия. Например гипертрофия левого желудочка развивается при гипертонической болезни.
Нервная регуляция сердечной деятельности осуществляется симпатическим и парасимпатическим отделами вегетативной нервной системы. Ядра блуждающего нерва, иннервирующего сердце, расположены в продолговатом мозге. Блуждающие нервы заканчиваются на интрамуральных ганглиях. Постганглионарные волокна правого вагуса идут к синоатриальному узлу, а левого к атриовентрикулярному. Кроме того они иннервируют миокард соответствующих предсердий. Парасимпатических окончаний в миокарде желудочков нет. Благодаря такой иннервации, правый вагус влияет преимущественно на частоту сердцебиений, а левый на скорость проведения возбуждения в атриовентрикулярном узле.
Тела симпатических нейронов, иннервирующих сердце, расположены в боковых рогах 5-ти верхних грудных сегментов спинного мозга. Аксоны этих нейронов идут к звездчатому ганглию. От него отходят постганглионарные волокна, многочисленные ветви которых иннервируют и предсердия и желудочки. В сердце имеется развитая внутрисердечная нервная система, включающая афферентные, эфферентные, вставочные нейроны и нервные сплетения. Ее считают отделом метасимпатической нервной системы. Она начинает участвовать в регуляции сердечной деятельности лишь после потери экстрамуральной иннервации. Например после пересадки сердца.
Блуждающие нервы оказывают следующие воздействия на сердце:
1. Отрицательный хронотропный эффект. Это уменьшение частоты сердечных сокращений. Он связан с тем, что правый вагус тормозит генерацию импульсов в синоатриальном узле. Под действием вагуса их генерация может временно прекращаться.
2. Отрицательный инотропный эффект. Снижение силы сердечных сокращений. Обусловлен уменьшением амплитуды и длительности ПД, генерируемых клетками пейсмекерами.
3. Отрицательный дромотропный эффект. Понижение скорости проведения возбуждения по проводящей системе сердца. Связан с воздействием левого вагуса на атриовентрикулярный узел. При достаточно сильном его возбуждении возможно возникновение временной атриовентрикулярной блокады.
4. Отрицательный батмотропный эффект. Это уменьшение возбудимости сердечной мышцы. Под влиянием вагуса удлиняется рефрактерная фаза.
Эти воздействия вагусов на сердце обусловлены тем, что их окончания выделяют ацетилхолин. Он связывается с М-холинорецепторами кардиомиоцитов и вызывает гиперполяризацию их мембраны. Поэтому уменьшаются возбудимость, проводимость, автоматия кардиомиоцитов, а как следствие сила сокращений.
Если длительно раздражать блуждающие нервы, остановившееся первоначально сердце начинает вновь сокращаться. Это явление называется ускользанием сердца из под влияния вагуса. Оно является следствием параллельного усиления влияния симпатических нервов. Центры блуждающих нервов находятся в состоянии тонуса. Поэтому импульсы от них постоянно идут к сердцу. В результате имеет место функциональное торможение сердечных сокращений. При перерезке вагусов в эксперименте или введении атропина, блокирующего передачу в холинергических синапсах, частота сердцебиений возрастает в 1,5-2 раза. Тонус центров вагуса обусловлен постоянным поступлением нервных импульсов к ним от рецепторов сосудистых рефлексогенных зон, внутренних органов, сердца.
Симпатические нервы противоположным образом воздействуют на сердечную деятельность. Они оказывают положительное хронотропное, инотропное, батмотропное и дромотропное влияния. Медиатор симпатических нервов норадреналин взаимодействует с 1-адренорецепторами мембраны кардиомиоцитов. Происходит ее деполяризация, а в результате ускоряется медленная диастолическая деполяризация в Р-клетках синоатриального узла, увеличиваются амплитуда и длительность генерируемых ПД, возрастает возбудимость клеток проводящей системы. Вследствие этого повышаются возбудимость, автоматия, проводимость и сила сокращений сердечной мышцы. Тонус симпатических центров регуляции сердечной деятельности выражен значительно слабее, чем парасимпатических.
§
Сердце снабжается кровью через коронарные артерии, отходящие от аорты. Они разветвляются на эпикардиальные артерии, от которых отходят интрамуральные снабжающие кровью миокард. В сердце имеется небольшое количество межартериальных анастомозов, артериовенозные шунты отсутствуют. Миокард пронизывает большое количество капилляров, но прекапиллярных сфинктеров в них нет. Отношение количества мышечных волокон и капилляров составляет 1:1. Они идут вдоль мышечных волокон. Имеется сеть сосудов (Вьессения-Тебезия), по строению напоминающих капилляры. Однако их функция неизвестна. Коронарные сосуды иннервируются симпатическими и парасимпатическими нервами, но первых больше. В состоянии покоя у человека через коронарные сосуды проходит 4-5% всего минутного объема крови или 200-250 мл/мин. При интенсивной физической работе коронарный кровоток возрастает в 5-7 раз. В период систолы коронарные сосуды частично сжимаются и кровоток в них снижается. Во время диастолы он восстанавливается. Несмотря на снижение коронарного кровотока в систолу, необходимый уровень метаболизма миокарда поддерживается за счет высокой объемной скорости кровотока в коронарных артериях, их большой растяжимости, усиления венозного оттока, наличия густой капиллярной сети и высокой скорости транскапиллярного обмена. Регуляция коронарного кровотока осуществляется миогенными, гуморальными и нервными механизмами. Первый обусловлен автоматией гладких мышц сосудов и обеспечивает поддержание постоянства коронарного кровотока при колебаниях артериального давления от 75 до 140 мм.рт.ст. Важнейшим является гуморальный механизм. Наиболее мощным стимулятором расширения коронарных сосудов является недостаток кислорода. Дилатация сосудов наступает при снижении содержания кислорода в крови всего на 5%. Предполагают, что в условиях гипоксии миокарда не происходит полного ресинтеза АТФ, что приводит к накоплению аденозина. Он тормозит сокращения ГМК сосудов. Расширяют сердечные сосуды гистамин, ацетилхолин, простагландины Е. Симпатические нервы обладают слабым сосудосуживающим влиянием. Слабое вазодилататорное действие оказывают парасимпатические нервы. Ишемия миокарда приводит к тяжелым нарушениям деятельности сердца. Уже через 6-10 минут прекращения кровотока наступает остановка сердца. Если аноксия длится 30 мин, то развиваются и структурные изменения в миокарде. После этого восстановить работу сердца невозможно. Поэтому 30-ти минутный срок называется пределом реанимации (гипотермия, мозг).
Кровоснабжение мозга осуществляется двумя внутренними сонными и двумя позвоночными артериями, а отток крови происходит по двум яремным венам. Магистральные артерии соединяются в обширный анастомоз — виллизиев круг. Вены образуют систему синусов. Отходящие от него крупные артерии образуют сеть пиальных сосудов. Эта сеть вместе с пиальными венами формирует мягкую мозговую оболочку. От пиальных сосудов вглубь мозга идут мелкие радиальные артерии, которые переходят в капиллярную сеть. Большое количество артерий и анастомозов обеспечивают высокую надежность системы кровоснабжения мозга. В основном сосуды иннервируются симпатическими нервами, хотя имеется и холинэргическая иннервация. Через сосуды мозга в покое проходит 15% минутного объема крови. Мозг потребляет до 20% всего кислорода и 17% глюкозы. Он очень чувствителен к гипоксии и гипогликемии, а следовательно ухудшению кровотока. За счет механизмов саморегуляции сосуды мозга способны поддерживать его нормальный уровень в широком диапазоне колебаний АД. Однако при его подъеме выше 180 мм.рт.ст. возможно резкое расширение артерий мозга, увеличение проницаемости гематоэнцефалического барьера и отек мозга. Тонус сосудов мозга регулируется миогенными, гуморальными и нейрогенными механизмами. Миогенный проявляется сокращением гладких мышц сосудов при повышении кровяного давления и наоборот расслаблением при его понижении. Он стабилизирует быстрые колебания кровотока. В частности при изменениях положения тела. Нервная регуляция осуществляется симпатическими нервами, которые кратковременно и незначительно суживают сосуды. Основная роль принадлежит гуморальным факторам, в первую очередь метаболическим. Увеличение концентрации СО2 крови сопровождается выраженным расширением сосудов мозга. Подобным же действием обладают катионы водорода, поэтому сдвиг реакции крови в кислую сторону приводит к вазодилатации. При гипервентиляции содержание СО2 падает, сосуды мозга суживаются, мозговой кровоток уменьшается. Возникают головокружение, спутанность сознания, судороги и т.д. Аденозин, брадикинин, гистамин расширяют сосуды. Вазопрессин, серотонин, ангиотензин суживают их.
Существенной особенностью сосудистой системы легких является то, что она включает сосуды малого круга и бронхиальные артерии большого. Первые служат для газообмена, вторые обеспечивают кровоснабжение ткани легких. У человека между ними имеются анастомозы, роль которых в гемодинамике малого круга значительно возрастает при застойных явлениях в нем. Легочная артерия разветвляется на более мелкие артерии, а затем артериолы. Артериолы окружены паренхимой легких, поэтому кровоток в них тесно связан с режимом вентиляции легких. В легких имеется 2 типа капилляров: широкие, диаметром 20-40 мкм, и узкие — 6-12 мкм. Стенка легочного капилляра и альвеолы образуют функциональную единицу — альвеолокапиллярную мембрану. Через нее осуществляется газообмен. Минутный объем крови в сосудах малого круга такой же, как и большом, но кровяное давление меньше. Оно не может значительно повышаться из-за большой растяжимости стенок сосудов легких. Нервная регуляция тонуса легочных сосудов осуществляется симпатическими нервами. Они оказывают слабое сосудосуживающее влияние. Из факторов гуморальной регуляции легочного кровотока главную роль играют серотонин, гистамин, ангиотензин, которые суживают сосуды. Катехоламины оказывают слабое вазоконстрикторное действие.
Через почки в состоянии покоя проходит 20% минутного объема крови.
Причем 90% этой крови проходит через корковый слой, образованный нефронами. Давление в капиллярах сосудистых клубочков нефронов значительно выше, чем в других капиллярах большого круга и составляет 50-70 мм.рт.ст. Это связано с тем, что диаметр приносящих артериол больше, чем выносящих. Основное значение в регуляции почечного кровотока принадлежит миогенным механизмам. Они поддерживают постоянство капиллярного давления и кровотока при колебаниях артериального от 80 до 180 мм.рт.ст. Вторым по значению является гуморальный механизм. Особую роль играют ренин-ангиотензиновая и калликреин-кининовая системы. При снижении системного кровяного давления, недостатке воды и ионов натрия юкстагломерулярными клетками приносящих артериол начинает вырабатываться фермент ренин. Он поступает в интерстициальную ткань почек и стимулирует образование ангиотензина II. Ангиотензин II суживает выносящие артериолы и снижает проницаемость стенки капилляров клубочков. Фильтрация в них уменьшается, что способствует задержке воды. Кроме того, ангиотензин повышает чувствительность гладкомышечных клеток артериол к норадреналину симпатических нервных окончаний. Это также способствует снижению почечного кровотока. При уменьшении кровотока в ткани почек синтезируется фермент калликреин. Под его влиянием из кининогенов образуется белок брадикинин. Брадикинин расширяет сосуды почек. Почечный кровоток и фильтрация воды в клубочках возрастают. Таким образом калликреин-кининовая система является антагонистом ренин-ангиотензиновой. Особенно ее активность возрастает при физической нагрузке и эмоциональном напряжении. При сужении сосудов почек в них также синтезируется простагландины, обладающие вазодилататорным действием. Адреналин и вазопрессин суживают почечные сосуды. Значение нервно-рефлекторных механизмов в регуляции их тонуса невелико. Сосуды иннервируются симпатическими вазоконстрикторами. Кратковременное рефлекторное сужение почечных сосудов наблюдается при эмоциональном стрессе.
3 вопрос. Депо крови. Физиологическое значение.
Депо крови,органы-резервуары, в которых у высших животных и человека может храниться изолированно от общего кровотока около 50% всей крови. При повышении потребности организма в кислороде(например, при тяжёлой физической работе) или уменьшении количества гемоглобина в циркулирующей крови (например, в результате кровопотери) в общую циркуляцию поступает кровь из Депо кровиОсновные Депо крови-селезёнка, печеньи кожа. Возможность функционирования этих органов в качестве Депо кровиобусловлена своеобразным строением их сосудистой системы. В селезёнке часть крови проникает в межклеточные пространства и оказывается выключенной из общей циркуляции; обратное поступление крови в общий кровоток осуществляется при сокращении гладкой мускулатуры селезёнки. В печени задержка крови может быть обусловлена превышением притока крови над её оттоком; освобождение печени от избытка крови происходит вследствие резкого сужения сосудов, приносящих к ней кровь. В коже кровь резервируется в подсосочковых сплетениях капилляров (параллельных ответвлениях от основного кровяного русла кожи), где кровь течёт непрерывно.
4 вопрос.ОПРЕДЕЛЕНИЕ ОСТРОТЫ ЗРЕНИЯ.
Определить остроту зрения по таблице Головина.
1. Сесть на стул на расстоянии м от таблицы Головина и закрыть один глаз экраном.
2. Показывать обследуемому буквы из строк в направлении сверху вниз; он должен их назвать. Отметить последнюю строку, буквы которой он может прочесть.
3. Определить остроту зрения по формуле:
| Острота = | расстояние, с которого Вам видна последняя прочитанная строка |
| расстояние, с которого эта строка должна быть видна нормальному глазу |
Например, если с м обследованный читает пятую строку, которую нормальный глаз должен видеть с м, то острота зрения равна 5/10 = 0,5.
Оформить результаты работы и выводы.
Билет №48
Пищеварение в желудке
Желудок выполняет следующие функции:
1.Депонирующая. Пища находится в желудке несколько часов.
2.Секреторная. Клетки его слизистой вырабатывают желудочный сок.
3.Моторная. Он обеспечивает перемешивание и перемещение пищевых масс в кишечник.
4.Всасывательная. В нем всасывается небольшое количество воды, глюкозы, аминокислот, спиртов.
5.Экскреторная. С желудочным соком в пищеварительный канал выводятся некоторые продукты обмена (мочевина, креатинин и соли тяжелых металлов).
6.Инкреторная или гормональная. В слизистой желудка имеются клетки вырабатывающие желудочно-кишечные гормоны — гастрин, гистамин, мотилин
7.Защитная. Желудок является барьером для патогенной микрофлоры, а также вредных пищевых веществ (рвота).
§
Тромбоциты или кровяные пластинки имеют дисковидную форму и диаметр 2-5 мкм. Они образуются в красном костном мозге путем отщепления участка цитоплазмы с мембраной от мегакариоцитов Тромбоциты не имеют ядра, но содержат сложную систему органелл. Ими являются гранулы, микротрубочки, микрофиламенты, митохондрии. Наружная мембрана тромбоцитов имеет рецепторы, при активации которых происходят их адгезия. Это приклеивание тромбоцитов к эндотелию сосудов. А также агрегация — склеивание друг с другом. В их мембране из простагландинов синтезируются тромбоксаны, ускоряющие агрегацию. При стимуляции тромбоцитов происходит активация сократительного аппарата, которым являются микротрубочки и микрофиламенты. Они сжимаются и из них, через систему канальцев мембраны, выходят вещества необходимые для свертывания крови — кальций, серотонин, норадреналин, адреналин. Кальций стимулирует адгезию тромбоцитов, их сокращение, синтез тромбоксанов. Серотонин, норадреналин, адреналин суживают сосуд. В тромбоцитах также вырабатываются антигепариновый фактор, ростковый фактор, стимулирующий заживление эндотелия и гладких мышц сосудов, фермент тромбостенин вызывающий сокращение нитей фибрина в тромбе и т.д. Поэтому при снижении содержания тромбоцитов в крови возникает тромбоцитопеническая пурпура. Это множественные кровоизлияния в кожу из-за сниженной стойкости и слущивания эндотелия стенки капилляров. Кроме того тромбоциты могут фагоцитировать небиологические частицы, вирусы. В норме содержание тромбоцитов должно составлять 180.000-320.000 в мкл или 180-320 * 109 л.
Лейкоциты или белые кровяные тельца — это клетки крови, содержащие ядро. У одних лейкоцитов цитоплазма содержит гранулы, поэтому их называют гранулоцитами. У других зернистость отсутствует, их относят к агранулоцитам. Выделяют три формы гранулоцитов. Те из них, гранулы которых окрашиваются кислыми красителями (эозином), называют эозинофилами. Лейкоциты, зернистость которых восприимчива к основным красителям, базофилами. Лейкоциты, гранулы которых окрашиваются и кислыми и основными красителями, относят к нейтрофилам. Агранулоциты подразделяются на моноциты и лимфоциты. Все гранулоциты и моноциты образуются в красном костном мозге и называются клетками миелоидного ряда. Лимфоциты также образуются из стволовых клеток костного мозга, но размножаются в лимфатических узлах, миндалинах, апендиксе, селезенке, тимусе, лимфатических бляшках кишечника. Это клетки лимфоидного ряда.
Общей функцией всех лейкоцитов является защита организма от бактериальных и вирусных инфекций, паразитарных инвазий, поддержание тканевого гомеостаза и участие в регенерации тканей.
Нейтрофилы находятся в сосудистом русле 6-8 часов, а затем переходят в слизистые оболочки. Они составляют подавляющее большинство гранулоцитов. Основная функция нейтрофилов заключается в уничтожении бактерий и различных токсинов. Они обладают способностью к хемотаксису и фагоцитозу. Выделяемые нейтрофилами вазоактивные вещества, позволяют проникать им через стенку капилляров и мигрировать к очагу воспаления. Движение лейкоцитов к нему происходит благодаря тому, что находящиеся в воспаленной ткани Т-лимфоциты и макрофаги вырабатывают хемоаттрактанты. Это вещества, которые стимулируют их продвижение к очагу. К ним относятся производные арахидоновой кислоты — лейкотриены, а также эндотоксины. Поглощенные бактерии попадают в фагоцитарные вакуоли, где подвергаются воздействию ионов кислорода, перекиси водорода, а также лизосомных ферментов. Важным свойством нейтрофилов является то, что они могут существовать в воспаленных и отечных тканях бедных кислородом. Гной в основном состоит из нейтрофилов и их остатков. Выделяющиеся при распаде нейтрофилов ферменты, размягчают окружающие ткани. За счет чего формируется гнойный очаг — абсцесс.
Базофилы (Б) содержатся в количестве 0-1%. Они находятся в кровеносном русле 12 часов. Крупные гранулы базофилов содержат гепарин и гистамин. За счет выделяемого ими гепарина ускоряется липолиз жиров в крови. На мембране базофилов имеются gЕ-рецепторы, к которым присоединяются gЕ-глобулины. В свою очередь с этими глобулинами могут связываться аллергены. В результате из базофилов выделяется гистамин. Возникает аллергическая реакция — сенная лихорадка (насморк, зудящаяся сыпь на коже, ее покраснение, спазм бронхов). Кроме того, гистамин базофилов стимулирует фагоцитоз, оказывает противовоспалительное действие. В базофилах содержится фактор активирующий тромбоциты, который стимулирует их агрегацию и высвобождение тромбоцитарных факторов свертывания крови. Выделяя гепарин и гистамин, они предупреждают образование тромбов в мелких венах легких и печени.
Эозинофилы (Э) содержатся в количестве 1-5%. Их содержание значительно изменяется в течение суток. Утром их меньше, вечером больше. Эти колебания объясняются изменениями концентрации глюкокортикоидов надпочечников в крови. Эозинофилы обладают способностью к фагоцитозу, связыванию белковых токсинов и антибактериальной активностью. Их гранулы содержат белок, нейтрализующий гепарин, а также медиаторы воспаления и ферменты, препятствующие агрегации тромбоцитов. Эозинофилы принимают участие в борьбе с паразитарными инвазиями. Они продвигаются к местам скопления в тканях тучных клеток и базофилов, которые образуются вокруг паразита. Там они фиксируются на поверхности паразита. Затем проникают в его ткань и выделяют ферменты, вызывающие его гибель. Поэтому при паразитарных заболеваниях возникает эозинофилия — повышение содержания эозинофилов. При аллергических состояниях и аутоиммунных заболеваниях, эозинофилы накапливаются в тканях, где происходит аллергическая реакция. Например, в перибронхиальной ткани легких при бронхиальной астме. Здесь они нейтрализуют вещества, образующиеся в ходе этих реакций. Это гистамин, субстанция анафилаксии, фактор агрегации тромбоцитов. В результате выраженность аллергической реакции снижается. Поэтому возрастает содержание эозинофилов и при этих состояниях.
Моноциты наиболее крупные клетки крови. Их 2-10%. Способность к макрофагов, т.е. вышедших из кровяного русла моноцитов, к фагоцитозу больше, чем у других лейкоцитов. Они могут совершать амебоидные движения. При эволюции моноцита в макрофаг увеличивается его размер, количество лизосом и ферментов. Макрофаги вырабатывают больше 100 биологически активных веществ. Это эритропоэтин, образующиеся из арахидоновой кислоты простагландины и лейкотриены. Выделяемый ими интерлейкин-I, стимулирует пролиферацию лимфоцитов, остеобластов, фибробластов, эндотелиальных клеток. Макрофаги фагоцитируют и уничтожают микроорганизмы, простейших паразитов, старые и поврежденные, в том числе опухолевые клетки. Это их свойство обусловлено наличием в макрофагах окисдантов, в первую очередь супероксида, перекиси водорода, гидроксиланионов. Кроме того, макрофаги участвуют в формировании иммунного ответа, воспаления, стимулируют регенерацию тканей. В тканях некоторые макрофаги превращаются в неподвижные гистиоциты, которые делятся и образуют воспалительный вал вокруг инородных тел, не поддающихся действию ферментов.
Лимфоциты составляют 20-40% всех лейкоцитов. Они делятся на Т- и В-лимфоциты. Первые дифференцируются в тимусе, вторые в различных лимфатических узлах. Т-клетки делятся на несколько групп. Т-киллеры уничтожают чужеродные белки-антигены и бактерии. Т-хелперы участвуют в реакции антиген-антитело. Т-клетки иммунологической памяти запоминают структуру антигена и распознают его. Т-амплификаторы стимулируют иммунные реакции, а Т-супрессоры тормозят образование иммуноглобулинов. В-лимфоциты составляют меньшую часть. Они вырабатывают иммуноглобулины и могут превращаться в клетки памяти.
Общее количество лейкоцитов 4000-9000 в мкл крови или 4-9*109 л.
В отличие от эритроцитов, численность лейкоцитов колеблется в зависимости от функционального состояния организма. Понижение содержания лейкоцитов называется лейкопенией, повышение — лейкоцитозом. Небольшой физиологический лейкоцитоз наблюдается при физической и умственной работе, а также после еды — пищеварительный лейкоцитоз. Чаще всего лейкоцитоз и лейкопения возникают при различных заболеваниях. Лейкоцитоз наблюдается при инфекционных, паразитарных и воспалительных заболеваниях, болезнях крови лейкозах. В последнем случае лейкоциты являются малодифференцированными и не могут выполнять свои функции. Лейкопения возникает при нарушениях кроветворения, вызванных действием ионизирующих излучений (лучевая болезнь), токсических веществ, например бензола, лекарственных средств (левомицетин), а также при тяжелом сепсисе. Больше всего уменьшается содержание нейтрофилов. Процентное содержание различных форм лейкоцитов называется лейкоцитарной формулой. В норме их соотношение постоянно и изменяется при заболеваниях. Поэтому исследование лейкоцитарной формулы необходимо для диагностики.
§
После 25 лет максимальное потребление кислорода организмом постоянно уменьшается и к 55 годам оно уже почти на 27% ниже величин, отмеченных у 20-летних. Вместе с тем, физически активные люди сохраняют относительно высокое максимальное потребление кислорода во всех возрастных группах. Отсюда следует, что уровень максимального потребления кислорода больше отражает уровень физической активности, чем хронологию возраста. Так, постепенное снижение максимального потребления кислорода после 25 лет у остающихся физически активными мужчин составляет около 0,4 мл О2 кг мин1 на каждый год жизни. У мужчин же ведущих малоподвижный образ жизни темп его снижения оказывается вдвое быстрее. Указанное снижение аэробных способностей организма при старении находит объяснение в изменениях функции сердечно-сосудистой системы, в частности, в уменьшении с возрастом максимальной частоты сердечных сокращений у мужчин и женщин. Эти отношения могут быть выражены следующим образом. Максимальное число сердечных сокращений = 220 -возраст (к-во лет). Как следствие снижения максимального числа сердечных сокращений минутный объем и сердечный индекс также уменьшаются с возрастом. Величина последнего уменьшается на 20-30% от 30 к 80 годам. Отложение жиров в коронарных артериях ухудшает обеспечение кровью сердечной мышцы. Гипоксия миокарда приводит к инфильтрации его коллагеном, что уменьшает сократительную активность сердца, лимитирует его работу. В связи с этим, имеет место уменьшение ударного объема крови, индекса сократимости, систолического давления в левом желудочке, максимальной скорости укорочения волокон миокарда. С возрастом уменьшаются и возможности снабжения кровью тканей. Так, во внутренних органах, скелетных мышцах уменьшается плотность капилляров, увеличивается радиус диффузии, расширяется базальный слой стенок капилляров, уменьшается площадь суммарного артериального сечения. В ходе старения в кровеносных сосудах возникают атеросклеротические изменения, которые могут уменьшать кровоток в органах. В свою очередь, это оказывается причиной многих симптомов, таких как слабоумие, нарушения психических функций, изменения функций почек. Потеря эластичности сосудистой стенки и увеличение сопротивления кровотоку в мелких артериях повышает общее периферическое сосудистое сопротивление. В результате, общее периферическое сосудистое сопротивление (в дин-с-см 5), равное 1323 62 в возрасте 20-49 лет, в 60-69 лет достигает 2075 122,9, в 70-79 лет — 2286±139, в 80-89 лет -2324±108,3, у долгожителей -2746±212. Это приводит к закономерному повышению системного артериального давления. Так, к 60 годам систолическое артериальное давление возрастает до 140 мм рт.ст., а диастолическое — до 90 мм рт.ст. У лиц старше 60 лет (включая и долгожителей) уровень артериального давления не превышает в среднем 150/90 мм рт.ст. Росту величин артериального давления препятствует как увеличение объема аорты, так и снижение сердечного выброса. Контроль кровяного давления с помощью барорецепторного механизма аорты и синокаротидной зоны с возрастом оказывается нарушен, что может быть причиной тяжелой гипотензии стариков при переходе в вертикальное положение. Гипотензия, в свою очередь, может вызывать ишемию мозга. Отсюда многочисленные падения у стариков, вызванные потерей равновесия и обмороком при быстром вставании. В венах с возрастом развиваются явления флебосклероза, выражающиеся в распаде эластических волокон и замене их коллагеновыми, дегенерация эндотелия и основного вещества. В результате, у пожилых и стариков имеет место снижение тонуса и эластичности венозной стенки, что влечет за собой расширение венозного русла, снижение давления в венах. Присасывающее действие грудной клетки снижается, уменьшается величина венозного возврата, возникает явление венозного стаза. Нарастание емкости сосудистого русла при одновременном снижении сердечного выброса увеличивает время общего кругооборота крови — от 47,8±2,7 с у 20-39-летних людей до 60,6±3,2 с у 60-69-летних и до 65,4±3,1 с в 70-79 лет. Замедление капиллярного кровотока способствует более полному насыщению крови кислородом в легких и более полной его отдачи в тканях, что, в известной мере, компенсирует как нарушение диффузионной способности легких, так и ухудшение тканевого кровотока с возрастом. Флебосклероз повышает риск венозного тромбоза у пожилых. Вместе с тем, регулярные занятия физическими упражнениями улучшают показатели функций сердечно-сосудистой системы в большей мере, чем у людей того же возраста, но ведущих малоподвижный образ жизни. Например, у мужчин в возрасте 50 и 70 лет, в течение 20 лет бывших неактивными физически, 8-недельная тренировка продолжительностью от 1до 2 часов по 3-5 раз в неделю повышает максимальное потребление кислорода в среднем на 20%. После 35 лет у мужчин и после 45 лет у женщин резко возрастает вероятность развития ишемической болезни сердца. В возрасте от 55 до 65 лет 13 из 100 мужчин и 6 из 100 женщин в США погибали от это болезни, хотя национальная программа борьбы за здоровый образ жизни в последние годы значительно снизила число этих заболеваний. Нарастание риска развития ишемической болезни сердца при старении во многом связывают с нарушением липидного состава крови (с гиперлипидемией), т.е. увеличением в ней уровня холестерина и триглицеридов. Но эти вещества не циркулируют свободно в плазме крови, а транспортируются ею в форме липопротеинов, поэтому точнее говорить о гиперлипопротеинемии. Количество холестерина, оседающего в мембранах клеток, и, в том числе, в сосудистой стенке, зависит от соотношения в плазме крови липопротеинов, экстрагирующих холестерин из мембран (липопротеины высокой плотности — ЛПВП) и способствующих его внедрению в мембрану (липопротеины особо низкой плотности — ЛПОНП и липопротеины низкой плотности — ЛПНП). Уровень ЛПВП отражает динамику движения холестерина из периферических тканей (включая сосудистую стенку) к печени, где он окисляется до желчных кислот и секретируется с желчью. ЛПНП и ЛПОНП — это средство транспорта жиров в организме к клеткам, в том числе, к гладким мышцах стенок артерий. В норме отношение липопротеинов, повышающих или понижающих уровень холестерина в мембранах, сбалансировано и коэффициент (ЛПНП ЛПОНП)/ЛПВП, отражающий избыток холестерина в мембранах, низкий, но с возрастом он нарастает. Нарастание холестерина в мембранах клеток сосудов становится характерной чертой артериосуживающего процесса — артериосклероза. Этому способствует уменьшающаяся липолитическая и АТФ-азная активность в гладкомышеч-ных клетках сосудов. Отложение липидов в стенке сосудов вызывает кальцификацию и фиброзные изменения, в результате, артериальные стенки становятся суженными, ригидными и жесткими, делая кровоток в тканях более затрудненным. Этот процесс ускоряется употреблением пищи, богатой холестерином и ненасыщенными кислотами. Ряд факторов, например, физическая активность, могут увеличивать производство ЛПВП. Так, их уровень оказывается повышенным у стариков, использующих энергичные аэробные тренировки. Атерогенное сужение сосудов сердца, ухудшающее кровоснабжение миокарда, может длительно не давать клинических признаков заболеваний. Но недостаточность снабжения миокарда кислородом может быть выявлена по изменениям электрической активности сердца при умеренной физической нагрузке. Наиболее выраженным признаком этого является горизонтальная депрессия S-T сегмента на ЭКГ. Оказалось, что в группе лиц с выраженной депрессией комплекса S-T до 1 мм во время физической нагрузки имеет место увеличение смертности в 4,6 раза чаще, чем у лиц того же возраста, но с нормальным сегментом S-T. Появление желудочковых экстрасистол во время физической нагрузки является другим признаком тяжелого ишемического атеросклероза сосудов сердца. Эта форма электрической нестабильности миокарда имеет большое прогностическое значение для ишемической болезни сердца.
§
Щитовидная железа. Основной структурно-функциональной единицей ЩЖ являются фолликулы. Они представляют собой округлые полости, стенка которых образована одним рядом клеток кубического эпителия. Фолликулы заполнены коллоидом и содержат гормоны тироксин и трийодтиронин, которые связаны с белком тиреоглобулином. В межфолликулярном пространстве проходят капилляры, обеспечивающие обильную васкуляризацию фолликулов. В ЩЖ объемная скорость кровотока выше че в других органах и тканях. В межфолликулярном пространстве находятся также парафолликулярные клетки (С-клетки), в которых вырабатывается гормон тиреокальцитонин. Биосинтез тироксина и трийодтиронина осуществляется за счет йодирования аминокислоты тирозина, поэтому в ЩЖ происходит активное поглощение йода. Содержание йода в фолликулах в 30 раз превышает его концентрацию в крови, а при гиперфункции ЩЖ это соотношение становится еще больше. Активность тироксина в несколько раз меньше, чем трийодтиронина. Содержание тироксина в крови примерно в 20 раз больше, чем трийодтиронина. Действие гормонов ЩЖ проявляется резким усилением метаболической активности организма. При этом ускоряются все виды обмена веществ (белковый, липидный, углеводный), что приводит к увеличению энергообразования и повышению основного обмена. Недостаток гормонов ЩЖ у детей приводит к задержке умственного и физического развития (кретинизм). У взрослых при гипофункции ЩЖ наблюдается торможение нервно-психической активности (вялость, сонливость, апатия); при избытке гормонов наблюдается эмоциональная лабильность, возбуждение, бессонница. В результате активации всех видов обмена веществ под влиянием гормонов ЩЖ изменятеся деятельность практически всех органов. Усиливается теплопродукция, что приводит к повышению температуры тела. Ускоряется работа сердца (тахикардия, повышение АД, увеличение минутного объема крови), стимулируется деятельность пищеварительного тракта (повышение аппетита усиление перистальтики кишечника, увеличение секреторной активности). При гиперфункции ЩЖ (базедова болезнь) обычно снижается масса тела. Недостаток гормонов ЩЖ приводит к изменениям обратного характера.
Кальцитонин, или тиреокальцитонин, снижает уровень кальция в крови. Он действует на костную систему, почки и кишечник, вызывая при этом эффекты, противоположные действию паратирина. В костной ткани тиреокальцитонин усиливает активность остеобластов и процессы минерализации. В почках и кишечнике угнетает реабсорбцию кальция и стимулирует обратное всасывание фосфатов. Реализация этих эффектов приводит к гипокальциемии.
Секрещия гормонов ЩЖ регулируется гипоталамическим тиреолиберином. Выработка тироксина и трийодтиронина резко усиливается в условиях длительного эмоционального возбуждения. Секреция этих гормонов ускоряется при снижении температуры тела.
Околощитовилные железы (окЩЖ). Их 4. Они вырабатывают паратгормон. Он регулирует уровень кальция в крови (увеличивает его содержание). Органами-мишенями этого гормона являютя почки и кости. В костной ткани он усиливает функцию остеокластов, что способствует деминерализации кости и повышению уровня кальция и фосфора в плазме крови. В канальцевом аппарате почек паратгормон стимулирует реабсорбцию фосфатов, что приводит к гиперкальциемии и фосфатурии. Паратгормон усиливает синтез кальцитриола, который является активным метаболитом витамина D3, кальцитриол усиливает образование кальцийсвязывающего белка в стенке кишечника, что способствует обратному всасыванию кальция и развитию гиперкальциемии (прямое влияние паратгормона на кишечную деятельность незначительно). При удалении окЩЖ животное погибает от тетанических судорог. Это связано с тем, что при низком содержании кальция в крови резко усиливается нервно-мышечная возбудимость. Гиперфункция паратгормона приводит к деминерализации и резорбции костной ткани, развитию остеопороза. Резко увеличивается уровень кальция в крови, в результате чего усиливается склонность к камнеобразованию в органах мочеполовой системы. Гиперкальциемия способствует развитию выраженных нарушений электрической стабильности сердца, а также образованию язв в пищеварительном тракте, возникновение которых обусловлено стимулирующим действием ионов кальция на выработку у гастрина и соляной кислоты в желудке.
При снижении содержания кальция усиливается секреция паратгормона и тормозится выработка тиреокальцитонина. В физиологических условиях это может наблюдаться при беременности, лактации, сниженном содержании кальция в принимаемой пище. Увеличение концентрации кальция в плазме крови способствует снижению секреции паратгормона и увеличению выработки тиреокальцитонина.
§
Дыханием называется комплекс физиологических процессов, обеспечивающих обмен кислорода и углекислого газа между клетками организма и внешней средой. Оно включает следующие этапы:
1. Внешнее дыхание или вентиляция. Это обмен дыхательных газов между атмосферным воздухом и альвеолами.
2. Диффузия газов в легких. Т.е. их обмен между воздухом альвеол и кровью.
3. Транспорт газов кровью.
4. Диффузия газов в тканях. Обмен газов между кровью капилляров и внутриклеточной жидкостью.
5. Клеточное дыхание. Поглощение кислорода и образование углекислого газа в клетках.
Механизмы внешнего дыхания
Внешнее дыхание осуществляется в результате ритмических движений грудной клетки. Дыхательный цикл состоит из фаз вдоха (inspiratio) и выдоха (exspiratio), между которыми отсутствует пауза. В покое у взрослого человека частота дыхательных движений 16-20 в минуту. Вдох это активный процесс. При спокойном вдохе сокращаются наружные межреберные и межхрящевые мышцы. Они приподнимают ребра, а грудина отодвигается вперед. Это ведет к увеличению сагитального и фронтального размеров грудной полости. Одновременно сокращаются мышцы диафрагмы. Ее купол опускается и органы брюшной полости сдвигаются вниз, в стороны и вперед. За счет этого грудная полость увеличивается и в вертикальном направлении. После окончания вдоха дыхательные мышцы расслабляются. Начинается выдох. Спокойный выдох пассивный процесс. Во время него происходит возвращение грудной клетки в исходное состояние. Это происходит под действием ее собственного веса, натянутого связочного аппарата и давления на диафрагму органов брюшной полости. При физической нагрузке, патологических состояниях, сопровождающихся одышкой (туберкулез легких, бронхиальная астма и т.д.) возникает форсированное дыхание. В акт вдоха и выдоха вовлекаются вспомогательные мышцы. При форсированном вдохе дополнительно сокращаются грудино-ключично-сосцевидные, лестничные, грудные и трапециевидные мышцы. Они способствуют дополнительному поднятию ребер. При форсированном выдохе сокращаются внутренние межреберные мышцы, которые усиливают опускание ребер. Т.е. это активный процесс. Различают грудной и брюшной тип дыхания. При первом дыхание в основном осуществляется за счет межреберных мышц, при втором за счет мышц диафрагмы. Грудной или реберный тип дыхания характерен для женщин. Брюшной или диафрагмальный для мужчин. Физиологически более выгоден брюшной тип, так как он осуществляется с меньшей затратой энергии. Кроме того, движения органов брюшной полости при дыхании препятствуют их воспалительным заболеваниям. Иногда встречается смешанный тип дыхания.
Несмотря на то, что легкие не сращены с грудной стенкой, они повторяют ее движения. Это объясняется тем, что между ними имеется замкнутая плевральная щель. Изнутри стенка грудной полости покрыта париетальным листком плевры, а легкие ее висцеральным листком. В межплевральной щели находится небольшое количество серозной жидкости. При вдохе объем грудной полости возрастает. А так как плевральная изолирована от атмосферы, то давление в ней понижается. Легкие расширяются, давление в альвеолах становится ниже атмосферного. Воздух через трахею и бронхи поступает в альвеолы. Во время выдоха объем грудной клетки уменьшается. Давление в плевральной щели возрастает, воздух выходит из альвеол. Движения или экскурсии легких объясняются колебаниями отрицательного межплеврального давления. После спокойного выдоха оно ниже атмосферного на 4-6 мм.рт.ст. На высоте спокойного вдоха на 8-9 мм.рт.ст. После форсированного выдоха оно ниже на 1-3 мм.рт.ст., а форсированного вдоха на 10-15 мм. рт. ст. Наличие отрицательного межплеврального давления объясняется эластической тягой легких. Это сила, с которой легкие стремятся сжаться к корням, противодействуя атмосферному давлению. Она обусловлена упругостью легочной ткани, которая содержит много эластических волокон. Кроме того, эластическую тягу увеличивает поверхностное натяжение альвеол. Изнутри они покрыты пленкой сурфактанта. Это липопротеид, вырабатываемый митохондриями альвеолярного эпителия. Благодаря особому строению его молекулы, на вдохе он повышает поверхностное натяжение альвеол, а на выдохе, когда их размеры уменьшаются, наоборот понижает. Это препятствует спадению альвеол, т.е. возникновению ателектаза. При генетической патологии, у некоторых новорожденных нарушается выработка сурфактанта. Возникает ателектаз и ребенок гибнет. В старости, а также при некоторых хронических заболеваниях легких, количество эластических волокон возрастает. Это явление называется пневмофиброзом. Дыхательные экскурсии затрудняются. При эмфиземе эластические волокна наоборот разрушаются и эластическая тяга легких снижается. Альвеолы раздуваются, величина экскурсий легких также уменьшается.
§
Ещев конце 19 века В.Я. Данилевский обнаружил, что электрическое раздражение лобных долей коры больших полушарий (КБП) вызывает изменения деятельности сердца и дыхательного ритма. Позже работами многих отечественных исследователей было установлено, что при раздражении или выключении отдельных участков КБП можно зарегистрировать изменения функционального состояния любого органа, иннервируемого АНС (сердца, желудка, кишечника, органов таза, желез, гладких мышц глаза и т.д.). Была показана и некоторая специализация отдельных областей коры, при стимуляции которых наблюдаются изменения определенных висцеральных процессов. Выяснено, что наибольшее значение имеют лобные доли КБП, которые считаются высшим центром вегетативной иннервации. В двигательных областях КБП обнаружено представительство тех висцеральных органов, функции которых связаны с мышечной деятельностью.
И.П. Павловым было высказано представление о том, что в КБП наряду с анализаторами внешних сигналов имеются и анализаторы внутренней среды организма. Последующие исследования выявили, что в КБП действительно существует сенсорное представительство (проекционные зоны) ряда внутренних органов. Кроме того, К.М. Быков и сотрудники установили возможность образования особых интероцептивных условных рефлексов и доказали влияние сигналов от интерорецепторов на КБП. Было показано, что, воздействуя на какой-либо внутренний орган, можно изменить условнорефлекторную деятельность коры.
В настоящее время считается доказанным, что кора больших полушарий может влиять на функции всех внутренних органов и в свою очередь сигналы от последних, достигая при определенных условиях коры больших полушарий, способны изменить её деятельность.
Многие отделы коры регулируют деятельность сердечно-сосудистой системы. При раздражении двигательных зон коры тонус сосудов возрастает, а частота сердцебиений увеличивается. Это свидетельствует о наличии согласованности механизмов регуляции деятельности сердечно-сосудистой системы и органов движения. Особое значение имеет древняя и старая кора. В частности, электростимуляция поясной извилины сопровождается расширением сосудов, а раздражение островка к их сужению. В лимбической системе происходит координация эмоциональных реакций с реакциями системы кровообращения. Например, при сильном страхе учащаются сердцебиения и суживаются сосуды.
Об участии КБП свидетельствует тот факт, что частоту и глубину дыхания можно изменять произвольно. Благодаря КБП при выполнении физических упражнений интенсивность дыхания становится адекватной потребностям организма.
Корковые влияния на моторику желудка реализуются с помощью условных и безусловных рефлексов посредством гипоталамуса, центра пищеварения (продолговатый мозг), симпатического и блуждающего нервов. Отрицательные эмоции, возникающие при виде и запахе плохо приготовленной пищи, тормозят моторику желудка, а разговор о вкусной еде усиливает ее.
Влияние КБП на процесс мочеобразования осуществляется с помощью условных рефлексов, посредством которых диурез может быть усилен и заторможен, проявляется в результате эмоций, болевых воздействий. Ведущим фактором при этом является антидиуретический гормон, а также возбуждение симпатической нервной системы.
4. Правила переливания крови.
Переливание крови — серьезная операция по трансплантации живой ткани человека. Этот метод лечения широко распространен в клинической практике. Переливание крови применяют врачи различных специальностей: хирурги, акушеры-гинекологи, травматологи, терапевты и т. д.
Абсолютными показаниями к переливанию крови считаются острая кровопотеря, шок, кровотечение, тяжелая анемия, тяжелые травматичные операции, в том числе с искусственным кровообращением. Показаниями к переливанию крови и ее компонентов служат анемии различного происхождения, болезни крови, гнойно-воспалительные заболевания, тяжелые интоксикации.
Врач, производящий трансфузию, обязан независимо от проведенных ранее исследований и имеющихся записей лично провести следующие контрольные исследования:
1) определить групповую принадлежность крови реципиента по системе AB0 и сверить результат с данными истории болезни;
2) определить групповую принадлежность эритроцитов донора и сопоставить результат с данными на этикетке контейнера или бутылки;
3) провести пробы на совместимость в отношении групп крови донора и реципиента по системе AB0 и резус-фактору;
4) провести биологическую пробу.
Запрещается переливание донорской крови и ее компонентов, не исследованных на СПИД, поверхностный антиген гепатита В и сифилис. Переливание крови и ее компонентов производится с соблюдением правил асептики одноразовыми пластиковыми системами. Полученная от донора кровь (обычно в объеме 450 мл) после добавления консервирующего раствора может храниться в холодильнике при температуре 4-8°С не более 21 дня. Замороженные при температуре жидкого азота (-196°С) эритроциты могут храниться годами.
Допускается переливание цельной крови и ее компонентов только той группы и резус-принадлежности, которая имеется у реципиента. В исключительных случаях допускается переливание резус-отрицательной крови группы О(I) («универсальный донор») реципиенту с любой группой крови в количестве до 500 мл (за исключением детей). Кровь резус-отрицательных доноров А (II) или В (III) можно переливать не только совпадающим по группе реципиентам, но и реципиенту с АВ (IV) группой независимо от его резус принадлежности. Больной с АВ (IV) группой резус-положительной крови может считаться «универсальным реципиентом».
Кроме того, при отсутствии одногруппной крови может быть перелита кровь (эритроцитная масса) 0(I) резус-положительной группы резус-положительному реципиенту любой группы по системе АВ0. Кровь группы А (II) или В (III) резус-положительная может быть перелита резус-положительному реципиенту с группой АВ (IV). Во всех случаях абсолютно обязательной является проба на совместимость. При наличии антител редкой специфичности требуется индивидуальный подбор донорской крови и проведение дополнительных проб на совместимость.
Физиология дыхательной системы: газообмен в легких : farmf | литература для фармацевтов
Биомеханика вдоха и выдоха
Вдох начинается с сокращения дыхательных (респираторных) мышц.
При вдохе межреберные мышцы сокращаются и приподнимают ребра, а диафрагма отодвигается в сторону брюшной полости, становится менее выпуклой. Сокращение диафрагмы приводит к увеличению объема грудной полости в вертикальном направлении, а сокращение наружных межреберных и межхрящевых мышц – к увеличению объема грудной полости в сагитальном и фронтальном направлениях. В результате этого объем грудной полости увеличивается. Так как давление в грудной полости ниже атмосферного, то при увеличении ее объема растягиваются и легкие. Давление в них на какой- то момент становится ниже атмосферного, в легкие по дыхательным путям устремляется воздух. При необходимости глубокого дыхания, кроме межреберных мышц и диафрагмы сокращаются, мышцы туловища и плечевого пояса.
Выдох осуществляется пассивно, в результате расслабления дыхательных мышц; он является следствием прекращения вдоха: межреберные мышцы расслабляются, ребра опускаются, диафрагма расслабляется, объем грудной полости и легких уменьшаются. Грудная клетка суживается под влиянием эластической тяги легких и постоянно имеющегося тонуса мышц стенки живота, при этом органы брюшной полости оказывают давление на диафрагму. Вследствие сужения грудной клетки легкие сжимаются. Давление в легких становится выше атмосферного: воздух выходит из них по дыхательным путям наружу.
Частота дыхания 16- 20 в минуту. Дыхательные движения грудной клетки обеспечивают вентиляцию альвеолярного воздуха и поддерживают постоянство его газового состава.
При глубоком вдохе происходит дополнительное сокращение межреберных и брюшных мышц и объем выдыхаемого воздуха возрастает. При глубоком, усиленном дыхании сокращаются не только главные мышцы, но и вспомогательные.
Объемы легочного воздуха
Человек в состоянии покоя вдыхает и выдыхает около 500 мл воздуха – это дыхательный объем. Если после спокойного вдоха сделать усиленный дополнительный вдох, то в легкие поступает еще 1500 мл воздуха – это резервный объем вдоха.
После спокойного выдоха можно при максимальном напряжении дыхательных мышц выдохнуть еще 1500 мл воздуха – это резервный объем выдоха.
В сумме дыхательный объем, резервный объем вдоха, и резервный объем выдоха составляют жизненную емкость легких.
ЖЕЛ = РОвд ДО РОвыд.
ЖЕЛ = 1500 500 1500 = 3500 мл.
ЖЕЛ – максимальный объем воздуха, который можно выдохнуть после глубокого вдоха.
После максимального выдоха в легких остается 1000 – 1500 мл воздуха – это остаточный объем. Его можно удалить не полностью только на трупе. В легочной ткани всегда остается воздух, поэтому, опущенный в воду кусочек легкого не тонет.
Функциональная остаточная емкость легких.
ФОЕЛ = РОвыд. ОО
ФОЕЛ = 1500 1000 (1500) = 2500 – 3000 мл.
Емкость вдоха = РОвд. ДО = 1500 500 = 2000 мл.
Объем воздуха, содержащийся в легких на высоте максимального вдоха, составляет Общую емкость легких.
ОЕЛ=ЖЕЛ ОО
Воздух находится не только в альвеолах, но и в воздухоносных путях – полости носа, носоглотки, трахеи, бронхов. Воздух, находящийся в воздухоносных путях не участвует в газообмене, поэтому просвет воздухоносных путей называется мертвым пространством. Объем анатомического мертвого пространства около 150 мл.
Количественной характеристикой легочной вентиляции является минутный объем дыхания (МОД) – объем воздуха, проходящего через легкие за одну минуту. В состоянии покоя МОД равен 6- 9 л. При физической нагрузке его величина резко возрастает и составляет 25- 30 л.
Объем воздуха, который проходит через легкие за определенное время, называют максимальной вентиляцией легких (МВЛ). Этот параметр может достигать у молодого человека 120- 150 л/мин. МВЛ характеризует проходимость дыхательных путей, упругость грудной клетки и растяжимость легких.
Газообмен в легких
Газообмен осуществляется с помощью диффузии: СО2 выделяется из крови в альвеолы, О2 поступает из альвеол в венозную кровь, пришедшую в легочные капилляры из всех органов и тканей организма.

Рисунок 6. Газообмен между альвеолярным воздухом и эритроцитом. Цифрами обозначены величины парциального давления кислорода (PО2) и углекислого газа (РСО2) в артериальном и венозном конце капилляра
Процесс диффузии газов через альвеолярно-капиллярную мембрану зависит от следующих факторов:
1. градиента парциального давления газов по обе стороны мембраны (в альвеолярном воздухе и в легочных капиллярах);
2. толщины альвеолярно-капиллярной мембраны;
3. общей поверхности диффузии в легком (поверхность контакта легочных капилляров и альвеол составляет 60- 120 м2).
Парциальное давление кислорода в альвеолах (100 мм рт. ст.) значительно выше, чем напряжение, кислорода в венозной крови, поступающей в капилляры легких. Градиент парциального давления углекислого газа направлен в обратную сторону: 46 мм. рт. ст. в начале легочных капилляров и 40 мм рт. ст. в альвеолах. Эти градиенты давлений являются движущей силой диффузии кислорода и двуокиси углерода, т.е. газообмена в легких.
Согласно закону Фика диффузионный поток прямо пропорционален градиенту концентрации. Коэффициент диффузии для углекислого газа в 20- 25 раз больше, чем кислорода. При прочих равных условиях углекислый газ диффундирует через определенный слой среды в 20- 25 раз быстрее, чем кислород. Поэтому обмен СО2 в легких происходит достаточно полно, несмотря на небольшой градиент парциального давления этого газа.
При прохождении каждого эритроцита через легочные капилляры время, в течение которого возможна диффузия (время контакта) относительно невелико – около 0,3 сек. Однако, этого времени вполне достаточно для того, чтобы напряжения дыхательных газов в крови и их парциальное давление в альвеолах практически сравнялись.
Диффузионную способность легких, как и альвеолярную вентиляцию, следует рассматривать в отношении к перфузии (кровоснабжению) легких..
Транспорт газов кровью
Транспорт кислорода кровью.
Содержание растворенного газа в жидкости зависит от его парциального давления. Содержание в крови кислорода и углекислого газа в физически растворенном состоянии относительно невелико, однако это состояние играет существенную роль в жизнедеятельности организма.
Для того, чтобы связаться с теми или иными веществами, дыхательные газы сначала должны быть доставлены к ним в физически растворенном виде. Таким образом, при диффузии в ткани или кровь каждая молекула кислорода или углекислого газа определенное время пребывает в состоянии физического растворения. Большая часть кислорода переносится кровью в виде химического соединения с гемоглобином. 1 моль гемоглобина может связать до 4 молей кислорода, a 1 г гемоглобина – 1,39 мл кислорода. При анализе газового состава крови получают меньшую величину (1,34 – 1,36 мл О2 на 1 г Нb). Это обусловлено тем, что небольшая часть гемоглобина находится в неактивном виде. Таким образом, можно считать, что in vitro 1 г. Нb связывает 1,34 мл О2 – так называемое число Хюффнера.
Исходя из числа Хюффнера и зная содержание гемоглобина, вычислить кислородную емкость крови: 0,20 л кислорода на 1 л крови; Однако, такое содержание кислорода в крови может достигаться лишь в том случае, если кровь контактирует с газовой смесью с высоким содержанием кислорода (р О2 = 300 мм рт. ст.), поэтому в естественных условиях гемоглобин оксигенируется не полностью.
Реакция, отражающая соединение кислорода с гемоглобином, подчиняется закону действующих масс. Это означает, что отношение между количеством гемоглобина и оксигемоглобина зависит от содержания физически растворенного кислорода в крови; последнее же пропорционально напряжению кислорода. Процентное отношение оксигемоглобина к общему содержанию гемоглобина называется насыщением гемоглобина кислородом.
В соответствии с законом действующих масс насыщение гемоглобина кислородом зависит от напряжения кислорода. Графически эту зависимость отражает кривая диссоциации оксигемоглобина, которая имеет S- образную форму.

Рисунок 7. График диссоциации оксигемоглобина а – при нормальном парциальном давлении СО2 б – влияние изменений парциального давления СО2 в – влияние изменений pH; г – влияние изменений температуры.
Наиболее простым показателем, характеризующим расположение этой кривой служит так называемое напряжение полунасыщения рО2 т.е. такое напряжение кислорода, при котором насыщение гемоглобина кислородом составляет 50%. В норме рО2 артериальной крови составляет около 26 мм рт. ст.
Конфигурация кривой диссоциации оксигемоглобина имеет важное значение для переноса кислорода кровью. В процессе поглощения кислорода в легких напряжение О2 в крови приближается к парциальному давлению этого газа в альвеолах. У молодых людей рО2 артериальной крови составляет около 95 мм рт. ст. При таком напряжении насыщение гемоглобина кислородом равно примерно 97%. С возрастом и в ещё большей степени при заболеваниях легких напряжение кислорода в артериальной крови может значительно снижаться, однако, поскольку кривая диссоциации оксигемоглобина в правой части почти горизонтальна, насыщение крови кислородом уменьшается ненамного. Даже при падении напряжения кислорода в артериальной крови до 60 мм рт. ст., насыщение гемоглобина кислородом равно 90 %. Таким образом, благодаря тому, что области высоких напряжений кислорода соответствует горизонтальный участок кривой диссоциации оксигемоглобина, насыщение артериальной крови кислородом сохраняется на высоком уровне даже существенных сдвигах рО2.
Крутой наклон среднего участка кривой диссоциации оксигемоглобина свидетельствует о благоприятной ситуации для отдачи кислорода тканям. В состоянии покоя рО2 в области венозного конца капилляра равно приблизительно 40 мм рт. ст., что соответствует примерно 73% насыщения. Если в результате увеличения потребления кислорода его напряжение в венозной крови падает лишь на 5 мм рт. ст., то насыщение гемоглобина кислородом снижается на 7%; высвобождающийся при этом кислород может быть сразу же использован для процессов метаболизма.
Конфигурация кривой диссоциации оксигемоглобина обусловлена главным образом химическими свойствами гемоглобина; а также влиянием температуры, pH, напряжения углекислого газа. Как правило, эти факторы смещают кривую, увеличивая иди уменьшая ее наклон, но не изменяя при этом ее S – образную форму.
Если сродство гемоглобина к кислороду повышается, то процесс идет в сторону образования оксигемоглобина и график диссоциации смещается влево. При снижении сродства гемоглобина к кислороду процесс идет больше в сторону диссоциации оксигемоглобина, при этом график диссоциации смещается вправо. Равновесие реакции оксигенации гемоглобина зависит от температуры. При понижении температуры наклон кривой диссоциации оксигемоглобина увеличивается, а при ее повышении – снижается. У теплокровных животных этот эффект проявляется только яри гипотермии или лихорадочном состоянии.
Форма кривой диссоциации оксигемоглобина в значительной степени зависит от содержания в крови ионов Н . При снижении pH (при закислении крови) сродство гемоглобина к кислороду уменьшается и кривая диссоциации оксигемоглобина уплощается. Влияние pH на расположение кривой диссоциации оксигемоглобина называется эффектом Бора.
Величина pH крови тесно связана с напряжением в ней СО2 (напряжение углекислого газа) – чем рСО2 выше, тем ниже pH. Увеличение напряжения в крови СО2 сопровождается снижением сродства гемоглобина к кислорода и уплощением кривой диссоциации оксигемоглобина. Эту зависимость также называют эффектом Бора, хотя при подробном количественном анализе было показано, что влияние углекислого газа на форму кривой нельзя объяснить только изменением pH. Очевидно, сам углекислый газ оказывает на диссоциацию оксигемоглобина «специфический эффект».
При ряде патологических состояний наблюдаются изменения процессов транспорта кислорода кровью. При некоторых видах анемий происходит сдвиг кривой вправо, реже влево. Известно, что на форму и расположение кривой оказывают выраженное влияние некоторые фосфорорганические соединения, содержание которых в эритроцитах при патологии может изменяться. Основным соединением является 2,3-дифосфоглицерат (2,3- ДФГ). Сродство гемоглобина к кислороду зависит от содержания в эритроцитах катионов. При патологических сдвигах pH также отмечаются соответствующие изменения: при алкалозе поглощение кислорода в легких в результате эффекта Бора увеличивается, но отдача его тканям затрудняется; при ацидозе наблюдается обратная картина. Значительный сдвиг кривой влево имеет место при отравлении угарным газом.
Транспорт углекислого газа кровью.
Двуокись углерода – конечный продукт окислительных обменных процессов в клетках – переносится с кровью к легким и удаляется через них во внешнюю среду. Так же как и кислород, СО2 может переноситься как в физически растворенном виде, так и в состоянии химических соединений.
Химические реакции связывания углекислого газа несколько сложнее, чем реакции присоединения кислорода. Это обусловлено тем, что механизмы, отвечающие за транспорт СО2, должны одновременно обеспечивать поддержание постоянства кислородно-основного равновесия крови и тем самым внутренней среды организма в целом.
Напряжение СО2 в артериальной крови, поступающей в тканевые капилляры составляет 40 мм рт. ст. В клетках же, расположенных около этих капилляров. Напряжение углекислого газа значительно выше, так как это вещество постоянно образуется в результате метаболизма. В связи с этим физически растворенный углекислый газ переносится по градиенту напряжения из тканей в капилляры. Здесь его некоторое количество остается в состоянии физического растворения. Но большая часть СО2 претерпевает, ряд химических превращений. Прежде всего, происходит гидратация молекул углекислого газа с образованием угольной кислоты.
В плазме крови эта реакция протекает очень медленно; в эритроците же она ускоряется примерно в 10000 раз, что связано с действием фермента карбоангидразы. Поскольку этот фермент присутствует только в клетках, практически все молекулы СО2, участвующие в реакции гидратации, должны сначала поступить в эритроциты. Следующая реакция в цепи химических превращений СО2 заключается в диссоциации слабой кислоты Н2СО2 на ионы бикарбоната и водорода.
Накопление НСО3– в эритроците приводит к тому, что между его внутренней средой и плазмой крови создается диффузионный градиент. Ионы НСО3– могут передвигаться по этому градиенту лишь в том случае, если при этом не будет нарушаться равновесное распределение электрических зарядов. В связи с этим одновременно с выходом каждого иона НСО3– должен происходить либо выход из эритроцита одного катиона, либо вход одного аниона.
Поскольку мембрана эритроцита практически непроницаема для катионов, но сравнительно легко пропускает небольшие анионы, взамен НСО3– в эритроцит поступают ионы хлора. Этот обменный процесс называется хлоридным сдвигом.
Углекислый газ может связываться также путем непосредственного присоединения к аминогруппам белкового компонента гемоглобина. При этом образуется так называемая карбаминовая связь. Гемоглобин, связанный с СО2, называется карбогемоглобином.

Рисунок 8. Схема процессов, происходящих в эритроцитах при поглощении или отдаче кровью кислорода и углекислого газа.
Содержание углекислого газа, находящегося в крови в виде химических соединений, непосредственно зависит от его напряжения. В свою очередь, величина рСО2 определяется скоростью образования СО2 в тканях и его выделения легкими. Зависимость содержания СО2 от его напряжения описывается кривой, аналогичной кривой диссоциации оксигемоглобина.
В легких происходит диссоциация соединений углекислого газа и выделение из организма углекислого газа. Начинается выход в альвеолы физически растворенного СО2 из плазмы крови, вследствие наличия градиента парциального давления РСО2 между альвеолами (40 мм.рт.ст.) и венозной кровью (46 мм.рт.ст.). Это ведет к уменьшению напряжения РСО2 в крови. Присоединение кислорода к гемоглобину ведет к уменьшению сродства углекислого газа к гемоглобину и расщепления карбогемогдобина.
Зависимость содержания СО2 от степени оксигенации гемоглобина называется эффектом Холдейна. Данный эффект частично обусловлен различной способностью оксигемоглобина и дезоксигемоглобина к образованию карбаминовой связи.
Газообмен а тканях
Газообмен в тканях так же, как и газообмен в легких зависит, от следующих факторов:
1. градиента напряжения газов между кровью и клетками
2. состояния мембран;
3. площади диффузии;
4. коэффициента диффузии.
В легких кровь из венозной превращается в артериальную:
– богатую кислородом
– бедную углекислым газом.
Артериальная кровь направляется к тканям, где в результате постоянно протекающих окислительных процессов потребляется кислород и образуется углекислый газ. В тканях напряжение кислорода близко к 0, а напряжение углекислого газа = 60 мм рт. ст.
Вследствие разности давления углекислый газ из ткани диффундирует в кровь, а кислород – в ткани. Кровь становится венозной, по венам поступает в легкие, где повторяется цикл обмена газов.

