- Биологические
- История
- Методы регистрации
- Получение
- Получение кислорода в лаборатории
- Применение
- Примечания
- Ракетное топливо
- Распространенность оксигена в природе
- Свойства и применение кислорода
- Физиологическое действие
- Физические свойства
- Физические свойства углекислого газа:
- Химические
- Химические свойства углекислого газа. химические реакции (уравнения) углекислого газа:
Биологические
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки[22].
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и мало в артериальной крови.
Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[23].
Содержание углекислого газа в крови человека приблизительно таково:
Углекислый газ транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом.
Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа.
Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторовауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты.
Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови.
Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты)[источник не указан 764 дня].
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя организм человека требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание).
В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию).
Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётахстюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[26].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 50 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10—20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра.
Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох.
В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановятся, а затем восстановится и сознание).
Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению)[источник не указан 1699 дней]. Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
История
Двуокись углерода была одним из первых газов, получивших название. В XVII веке фламандский химик Йохан Баптиста ван Гельмонт заметил, что масса древесного угля уменьшалась, когда он сжигался, потому что масса оставшейся золы была меньше массы используемого древесного угля.
Свойства углекислого газа более тщательно изучил шотландский врач Джозеф Блэк. В 1754 году он обнаружил, что при смешивании растворов карбоната кальция с кислотами выделяется газ, который он назвал неподвижным воздухом[11].
Он понял, что он тяжелее воздуха и не поддерживает процессы горения. Когда этот газ вводили в раствор гидроксида кальция, он мог образовывать осадок. С помощью этого явления он показал, что углекислый газ содержится в дыхании млекопитающих и выделяется в результате микробиологической ферментации.
Джозефу Пристли удалось создать первую газированную воду в 1772 году, переведя серную кислоту в известковый раствор и растворив полученный диоксид углерода в стакане с водой[13].
Однако Уильям Браунригг[en] обнаружил связь между углекислым газом и угольной кислотой гораздо раньше.
В 1823 году Гэмфри Дэви и Майкл Фарадей сжижили углекислый газ, увеличив давление[14]. Первое описание твердого углекислого газа принадлежит Адриену Тилорье, который открыл в 1834 году герметичный контейнер с жидким углекислым газом и обнаружил, что при самопроизвольном испарении происходит охлаждение, с образованием в результате твердого СО2[15].
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации СО2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Для измерения низких концентраций СО2 (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[29].
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[30].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Получение
- В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов[27] (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбироватьCO2{displaystyle {ce {CO2}}}, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа[27]:
- CaCO3 2HCl⟶CaCl2 H2O CO2↑{displaystyle {ce {CaCO3 2HCl -> CaCl2 H2O CO2 ^}}}.
Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который замедляет реакцию, и который удаляется значительным избытком кислоты с образованием кислого сульфата кальция.
Для приготовления сухих напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Также для получения углекислого газа применяется экзотермическая реакция горения углерода в кислороде[27]:
- C O2⟶CO2↑ 394kJ{displaystyle {ce {C O2 -> CO2 ^ 394 kJ}}}.
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий
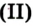 Рис. 54.Получение кислорода нагреванием меркурий
Рис. 54.Получение кислорода нагреванием меркурий оксида
оксида
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
Небольшое количество катализатора — манган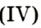
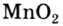
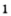 Получение кислорода разложением гидроген пероксида
Получение кислорода разложением гидроген пероксида 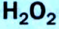 Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган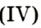
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 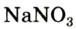

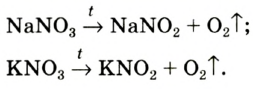
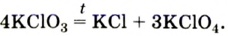
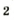 селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока: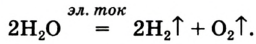
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляцииновообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
При сооружении московского метро в XX веке жидкая углекислота использовалась для заморозки грунта.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространённый метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги.
Углекислый газ используется для газирования лимонада, газированной воды и других напитков. Углекислый газ используется также в качестве защитной среды при сваркепроволокой, но при высоких температурах происходит его распад с выделением кислорода.
Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру 31 °С. В стандартный 40-литровый баллон заливают около 20 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см2).
Если температура будет выше 31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см2), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при их посадке внатяжку) и так далее. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Примечания
- ↑Carbon Dioxide - Thermophysical Properties (неопр.). Дата обращения: 23 ноября 2022.Архивировано 24 ноября 2022 года.
- ↑Carbon dioxide: Immediately Dangerous to Life or Health Concentrations (IDLH) (неопр.). Дата обращения: 7 марта 2020.Архивировано 20 апреля 2022 года.
- ↑name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007-76. Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования
- ↑Раков Э. Г., Углерода диоксид, 2022.
- ↑Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Дата обращения: 24 сентября 2022.Архивировано 5 февраля 2022 года.
- ↑Jochem Marotzke; Martin Stratmann.Die Zukunft des Klimas : neue Erkenntnisse, neue Herausforderungen : ein Report der Max-Planck-Gesellschaft (нем.). — München: C. H. Beck, 2022. — S. 9—22. — ISBN 978-3-406-66968-2, 3-406-66968-9.
- ↑Eggleton, R. A.A short introduction to climate change (англ.). — Cambridge: CUP, 2022. — 240 p. — ISBN 978-1-139-52435-3, 1-139-52435-6, 978-1-139-62739-9, 1-139-62739-2, 978-1-283-94302-4, 1-283-94302-6, 978-1-139-62794-8, 1-139-62794-5, 1-139-62705-8, 978-1-139-62705-4.Архивная копия от 21 апреля 2020 на Wayback Machine
- ↑Treibhausgas-Konzentration erreicht neuen Rekordwert (нем.). klimareporter°. Дата обращения: 22 сентября 2020.Архивировано 21 октября 2020 года.
- ↑Chen Zhou, Mark D. Zelinka & Stephen A. Klein.Impact of decadal cloud variations on the Earth’s energy budget (англ.). Nature Geoscience. Дата обращения: 4 декабря 2022.Архивировано 13 октября 2022 года.
- ↑Brock, William H. 1936-.Viewegs Geschichte der Chemie. — Braunschweig. — С. 35. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑Brock, William H. 1936-.Viewegs Geschichte der Chemie. — Braunschweig. — С. 50. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑Brock, William H. 1936-.Viewegs Geschichte der Chemie. — Braunschweig. — С. 72. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑Joseph Priestley.XIX. Observations on different kinds of air. // Philosophical Transactions of the Royal Society of London. — 1772-01-01. — Т. 62. — С. 147–264. — doi:10.1098/rstl.1772.0021. Архивировано 12 октября 2020 года.
- ↑XVIII. On the application of liquids formed by the condensation of gases as mechanical agents (EN) // Philosophical Transactions of the Royal Society of London. — 1823-12-31. — Т. 113. — С. 199–205. — ISSN2053-9223 0261-0523, 2053-9223. — doi:10.1098/rstl.1823.0020.
- ↑Joost Mertens.Du côté d’un chimiste nommé Thilorier // L’Année balzacienne. — 2003. — Т. 4, вып. 1. — С. 251. — ISSN0084-6473. — doi:10.3917/balz.004.0251.
- ↑Die Zukunft des Klimas : neue Erkenntnisse, neue Herausforderungen : ein Report der Max-Planck-Gesellschaft. — München: C.H. Beck, 2022. — С. 125. — 123-136 с. — ISBN 978-3-406-66968-2, 3-406-66968-9.
- ↑Kappas, M. (Martin).Klimatologie : Klimaforschung im 21. Jahrhundert - Herausforderung für Natur- und Sozialwissenschaften. — Heidelberg: Spektrum Akademischer Verlag, 2009. — С. 159. — 1 online resource с. — ISBN 978-3-8274-2242-2, 3-8274-2242-6.
- ↑Permafrost - Auf dünnem Eis (нем.). Deutschlandfunk. Дата обращения: 22 сентября 2020.Архивировано 22 октября 2020 года.
- ↑International Permafrost Association Country Reports (англ.). International Permafrost Association. Дата обращения: 22 сентября 2020.Архивировано 31 августа 2020 года.
- ↑NABU - Moore und Klimawandel (нем.). NABU - Naturschutzbund Deutschland e.V.. Дата обращения: 22 сентября 2020.Архивировано 20 января 2021 года.
- ↑Егоров А. С. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- ↑7. How much carbon dioxide do humans contribute through breathing?. Frequent Questions — Emissions (англ.).US EPA.Дата обращения: 4 декабря 2022.Архивировано 2 февраля 2022 года.
- ↑Charles Henrickson. Chemistry (англ.). — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1234Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- ↑ 12Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 123Glinka, Nikolaj Leonidovič (1882-1965).Obŝaâ himiâ. — Izd. 27-e ster. — Leningrad: «Himiâ», 1988. — 702, [2] s. с. — ISBN 5724500035, 9785724500036.
- ↑Большая Энциклопедия Нефти и Газа.
- ↑ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. Определение состава методом газовой хроматографии с оценкой неопределённости. Часть 6. Определение водорода, гелия, кислорода, азота, диоксида углерода и углеводородов C1 — C8 с использованием трёх капиллярных колонок (рус.). Docs.cntd.ru. — М.: Стандартинформ, 2009.. Дата обращения: 4 декабря 2022.Архивировано 4 декабря 2022 года.
- ↑Бялко А. В. Растения убыстряют рост // Природа. — 1996. — № 10. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑Carbon dioxide poisoning: a literature review of an often forgotten cause of intoxication in the emergency department (неопр.). Дата обращения: 3 марта 2020.Архивировано 1 ноября 2020 года.
- ↑name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.005-76. Воздух рабочей зоны. Общие санитарно-гигиенические требования
- ↑name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 8050-85 Двуокись углерода
- ↑Rauchvergiftungen/Vergiftungen durch Gase (TK) (неопр.). web.archive.org (4 июня 2022). Дата обращения: 22 сентября 2020.
- ↑Deutsches Rotes Kreuz.Vergiftungen und Hilfe bei Erbrechen - Erste Hilfe (нем.). DRK e.V. (17 июня 2020). Дата обращения: 22 сентября 2020.Архивировано 23 октября 2020 года.
- ↑Carbon Dioxide - Life and Death (неопр.). web.archive.org (22 мая 2022). Дата обращения: 22 сентября 2020.
- ↑Greenwood, Veronique.Is Conference Room Air Making You Dumber? : [англ.] // The New York Times : газ. — 2022. — 6 May.
- ↑Ventilation rates and carbon dioxide concentrations in schools. — In: Ventilation with Outdoor Air : [англ.] // Berkeley Lab : [сайт]. — 2022.
- ↑Сорокин, Андрей.«Глобальное потепление отупляет. От этого уже страдают школьники и офисные работники» // Republic : [сайт]. — 2020. — 7 января.
- ↑ (англ.)Glatte Jr H. A., Motsay G. J., Welch B. E.Carbon Dioxide Tolerance Studies (англ.) // Brooks AFB, TX School of Aerospace Medicine Technical Report. — 1967. — Vol. SAM—TR—67—77. Архивировано 9 мая 2008 года.
- ↑name=https://docs.cntd.ru_ПДК (недоступная ссылка) вредных веществ в воздухе рабочих помещений
Ракетное топливо
В качестве окислителя для ракетноготоплива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения.
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
Медицинский кислород хранится в металлических газовых баллонах высокого давления (для сжатых или сжиженных газов) голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей.
Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки.
Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха.
Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометруредуктора) умножают на величину ёмкости баллона в литрах.
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавкиE948[9], как пропеллент и упаковочный газ.
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 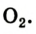
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 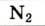 | 78,09 | 75,51 |
| Кислород | 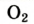 | 20,95 | 23,15 |
| Аргон | 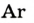 | 0,93 | 1,28 |
| углекислый газ | 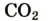 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой 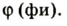
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52).
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 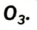 Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород:
Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород: 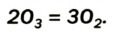
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
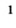
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 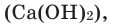
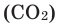
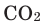
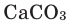
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ (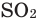
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (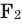
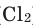
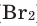
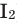
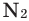
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (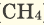
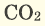
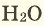
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода.
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Физиологическое действие
Углекислый газ [31]нетоксичен, однако при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам (англ.) (рус..
В соответствии с ГОСТом 12.1.007-76 диоксид углерода относится к вреднымвеществам IV классаопасности[32][33].
Растворенный в крови углекислый газ активирует дыхательный центр мозга в физиологических и несколько повышенных концентрациях. Незначительные повышения концентрации, вплоть до 0,2−0,4 % (2000−4000 ppm), в помещениях приводят к развитию у людей сонливости и слабости.
В значительно более высоких концентрациях он приводит к снижению или устранению рефлекторного респираторного раздражителя, сначала к угнетению дыхания и, наконец, к остановке дыхания[34]. От 5 % углекислого газа во вдыхаемом воздухе возникают головные боли и головокружение, при более высоких концентрациях учащенное сердцебиение (тахикардия), повышение артериального давления, одышка и потеря сознания, так называемая углекислотная анестезия.
Концентрация углекислого газа свыше 8 % приводит к отравлению с последующим смертельным исходом в течение 30-60 минут[35][36]. Накопление углекислого газа в крови называется гиперкапнией.
Для помещений нормальным является уровень CO2 около 600 ppm (частей на миллион). Повышенные концентрации углекислого газа снижают когнитивные способности людей. Уже при 1200 ppm расширяются кровеносные сосуды в мозге, снижается активность нейронов и уменьшается объём коммуникации между регионами мозга[37].
В школьных классах типичной является концентрация 2000−2500, а общий разброс значений — от 1000 до 6000, это вызывает обеспокоенность у исследователей[38], поскольку выявлено снижение результатов учеников, выполняющих тестовые задания в душных помещениях[39].
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия[40].
Рекомендуемая ПДК в воздухе рабочей зоны для диоксида углерода составляет 9000 мг/м3[41].
Физические свойства
В мировом океане содержание растворённого O2 больше в холодной воде, а меньше — в тёплой.
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при 50 °C) и спирте (2,78 мл/100 г при 25 °C).
Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
Твёрдый кислород (температура плавления −218,35°C) — синие кристаллы.
Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейкиa=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°[4].
- β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°[4].
- γ-О2 — существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å[4].
Ещё три фазы образуются при высоких давлениях:
Физические свойства углекислого газа:
| Наименование параметра: | Значение: |
| Химическая формула | CO2 |
| Синонимы и названия иностранном языке | углерода двуокись (рус.) углерода диоксид (рус.) угольный ангидрид (рус.) оксид углерода (IV) carbon dioxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветный газ |
| Цвет | бесцветный |
| Вкус | кисловатый вкус |
| Запах | почти без запаха (в больших концентрациях с кисловатым «содовым» запахом) |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (состояние вещества – твердое вещество, при -79 °C и атмосферном давлении 1 атм.), кг/м3 | 1561 |
| Плотность (состояние вещества – твердое вещество, при -79 °C и атмосферном давлении 1 атм.), г/см3 | 1,561 |
| Плотность (состояние вещества – жидкость, при -60 °C и атмосферном давлении 1 атм.), кг/м3 | 1190 |
| Плотность (состояние вещества – жидкость, при -60 °C и атмосферном давлении 1 атм.), г/см3 | 1,19 |
| Плотность (состояние вещества – жидкость, при -37 °C и атмосферном давлении 1 атм.), кг/м3 | 1101 |
| Плотность (состояние вещества – жидкость, при -37 °C и атмосферном давлении 1 атм.), г/см3 | 1,101 |
| Плотность (состояние вещества – жидкость, при 0 °C и атмосферном давлении 35,5 атм.), кг/м3 | 925 |
| Плотность (состояние вещества – жидкость, при 0 °C и атмосферном давлении 35,5 атм.), г/см3 | 0,925 |
| Плотность (состояние вещества – газ, при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,9768 |
| Плотность (состояние вещества – газ, при 0 °C и атмосферном давлении 1 атм.), г/см3 | 0,0019768 |
| Температура сублимации (возгонки), °C | -78,5 |
| Критическая температура*, °C | 31 |
| Критическое давление, МПа | 7,387 |
| Критический удельный объём, м3/кг | 0,468 |
| Критическая точка | 31 °C, 7,38 МПа |
| Тройная точка | −56,6 °C, 0,52 МПа |
| Молярная масса, г/моль | 44,01 |
| Растворимость в воде, г/100 г | 0,3803 при 16 °C, 0,3369 при 20 °C, 0,2515 при 30 °C |
| Теплопроводность, Вт/(м·K) | 0,0166 |
| Удельная теплоемкость, Дж/(кг·К) | 849 |
| Удельная теплота испарения, кДж/кг | 379,5 |
| Удельная теплота плавления, кДж/кг | 205 |
| Стандартная энтальпия образования ΔH (при 298 К, для состояния вещества – газ), кДж/моль | -393,51 |
| Стандартная энергия Гиббса образования ΔG (при 298 К, для состояния вещества – газ), кДж/моль | -394,38 |
| Стандартная энтропия вещества S (при 298 К, для состояния вещества – газ) | 213,68 |
| Стандартная мольная теплоемкость Cp (298 К, для состояния вещества – газ), Дж/(моль·K) | 37,11 |
| Энтальпия плавления ΔHпл, кДж/моль | 8,37 |
| Энтальпия возгонки ΔHвозг, кДж/моль | 25,23 |
| Скорость звука в веществе (при 20°C, состояние среды – газ), м/с | 274,6 |
| Давление паров, мм.рт.ст. | 0,000001 (при -186,4°C), 0,00001 (при -180,7°C), 0,0001 (при -174,3°C), 0,001 (при -166,8°C), 0,01 (при -158°C), 2,31 (при -130°C), 9,81 (при -120°C), 34,63 (при -110°C), 104,81 (при -100°C), 279,5 (при -90°C), 672,2 (при -80°C), 1486,1 (при -70°C), 3073,1 (при -60°C), 5127,8 (при -50°C), 7545 (при -40°C), 10718 (при -30°C), 14781 (при -20°C), 19872 (при -10°C), 26142 (при 0°C), 33763 (при 10°C), 42959 (при 20°C), 54086 (при 30°C) |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует нестойкую угольную кислоту. Реагирует со щёлочами с образованием её солей — карбонатов и гидрокарбонатов.
Оксид углерода(IV) останавливает горение, вытесняя кислород из зоны реакции. В нём горят только некоторые активные металлы[21]:
- 2Mg CO2⟶2MgO C{displaystyle {ce {2Mg CO2 -> 2MgO C}}}.
Взаимодействие с оксидом активного металла:
- CaO CO2⟶CaCO3{displaystyle {ce {CaO CO2 -> CaCO3}}}.
При растворении в воде образует равновесную смесь раствора диоксида углерода и угольной кислоты, причём равновесие сильно сдвинуто в сторону разложения кислоты:
- CO2↑ H2O⇄H2CO3{displaystyle {ce {CO2uparrow H2Orightleftarrows H2CO3}}}.
Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
- Ca(OH)2 CO2⟶CaCO3↓ H2O{displaystyle {ce {Ca(OH)2 CO2 -> CaCO3 v H2O}}} (качественная реакция на углекислый газ),
- KOH CO2⟶KHCO3{displaystyle {ce {KOH CO2 -> KHCO3}}}.
Химические свойства углекислого газа. химические реакции (уравнения) углекислого газа:
Диоксид углерода относится к кислотным оксидам, поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия оксида углерода (IV) и водорода:
CO2 4H2 → CH4 2H2O (t ~ 200 °C, kat = Cu2O).
В результате реакции образуются метан и вода.
2. реакция взаимодействия оксида углерода (IV) и углерода:
CO2 C ⇄ 2CO (t = 700-1000 °C).
В результате реакции образуется оксид углерода (II). Реакция протекает при взаимодействии углекислого газа с раскаленными углями.
3. реакция взаимодействия оксида углерода (IV) и магния:
CO2 2Mg → 2MgO C (t ~ 500 °C).
В результате реакции образуются оксид магния и углерод.
4. реакция взаимодействия оксида углерода (IV) и гафния:
Hf CO2 → HfC HfO2 (t = 800-1000 °C).
В результате реакции образуются карбид гафния и оксид гафния.
5. реакция взаимодействия оксида углерода (IV) и германия:
Ge CO2 → GeO CO (t = 700-900 °C).
В результате реакции образуются оксид германия и оксид углерода (II).
6. реакция взаимодействия оксида углерода (IV) и цинка:
Zn CO2 → ZnO CO (t = 800-950 °C).
В результате реакции образуются оксид цинка и оксид углерода (II).
7. реакция взаимодействия оксида углерода (IV) и индия:
2In CO2 → In2O CO (t ~ 850 °C).
В результате реакции образуются оксид индия и оксид углерода (II).
8. реакция взаимодействия оксида углерода (IV) и циркония:
2Zr CO2 → ZrC ZrO2 (t = 800-100 °C).
В результате реакции образуются карбид циркония и оксид циркония.
9. реакция взаимодействия оксида углерода (IV) и вольфрама:
W 2CO2 → WO2 2CO (t ~ 1200 °C).
В результате реакции образуются оксид вольфрама и оксид углерода (II).
10. реакция взаимодействия оксида углерода (IV) и оксида лития:
Li2O CO2 → Li2CO3.
В результате реакции образуется карбонат лития.
11. реакция взаимодействия оксида углерода (IV) и оксида натрия:
Na2O CO2 → Na2CO3 (t = 450-550 °C).
В результате реакции образуется карбонат натрия.
12. реакция взаимодействия оксида углерода (IV) и оксида калия:
K2O CO2 → K2CO3 (t ~ 400 °C).
В результате реакции образуется карбонат калия.
13. реакция взаимодействия оксида углерода (IV) и оксида бария:
BaO CO2 → BaCO3.
В результате реакции образуется карбонат бария.
14. реакция взаимодействия оксида углерода (IV) и оксида кальция:
CaO CO2 → CaCO3.
В результате реакции образуется карбонат кальция.
15. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
CaCO3 CO2 H2O → Ca(HCO3)2.
В результате реакции образуется гидрокарбонат кальция.
16. реакция взаимодействия оксида углерода (IV) и оксида магния:
MgO CO2 → MgCO3.
В результате реакции образуется карбонат магния.
17. реакция взаимодействия оксида углерода (IV) и оксида кремния (II):
SiO CO2 → SiO2 CO (t ~ 500 °C).
В результате реакции образуются оксид кремния (IV) и оксид углерода (II).
18. реакция взаимодействия оксида углерода (IV) и воды:
CO2 H2O ⇄ H2CO3.
В результате реакции образуется угольная кислота.
19. реакция взаимодействия оксида углерода (IV) и гидроксида лития:
2LiOH CO2 → Li2CO3 H2O.
В результате реакции образуются карбонат лития и вода. В ходе реакции используется концентрированный раствор гидроксида лития.
20. реакция взаимодействия оксида углерода (IV) и гидроксида калия:
KOH CO2 → KHCO3,
2KOH CO2 → K2CO3 H2O.
В первом случае в результате реакции образуются гидрокарбонат калия, во втором случае – карбонат калия и вода. Реакция протекает в первом случае в этаноле и используется разбавленный раствор гидроксида калия, во втором используется концентрированный раствор гидроксида калия.
21. реакция взаимодействия оксида углерода (IV) и гидроксида натрия:
NaOH CO2 → NaHCO3,
2NaOH CO2 → Na2CO3 H2O.
В первом случае в результате реакции образуются гидрокарбонат натрия, во втором – карбонат натрия и вода. В ходе первой реакции используется разбавленный раствор гидроксида натрия, в ходе второй – концентрированный раствор гидроксида натрия.
22. реакция взаимодействия оксида углерода (IV) и гидроксида кальция:
Ca(OH)2 CO2 → CaCO3 H2O.
В результате реакции образуются карбонат кальция и вода.
23. реакция взаимодействия оксида углерода (IV) и гидроксида бария:
Ba(OH)2 CO2 → BaCO3 H2O.
В результате реакции образуются карбонат бария и вода.
24. реакция взаимодействия оксида углерода (IV) и метана:
CH4 CO2 → 2CO 2H2 (t = 800-900 °C, kat = NiO, нанесенный на Al2O3).
В результате реакции образуются оксид углерода (II) и вода.
25. реакция термического разложения оксида углерода (IV):
2CO2 → 2CO O2 (t > 2000 °C).
В результате реакции образуются оксид углерода (II) и кислород.
26. реакция фотосинтеза:
6CO2 6H2O → C6H12O6 6O2 (hv, kat = хлорофилл).
В результате реакции образуются глюкоза и кислород.









