- Влияние на организм.
- Гидролиз карбонатов и гидрокарбонатов
- Диоксид углерода (углекислый газ)
- Как не отравиться? правила безопасности
- Как со ведет себя в организме
- Карбиды
- Нахождение в природе
- Общая характеристика элементов iva группы
- Оксид углерода ii — сo
- Оксиды углерода — урок. химия, 9 класс.
- Свойства токсичного вещества
- Соединения углерода
- Строение молекулы
- Строение молекулы и физические свойства
- Угарный газ и кислород
- Угарный газ, свойства, физиологическое действие на организм. углекислый газ, угольная кислота и ее соли
- Угольная кислота и карбонаты
- Условия появления угара в помещении
- Физические свойства
- Химические свойства
- Электронное строение углерода
- Этиология и патогенез
Влияние на организм.
Угарный газ очень ядовит. Первыми признаками острого отравления СО являются головная боль и головокружение, в дальнейшем наступает потеря сознания. Предельно допустимая концентрация СО в воздухе промышленных предприятий считается 0,02 мг/л. Основным противоядием при отравлении СО служит свежий воздух. Полезно также кратковременное вдыхание паров нашатырного спирта.
Чрезвычайная ядовитость СО, отсутствие у него цвета и запаха, а также очень слабое поглощение его активированным углём обычного противогаза делают этот газ особенно опасным. Вопрос защиты от него был разрешён изготовлением специальных противогазов, коробка которых заполнялась смесью различных оксидов (в основном MnO2 и CuO).
Гидролиз карбонатов и гидрокарбонатов
Растворимые карбонаты и гидрокарбонаты гидролизуются по аниону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: CO32- H2O = HCO3— OH—
II ступень: HCO3— H2O = H2CO3 OH—
Однако карбонаты и гидрокарбонаты алюминия, хрома (III) и железа (III) гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Al2(SO4)3 6NaHCO3 → 2Al(OH)3 6CO2 3Na2SO4
2AlBr3 3Na2CO3 3H2O → 2Al(OH)3↓ CO2↑ 6NaBr
Al2(SO4)3 3K2CO3 3H2O → 2Al(OH)3↓ 3CO2↑ 3K2SO4
Более подробно про гидролиз можно прочитать в соответствующей статье.
Диоксид углерода (углекислый газ)
Способы получения углекислого газа
- CO2 – Конечный продукт окисления органических веществ в клетках аэробных организмов
- Образуется
при действии сильных
кислот на карбонаты
(растворимые и нерастворимые) и гидрокарбонаты
металлов:
CaCO3 2HCl → CaCl2 H2O CO2
NaHCO3 HBr → NaBr H2O CO2
2AlCl3 3K2CO3 3H2O → 2Al(OH)3↓ CO2↑ 6KCl
- При
термическом разложении нерастворимых
карбонатов и при разложении растворимых гидрокарбонатов:
CaCO3 → CaO CO2
2NaHCO3 → Na2CO3 H2O CO2
- При сжигании всех видов топлив:
СxHy O2 = H2O CO2
- При
спиртовом брожении глюкозы под действием ферментов:
С6H12O6 → 2CO2 2C2H5OH
Химические свойства углекислого газа
Углекислый
газ — типичный кислотный
оксид. Проявляет слабые окислительные
свойства
Ca(OH)2 CO2 → CaCO3 H2O
- Взаимодействует с водой, но реакция сильно обратима, и с водой соединяется лишь 1% молекул угольной кислоты:
CO2 H2O ↔ H2CO3
- С основными оксидами и сильными основаниями (щелочами), с образованием карбонатов или гидрокарбонатов. При этом возможно образование как кислых, так и средних солей:
Na2O CO2 → 2Na2CO3
KOH CO2 → KHCO3
2KOH CO2 → K2CO3 H2O
- С карбонатами, с образованиемгидрокарбонатов:
Na2CO3 CO2 H2O → 2NaHCO3
- С водными растворами солей, образованными кислотами, слабее угольной (очень слабые кислоты):
Na2SiO3 CO2 H2O = H2SiO3 Na2CO3
C6H5OK CO2 H2O → C6H5OH KHCO3
- С
некоторыми восстановителями:
CO2 3H2 → 2CН3OН H2O
CO2 C → 2CO
2Мg
CO2→C
2MgO
Внимание! Магнийгорит в атмосфере углекислого газа, поэтому горящий магний нельзя тушить углекислотными огнетушителями.
- В листьях растений на свету из CO2 и H2O образуются углеводы и кислород:
nCO2 mH2O = Cn(H2O)m nO2
- С пероксидом натрия, с образованием карбоната натрия:
2CO2 2Na2O2 → 2Na2CO3 O2
- Синтез карбамида (мочевины):
CO2 2NH3 = CO(NH2)2 H2O
- Получение питьевой соды по методу Сольвэ:
NaCl CO2 NH3 H2O= NaHCO3 NH4Cl
Как не отравиться? правила безопасности
МЧС разработали правила безопасности по недопущению отравления угарным газом, которые включают в себя:
- Если человек находится в горящем помещении, нагнуть голову как можно ниже к полу и срочно выбираться из огня, ведь СО легче кислорода, поэтому держится в верхней части помещения;
- Не заводите автомобиль в замкнутом пространстве, гараже – только при открытом помещении;
- Периодическая проверка исправности вытяжной системы, вентиляции помещения;
- Установка в жилом помещении системы контроля загазованности;
- Своевременно производить чистку дымоходов;
- Проводить профилактический осмотр газового оборудования с проверкой оного на предмет утечек;
- При постройке отопительной системы в доме приглашать проверенных специалистов, которые имеют сертификаты на данный вид деятельности;
- Не покупайте б/у отопительную и газовую технику, а также, если это оборудование сомнительного происхождения/производителя;
- При работе с газовым оборудованием (установка, настройка) использовать индивидуальные защитные средства.
Важно! Прикрытие органов дыхания влажной тканью во время пожара способно частично задержать лишь некоторые продукты горения, однако, молекулы СО настолько мелки, что защититься от них таким приспособлением практически невозможно.
Как со ведет себя в организме
Для начала, откуда окись углерода берется в организме, те самые 10 мл, о которых я говорила выше? В самых общих чертах, он является одним из продуктов реакции превращения гемоглобина в билирубин. Затем он связывается гемоглобином крови и вместе с углекислым газом транспортируется в легкие, чтобы выйти из них при выдохе.
Теперь чуть подробнее про гемоглобин. В его состав входят ионы двухвалентного железа, с помощью которых происходит перенос кислорода, попавшего в организм с воздухом. Именно гемоглобин крови разносит кислород по тканям организма, чтобы они могли нормально функционировать.
Но проблема в том, что монооксид углерода присоединяется к гемоглобину во много раз легче кислорода. Так что, если в воздухе появляется избыток окиси углерода, то она составит успешную конкуренцию кислороду и будет захватывать гемоглобин, не давая кислороду присоединиться к нему.
Карбоксигемоглобин имеет ярко-красную окраску, именно поэтому кожа человека краснеет, кровь и внутренние ткани организма становятся вишнево-красного цвета. Таким образом, при вскрытии (если дойдет до смертельного исхода) сразу становится ясно, от чего умер человек.
Кроме того, монооксид углерода действует не только на гемоглобин. В мышечном белке миоглобине также содержатся ионы железа. С ними угарный газ соединяется, образуя карбоксимиоглобин. Правда, не так легко, как с гемоглобином крови, но, тем не менее, этого хватает, чтобы человек почувствовал мышечную слабость, которая является одним из признаков отравления.
Еще пару слов скажу о курении. Не знаю, знаете ли вы или нет, но в табачном дыме содержится до 1% угарного газа. Так что, если вы курите, то автоматически каждый день подвергаете себя хроническому отравлению этим веществом. В случае, если вы окажетесь в ситуации, когда в воздухе превышено содержание окиси углерода (например, на пожаре), то у вас гораздо больше шансов умереть, чем у некурящего человека, так как отравление наступит гораздо быстрее.
Отравлению угарным газом подвергаются также люди, которые не курят, но находятся в помещении, заполненным табачным дымом.
Карбиды
Карбиды – это соединения элементов с углеродом. Карбиды разделяют на ковалентные и ионные в зависимости от типа химической связи между атомами.
| Ковалентные карбиды | Ионные карбиды | ||
| Метаниды | Ацетилениды | Пропиниды | |
| Это соединения углерода с неметаллами Например: SiC, B4C | Это соединения с металлами, в которых с.о. углерода равна -4 Например: Al4C3, Be2C | Это соединения с металлами, в которых с.о. углерода равна -1 Например: Na2C2, CaC2 | Это соединения с металлами, при гидролизе которых образуется пропин Например: Mg2C3 |
| Частицы связаны ковалентными связями и образуют атомные кристаллы. Поэтому ковалентные карбиды химически стойкие. Окисляются только сильными окислителями | Метаниды разлагаются водой или кислотами с образованием метана и гидроксида или соли: Например: Al4C3 12H2O → 4Al(OH)3 3CH4 | Ацетилениды разлагаются водой или кислотами с образованием ацетилена и гидроксида или соли: Например: СаС2 2Н2O → Са(OH)2 С2Н2 | Пропиниды разлагаются водой или кислотами с образованием пропина и гидроксида или соли Например: Mg2C3 4HCl → 2MgCl2 С3Н4 |
Все карбиды проявляют свойства восстановителей и могут быть окислены сильными окислителями.
Например, карбид кремния окисляется концентрированной азотной кислотой при нагревании до углекислого газа, оксида кремния (IV) и оксида азота (II):
SiC 8HNO3→ 3SiO2 3CO2 8NO 4H2O
Нахождение в природе
Основной источник СО в атмосфере Земли — лесные пожары. Ведь главный способ образования данного газа естественным путем — это неполное сгорание различного вида топлива, в основном органической природы.
Антропогенные источники загрязнения воздуха монооксидом углерода так же немаловажны и дают по массовой доле такой же процент, как и природные. К ним относятся:
- дым от работы фабрик и заводов, металлургических комплексов и прочих промышленных предприятий;
- выхлопные газы из двигателей внутреннего сгорания.
В природных условиях угарный газ легко окисляется кислородом воздуха и парами воды до углекислого газа. На этом основана первая помощь при отравлении этим соединением.
Общая характеристика элементов iva группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Оксид углерода ii — сo
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 C → (t) CO
C H2O → (t) CO H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO O2 → CO2
Fe2O3 CO → Fe CO2
FeO CO → Fe CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Fe CO → (t) Fe(CO)5
Оксиды углерода — урок. химия, 9 класс.
- в лаборатории углекислый газ получают действием кислот на карбонаты:
- В промышленности для его получения используют прокаливание известняка:
- в качестве топлива;
- как восстановитель в производстве чугуна;
- для получения метанола.
- в производстве газированных напитков;
- для тушения пожаров;
- для охлаждения пищевых продуктов («сухой лёд»).
Свойства токсичного вещества
В природе и свойствах угарного газа нет ничего необычного. По сути, это продукт частичного окисления угля или угольсодержащих видов топлива. Формула угарного газа проста и незамысловата – СО, в химических терминах — монооксид углерода. Один атом углерода соединен с атомом кислорода.
Угли, родственные им виды топлива, торф, дрова при нагреве в топке газифицируются в угарный газ, и только потом дожигаются притоком воздуха. Если угар просочился из камеры горения в помещение, то он будет оставаться в стабильном состоянии до момента, когда вентиляцией угарный поток будет вынесен из комнаты или накапливаться, заполняя все пространство, от пола до потолка.
Что необходимо знать об угарном газе:
- В стандартных условиях плотность угарного газа – 1,25 кг/м3, что очень близко к удельному весу воздуха 1,25 кг/м3. Горячий и даже теплый монооксид легко поднимается под потолок, по мере остывания оседает и перемешивается с воздухом;
- Угарный газ не имеет вкуса, цвета и запаха, даже в условиях высокой концентрации;
- Для начала образования угарного газа достаточно нагреть металл, контактирующий с углеродом, до температуры в 400-500оС;
- Газ способен гореть в воздухе с выделением большого количества тепла, примерно 111 кДж/моль.
Опасно не только вдыхание угарного газа, газовоздушная смесь способна взрываться при достижении объемной концентрации от 12,5% до 74%. В этом смысле газовая смесь похожа на бытовой метан, но гораздо опаснее сетевого газа.
Метан легче воздуха и менее токсичен при вдыхании, кроме того, благодаря добавке в газовый поток специальной присадки – меркаптана, его наличие в помещении легко уловить по запаху. При небольшой загазованности кухни можно без последствий для здоровья войти в помещение и проветрить его.
С угарным газом все сложнее. Близкое родство СО и воздуха препятствует эффективному удалению токсичного газового облака. По мере охлаждения облако газа будет постепенно оседать в области пола. Если сработал датчик угарного газа, или обнаружилась утечка продуктов горения из печи или котла на твердом топливе, необходимо немедленно принимать меры к проветриванию, иначе первыми пострадают дети и домашние питомцы.
Подобное свойство угарного облака ранее широко использовалось для борьбы с грызунами и тараканами, но эффективность газовой атаки значительно ниже современных средств, а риск заработать отравление несоизмеримо выше.
К сведению! Газовое облако СО, при отсутствии вентиляции, способно сохранять свои свойства без изменений длительное время.
При наличии подозрения в накоплении угарного газа в подвальных помещения, подсобках, котельных, погребах первым делом необходимо обеспечить максимальное проветривание с кратностью газообмена 3-4 единицы в течение часа.
Соединения углерода
Основные степени окисления углерода — 4, 2, 0, -1 и -4.
Наиболее типичные соединения углерода:
| Степень окисления | Типичные соединения |
| 4 | оксид углерода (IV) CO2 угольная кислота H2CO3 карбонаты MeCO3 гидрокарбонаты MeHCO3 |
| 2 | оксид углерода (II) СО муравьиная кислота HCOOH |
| -4 | метан CH4 карбиды металлов (карбид алюминия Al4C3) бинарные соединения с неметаллами (карбид кремния SiC) |
Строение молекулы
Во-первых, по эмпирической формуле видно, что валентность углерода в соединении равна II. Так же, как и у кислорода. Следовательно, каждый из них может сформировать по две связи. Химическая формула угарного газа СО это наглядно подтверждает.
Так и происходит. Между атомом углерода и кислорода по механизму обобществления неспаренных электронов происходит образование двойной ковалентной полярной связи. Таким образом, структурная формула угарного газа принимает вид С=О.
Однако на этом особенности молекулы не заканчиваются. По донорно-акцепторному механизму в молекуле происходит формирование третьей, дативной или семиполярной связи. Чем это объясняется? Так как после образования ковалентных связей по обменному порядку у кислорода остается две пары электронов, а у атома углерода — пустая орбиталь, то последний выступает в роли акцептора одной из пар первого. Другими словами, пара электронов кислорода размещается на свободной орбитали углерода и происходит образование связи.
Так, углерод — акцептор, кислород — донор. Поэтому формула угарного газа в химии принимает следующий вид: С≡О. Такая структуризация сообщает молекуле дополнительную химическую стабильность и инертность в проявляемых свойствах при обычных условиях.
Итак, связи в молекуле монооксида углерода:
- две ковалентные полярные, образованные по обменному механизму за счет обобществления неспаренных электронов;
- одна дативная, сформированная по донорно-акцепторному взаимодействию между парой электронов и свободной орбиталью;
- всего связей в молекуле — три.
Строение молекулы и физические свойства
Оксид углерода (IV) (углекислый газ) — газ без цвета и запаха. Тяжелее воздуха. Замороженный углекислый газ называют также «сухой лед». Сухой лед легко подвергается сублимации — переходит из твердого состояния в газообразное.
Смешивая сухой лед и различные вещества, можно получить интересные эффекты. Например, сухой лед в пиве:
Углекислый газ не горит, поэтому его применяют при пожаротушении.
Молекула углекислого газа линейная, атом углерода находится в состоянии sp-гибридизации, образует две двойных связи с атомами кислорода:
Обратите внимание! Молекула углекислого газа не полярна. Каждая химическая связь С=О по отдельности полярна, а вся молекула не будет полярна. Объяснить это очень легко. Обозначим направление смещения электронной плотности в полярных связях стрелочками (векторами):
Теперь давайте сложим эти векторы. Сделать это очень легко. Представьте, что атом углерода — это покупатель в магазине. А атомы кислорода — это консультанты, которые тянут его в разные стороны. В данном опыте консультанты одинаковые, и тянут покупателя в разные стороны с одинаковыми силами.
Угарный газ и кислород
Угарный газ и кислород вступают в реакцию взаимодействия при комнатной температуре, катализатором может выступать диоксид марганца или оксид меди (II). Уравнение реакции имеет вид:
![]()
Адсорбенты различных типов (полярные и неполярные) проявляют неодинаковую селективность по отношению к разделяемым соединениям. В качестве адсорбентов применяют тонкодисперсные пористые материалы с удельной поверхностью более 50 ![]() . Полярные адсорбенты (
. Полярные адсорбенты (![]() . Полярные адсорбенты (
. Полярные адсорбенты ( , оксиды металлов, флорисил и др.) имеют на поверхности слабокислотные ОН-группы, способные удерживать вещества с основными свойствами. Эти адсорбенты применяют главным образом для разделения неполярных соединений и соединений со средней полярностью. Недостаток полярных адсорбентов — высокая чувствительность к содержанию воды в растворителях: например, силоксановые группы
, оксиды металлов, флорисил и др.) имеют на поверхности слабокислотные ОН-группы, способные удерживать вещества с основными свойствами. Эти адсорбенты применяют главным образом для разделения неполярных соединений и соединений со средней полярностью. Недостаток полярных адсорбентов — высокая чувствительность к содержанию воды в растворителях: например, силоксановые группы ![]() на поверхности
на поверхности ![]() на поверхности
на поверхности 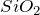 в присутствия воды переходят в силанольные
в присутствия воды переходят в силанольные ![]() , при этом изменяются свойства поверхности и результаты становится невоспроизводимыми.
, при этом изменяются свойства поверхности и результаты становится невоспроизводимыми.
Для ВЭЖХ применяют полярные сорбенты с привитыми полярными группами (амины, диолы и др.), что позволяет менять селективностъ, подбирая подходящий элюент. Неполярные адсорбенты (графитированная сажа, кизельгур, диатомит) не проявляют селективности к полярным молекулам. Используют также сорбенты с привитыми неполярными фазами, например силикагель с алкилсилильными группами от ![]() , при этом изменяются свойства поверхности и результаты становится невоспроизводимыми.
, при этом изменяются свойства поверхности и результаты становится невоспроизводимыми.
Для ВЭЖХ применяют полярные сорбенты с привитыми полярными группами (амины, диолы и др.), что позволяет менять селективностъ, подбирая подходящий элюент. Неполярные адсорбенты (графитированная сажа, кизельгур, диатомит) не проявляют селективности к полярным молекулам. Используют также сорбенты с привитыми неполярными фазами, например силикагель с алкилсилильными группами от  до
до ![]() .
.
Угарный газ, свойства, физиологическое действие на организм. углекислый газ, угольная кислота и ее соли
Урок посвящен изучению свойств и способов получения некоторых неорганических соединений углерода. В нем рассмотрены такие вещества, как оксид углерода (II) (или угарный газ), оксид углерода (IV) (или углекислый газ), угольная кислота, а также карбонаты и гидрокарбонаты.
I. Оксид углерода(II) – СО (угарный газ, окись углерода, монооксид углерода)
Физические свойства:
Бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода 2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):

В связи с этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления только при высоких температурах. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами.
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах):
Видео — опыт: «Получение угарного газа»

C O2 = CO2 402 кДж
CO2 C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
С Н2О = СО Н2 – Q,
смесь СО Н2 – называется синтез – газом.
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH t˚C, H2SO4 → H2O CO
H2C2O4 t˚C,H2SO4→ CO CO2 H2O
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO — несолеобразующий оксид.
1) Взаимодействие с кислородом: 2C 2O O2 t˚C → 2C 4O2↑
2) Взаимодействие с оксидами металлов: CO MexOy = CO2 Me
C 2O CuO t˚C → Сu C 4O2↑
3) Взаимодействие с хлором (на свету)
CO Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* Взаимодействие с расплавами щелочей (под давлением)
CO NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
II. Оксид углерода (IV) СO2 – углекислый газ
Учебный видео-фильм: “Углекислый газ”
Физические свойства:
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение. При обычной температуре и высоком давлении диоксид углерода сжижается. При его испарении поглощается так много теплоты, что часть оксида углерода (IV)превращается в снегообразную массу – «сухой лед» (Рис. 1).

Рис. 1. Сухой лед
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
Строение молекулы:
Углекислый газ имеет следующие электронную и структурную формулы —  O=C=O
O=C=O
Все четыре связи ковалентые полярные.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
CaCO3 t=1200˚C→ CaO CO2
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
Опыт: “Получение углекислого газа в лаборатории”
CaCO3 (мрамор) 2HCl → CaCl2 H2O CO2
NaHCO3 HCl → NaCl H2O CO2
Способы собирания: вытеснением воздуха

3. Сгорание углеродсодержащих веществ:
СН4 2О2 → 2H2O CO2
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства:
Видео: «Химические свойства углекислого газа»
Кислотный оксид:
1) С водой даёт непрочную угольную кислоту:
СО2 Н2О ↔ Н2СО3
2)Рреагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
Na2O CO2 → Na2CO3
2NaOH CO2 → Na2CO3 H2O
NaOH CO2 (избыток) → NaHCO3
3) При повышенной температуре может проявлять окислительные свойства – окисляет металлы: -СO2 Me = MexOy C
С 4O2 2Mg t˚C→ 2Mg 2O C0
Видео: «Горение магния в углекислом газе»
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
Ca(OH)2 CO2 → CaCO3 ↓ H2O
Применение углекислого газа:

Видео: «Тушение пламени углекислым газом»
III. Угольная кислота и её соли
Химическая формула — H2CO3
Структурная формула – все связи ковалентные полярные: 
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
CO2 H2O ↔ H2CO3
Опыт: «Разложение угольной кислоты»
Опыт: «Получение угольной кислоты»
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
H2CO3 ↔ H HCO3—(гидрокарбонат-ион)
HCO3— ↔ H CO32- (карбонат-ион)
2) с активными металлами
H2CO3 Ca = CaCO3 H2↑
3) с основными оксидами
H2CO3 CaO = CaCO3 H2O
4) с основаниями
H2CO3(изб) NaOH = NaHCO3 H2O
H2CO3 2NaOH = Na2CO3 2H2O
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
- Средние соли — карбонаты Na2СO3, (NH4)2CO3
- Кислые соли — бикарбонаты, гидрокарбонаты NaHCO3 , Ca(HCO3)2
В природе встречаются:
CaCO3



Мел Мрамор Известняк
NaHCO3 – питьевая сода
K2CO3(поташ, в золе растений)
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
Na2CO3 CaCl2 = CaCO3↓ 2NaCl
2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 H2O CO2↑
3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO CO2↑
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Опыт: «Взаимопревращение карбонатов и гидрокарбонатов»
гидрокарбонаты в карбонаты
Me(HCO3)n Me(OH)n → MeCO3 H2O
Me(HCO3)n t˚C → MeCO3↓ H2O CO2↑
карбонаты в гидрокарбонаты
MeCO3 H2O CO2= Me(HCO3)n
Специфические свойства:
1) Качественная реакция на CO32- карбонат – ион «вскипание» при действии сильной кислоты:
Na2CO3 2HCl = 2NaCl H2O CO2↑
IV. Задания для закрепления
Задание №1. Закончите уравнения реакций, составьте электронный баланс для каждой из реакций, укажите процессы окисления и восстановления; окислитель и восстановитель:
CO2 C =
C H 2 O =
С O O2 =
CO Al2O3 =
Задание №2. Вычислите количество энергии, которое необходимо для получения 448 л угарного газа согласно термохимическому уравнению
CO2 C = 2CO – 175 кДж
Задание №3. Закончите уравнения осуществимых химических реакций:
CO 2 KOH =
CO Al =
H2CO3 K2SO4 =
CO2( изб ) NaOH =
С O2 Na2O =
CaCO3 CO2 H2O =
CO2 Ca(OH)2 =
CO CaO =
CO2 H2SO4 =
Ca(HCO3)2 Ca(OH)2=
H2CO3 NaCl =
C ZnO =
Задание №4. Осуществите превращения по схеме:
1) Al4C3→ CH4→ CO2→ CaCO3→ Ca(HCO3)2→ CaCO3
2) Ca → CaC2→ Ca(OH)2→ CaCO3→ CO2→ C
3) CO2 → H2CO3 → Na2CO3 → CO2
4) CaCO3 → CO2 → NaHCO3 → Na2CO3
Задание №5. Решите задачи
1.Какой объём углекислого газа выделится при обжиге карбоната кальция массой 200 г
2. Сколько угольной кислоты можно получить при взаимодействии 2 л углекислого газа (н.у.) с водой, если выход кислоты составил 90% по сравнению с теоретическим.
Интерактивное задание LearningApps.org по теме:“Соединения углерода”
ЦОРы
Видео — опыт: «Получение угарного газа»
Учебный видео-фильм: “Углекислый газ”
Видео-опыт: ”Получение углекислого га в лаборатории”
Видео:«Химические свойства углекислого газа»
Видео:«Горение магния в углекислом газе»
Видео:«Тушение пламени углекислым газом»
Опыт: «Разложение угольной кислоты»
Опыт:«Получение угольной кислоты»
Опыт: «Взаимопревращение карбонатов и гидрокарбонатов»
Угольная кислота и карбонаты
Химические свойства угольной кислоты и карбонатов
Угольная
кислота – слабая двухосновная
кислота
Угольная кислота существует только в водном растворе, где количество ее
молекул и анионов в сотни раз меньше, чем количество растворенных молекул
углекислого газа CO2
- Диссоциирует по 2-м ступеням с образованием гидрокарбонат- и карбонат ионов:
H2CO3 ↔ H НCO3—
НCO3— ↔ H CO32-
H2CO3 как индивидуальное соединение неустойчиво и не имеет практического значения, но ее соли устойчивы и нашли широкое применение.
- Растворимыми являются карбонаты щелочных металлов. Высокая степень гидролиза является причиной щелочной реакции их водных растворов рН(0,1 М р-ра) ~ 11,7:
Na2CO3 H2O = NaOH NaHCO3
CO32- H2O = OH— HCO3—
- Все
карбонаты, кроме карбонатов щелочных металлов и аммония при нагревании (более
900ºС) разлагаются до оксида металла и оксида углерода (IV):
CaCO3 → CaO CO2
Карбонат аммония при нагревании разлагается иначе:
(NH4)2CO3 → 2NH3 2H2O CO2
- Качественной реакцией является взаимодействие с кислотами является на ионы СО32─ и НСО3− в результате которой происходит выделение СО2:
Na2CO3 2HCl → 2NaCl
CO2 ↑ H2O
- при взаимодействии с разбавленными растворами соляной или серной кислот происходит выделение углекислого газа, который затем пропускают через раствор известковой воды. При этом наблюдается помутнение раствора:
NaHCO3 HCl → NaCl CO2 ↑ H2O
CO2 Сa(OH)2 = CaCO3↓ H2O
При дальнейшем пропускании раствор вновь становится прозрачным,
помутнение исчезает:
CaCO3 CO2 H2O = Сa(НCO3)2
- Переход в гидрокарбонаты при пропускании CO2 через растворы карбонатов или постепенном добавлении кислот:
Na2CO3 CO2 H2O = 2NaНCO3
Na2CO3 HCl → NaНCO3 NaCl
- Гидрокарбонаты все, кроме NaНCO3 легко растворяются в воде. Водные растворы также имеют щелочную реакцию вследствие гидролиза:
НCO3— H2O = OH— H2CO3
- при нагревании гидрокарбонаты переходят в карбонаты или гидроксиды:
2NaHCO3 → Na2CO3 CO2 ↑ H2O
Mg(HCO3)2 = Mg(OH)2↓ 2CO2↑ H2O
Условия появления угара в помещении
Монооксид углерода можно получить с помощью десятков вариантов химических реакций, но для этого необходимы специфические реактивы и условия их взаимодействия. Риск заработать отравление газом таким способом практически равен нулю. Основными причинами появления угарного газа в котельной или в помещении кухни остаются два фактора:
- Плохая тяга и частичное перетекание продуктов горения из очага горения в помещение кухни;
- Неправильная эксплуатация котельного, газового и печного оборудования;
- Пожары и локальные очаги возгорания пластика, проводки, полимерных покрытий и материалов;
- Отходящие газы из канализационных коммуникаций.
Источником угарного газа может стать вторичное горение золы, рыхлых отложений сажи в дымоходах, копоть и смола, въевшиеся в кирпичную кладку каминных полок и сажегасителей.
Чаще всего источником газового СО становятся тлеющие угли, догорающие в топке при закрытой задвижке. Особенно много выделяется газа при термическом разложении дров в отсутствии воздуха, примерно половину газового облака занимает угарный газ. Поэтому любые эксперименты с копчением мяса и рыбы на дымке, получаемом от тлеющей стружки, должны выполняться только на открытом воздухе.
Незначительное количество угарного газа может появляться и в процессе приготовления пищи. Например, все, кто сталкивался с установкой на кухне газовых отопительных котлов с закрытой топкой, знают, как реагируют датчики угарного газа на жареную картошку или любые продукты, приготовленные в кипящем масле.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз— это модификация углерода с атомной кристаллической решеткой. Алмаз — самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации.
Графит— это аллотропная модификация, в которой атомы углерода находятся в состоянии sp2-гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n
Фуллерен— это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.
В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1. Углерод проявляет свойства окислителя(с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя(с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
C 2F2 → CF4
1.2. При сильном нагревании углерод реагирует с серой и кремниемс образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C 2S → CS2
C Si → SiC
1.3.Углерод не взаимодействует с фосфором.
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
С 2Н2 → СН4
1.4.С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C 3Al → Al4C3
2C Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C0 H2 O → C 2O H20
2.2.Углерод восстанавливает многие металлы из основных и амфотерных оксидов. При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
ZnO C → Zn CO
Также углерод восстанавливает железо из железной окалины:
4С Fe3O4 → 3Fe 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С СаО → СаС2 СО
9С 2Al2O3 → Al4C3 6CO
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
C 2H2SO4(конц) → CO2 2SO2 2H2O
2.4.Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
C 4HNO3(конц) → CO2 4NO2 2H2O
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями, в которых содержатся неметаллы с высокой степенью окисления.
Например, углерод восстанавливает сульфат натрия до сульфида натрия:
4C Na2SO4 → Na2S 4CO
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии:
6С 1s22s22p2 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
Электронная конфигурация углерода в возбужденном состоянии:
6С* 1s22s12p3 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода — от -4 до 4. Характерные степени окисления -4, 0, 2, 4.
Этиология и патогенез
Первая помощь должна быть оказана максимально оперативно, так как угарный газ быстро диффундирует через легочную капиллярную мембрану и связывается с железной частью гемма. Это происходит с примерно в 240 раз большей аффинностью, чем с кислородом.
Степень гемоглобинемии окиси углерода (CO-Hb) является функцией относительного количества СО и кислорода в воздухе, продолжительности воздействия и объема дыхания в минуту.
Некурящие могут иметь до 3% СО в крови, в то время как курильщики имеют уровни 10-15%.
Когда СО связывается с гемом, способность выделять кислород непосредственно в периферическую ткань организма снижается. Таким образом, дефицит кислорода происходит в тканях. CO влияет на периферическое потребление кислорода несколькими способами.
Концентрация СО в атмосфере обычно ниже 0,001%, но она выше в городских районах и в закрытых помещениях.
Большинство смертельных отравлений угарным газом происходит из-за пожаров, утечек в печах, портативных источников питания, работающих на бензине, гриля в помещении, выхлопных газов автомобилей. Угарный газ быстро всасывается в легкие. Выделение зависит от степени оксигенации и, в меньшей степени, минутного объема.
- Период полувыведения СО, когда человек дышит обычным воздухом, составляет около 300 минут.
- Если вы дышите богатым кислородом воздухом через маску, которая фильтрует выдыхаемый воздух, период полураспада составляет около 90 минут.
- При 100% гипербарическом кислороде это около 30 минут.
Вероятность смертельного исхода отравления возрастает при отсутствии своевременной помощи.
