Ход реакции
14. Тепловой эффект, а также изменение энтальпии химической реакции зависят от температуры, давления и агрегатного состояния вещества. Поэтому при сопоставлении величин Qри ΔHприняты определенные стандартные условия. За стандартные принимают значения:
а) давления 1 атм и температуры 0°С;
б) давления 101325 Па и температуры 273К;
в) давления 100 Па и температуры 100К;
г) давления 101325 Па и температуры 298К.
15. Стандартные тепловые эффекты принято обозначать
а) ΔUст;
б) ΔH◦298;
в) Q273101,3;
г) ΔH ст.
16. Чему равны стандартные энтальпии образования простых веществ, находящихся в стандартных состояниях?
а)1 кДж;
б) 298 Дж;
в) нулю;
г) 273 кДж.
17. Стехиометрические коэффициенты в термохимических уравнениях указывают на:
а) соотношение между количествами веществ;
б) реальные количества реагирующих и образующихся веществ;
в)массы веществ;
г)скорость расходования и образования веществ.
18. Единицей измерения энергии в системе СИ является джоуль. Однако до сих пор так же широко используется внесистемная единица — калория (килокалория) люди, далекие от химии, хорошо знакомы, например, с термином «калорийность» продуктов). Как связаны между собой джоуль и калория?
а) 1 кал = hcν Дж;
б) 1 Дж = 6,02 1023 кал;
в) 1 Дж = 22,4 кал;
г) 1 кал = 4,184 Дж.
19.Каждый человек поглощает энергию в виде пищи и напитков. Рассчитайте, какое количество энергий поглощает человек, съедая 100 г белого хлеба (в нем содержится 50 г углеводов, 8 г белков, 2 г жиров и около 40 г воды). Калорийность углеводов, белков и жиров составляет соответственно 3,8; 4,1 и 9,1 ккал/г.
а) 241ккал;
б) 100 кДж;
в) 1008,3 кДж;
г) –13 кал.
20. Девушка, строго следящая за фигуру, не удержалась от соблазна сладостей и съела шоколада в два раза больше ее обычной ежедневной нормы (9200 кДж). Чтобы ликвидировать энергетические излишества, в течение ближайших двух часов ей пришлось:
а) стирать белье (540);
б)ездить на велосипеде (920);
в) бегать трусцой по парку (2300);
г) плавать в бассейне (1200).
В скобках указаны энергетические затраты организма ΔH сгорания в кДж/ч.
21. Важнейшим следствием термохимического закона Гесса является утверждение, что тепловой эффект химической реакции равен:
а) сумме теплот образования исходных веществ;
б) сумме теплот образования продуктов реакции;
в) сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов термохимического уравнения реакции;
г) сумме теплот образования исходных веществ за вычетом суммы теплот образования продуктов реакции.
22. Какая из написанных ниже реакций отвечает теплоте образования оксида азота (II) в стандартных условиях (ΔH◦298)?
а) 1/2N2 О = NO;
б) N 1/2O2 = NO;
в) 1/2N2 l/2O2 = NO;
г) 2NH3 5/2O2 = 2NO 3H2O.
23. Какие из нижеприведенных реакций являются эндотермическими?
а) 1/2N2 3/2H2 = NH3 ΔH◦298 = –46 кДж/моль;
б) H2 1/2O2 = H2О, ΔH◦298 = –242 кДж/моль;
в) 1/2N2 l/2O2 = O2, ΔH◦298 = 90 кДж/моль;
г) 1/2H2 1/2I2 = HI, ΔH◦298 = 26 кДж/моль;
24. Сколько энергии надо затратить для разложения 9 г жидкой воды на водород и кислород в стандартных условиях?
а) 1 ккал;
б) 286 кДж;
в) Разложение воды происходит без видимых затрат энергии;
г) 143 кДж.
25 Теплоты сгорания графита и алмаза при стандартные условиях составляют 393,5 кДж/моль и 395,4 кДж/моль соответственно. Чему равна энтальпия перехода графита в алмаз?
а) ΔH◦298 = –1,9 кДж/моль;
б) ΔH◦298 = 1,9 кДж/моль;
в) Графит невозможно превратить в алмаз;
г) ΔH◦298 = 0.
26. Экспериментально теплоты сгорания (а также энтальпии образования) определяют в специальном приборе, называемом:
а) спектрофотометром;
б) калориметром;
в) аппаратом Кипа;
г) колориметром.
27. При стандартных условиях теплота сгорания водорода в кислороде равна 286,2 кДж/моль, а теплота сгорания водорода в озоне равна
333,9 кДж/моль. Чему равна теплота образования озона из кислорода при стандартных условиях?
а) – 143,1 кДж/моль;
б) 47,7 кДж/моль;
в) – 47,7 кДж/моль;
г) нулю.
28. Энергии диссоциации Н2, С12 и энтальпия образования НС1 составляют соответственно 436, 243 и –92 кДж/моль. Чему равна энергия связи Н–С1?
а) –46 кДж/моль;
б) –486 кДж/моль;
в) 431,5 кДж/моль;
г) 218 кДж/моль.
29. Для полного разложения некоторого количества карбоната магния потребовалось 5,1 кДж теплоты. Полученный оксид углерода (IV) был поглощен 5,7%-ным раствором гидроксида бария массой 75 г. Рассчитайте массовую долю образовавшейся при этом соли. Тепловой эффект реакции разложения карбоната магния составляет 102 кДж/моль.
а) 8,4% Ва(НСО3)2;
б) образовался осадок ВаСО3;
в) 10% (Ва(ОН))2СО3;
г) 10% Ва(НСО3)2.
30. Все вопросы данной главы иллюстрируют утверждение, что любая химическая реакция обязательно сопровождается выделением или поглощением энергии (см. задание 5). Однако изменения энергии могут происходить не только в результате химических, но и в ряде физических превращений. Назовите физическое превращение, в результате которого не происходит изменение энтальпии.
а) растворение соли в воде;
б) плавление льда;
в) сублимация иода;
г) интерференция света.
31. Стандартная молярная энтальпия плавления ΔH◦пл.т— это:
а) изменение энтальпии, которым сопровождается испарение одного моля вещества;
б) изменение энтальпии, которым сопровождается плавление одного моля данного вещества при его температуре плавления и давлении одна атмосфера;
в) изменение энтальпии, которым сопровождается плавление одного моля данного вещества при нормальных условиях;
г) теплота, которую необходимо затратить для преодоления сил притяжения, существующих между частицами жидкости.
32. Эмпирическое правило Трутона формулируется так: отношение стандартной молярной энтальпии испарения жидкости (ΔH◦исп.m) при ее температуре кипения к значению этой температуры в шкале Кельвина равно приблизительно 88 Дж/(К-моль). Используя это правило, определите значение ΔH◦исп.mбензола (tкип. = 80,1◦С).
а) 31,1 Дж/моль;
б) 62,2 кДж/моль;
в) 31,1 кДж/моль;
г) 93,3 Дж/моль.
33. Наибольший вклад в развитие термодинамических и термохимических представлений внесли работы следующих ученых:
а) Гесса и Авогадро;
б) Моцарта и Бетховена;
в) Гессе и Гейне;
г) Майера и Гесса.
| 1. в). | 12. б). | 23. в) и г). |
| 2. г). | 13. в). | 24 г). |
| 3. в). | 14. г). | 25. б). |
| 4. б). | 15. б). | 26. б); в ответе г) нет опечатки -колориметр — это прибор для определения концентрации веществ по интенсивности цвета окрашенного раствора. |
| 5. а). | 16. в). | 27. а). |
| 6. г). | 17. б). | 28. в). |
| 7. в). | 18. г). | 29. а). |
| 8. в) | 19. а) или в), поскольку 241 ккал — 10083 кДж (см. задание 18). | 30. г). |
| 9. а). | 20. г). | 31. б). |
| 10. в). | 21. в). | 32. в). |
| 11. а). | 22. в). | 33. г) – немецкий врач (!) Ю.Р.Майср в 1840 г. впервые сформулировал первое начало термодинамики. |
12. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
ВЫЧИСЛЕНИЕ СТАНДАРТНЫХ ТЕПЛОТ ОБРАЗОВАНИЯ ВЕЩЕСТВ И ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
Date: 2022-09-18; view: 4979; Нарушение авторских прав
§
Пример. Возможна ли следующая реакция в стандартных условиях:
t
SiО2(к) 2NaОH (p) = Na2SiО3(к) Н2О (ж)
если ΔGо(SiО2 (к)) = –803,75 кДж/моль; ΔGо (Na2SiО3(к))= –1427,8 кДж/моль;
ΔGо (NaОH(p)) = –419,5 кДж/моль; ΔGо (Н2О (ж)) = –237,5 кДж/моль?
Можно ли выпаривать щелочь в стеклянном сосуде?
Решение. Изменение энергии Гиббса ΔGо298 реакции равно:
ΔGо = ΣGопрод. – ΣGоисх.;
ΔGо298 = (–1427,8 – 237,5) – (–803,75 –419,5·2)= –22,55 кДж;
ΔGо298 = –22,55 кДж (т. е. ΔG<0), а следовательно, данная реакция возможна. Щелочь нельзя выпаривать в стеклянном сосуде, так как в состав стекла входит SiО2.
Пример. Вычислить ΔGо для реакции 2Н2 (г) О2 (г)  2Н2О(г).
2Н2О(г).
при 298, 500, 1000, 1500 К. Зависимостью ΔНо и ΔSo от температуры пренебречь. Построить график зависимости ΔGо от температуры и найти по графику температуру, ниже которой указанная реакция в стандартных условиях может протекать самопроизвольно.
Решение. Согласно уравнению ΔG = ΔН – TΔS влияние температуры на ΔG определяется знаком и величиной ΔS. Если пренебречь влиянием Т на значения ΔН и ΔS, то приведённая зависимость ΔG =ƒ(T) является уравнением прямой, наклон которой определяется знаком ΔS. при ΔS>0 прямая идет вниз, при ΔS<0 – вверх.
Определим величину ΔН°298 (исходные данные берем из табл.1)
∆Hºp = Σ∆Hºобр.(прод.) – Σ∆Hºобр.(исх..)
ΔН°298 = 2ΔН°обр.(H2O) – (2ΔН°обр.(H2) 2ΔН°обр.(O2) = 2ΔН°обр.(H2O) =
=2(-241,84) = –483,68 (кДж) (на 2 моля H2O)
ΔН°обр.(Н2О) = 0,5(–483,8) = –241,89 кДж/моль.<0
Следовательно, реакция экзотермическая.
Определим изменение энтропии данной реакции в стандартных условиях ΔS°298 (исходные данные берем из табл.1)
ΔSо = ΣSопрод. – ΣSоисх.:
ΔS°298= 2S°298.(H2O) – [2S°298.(H2) S° 298.(O2)]= 2·188,74 – (2·130.6 205) =
–98,6(Дж/ К) = –0,0986(кДж/ К) < 0, ΔG =ƒ(T) прямая идет вверх.
Определим изменение энергии Гиббса ΔG°298 в стандартных условиях (исходные данные берем из табл.1):
ΔGо = ΣGопрод. – ΣGоисх.;
ΔG°298 = 2ΔG°298.(H2O) – [2ΔG°298(H2) – ΔG°298(O2)] = 2(–228,8) = –457,6 кДж.
Отрицательная величина ΔG°298 свидетельствует о том, что в стандартных условиях реакция самопроизвольно протекает в прямом направлении.
ΔG°298 = ΔН°298 – 298·ΔS0298 = –483,68 – 298·(–0,0986) = –457,6кДж
ΔG°500 = ΔН°298 – 500·ΔS0298 = –483,68 – 500·(–0,0986) = –434,38кДж
ΔG°1000 = ΔН°298 – 1000·ΔS0298 = –483,68 – 1000·(–0,0986) = –385,08кДж
ΔG°1500 = ΔН°298 – 1500·ΔS0298 = –483,68 – I500·(–0,0986) = –335,78 кДж
Построим график ΔG°Т =f(Т):
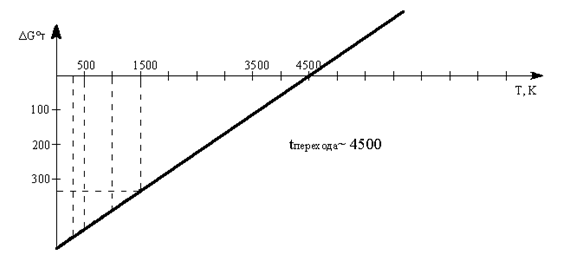
Температура перехода ~4500 К
13. РЕКОМЕНДАЦИИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ
И ВАРИАНТЫ ЗАДАНИЙ
РЕКОМЕНДАЦИИ:
1. Внимательно изучить теоретический материал, используя конспекты лекций, данное учебное пособие и рекомендуемую литературу.
2. Проверить усвоение теории, ответив на контрольные вопросы, выполнив тестовые задания.
3. Разобрать примеры решения типовых задач.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГОГ РЕШЕНИЯ
Задачи
1. Вычислите стандартную теплоту образования бензола С6Н6 (ж), если известны теплоты сгорания водорода, углерода и бензола.
2. Определите стандартную теплоту образования сероуглерода CS2, если известно, что
CS2 (ж) 3О2 = СО2 (г) 2SО2 (г) ΔНо298 = –1075 кДж/моль.
3. Вычислите ΔНо298 хлорида аммония, если для реакции
NH3 (г) НС1(г) = NH4CI (к)
ΔНо298 = –176,93 кДж/моль.
4. Определите ΔНо298 BiCl3(к), если ΔНо298BiCl3(г) = –270,70 кДж/моль, а ΔНо возгонки BiCl3(к) 113,39 кДж/моль.
5. При взаимодействии 5 г металлического натрия с водой выделяется 40,25 кДж теплоты, а при взаимодействии 10 г оксида натрия с водой выделяется
36,46 кДж теплоты. Рассчитайте ΔНо298 Na20.
6. При растворении 16 г СаС2 в воде выделяется 31,3 кДж теплоты. Определите стандартную теплоту образования Са(ОН)2.
7. Определите ΔНо298 Fe2О3, если при реакции
2Fe А12О3 = Fe2О3 2A1
на каждые 80 г Fe2О3 поглощается 426,5 кДж теплоты.
8. Тепловой эффект реакции
SО2(г) 2H2S(г) = 3S(ромб) 2Н2О(ж)
равен –234,50 кДж. Определите стандартную теплоту образования H2S.
9. Окисление аммиака протекает по уравнению
4NH3(г) 3О2(г) = 2N2 6Н20(ж) ΔНо298 = –1528 кДж.
Определите стандартную теплоту образования NH3(г) и NH4ОH, если теплота растворения NH3(г) в воде равна –34,65 кДж.
10. Вычислите стандартную теплоту образования сахарозы С12Н22О11, если тепловой эффект реакции
С12Н22О11 12О2 = 12СО2 11Н2О(ж)
равен –5694 кДж.
11. Рассчитайте ΔНо298 ZnSО4, если известно, что
2ZnS 3О2 = 2ZnО 2SО2 ΔНо = –890,0 кДж;
2SО2 О2 = 2SО3 ΔНо = –196,6 кДж;
ZnSО4 = ZnO SО4 ΔНо = 234,0 кДж.
12. Восстановление диоксида свинца водородом протекает по уравнению
РbО2 Н2 = РbО Н2О(г) ΔНо = –182,8 кДж.
Определите стандартную теплоту образования РbО2.
13. Вычислите стандартную теплоту образования бензойной кислоты С6Н5СООН(к), если стандартная теплота сгорания бензойной кислоты равна
–3227,54 кДж/моль, а стандартные теплоты образования Н2О и СО2 см. в табл. 1 приложения.
14. Вычислите теплоту образования карбида кальция CaC2, исходя из теплового эффекта реакции
CaО 3С = CaC2 CО; ΔНо = 460,0 кДж.
15.Определите ΔНо298 образования этилена, используя следующие данные:
C2H4 (г) 3O2 (г) = 2CO2 (г) 2H2O(г), ΔНо = –1323 кДж;
C(графит) O2 (г) = CO2 (г) ΔНо = –393,5 кДж;
H2(г) ½ O2(г)=H2O(г); ΔНо = –241,8 кДж
16. Вычислите ΔНо реакций. Укажите, какая из них является эндотермической, а какая экзотермической. Тепловой эффект каких реакций представляет собой теплоту сгорания вещества?
а) 4NH3 (г) 5O2 (г)→4NO(г) 6H2O(г);
б) 4NH3 (г) 3O2 (г)→2N2 (г) 6H2O(г);
в) Fe2O3 (к) 3CO(г)→2Fe(к) 3CO2 (г);
г) CH4 (г) 2O2 (г)→CO2 (г) H2O(ж);
д) 2Mg(к) CO2 (г)→2MgO(к) C(графит);
е) 2Сl2 (г) H2O(г)→4HCl(г) O2 (г);
ж) 3CH4 (г) CO2 (г) H2O(ж)→4CO(г) 8H2 (г);
и) CaO(к) SiO2(к)→CaSiO3 (к);
к) 2H2S(г) SO2(г)→3S(ромб) 2H2O(ж);
л) 2H2(г) P4(т)→4PH3(г);
м) 3Fe(т) 2O2(г)→Fe2O3(к);
н) 2C2H2 (г) 5О2 (г)→4CO2 (г) 2H2O(г);
п) 4HF(г) Br2 (ж)→2HBr(ж) F2 (г);
р) CaO(к) CO2 (г)→CaCO3 (к);
с) 4СО(г) 2SO2 (г)→4СО2 (г) S2 (г).
Как необходимо было бы записать уравнения некоторых реакций (каких?), чтобы теплота этих реакций могла бы быть названа теплотой сгорания?
17. Вычислите тепловой эффект реакции
АI2O3(к) 3SO3(г) = Al2(S04)3(к),
если известны стандартные теплоты образования реагирующих веществ.
18. Зная стандартные теплоты сгорания этана, метана и водорода (см. табл. 2 приложения), определите ΔНо реакции:
С2Н6 (г) Н2(г) = 2СН4(г)
19. Используя значение ΔНо298 реагирующих веществ, определите тепловой эффект реакции восстановления оксидом углерода оксида свинца (IV) до оксида свинца (II) с образованием диоксида углерода.
20. По стандартным теплотам сгорания веществ рассчитайте ΔНо298 системы
С2Н5ОН (ж) СH3СООН (ж) = СН3СООС2Н5 (ж) Н2O
ΔНосгор..сн3соос2н5 = –2254,21 кДж/моль.
Конечные продукты сгорания – газообразный СО2 и жидкая Н2О.
21. Определите тепловой эффект реакции
NaH (к) Н2О (ж) = NaOH (p) Н2(г)
по стандартным теплотам образования веществ, участвующих в реакции, если ΔНоNaH (к) = –56,94 кДж/моль, ΔНоNaОН (р) = –469,47 кДж/моль.
22. Определите тепловой эффект реакции
2PbS 3О2 = 2РbO 2SО2 ,
используя значение стандартных теплот образования реагирующих, веществ.
23 Вычислите теплоту перехода графита в алмаз, если при образовании
одного моля СО2 из графита выделяется 393,5 кДж/моль, а из алмаза – 395,4 кДж/моль.
24. Исходя из реакций
КСIО3 = КС1 ½О2; ΔНо = –49,4 кДж/моль,
KCIО4 = КС1 2О2; ΔНо = 33 кДж/моль,
вычислите ΔНо реакции
4KСIО3 = 3KCIО4 КС1
25. Теплоты сгорания этана С2Н6 и этилена С2Н4 соответственно составляют –1560 и
–1411 кДж/моль. Вычислите ΔНо298 реакции гидрирования этилена
С2Н4 Н2 = С2Н6
26. Теплоты сгорания бензола (г) и ацетилена соответственно составляют –3268 и
–1301 кДж/моль. Вычислите ΔНо298 реакции 3С2Н2 (г) = С6Н6 (г)
27. Теплота сгорания этилового спирта составляет –1409 кДж/моль. Вычислите ΔНо298 реакции
2СО 4Н2 = С2Н5ОН Н2О(ж)
28. Вычислите ΔНо298 реакции:
а) 2Li (к) 2H2O (ж) = 2Li (водн.) 2ОН–(водн.) Н2 (г);
б) 2Nа (к) 2H2O (ж) = 2Nа (водн.) 2ОН–(водн.) Н2 (г);
Стандартные энтальпии образования Li (водн.), Nа (водн.), ОН–(водн.) принять соответственно равными –278,5, – 239,7 и –228,9 кДж/моль.
29. Исходя из ΔНо298 образования H2O (г) и следующих данных:
FeO (к) CO (г) = Fe(к) СО2 (г) ΔНо298 = –18,2 кДж;
2CO (г) О2 = 2СО2 (г) ΔНо298 = –566,0 кДж;
вычислить ΔНо298 реакции
FeO (к) H2 (г) = Fe (к) H2O (г) .
30. Определить ΔНо298 реакции 3С2Н2 (г) = С6Н6 (ж), если ΔНо298 реакции горения ацетилена с образованием СО2 (г) и Н2O (ж) равна –1301 кДж/моль, а ΔНо298 образования С6Н6 (ж) составляет 82,9 кДж/моль.
31. При стандартных условиях теплота полного сгорания белого фосфора равна
760,1 к Дж/моль, а теплота сгорания черного фосфора равна 722,1 к Дж/моль. Чему равна теплота превращения черного фосфора в белый при стандартных условиях?
32. При получении азотной кислоты из KNО3 протекают следующие реакции:
KNО3(к) H2SО4(р) = KHSО4(к) HNО3(г) (а)
2KNО3 (к) H2SО4(р) = K2SО4(к) 2HNО3(г) (б)
Сколько теплоты выделяется (или поглощается) при получении 1 кг азотной кислоты, если 80% ее образуется по реакции (а), ΔНо (HNО3(г))=
–133,90 кДж/моль.
33. Разложение гремучей ртути при взрыве идет по уравнению
Hg(ONC)2 = Hg 2CO N2 364,2 кДж.
Определите объем выделившихся газов (н.у.) и количество теплоты, поглотившейся при взрыве 1,5 кг Hg(ONC)2.
34. Определите количество теплоты, выделяющейся при взаимодействии 50 г фосфорного ангидрида с водой по реакции
Р2O5 Н2О = 2НРO3,
если тепловые эффекты реакции равны:
2Р 5/2O2 = Р2O5 –1549,0 кДж;
2Р Н2 3O2 = 2НРO3 –1964,8 кДж.
35. Вычислите количество теплоты, которое выделяется при сгорании 20 л диборана (н.у.), если ΔНо298В203 (к) и В2Н6 (г) соответственно равны –1264 и
31,4 кДж/моль. Целесообразно ли использовать в качестве топлива диборан вместо этана, если стандартная теплота сгорания этана –1559,88 кДж/моль?
36. Найдите теплоту сгорания алмаза, если стандартная теплота сгорания графита равна –393,51 кДж/моль, а теплота фазового перехода
С (графит) → С (алмаз) равна 1,88 кДж/моль.
37. Какое количество теплоты выделяется при превращении 1 кг красного фосфора в черный, если ΔНоР (красный) = –18,41; ΔНоР (чёрный)= –43,20 кДж/моль?
38. Сколько нужно затратить теплоты, чтобы разложить 200 г Na2CО3 до оксида натрия и диоксида углерода, если тепловые эффекты реакций равны:
Na2CО3 SiО2 = Na2SiО3 СО2 819,29 кДж;
Na2О SiО2 = Na2SiО3 –243,5 кДж?
39. Сколько теплоты выделится при сжигании 38 г сероуглерода CS2?
40. При полном сгорании этилена (с образованием жидкой воды) выделилось 6226 кДж. Найти объем вступившего в реакцию кислорода (условия нормальные).
41. Водяной газ представляет собой смесь равных объемов водорода и оксида углерода (II). Найти количество теплоты, выделяющейся при сжигании 112 л водяного газа, взятого при нормальных условиях.
42. Сожжены с образованием H2O (г) равные объемы водорода и ацетилена, взятых при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз?
43. Найти массу метана, при полном сгорании которой (с образованием жидкой воды) выделяется теплота Q, достаточная для нагревания 100г воды от 20 до 30ºС. Мольную теплоемкость воды принять равной С = 75,3 Дж/(моль·К).
Q = C·ν·Δt, где ν – число молей воды.
44. Найти количество теплоты, выделяющееся при взрыве 8,4 л гремучего газа (2Н2 О2), взятого при нормальных условиях.
Date: 2022-09-18; view: 2267; Нарушение авторских прав
§
47. Вычислите ΔGо следующих реакций и определите, в каком направлении они будут протекать, если все вещества взяты при стандартных условиях:
а) 2N2O(г) O2(г) ↔ 4NO(г);
б) N2O(г) NO(г) ↔ NO2 (г) N2(г);
в) N2O(г) NO2 (г) ↔ 3NO(г);
г) 4НС1(г) O2 (г) ↔ 2C12 (г) 2H2O(г);
д) H2 (г) Se(г) ↔ H2Se(г);
е) 2HF(г) O3 (г) ↔ Н2О(г) F2(г) O2 (г);
ж) O3 (г) Н2О2 (ж) ↔ 2O2(г) Н2О(ж);
и) СаСО3 (к) ↔ СаО(к) СО2(г);
к) MgCO3(к) ↔ MgO(к) СО2 (г);
л) N2(г) О2(г) ↔ 2NО(г);
м) 3MnO2 (к) ↔ Mn3O4(к) О2 (г);
н) ВаСО3 (к) ↔ ВаО(к) СО2 (г);
п) 2Au(к) 3/2О2 (г) ↔ Au2О3 (к);
р) Fe2O3(к) 3СО(г) ↔ 2Fe(к) 3СО2 (г);
с) NiO(к) Pb(к) ↔ Ni(к) PbO(к).
48. Возможна ли следующая реакция:
2Hg2Cl2 = 2HgCl2 2Hg?
Ответ подтвердите, рассчитав AG°298 этой системы.
49. Определите ΔGо298 реакции
МеО(к) СО2 (г) = МеСО2(к)
для металлов от Вe до Ва; на основании этого сделайте вывод об изменении основных свойств оксидов этих металлов.
50. Исходя из величин ΔGо298 соединений, участвующих в реакции, определите, возможна ли реакция
А12О3(к) 2SО3(к) = A12(SО4)3 (к)
51. Какая из приведенных реакций разложения KNО3 наиболее вероятна?
а) КNО3 = K NО2 1/2О2
б) 2КNО3 = К2О 2NО2 О2
в) KNО3 = КNО2 1/2О2
52. Вычислите значение ΔGо298 следующих реакций восстановления оксида железа (II):
а) FeO(к) ½С(графит) = Fe(к) ½СО2 (г)
б) FeO(к) С(графит) = Fe(к) СО(г)
в) FeO(к) СО(г) = Fe(к) СО2(г)
Протекание какой из этих реакций наиболее вероятно?
53. Будут ли при 25° С протекать реакции:
а) КН Н2О = КОН Н2;
б) КН = К 1/2Н2?
Как будет влиять повышение температуры на направление указанных процессов?
54. Как изменяются основные свойства гидроксидов в ряду
LiOH → NaOH → КОН →RbOH → CsOH?
Ответ дайте, рассчитав ΔGо298 системы
Ме2О Н2О = 2МеОН
55. Какие из приведенных ниже водородных соединений получают непосредственно из элементов, а какие косвенным путем: Н2О(г), H2S(г), H2Se(г), H2Te(г)?
56. Можно ли использовать при стандартных условиях нижеприведенную реакцию для получения аммиака?
NH4C1(к) NaOH(к) = NaCl(к) Н2O(г) NH3(г)
57. Вычислите ΔGообразования СН4, С2Н4 и NH3,исходя из значений ΔНо обр. и изменения энтропии ΔSo.
Полученные величины сравните с данными, приведенными в табл.1
58. Какие из перечисленных оксидов можно восстановить водородом:
а) Li2О; б) СuО; в) МnО; г) РЬО?
59. Какие из перечисленных оксидов могут быть восстановлены водородом до свободного металла при 298 К: СаО, ZnO, NiO, SnO2, А12О3?
60. Какие из перечисленных оксидов могут быть восстановлены алюминием до свободного металла при 298 К: СаО, FeO, СuО, РЬО, Fe2O3, Cr2O3?
61. Вычислить ΔGо для реакции СаСО3(к) ↔ СаО(к) СО2(г)
при 25, 500 и 1500оС. Зависимостью ΔНо и ΔSo от температуры пренебречь.
Построить график зависимости ΔGо от температуры и найти по графику температуру, выше которой указанная реакция в стандартных условиях может протекать самопроизвольно.
62. В приведенных ниже реакциях под символами ионов в растворе кристаллических солей указаны их ΔG° образования в кДж/моль. Вычислите ΔG° образования соли из ионов и определите, в каком случае произойдет образование кристаллической соли, а в каком будет преобладать переход соли в раствор в виде ионов:
a) Ag (Р) F–(р) = AgF(к)
77,11 –276,5 –186,6
б) Ag (р) С1–(р) = AgCl (к)
77,11 –131,17 –109,6
в) Mg2 (p) SO4–2(p) = MgSO4(к)
–456,0 –743 –1171,5
г) Ва2 (р) SO4(p) = BaSO4(к)
–560,7 –743 –1351,4
д) Са2 (р) 2F–(р) = CaF2(к)
–553,0 –276,5 –1164,0
е) Са2 (р) 2С1–(р) = СаС12(к)
–553,0 –131,17 –750,2
ВАРИАНТЫ ЗАДАНИЙ
| Номер варианта | Номер задачи | |||||
| 16а | 47а | |||||
| 16б | 47б | |||||
| 16в | 47в | |||||
| 16г | 47г | |||||
| 16д | 47д | |||||
| 16е | 47е | |||||
| 16ж | 47ж | |||||
| 16и | 47и | |||||
| 16к | 47к | |||||
| 16л | 47л | |||||
| 16м | 47м | |||||
| 16н | 47н | |||||
| 16п | 47п | |||||
| 16р | 47р | |||||
| 16с | 47с |
14.ТРЕБОВАНИЯ К ЗНАНИЯМ И УМЕНИЮ
Изучив данный раздел химии, студент должен:
1) знать:
· что такое эндо– и экзотермический процесс и какова причина возникновения теплового эффекта при протекании химического процесса;
· формулировку закона Гесса и уметь термодинамически обосновать выполнение его. Знать следствия из закона Гесса;
· что такое термодинамические функции состояния и каков физический смысл таких функций состояния, как энтальпия, внутренняя энергия, энтропия и энергия Гиббса;
· что такое стандартное состояние;
· что такое энтальпия образования, сгорания, нейтрализации, растворения, гидратации, гидролиза, связи;
2) уметь:
· составлять термохимические уравнения и осуществлять алгебраические действия над ними при проведении термохимических вычислений;
· производить различные термохимические вычисления;
· производить качественную оценку изменения энтальпии и энтропии для заданных процессов;
· вычислять изменение энтропии и энергии Гиббса для различных процессов;
· определять направление процесса в стандартных условиях и при изменении этих условий (при изменении температуры).
ПРИЛОЖЕНИЕ
Таблица 1
Стандартные энтальпии образования, ∆Нº298 энтропии, Sº298 и энергии Гиббса образования ∆Gº298 некоторых веществ при 298К (25 °С)
| Вещество | ∆Нº298, кДж/моль | Sº298, Дж/(моль·К) | ∆Gº298, кДж/моль |
| Ag (к) | 42,69 | ||
| AgBr (к) | –99,16 | 107,1 | –95,94 |
| AgCI (к) | –126,8 | 96,07 | –109,7 |
| AgI (к) | –64,2 | 114,2 | –66,3 |
| AgF (к) | –202,9 | 83,7 | –184,9 |
| AgNO3 (к) | –120,7 | 140,9 | –32,2 |
| Ag2O (к) | –30,56 | 121,7 | –10,82 |
| Ag2CO3 (к) | –506,1 | 167,4 | –437,1 |
| AI (к) | 28,31 | ||
| А12О3 (к) | –1676,0 | 50,9 | –1582,0 |
| AI(OH)3 (к) | –1275,7 | 74,1 | –1139,72 |
| AICI3 (к) | –697,4 | 167,0 | –636,8 |
| AI2(SO4)3 | –3434,0 | 239,2 | –3091,9 |
| As (к) | 35,1 | ||
| As2O3 (к) | –656,8 | 107,1 | –575,0 |
| As2O5 (к) | –918,0 | 105,4 | –772,4 |
| Au (к) | 47,65 | ||
| Au2О3 (к) | –3 | ||
| AuF (к) | –74,3 | 96,4 | –58,6 |
| AuF3 (к) | –348,53 | 114,2 | –297,48 |
| Au(OH)3 (к) | –418,4 | 121,3 | –289,95 |
| AuCI3 (к) | –118,4 | 146,4 | –48,53 |
| B (к) | 5,87 | ||
| B2O3 (к) | –1264,0 | 53,85 | –1184 |
| B2H6 (г) | 31,4 | 232,9 | 82,8 |
| Ba (к) | 64,9 | ||
| ВаО (г) | –131 | –152 | |
| ВаО (к) | –538 | 70,3 | –510 |
Продолжение табл. 1
| BaCO3 (к) | –1201 | –1123 | |
| Be (к) | 9,54 | ||
| BeO (к) | –598,7 | 14,10 | –581,6 |
| BeCO3 (к) | –981,57 | 199,4 | –944,75 |
| Bi (к) | 56,9 | ||
| BiCI3 (г) | –270,7 | 356,9 | –260,2 |
| BiCI3 (к) | –379,1 | 189,5 | –318,9 |
| Br2 (ж) | |||
| Br2 (г) | 30,92 | 254,35 | 3,14 |
| С (графит) | 5,7 | ||
| С (алмаз) | |||
| СС14 (г) | –103 | –61 | |
| СС14 (ж) | –135,4 | 214,4 | –64,6 |
| СН4 (г) | –74,9 | 186,2 | –50,8 |
| С2H2 (г) | 226,8 | 200,8 | 209,2 |
| С2H4 (г) | 52,3 | 219,4 | 68,1 |
| С2H6 (г) | –89,7 | 229,5. | –32,9 |
| С6H6 (ж) | 82,9 | 269,2 | 129,7 |
| C2H5OH (ж) | –277,6 | 160,7 | –174,8 |
| C6H12O6(глюкоза) | –1273,0 | – | –919,5 |
| CH3COOH (ж) | –484,9 | 159,8 | –392,46 |
| C6H5COOH (к) | –385 | – | |
| СО (г) | –110,5 | 197,5 | –137,1 |
| СO2 (г) | –393,5 | 213,7 | –394,4 |
| СOCI2 (г) | –223,0 | 289,2 | –210,5 |
| CS2 (г) | 115,3 | 237,8 | 65,1 |
| CS2 (ж) | 87,8 | 151,0 | 63,6 |
| Ca | 41,62 | ||
| СаСO3 (к) | –1207,0 | 88,7 | –1127,7 |
| СаSiО3 (к) | –1635 | 82 | –1550 |
| СаF2 (к) | –1214,6 | 68,9 | –1161,9 |
| CaCI2 (к) | –785,8 | 113,8 | –750,2 |
| CaC2 (к) | –62,7 | 70,3 | 67,8 |
Продолжение табл. 1
| Ca3N2 (к) | –431,8. | –368,6 | |
| CaO (к) | –635,5 | 39,7 | –604,2 |
| Са(OH)2 (к) | –986,6 | 76,1 | –896,8 |
| СаSО4 (к) | –1424,0 | 106,7 | –1320,3 |
| Ca3(PO4)2 (к) | –4125,0 | 240,9 | –3899,5 |
| С12 (г) | 222,9 | ||
| С12O (г) | 76,6 | 266,2 | 94,2 |
| ClО2 (г) | 105,0 | 257,0 | 122,3 |
| Cl2O7 (ж) | 251,0 | – | – |
| Cr (к) | 23,76 | ||
| Cr2O3 (к) | –1140,6 | 81,2 | –1050,0 |
| – | |||
| CoO (к) | –162,0 | 42,6 | –129,9 |
| Cu (к) | 33,3 | ||
| Cu2O (к) | –167,36 | 93,93 | –146,36 |
| CuO (к) | –165,3 | 42,64 | –127,19 |
| Cu(OH)2 | –443,9 | 79,50 | –356,90 |
| CuF2 (к) | –530,9 | 84,5 | –485,3 |
| CuCI2 (к) | –205,9 | 113,0 | –166,1 |
| CuBr2 (к) | –141,42 | 142,34 | –126,78 |
| CuI2 (к) | –21,34 | 159,0 | –23,85 |
| Cu2S (к) | –82,01 | 119,24 | –86,19 |
| CuS (к) | –48,5 | 66,5 | –48,95 |
| CuSO4 (к) | –771,1 | 113,3 | –661,91 |
| CuCO3 (к) | –594,96 | 87,9 | –517,98 |
| Cu(NO3)2 (к) | –307,11 | 193,3 | –114,22 |
| Fe (к) | 27,15 | ||
| FeO (к) | –263,68 | 58,79 | –244,35 |
| Fe2O3(к) | –822,2 | 87,4 | –740,3 |
| Fe3O4 (к) | –1117,1 | 146,2 | –1014,2 |
| Fe(ОН)3 (к) | –824,25 | 96,23 | –694,54 |
Продолжение табл. 1
| FeCl3(к) | –405,0 | 130,1 | –336,39 |
| FeSO4 (к) | –922,57 | 107,51 | –829,69 |
| FeCO3 (к) | –744,75 | 92,9 | –637,88 |
| Н2 (г) | 130,5 | ||
| HBr (г) | –36,3 | 198,6 | –53,3 |
| НСN (г) | 135,0 | 113,3 | 125,5 |
| НCl (г) | –92,3 | 186,8 | –95,2 |
| НCl (ж) | –167,5 | 55,2 | –131,2 |
| HF (г) | –270,7 | 178,7 | –272,8 |
| HI (г) | 26,6 | 206,5 | 1,8 |
| HN3 (ж) | 294,0 | 328,0 | 238,8 |
| Н2O (г) | –241,8 | 188,7 | –228,6 |
| Н2O (ж) | –285,8 | 70,1 | –237,3 |
| Н2S (г) | –21,0 | 205,7 | –33,02 |
| Н2S (ж) | –39,33 | 122,2 | –27,36 |
| Н2Sе (г) | 85,77 | 221,3 | 71,13 |
| Н2Te (г) | 154,39 | 234,3 | 138,48 |
| HCIO (ж) | –116,4 | 129,7 | 80,0 |
| HNO3 (ж) | –173,0 | 156,16 | –79,91 |
| Н2SO4 (ж) | –811,3 | 156,9 | –742,0 |
| HPO3 (ж) | –982,4 | 150,6 | –902,91 |
| H3PO4 (ж) | –1271,94 | 200,83 | –1147,25 |
| K (к) | 64,35 | ||
| K2О (к) | –361,5 | 87,0 | –193,3 |
| KОН (к) | –425,93 | 59,41 | –374,47 |
| KNO3 (к) | –492,71 | 132,93 | –393,13 |
| KNO2 (к) | –370,28 | 117,15 | –281,58 |
| K2SO4 (к) | –1433,44 | 175,73 | –1316,37 |
| KНSO4 (к) | –1158,1 | 187,89 | –1043,49 |
Продолжение табл. 1
| KН (к) | –56,9 | 67,95 | –38,49 |
| KCl (к) | –435,9 | 82,6 | –408,0 |
| KClO3 (к) | –391,2 | 143,0 | –289,9 |
| Li | 28,03 | ||
| Li2O | –595,8 | 37,9 | –560,2 |
| Li(OH) | –487,8 | 42,81 | –443,1 |
| Mg (к) | 32,55 | ||
| MgО (к) | –601,24 | 26,94 | –569,6 |
| Mg(ОН)2 (к) | –924,66 | 63,14 | –833,7 |
| MgCO3 (к) | –1096,21 | 65,69 | –1029,3 |
| МgSO4 (к) | –1063,74 | 112,13 | –955,96 |
| МgCI2 (к) | –641,1 | 89,9 | –591,6 |
| Мg3N2 (к) | –461,1 | 87,9 | –400,9 |
| МgО (к) | –601,8 | 26,9 | –569,6 |
| МnО (к) | –385,10 | 61,5 | –363,3 |
| МnО2 (к) | –521,49 | 53,14 | –466,68 |
| Мn2O3 (к) | –957,72 | 110,46 | –879,91 |
| Мn3O4 (к) | –1387,60 | 154,81 | –1282,9 |
| N2 (г) | 200,0 | ||
| NH3(г) | –46,2 | 192,6 | –16,7 |
| NH4OH (ж) | –366,69 | 179,9 | –263,8 |
| NH4CI (к) | –315,39 | 94,56 | –343,64 |
| NH4NO2 (к) | –256 | – | – |
| N2O (г) | 82,0 | 219,9 | 104,1 |
| NO (г) | 90,3 | 210,6 | 86,6 |
| N2O3 (г) | 83,3 | 307,0 | 140,5 |
| NO2 (г) | 33,5 | 240,2 | 51,5 |
| N2O4 (г) | 9,6 | 303,8 | 98,4 |
| N2O5 (г) | 83,3 | 307,0 | 140,5 |
| Na (к) | 51,42 | ||
| Na2O (к) | –430,6 | 71,1 | –376,6 |
| NaOH (к) | –426,6 | 64,18 | –377,0 |
Продолжение табл. 1
| NaCI (к) | –410,9 | 72,36 | –384,0 |
| Na2CO3 (к) | –1129,0 | 136,0 | –1047,7 |
| Na2SO4 (к) | –1384,0 | 149,4 | –1266,8 |
| Na2 SiO3 (к) | –1518,0 | 113,8 | –426,7 |
| NiO (к) | –239,7 | 33,0 | –211,6 |
| O2 (г) | 205,0 | ||
| OF2(г) | 25,1 | 247,0 | 42,5 |
| РС13 (ж) | –320,9 | 218,5 | –274,1 |
| РС13 (г) | –287,02 | 311,7 | –267,9 |
| РС15 (к) | –445,9 | 170,8 | –318,2 |
| РС15 (г) | –374,9 | 364,5 | –305,1 |
| РН3(г) | |||
| P2O3 (к) | –820 | 173,5 | – |
| P2O5 (к) | –1492 | 114,5 | –1348,8 |
| Pb (к) | 64,9 | ||
| РЬО (к) | –219,3 | 66,1 | –189,1- |
| PbO2 (к) | –276,6 | 74,9 | –218,3 |
| PbCI2 (к) | –359,2 | 136,4 | –313,97 |
| PbSO4 (к) | –918,1 | 147,28 | –811,24 |
| PbS (к) | –94,28 | 91,20 | –92,68 |
| Rb (к) | 76,2 | ||
| Rb2O (к) | –330,12 | 109,6 | –290,79 |
| RbOH (к) | –413,8 | 70,7 | –364,43 |
| S (ромб) | 31,88 | ||
| SO2 (г) | –296,9 | 248,1 | –300,г |
| SO3 (г) | –395,8 | 256,7 | –371,2; |
| SiCI4 (ж) | –687,8 | 239,7 | – |
| SiH4 (г) | 34,7 | 204,6 | 57,2 |
| SiO2 (кварц) | –910,9 | 41,8 | –856,7 |
| SnO (к) | –286,0 | 56,5 | –256,9 |
| SnO2 (к) | –580,8 | 52,3 | –519,3 |
Продолжение табл. 1
| I | 2 | ||
| SrO (к) | –590,4 | 54,4 | –559,8 |
| SrCO3 (к) | –1221,3 | 97,1 | –1137,6 |
| Тi (к) | 30,6 | ||
| TiС14(ж) | –804,2 | 252,4 | –737,4 |
| TiO2 (к) | –943,9 | 50,3 | –888,6 |
| WО3 (к) | –842,7 | 75,9 | –763,9 |
| Zn (к) | 41,52 | ||
| ZnО(к) | –350,6 | 43,6 | –320,7 |
| ZnS (к) | –201,0 | 57,7 | –198,32 |
| ZnSO4 (к) | –978,2 | 124,6 | –871,57 |
Влияние температуры на направление химических реакций
| ΔН | ΔS | ΔG | Направление реакции | Примеры реакций |
| ΔН<0 | ΔS>0 | ΔG<0 | Прямая реакция может быть самопроизвольной при любых температурах | 2C (графит) O2 (г) = 2СО (г) |
| ΔН>0 | ΔS<0 | ΔG>0 | Прямая реакция не может идти самопроизвольно при любых температурах | 2СО (г) = 2C (графит) O2 (г) |
| ΔН<0 | ΔS<0 | ΔG<0 ΔG>0 | Самопроизвольно может идти прямая реакция при низких температурах и обратная реакция при высоких температурах | CaO (к) СО2 (г) = CaCO3 (к) |
| ΔН>0 | ΔS>0 | ΔG>0 ΔG<0 | Самопроизвольно может протекать прямая реакция при высоких температурах и обратная реакция при низких температурах | CH4 2H2O(г) = СО2 (г) 4H2(г) |
Таблица 2
Теплоты сгорания некоторых веществ в стандартных условиях
(конечные продукты сгорания СО2 (г), и Н2О(ж))
| Соединение | ∆Нºсгор, кДж/моль | |
| CO | Монооксид углерода | –284,1 |
| СН4 (г) | Метан | –890,31 |
| С2Н2(г) С2Н4(г) С2H6 (г) | Ацетилен Этилен Этан | –1299,63 –1410,97 –1559,88 |
| С3H8 (г) | Пропан | –2210,5 |
| С5H12 (г) | н-Пентан | –3520,9 |
| С6H6 (ж) | Бензол | –3267,7 |
| С7H8 (ж) | Толуол | –3910,28 |
| CH3OH (ж) | Метиловый спирт | –726,64 |
| C2H5OH (ж) | Этиловый спирт | –1366,91, |
| C2H4(OH)2 (ж) C3H5(OH)3 (ж) C4H8O2 (ж) С4Н10О (ж) СН3СООН (ж) С7Н6О2 (к) С6Н12О6 С12Н22О11 CH3NO2 (ж) | Этиленгликоль Глицерин Этилацетат Диэтиловый эфир Уксусная кислота Бензойная кислота Глюкоза Сахароза Нитрометан | –1192,86 –1664,40 –2254,21 –2730,90 –873,79 –3227,54 –2815,8 –5648,0 –711,50 |
| C2H5NO2 (ж) | Нитроэтан | –1353,20 |
| CHCl3 (ж) | Хлороформ | –374,60 |
| СС14 (ж) | Тетрахлорид углерода | –156,70 |
Таблица 3
Значения энергии связей при 298 К и приближенные значения молярных теплот атомизации
| Энергия связи, кДж/моль | Молярная теплота атомизации, кДж/моль | ||||||||||
| H- | C- | C | C | N | N | N | O | O | |||
| H | 217,9 | ||||||||||
| C | 718,4 | ||||||||||
| N | 472,6 | ||||||||||
| O | 247,5 | ||||||||||
| F | 76,6 | ||||||||||
| Si | 368,4 | ||||||||||
| P | 314,5 | ||||||||||
| S | 222,8 | ||||||||||
| Cl | 121,4 | ||||||||||
| Br | 111,8 | ||||||||||
| J | 106,6 |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Ахметов Н.С Общая и неорганическая химия. – М.: Высшая школа, 1981. – 670 с.
2. Курс общей химии /под ред. Н.В. Коровина. – М.: Высшая школа, 1999.
3. Слейбо У, Персонс Т. Общая химия. – М.: Мир, 1979. – 550 с.
4. Браун Т., Лемей Г.Ю. Химия в центре наук: 2 т. – М.: Мир, 1983.
5. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии: 2 т. –М.:Мир, 1983.
6. Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. – М.: Химия, 1987. – 319 с.
7. Хаукрофт К., Констебл Э. Современный курс общей химии: 2 т. – М.: Мир, 2002.
8. Глинка Н.И., Рабинович В.А., Рубина Х.М. Задачи и упражнения по общей химии: учеб. пособие для студентов нехим. спец. вузов/под ред. В.А. Рабиновича, Х.М. Рубиной.–М.: Интеграл–Пресс, 2004.–240 с.
9. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. – М.: Высшая школа, 1980. – 228 с.
10. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по общей химии. – М.: Высшая школа, 1997. – 384 с.
11. Кузьменко Н.Е., Еремин В.В. 1000 вопросов и ответов. ХИМИЯ: учеб. пособие для поступающих в вузы. – М.: Книжный дом «Университет» 1999.-288 с.
СОДЕРЖАНИЕ
Введение 3
1. Первый закон термодинамики 4
2. Тепловые эффекты химических процессов 5
3. Закон Гесса и следствия из него 7
4. Энтропия. Второй и третий законы термодинамики 9
5. Энергия Гиббса 12
6. Константа равновесия
и изобарно–изотермический потенциал реакции 15
7. Термохимические измерения и вычисления 16
8. Лабораторные работы 18
8.1. Определение энтальпии реакции нейтрализации 18
8.2. Определение энтальпии реакции присоединения
кристаллизационной воды к безводной соли
(энтальпия гидратации) 20
8.3. Определение энтальпии гидролиза карбонатов
щелочных металлов 23
8.4.Определение энтальпии образования соли 24
9. Вычисления энергии связи по тепловому эффекту и наоборот 26
10. Контрольные вопросы 28
11. Тестовые задания для самопроверки по теме
«Энергетические эффекты химических реакций» 32
12. Примеры решения задач 42
13. Рекомендации для самостоятельной работы
студентов и варианты заданий 46
14. Требования к знаниям и умению 55
Приложение 56
Список рекомендуемой литературы 65
Учебное издание
Булатова Ольга Фёдоровна
Date: 2022-09-18; view: 1585; Нарушение авторских прав
§
Естественнонаучный факультет
Кафедра «Химии»
ДИСЦИПЛИНА ХИМИЯ
Отчет по лабораторной работе
ОПРЕДЕЛЕНИЕ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ НЕЙТРАЛИЗАЦИИ
| Лабораторную работу выполнил | _________ (подпись) | студент группы ______ |
| | ___________________________(ФИО ) | |
| Дата выполнения работы | _______________ | |
| Лабораторную работу принял | _________ (подпись) | Лапина С.Ф., доц. каф. Химии, к.фарм.н. |
| Рейтинговый бал: | подготовка ______ отчет ______ тематитическая карточка ______ | |
| Итого ______ | ||
| |
Братск 2022 г.
Цель работы – определение теплового эффекта реакции нейтрализации при взаимодействии сильной кислоты с сильным основанием.
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Химические реакции сопровождаются выделением или поглощением энергии (теплоты). Первые называются экзотермическими, вторые – эндотермическими.
Количество выделенной или поглощенной теплоты называют тепловым эффектом процесса (Q). Последний зависит от природы веществ, их количества, агрегатного состояния и температуры процесса. Изучением тепловых эффектов химических процессов занимается термохимия.
Большинство химических процессов протекают при постоянном давлении (р=const), т.е. является изобарными. Для изобарных процессов тепловой эффект равен разности энтальпий ( 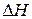 ) конечного и исходного состояния системы, характеризующей «теплоспособность» системы:
) конечного и исходного состояния системы, характеризующей «теплоспособность» системы:
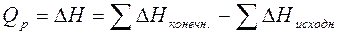
Величина ( 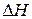 ) – энтальпия химической реакции — измеряется в кДж. Для экзотермических реакций (
) – энтальпия химической реакции — измеряется в кДж. Для экзотермических реакций ( 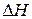 ) < 0, для эндотермических — (
) < 0, для эндотермических — ( 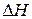 ) > 0. Изменение энтальпии (тепловой эффект химической реакции), а также агрегатное состояние каждого из исходных веществ и продуктов реакции указывают в термохимических уравнениях. Кроме этого, в них допускается применение дробных коэффициентов, так как тепловой эффект рассчитывается на один моль вещества.
) > 0. Изменение энтальпии (тепловой эффект химической реакции), а также агрегатное состояние каждого из исходных веществ и продуктов реакции указывают в термохимических уравнениях. Кроме этого, в них допускается применение дробных коэффициентов, так как тепловой эффект рассчитывается на один моль вещества.
Пример термохимического уравнения:
(NH4)2Cr2O7(к) = N2(г) Cr2O3(к) 4H2O(ж); 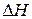 = -477 кДж.
= -477 кДж.
В данной записи (к), (г), (ж) означают соответственно кристаллическое, газообразное и жидкое состояния.
Для термохимических расчетов важна стандартная энтальпия образования соединений ΔНообр – это тепловой эффект реакции образования 1 моля этого соединения из простых веществ, устойчивых при стандартных условиях (температура 298 К и давление 101,3 кПа).
Основным законом термохимии является закон Г.И.Гесса, согласно которому изменение энтальпии (внутренней энергии) в химической реакции определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от начальных веществ к конечным.
Следствием из закона Гесса является соотношение:
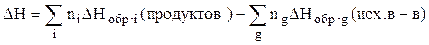
Где 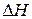 – энтальпия химической реакции.
– энтальпия химической реакции.
Первый член в правой части уравнения – сумма энтальпий образования продуктов реакции, взятых с учетом стехиометрических коэффициентов в уравнении реакции;
Второй член – аналогичная сумма для исходных веществ.
Известно, что нейтрализация 1 эквивалента любой сильной кислоты любым сильным основанием в разбавленных водных растворах сопровождается экзотермическим эффектом, при 298 К равным – 57,22 кДж/моль.
Это объясняется тем, что изменение энтальпии таких реакций не зависят от исходных веществ, и определяется при взаимодействии любых сильных кислот и щелочей реакцией:
Н (р) ОН — (р) = Н2О (ж); 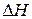 = -57,22 кДж/моль
= -57,22 кДж/моль
Этот факт подтверждает полную диссоциацию сильных электролитов в водных растворах. Например, нейтрализация азотной кислоты гидроксидом калия в разбавленных водных растворах сводится к образованию 1 моля жидкой воды, что следует из ионно-молекулярного уравнения реакции:
НNO3 KOH = KNO3 H2O (ж)
Н з (р) NO—3 (р) K (р) OH— = K (p) NO—3 (p) H2O (ж)
Н ОН— = Н2О (ж)
Date: 2022-09-18; view: 458; Нарушение авторских прав
§
§
ТЕРМОХИМИЯ И КИНЕТИКА
Москва 2003
Министерство образования Российской Федерации
_______________
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИНЖЕНЕРНОЙ ЭКОЛОГИИ
________________________________________________
Кафедра «Общая и физическая химия»
ТЕРМОХИМИЯ И КИНЕТИКА
Методические указания
Под редакцией д-ра хим. наук В.С.Первова
Москва 2003
Допущено редакционно-издательским советом.
Составители: В.В.Горбунов, Е.А.Зеляева, Г.С.Исаева
УДК 554,4; 544,33
Термохимия и кинетика: Методические указания
/Cост.: В.В.Горбунов, Е.А.Зеляева, Г.С.Исаева;
М.: МГУИЭ, 2003. — 24.
Методические указания предназначены студентам всех специальностей дневных и вечернего факультетов, изучающим общую химию. Работа содержит теоретические сведения по разделу «Термохимия и кинетика», а также контрольные вопросы, упражнения и задачи, необходимые для самостоятельной подготовки к лабораторным и контрольным работам.
Рецензенты: кафедра физической химии МГПУ ;
доц. Т.С.Тамурова, РУДН.
© В.В.Горбунов, Е.А. Зеляева, Г.С.Исаева, 2003
© МГУИЭ, 2003
ТЕРМОХИМИЯ
Тепловой эффект реакции. Экзотермические и эндотермические реакции. Термохимические уравнения реакций. Стандартная энтальпия образования вещества. Закон Гесса и применение его для термохимических расчетов.
Химические реакции протекают с выделением или поглощением энергии, чаще всего в виде теплоты. Реакции, при которых теплота выделяется, называются экзотермическими, поглощается – эндотермическими. Количество теплоты, выделяющееся или поглощающееся при химической реакции, протекающей при постоянной температуре, называется тепловым эффектом реакции. При постоянном давлении тепловой эффект реакции равен изменению энтальпии (ΔН). Тепловой эффект экзотермической реакции считают отрицательным (ΔН<0), а эндотермической – положительным (ΔН>0).
Тепловой эффект реакции выражается в единицах энергии – килоджоулях (кДж) или килокалориях (ккал) (1ккал = 4,1868кДж).
Наука, которая изучает тепловые эффекты химических реакций, называется термохимией, а уравнения химических реакций, в которых указывается тепловой эффект, — термохимическими уравнениями.
Тепловой эффект реакции (ΔН) зависит от природы реагирующих веществ, от количества этих веществ и их агрегатного состояния, от температуры.
Для сопоставления энергетических эффектов различных реакций и для проведения термохимических расчетов используют стандартные тепловые эффекты (обозначаются 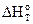 ).
).
Под стандартным понимается тепловой эффект реакции, осуществляемой в условиях, когда все участвующие в реакции вещества находятся в заданных стандартных состояниях (давление 101 кПа).
В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов, а тепловой эффект реакции (ΔН°) записывать отдельно, через запятую.
Например, термохимическое уравнение
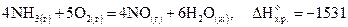 кДж,
кДж,
показывает, что данная химическая реакция сопровождается выделением 1531кДж теплоты, если давление 101кПа, и относится к тому числу молей каждого из веществ, которое соответствует стехиометрическому коэффициенту в уравнении реакции.
Важнейшей величиной в термохимии является стандартная теплота образования (стандартная энтальпия образования). Стандартной теплотой (энтальпией) образования сложного вещества называется тепловой эффект (изменение стандартной энтальпии) реакции образования одного моля этого вещества из простых веществ в стандартном состоянии. Стандартная энтальпия образования простых веществ в этом случае принята равной нулю.
В термохимии часто используют уравнения, в которых тепловой эффект относят к одному молю образовавшегося вещества, применяя в случае необходимости дробные коэффициенты.
Например, 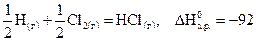 кДж.
кДж.
Тепловой эффект данной химической реакции равняется энтальпии образования HCl(г), т.е. 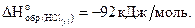
В основе термохимических расчетов лежит законГесса. Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) не зависит от пути ее протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции.
Следствия из закона Гесса
1. Тепловые эффекты прямой и обратной реакций равны по величине и противоположны по знаку.
2. Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учетом коэффициентов в уравнении реакции.
Date: 2022-09-18; view: 486; Нарушение авторских прав
§
Пример 1.
При образовании 1,8 г воды (H2O(ж)) из газообразных водорода и кислорода выделилось 28,6 кДж тепла. Вычислить энтальпию образования H2O(ж) и написать уравнение реакции, тепловой эффект которой равен 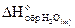 .
.
Решение. 1-й способ.
Так как 1 моль воды равен 18 г, то энтальпию образования
1 моль H2O(ж) можно вычислить
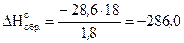 кДж/моль,
кДж/моль,
что соответствует уравнению
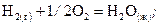
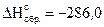 кДж/моль.
кДж/моль.
2-й способ: Из условия: DH=-28,6 кДж.
По определению: 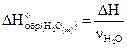 ;
;

Следовательно,
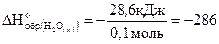 кДж/моль.
кДж/моль.
Пример 2.
Вычислить энтальпию образования N2O5(кр), если известен тепловой эффект реакции
N2O5(к) 2KOH(к)=2KNO3(к) H2O(ж); 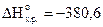 кДж,
кДж,
а также энтальпии образования KOH(к), KNO3(к) и H2O(ж),
которые соответственно равны
-425,0;-493,2 и –286,0 (кДж/моль).
Решение
Используя следствие из закона Гесса, запишем
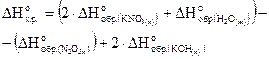
Подставим данные из условия и получим
-380,6=(2×-493,2-286)-( 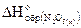 2×-425)
2×-425)
Проводим арифметические вычисления:
-380,6=-422,4- 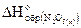 .
.
Отсюда
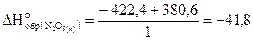 кДж/моль
кДж/моль
Пример 3.
Сколько выделится теплоты при получении 1 кг железа по реакции
Fe2O3(к) 3СО(г)=2Fe(к) 3СО2(г),
если энтальпии образования Fe2O3(к), СО(г) и СО2(г)
соответственно равны (кДж/моль):
-822,7; -110,6 и -394,0.
Решение
1.Вычисляем тепловой эффект реакции (DH), используя следствие из закона Гесса.
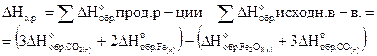
Так как энтальпия образования простого вещества принимается равной нулю то, 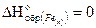 .
.
Тогда
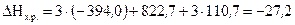 кДж
кДж
- Проведем расчет по термохимическому уравнению:
если образуется 2×56г Fe, то выделяется 27,2 кДж;
если образуется 1000г Fe, то выделяется х кДж.
Решаем пропорцию и получаем
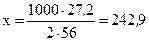 кДж, т.е.
кДж, т.е.
выделится 242,9 кДж теплоты.
Контрольные вопросы и задачи
1. Что называется тепловым эффектом химической реакции (DH)?
2. Перечислите факторы, влияющие на тепловой эффект химической реакции (DH).
3. Какие реакции называются экзотермическими и эндотермическими? Приведите примеры.
4. Какой знак имеет тепловой эффект (DH) для экзотермических и эндотермических реакций?
5. Дайте определение стандартной энтальпии образования сложного вещества 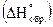 .
.
6. Дайте формулировку закона Гесса.
7. Сформулируйте следствия из закона Гесса.
8. При взаимодействии 1 моль водорода и 1 моль хлора выделяется 184 кДж. Чему равна энтальпия образования хлористого водорода 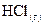 ?
?
9. На разложение 1 моль бромистого водорода на простые вещества требуется затратить 72 кДж теплоты. Чему равна энтальпия образования HBr?
10. При образовании 2 моль газообразного HCl выделяется 184 кДж. Чему равна энтальпия образования 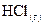 ?
?
11. Чему равен тепловой эффект разложения 1 моль хлористого водорода на простые вещества, если 
= -92 кДж/моль?
12. При образовании 2 моль паров воды выделилось
490,2 кДж. Чему равна энтальпия образования 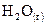 ?
?
13. При полном сгорании 1 моль водорода в кислороде выделилось 245,1 кДж. Чему равна энтальпия образования 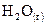 ?
?
14. Определите тепловой эффект (DHо) реакции разложения 2 молей йодистого водорода на простые вещества, если 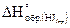 =26 кДж/моль.
=26 кДж/моль.
15. Сколько выделится теплоты при сжигании 1 кг алюминия, если 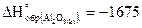 кДж/моль.
кДж/моль.
16. При сжигании какого количества магния выделяется 1000 кДж, если 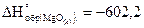 кДж/моль?
кДж/моль?
17. Сколько тепла выделяется при разложении 260 г ацетилена 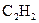 на простые вещества, если
на простые вещества, если 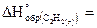
= 226,9 кДж/моль?
18. Сколько тепла выделится при разложении 4,4 г оксида азота (I) на азот и кислород, если  кДж/моль.
кДж/моль.
19. При взаимодействии 10 г водорода с хлором выделяется 920 кДж. Чему равна энтальпия образования 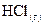 ?
?
20. Вычислите энтальпию образования оксида фосфора (V), если при сгорании 4 г фосфора выделяется 97,2 кДж.
21. При разложении 3 г оксида азота (II) на простые вещества выделяется 9,13 кДж. Определите 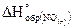 .
.
22. Определите тепловой эффект 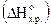 реакции 2Mg(к) CO2(г)=2MgO(k) C(k), если
реакции 2Mg(к) CO2(г)=2MgO(k) C(k), если 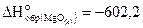 кДж/моль и
кДж/моль и 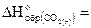
= -393,5кДж/моль. Вычислите, сколько потребуется теплоты для сгорания 2,4 г магния в диоксиде углерода.
23. Сероуглерод сгорает согласно уравнению
CS2(ж) 3O2(г) = CO2(г) 2SO2(г), 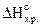 = -1103 кДж.
= -1103 кДж.
Рассчитайте стандартную энтальпию образования сероуглерода, если 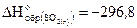 кДж/моль и
кДж/моль и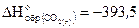 кДж/моль.
кДж/моль.
Вычислите, сколько теплоты выделится при сгорании 150 г сероуглерода.
24. Определите  стандартную энтальпию химической реакции
стандартную энтальпию химической реакции
4NH3(г) 5О2(г) = 4NO(г) 6H2O(ж), если 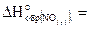
= 91,3 кДж/моль, 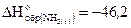 кДж/моль и
кДж/моль и 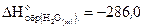 кДж/моль.
кДж/моль.
Рассчитайте, сколько выделится теплоты при окислении
44,8 л (н.у.) аммиака.
25. Рассчитайте стандартную энтальпию образования пероксида водорода 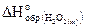 , если его разложение происходит по реакции
, если его разложение происходит по реакции 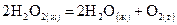
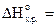
= -196,4 кДж, а 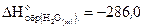 кДж/моль.
кДж/моль.
Сколько выделится теплоты при разложении 100 г пероксида водорода?
26. Рассчитайте, сколько потребуется теплоты для получения 650 г цинка по реакции ZnO C = Zn CO, если 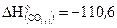 кДж/моль, а
кДж/моль, а
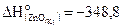 кДж/моль.
кДж/моль.
1. Рассчитайте стандартную энтальпию образования H2S(г), если при его сгорании по уравнению 2H2S(г) 3O2(г)=2H2O(г) 2SO2(г) выделяется 1037 кДж, а 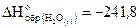 кДж/моль,
кДж/моль,
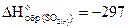 кДж/моль.
кДж/моль.
Вычислите, сколько тепла выделится при сгорании 11,2 л (н.у.) H2S.
2. Сера сгорает в закиси азота (N2O) согласно уравнению 2N2O(г) S(ромб.)=2N2(г) SO2(г).
Сколько тепла выделится при сгорании 5 г ромбической серы в закиси азота, если 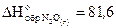 кДж/моль,
кДж/моль,
а 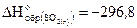 кДж/моль?
кДж/моль?
Date: 2022-09-18; view: 3940; Нарушение авторских прав
§
Скорость химических реакций, влияние на нее концентрации реагирующих веществ и температуры. Катализ. Необратимые и обратимые реакции. Константа химического равновесия. Правило Ле Шателье. Смещение химического равновесия.
Химическая кинетика – это учение о скоростях химических реакций и механизмах их протекания.
Системой в химии называется часть пространства, заполненная веществом и отграниченная от окружающей среды воображаемой или реальной поверхностью раздела. Система состоит из одной или нескольких фаз. Фазой называется совокупность всех однородных частей системы, обладающих одинаковым химическим составом и свойствами и отделенных от остальных частей системы поверхностью раздела, при переходе через которую свойства системы изменяются скачком. Системы, состоящие из одной фазы, являются гомогенными (смесь газов, растворы), двух или более фаз – гетерогенными (вода жидкая лед, кристаллы раствор).
Скорость химических реакций в гомогенных системах равна изменению молярной концентрации одного из веществ, участвующих в процессе, за единицу времени.
 (моль/л×с).
(моль/л×с).
Скорость химической реакции зависит от природы реагирующих веществ, их концентраций, от температуры и присутствия катализатора.
Влияние концентрации реагирующих веществ на скорость химической реакции.
Химическое взаимодействие веществ в газообразной среде или в растворе происходит при столкновении молекул этих веществ. Число успешных столкновений при постоянной температуре зависит от действующей массы вещества, которая пропорциональна общему количеству молекул в единице объема или числу молей вещества в единице объема, т.е. молярной концентрации. Зависимость скорости химической реакции от концентрации определяется законом действующих масс: скорость химической реакции пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, соответствующих коэффициентам для этих веществ в уравнении химической реакции. Если уравнение реакции имеет вид

то для этой реакции выражение скорости определяется уравнением
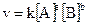 ,
,
где v — скорость реакции; a и b – стехиометрические коэффициенты в уравнении реакции; k – константа скорости; [A] и [B] – молярные концентрации веществ A и B соответственно.
Константа скорости есть скорость химической реакции при концентрациях исходных веществ, равных 1 моль/л; она зависит от природы реагирующих веществ, от температуры и от присутствия катализатора и не зависит от концентрации (давления).
Влияние температуры на скорость химической реакции. Зависимость скорости реакции от температуры приближенно может быть выражена правилом Вант-Гоффа, согласно которому при увеличении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза. Если известна скорость химической реакции v1 при температуре T1, то скорость этой реакции при температуре T2 может быть вычислена по формуле
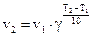 ,
,
где g — температурный коэффициент скорости химической реакции, равный 2-4.
Скорость реакции в гетерогенных системах.
Закономерности, определяющие течение реакций в гомогенных системах, распространяются на гетерогенные системы не в полной мере. Например, в гетерогенной системе газ — твердое тело столкновение между молекулами газа и твердого вещества может происходить лишь на поверхности раздела фаз, таким образом концентрация твердого вещества в целом (масса твердой фазы) не влияет на скорость реакции. При восстановлении оксида железа (II) водородом
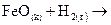
скорость реакции не зависит от концентрации FeO и пропорциональна только концентрации водорода, т.е. 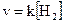 .
.
Гетерогенная реакция протекает на поверхности раздела фаз, поэтому, чем больше поверхность соприкосновения, тем выше скорость реакции. Вот почему твердые вещества значительно быстрее реагируют в измельченном состоянии.
Катализ. Катализом называется изменение скорости химической реакции под влиянием присутствующего в реагирующей системе постороннего вещества, состав и количество которого к концу реакции остаются без изменения. При гомогенном катализе взаимодействующие вещества и катализатор составляют однофазную систему (например, взаимодействие газов NH3 и HCl в присутствии паров H2O). При гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах (например, воспламенение смеси водорода и кислорода на поверхности твердого вещества – платиновой черни). Явление катализа широко используется в химической промышленности.
Химическое равновесие. Все химические реакции можно разделить на два типа: необратимые и обратимые. Обратимыми называются реакции, протекающие одновременно в двух противоположных направлениях; необратимыми – реакции, протекающие практически до конца в одном направлении. Число необратимых реакций ограничено; большинство реакций обратимы.
Для обратимой химической реакции
aA bB D mM nN,
протекающей в гомогенной системе, скорости прямого ( 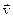 ) и обратного (
) и обратного ( 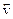 ) процессов определяются уравнениями:
) процессов определяются уравнениями:
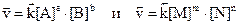 .
.
При этом скорость прямой реакции ( 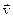 ) уменьшается, а скорость обратной реакции (
) уменьшается, а скорость обратной реакции ( 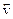 ) увеличивается.
) увеличивается.
В момент установления равновесия прямая и обратная реакции не прекращаются, а продолжают протекать в противоположных направлениях с равными скоростями, т.е. 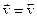 . Тогда
. Тогда
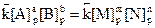
и соотношение между концентрациями реагирующих веществ имеет вид
 ,
,
где K — константа равновесия (величина постоянная для данной температуры); [A]p, [B]p, [M]p и [N]p – равновесные молярные концентрации веществ A, B, M, и N; a, b, m, n – стехиометрические коэффициенты.
Константой равновесия называется отношение констант скоростей прямой и обратной реакций при постоянной температуре. Её величина может быть рассчитана как отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ, также взятых в степенях, равных стехиометрическим коэффициентам.
Константа равновесия зависит от природы реагирующих веществ и температуры и не зависит от концентрации реагирующих веществ.
Для равновесной системы, если реакция протекает в гетерогенных условиях, например
СaCO3(к) D СaO(к) CO2(г),
выражение константы равновесия будет иметь вид K=[CO2]p, так как концентрации твердых веществ (CaCO3 и CaO),определяемые числом молей вещества в единице его объема, есть величины постоянные и в выражении K не пишутся.
Смещение химического равновесия. Положению равновесия системы реагирующих веществ соответствует такое её состояние, при котором скорости прямой и обратной реакций равны. При изменении внешних условий происходит изменение положения равновесия, так называемое смещение равновесия. Если равновесие смещается вправо, это означает, что в равновесной системе увеличиваются концентрации продуктов, если влево – концентрации исходных веществ. Направление смещения равновесия системы при изменении концентрации, температуры или давления определяется принципомЛе Шателье. Если на систему, находящуюся в равновесии, воздействовать извне, изменяя условия, определяющие положение равновесия, то оно сместится в таком направлении, что оказанное воздействие уменьшится.
Влияние различных факторов на положение химического равновесия рассмотрим на примере равновесной системы
N2(г) 3H2(г) D 2NH3(г); DHх.р.<0,
в которой прямая реакция протекает с выделением тепла.
В каком направлении будет смещаться равновесие в этой системе при увеличении давления и понижении температуры? Согласно принципу Ле Шателье, повышение давления смещает равновесие в направлении понижения давления т.е. в сторону химической реакции, идущей с уменьшением числа молей газообразных веществ. Объем исходных газов (N2 3H2) в два раза больше объема продукта 2NH3. Поэтому при увеличении давления в системе произойдет смещение равновесия в сторону прямой реакции, т.е. слева направо. Повышение температуры вызывает смещение равновесия в сторону химической реакции, протекающей с поглощением тепла, а понижение температуры — в сторону химической реакции, идущей с выделением тепла, т.е. слева направо.
Смещение равновесия происходит также при изменении концентрации реагирующих веществ. Повышение концентрации какого-либо реагента смещает равновесие в сторону химической реакции, ведущей к уменьшению концентрации этого реагента.
Поэтому для получения максимального выхода аммиака в данной реакции надо увеличить концентрации азота или водорода или уменьшить концентрацию конечного продукта – аммиака.
Date: 2022-09-18; view: 551; Нарушение авторских прав
§
Пример 1. Как изменится скорость реакции
2H2 O2 ®,
если давление увеличить в три раза?
Решение. По закону действующих масс скорость реакции
v=k[H2]2[O2].
Если давление увеличить в три раза, то и концентрации H2 и O2 увеличатся во столько же раз. Скорость реакции в новых условиях будет
v’=k×(3[H2])2×(3[O2])=27k[H2]2[O2],
т.е. увеличится в 27 раз.
Пример 2. Во сколько раз увеличится скорость реакции при повышении температуры от 10 до 100°С, если коэффициент g равен двум?
Решение. По правилу Вант-Гоффа
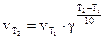 , отсюда
, отсюда
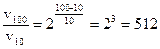 раз.
раз.
Пример 3. Реакция протекает по уравнению
N2 3H2 D 2NH3.
Определить исходные концентрации веществ N2 и H2, если равновесные концентрации составляли (моль/л):
[N2]=0,2; [H2]=0,3 и [NH3]=0,25.
Решение 1-й способ
Из условия задачи следует, что в исходной смеси аммиака не было, т.е. его концентрация была равна нулю.
Согласно уравнению реакции для образования 2 моль аммиака расходуются 1 моль азота и 3 моль водорода. Тогда для получения 0,25 моль NH3 потребуется 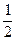 ×0,25=0,125 моль и
×0,25=0,125 моль и 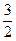 ×0,25=0,375 моль H2.
×0,25=0,375 моль H2.
Отсюда исходные концентрации N2 и H2 будут равны (моль/л):
[N2]исх=0,125 0,2=0,325
[H2]исх=0,375=0,3=0,675
Date: 2022-09-18; view: 432; Нарушение авторских прав
§
Обозначим исходные концентрации N2 и H2 через а, в соответственно. Начальная концентрация аммиака равна нулю. Исходные концентрации веществ являются произвольными величинами и никак не связаны между собой.
Пусть из имеющихся а моль/л азота в реакцию вступит х моль/л. По уравнению реакций с х моль/л азота прореагирует 3х моль/л водорода и образуется 2х моль/л аммиака. Поскольку реакция обратима и процесс стремится к равновесию, то при установлении равновесия концентрации азота и водорода уменьшатся и станут (моль/л) [N2]рав=а-х, [H2]рав=в-3х, а концентрация аммиака увеличится и станет: [NH3]рав. = 0 2х моль/л.
На основании приведенных рассуждений составим таблицу:
| Уравнение реакции Концентрации моль/л | N2 | 3H2 | D 2NH3 |
| начальные | а | в | |
| прореагировавшие | х | 3х | — |
| образовавшиеся | — | — | 2х |
| равновесные | а-х | в-3х | 2х |
Обратимся к условию задачи.
Обратимся к условию задачи.
[N2]рав = а-х = 0,2 моль/л
[H2]рав = в-3х = 0,3 моль/л
[NH3]рав = (0 2х) = 0,25 моль/л.
Из последнего соотношения определяем величину х:
х = 0,25:2 = 0,125 моль/л.
Тогда [N2]нач = а = 0,2 0,125 = 0,325 моль/л
[H2]нач = в = 0,3 3×0,125 = 0,675 моль/л
Ответ на вопрос получен.
Пример 4.
Для равновесной системы
CO H2O(пар) D H2 CO2
K=1,0 при 830°С. Определить равновесные концентрации всех веществ, если начальные концентрации (моль/л): [CO2]=2; [H2O]=3.
Решение. Уравнение константы равновесия имеет вид
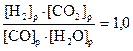
Составим следующую таблицу:
| CO | H2O | DH2 | CO2 | |
| Начальные концентрации | — | — | ||
| К моменту установления равновесия прореагировало молей | x | x | — | — |
| Образовалось молей | — | — | x | x |
| Равновесная концентрация | 2-x | 3-x | x | x |
Тогда 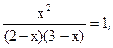 откуда x=1,2.
откуда x=1,2.
Следовательно, равновесные концентрации (моль/л):
[CO2]=2-1,2=0,8
[H2O]=3-1,2=1,8
[H2]=[CO2]=1,2.
Контрольные вопросы и задачи
1. Дайте определение понятий «система», «фаза». Приведите примеры одно-, двух- и трехфазных систем.
2. Какую систему называют гомогенной, какую – гетерогенной? Приведите примеры гомогенной и гетерогенной систем.
3. Какие реакции называются гомогенными, какие – гетерогенными? Приведите примеры гомогенной и гетерогенной реакций.
4. Скорость химической реакции. Перечислите факторы, влияющие на скорость гомогенной химической реакции.
5. Сформулируйте закон действующих масс. Почему скорость химической реакции зависит от концентрации реагирующих веществ?
6. Константа скорости химической реакции, её физический смысл. От каких факторов она зависит?
7. Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Температурный коэффициент скорости реакции.
8. От каких факторов зависит скорость гетерогенной химической реакции? Объясните влияние величины поверхности раздела реагирующих веществ на скорость реакции.
9. Обратимые и необратимые реакции. Приведите примеры.
10. Как изменяются скорости прямой и обратной реакций с течением времени?
11. Какое состояние системы реагирующих веществ называется химическим равновесием?
12. Принцип Ле Шателье. Рассмотрите его применение на примере реакции N2O4(г) D 2NО2(г); DHх.р.>0.
13. Что означает «смещение равновесия вправо или влево»?
14. Константа химического равновесия. Зависит ли константа химического равновесия от концентраций веществ, от температуры? Почему?
II.Составьте математическое выражение закона действующих масс для следующих реакций?
| 15. CH4(г) 2O2(г) ® 16. PCl5(г) Cl(г) ® 17. 2HCl(г) O2(г) ® 18. CO(г) Cl2(г) ® 19. 2NO(г) Cl2(г) ® 20. 4NH3(г) 3O2 ® 21. 2SO2(г) O2(г) ® | Cr2O3(к) 3CO(г) ® C(к) 2N2O(г) ® 3Ca(к) N2(г) ® Fe2O3(к) 3H2(г) ® MgO(к) CO2(г) ® Mg(к) H2O(г) ® 2B(к) 3F2(г) ® |
III. Составьте уравнение константы равновесия и укажите, в каком направлении сместится равновесие: а) при повышении температуры; б) при повышении давления.
22. 2NO(г) O2(г) D 2NO2(г); DH<0
23. CaCO3(к) D CaO(к) CO2(г); DH>0
24. Cl2(г) H2(г) D 2HCl(г); DH<0
25. SO2(г) NO2(г) D SO3(г) NO(г); DH<0
26. CH4(г) CO2(г) D 2CO(г) 2H2(г); DH>0
27. NH3(г) HCl(г) D NH4Cl(к); DH<0
28. Fe3O4(к) 4H2(г) D 4H2O(г) 3Fe(к); DH>0
IV. Задачи.
- Как изменится скорость прямой реакции
N2(г) O2(г) D 2NO(г),
если концентрация азота увеличится в 5 раз, а концентрация кислорода одновременно уменьшится в 4 раза?
30. Как изменится скорость прямой и обратной реакций в системе 2NO(г) O2(г) D 2NO2(г), находящейся в закрытом сосуде, если увеличить давление в 4 раза?
31. Как изменится скорость прямой реакции
2H2(г) O2(г) D 2H2O(г), если объем газовой смеси
уменьшится в 3 раза?
32. Скорость реакции при повышении температуры на 20°С возросла в 9 раз. Определите температурный коэффициент скорости этой реакции.
33. Температурный коэффициент скорости реакции равен 2,5. При какой температуре следует проводить реакцию, если скорость реакции, проводимой при 50°С, нужно уменьшить в 6,25 раза?
34. Взаимодействие между оксидом углерода (II) и хлором идет по уравнению CO(г) Cl2(г) D COCl2(г). Начальные концентрации [CO]=0,3 моль/л, а [Cl2]=0,2 моль/л. Как изменится скорость прямой реакции, если концентрацию оксида углерода увеличить до 1,2 моль/л, а хлора – до 0,6 моль/л.
35. Взаимодействие NO с Cl2 идет по уравнению 2NO(г) Cl2(г) D 2NOCl(г).
В начальный момент времени концентрации исходных веществ были: [NO]=0,5 моль/л, [Cl2]=0,3 моль/л. Как и во сколько раз изменится скорость реакции к моменту, когда концентрация хлора уменьшится на 0,1 моль/л
36. Равновесие реакции N2(г) 3H2(г) D 2NH3(г) при некоторой температуре установилось при следующих концентрациях (моль/л): [N2]=3; [H2]=9; и [NH3]=4. Найти начальные концентрации водорода и азота.
37. Равновесие реакции 2SO2(г) O2(г) D 2SO3(г) наступило при концентрации [SO2]=0,01 моль/л.
Исходные концентрации были равны:
[SO2]=0,03 моль/л и [O2]=0,025моль/л.
Вычислить равновесные концентрации SO3 и O2.
38. Реакции протекают по уравнению A2B2(г) D 2AB(г). Константа равновесия при некоторой температуре равна 3,6. Определить равновесную концентрацию [AB], если равновесная концентрация [A2B2]=0,004 моль/л.
39. При некоторой температуре константа равновесия COCl2(г) D CO(г) Cl2(г) равна 0,072. Определите равновесные концентрации оксида углерода (II) и хлора, если исходная концентрация фосгена (СOCl2) была равна 0,32 моль/л.
40. Исходные концентрации метана и оксида углерода (IV) в системе CH4(г) CO2(г) D 2CO(г) 2H2(г) составляли соответственно 0,4 моль/л и 0,6 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 25% метана.
41. При некоторой температуре равновесная концентрация SO3 в системе 2SO2(г) O2(г) D 2SO3(г) оказалось равной 0,04 моль/л, при этом 40% SO2 превратилось в SO3. Вычислите исходную концентрацию SO2, если исходная концентрация O2 составляла 0,2 моль/л.
42. В сосуде объемом 15 л содержалось 3,15 моль COCl2.При некоторой температуре в системе установилось равновесие COCl2(г) D CO(г) Cl2(г); при этом количество COCl2 уменьшилось в 3 раза. Вычислите равновесные концентрации всех веществ.
Домашние задания. Кинетика
Date: 2022-09-18; view: 400; Нарушение авторских прав
§
по теме «Кинетика и термохимия»
- Как зависит скорость химической реакции от температуры и почему?
- Взаимодействие CO с Cl2 идет по уравнению
CO(г) Cl2(г) D COCl2(г). Концентрации [CO]н=0,3 моль/л и [Cl2]н = 0,2 моль/л. Как и во сколько раз изменится скорость реакции через некоторый интервал времени, когда концентрация хлора уменьшится до 0,1 моль/л?
- В закрытом сосуде протекает реакция
2NO(г) O2(г) D 2NO2(г).
Определите константу равновесия этой реакции при некоторой постоянной температуре, если начальные концентрации веществ равны (моль/л): [NO]=0,08; [O2]=0,06, а к моменту установления равновесия в смеси осталось 20% от первоначального количества NO(г).
4. Сформулируйте закон Гесса. Определите стандартную энтальпию образования фосфата кальция по уравнению
3CaO(к) P2O5 = Ca3(PO4)2, если
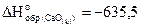 кДж/моль,
кДж/моль,
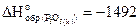 кДж/моль,
кДж/моль,
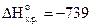 кДж/моль.
кДж/моль.
Date: 2022-09-18; view: 329; Нарушение авторских прав
§
закона Гесса: «Тепловой эффект химической реакции не зависит от пути протекания реакции, а зависит только от термодинамического состояния и природы исходных веществ и продуктов реакции».
Из закона Гесса вытекает ряд следствий.
1. Теплота образования (энтальпия) химического соединения представляет собой тепловой эффект образования одного моль вещества из соответствующих простых веществ.
Тепловой эффект зависит не только от природы вещества, но и его термодинамического состояния, поэтому теплоты образования определяют при стандартных условиях (Т = 298 К, р = 101,3 кПа). При этих условиях теплоту образования называют стандартной. Теплоты образования неорганических и органических веществ сведены в таблицу «Термодинамические величины простых и сложных веществ».
ΔН0298 (Al2(SO4)3) = -3434 кДж/моль;
2Al 3S 6O2 = Al2(SO4)3 3434 кДж/моль.
2. Закон Лавуазье-Лапласа: «Теплота разложения химического соединения равна по абсолютной величине, но противоположна по знаку теплоте образования данного соединения».
Теплотой (энтальпией) разложения химического соединения называется тепловой эффект разложения одного моль вещества до соответствующих простых веществ.
ΔН0298 (BaCO3) = -1264 кДж/моль; ΔНразл298 (BaCO3) = 1264 кДж/моль;
BaCO3 = Ba C 3/2O2 – 1264 кДж/моль.
3. Тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и сумой теплот образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции.
ΔН0298 (х.р.) = Σ ni ΔН0298 (прод) — Σ ni ΔН0298 (исх).
4. Теплотой (энтальпией) сгорания химического соединения называется количество теплоты, которое выделяется при сгорании одного моль вещества до соответствующих оксидов.
Продукты сгорания веществ указаны в таблице «Теплоты сгорания органических веществ ».
а) ΔНсг298 (С2Н2) = — 1299,63 кДж/моль;
С2Н2 5/2О2 → 2СО2 Н2О 1299,63 кДж/моль.
б) ΔНсг298 (С6Н5Cl) = — 726,64 кДж/моль;
С6Н5Cl 7О2 → 6СО2 2Н2О HCl 726,64 кДж/моль.
5. Теплота образования органического соединения равна разности между суммой теплот сгорания простых веществ и теплотой сгорания органического вещества с учетом стехиометрических коэффициентов в уравнении реакции.
C 2H2 O2 = CH3OH; ΔН0298 (CH3OH) = ?
ΔНсг298 (С) = ΔН0298 (CO2) = -393,51 кДж/моль;
ΔНсг298 (H2) = ΔН0298 (H2Oж) = -285,84 кДж/моль;
ΔН0298 (CH3OH) = ΔНсг298 (С) 2 ΔНсг298 (H2) – ΔНсг298 (CH3OH) =
-393,51 2(-285,84) 726,64 = -238,55 кДж/моль.
6. Тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
ΔН0298 (х.р.) = Σ ni ΔНсг298 (исх) — Σ ni ΔНсг298 (прод).
Если в таблицах стандартных термодинамических величин отсутствуют данные по теплотам образования или теплотам сгорания, то тепловой эффект реакции может быть рассчитан по энергиям связей.
7. Тепловой эффект реакции, протекающей в газовой фазе, равен разности между суммой энергий связей в молекулах исходных веществ и суммой энергий связей в молекулах продуктов реакции.
8. Тепловой эффект сгорания жидкого вещества равен разности между суммой теплоты испарения и энергий связей исходного вещества и суммой теплоты испарения и энергий связей продуктов реакции.
9. Если совершаются две или несколько реакций из разных исходных состояний к одинаковым конечным, то разница между тепловыми эффектами этих реакций представляет собой тепловой эффект перехода из одного исходного состояния в другое.
Сгр О2 → СО2; δНо298 = -393.5кДж/моль
Салм О2 → СО2; δНо298 = -395.4 кДж/моль
Сгр →Салм; δНо298 = 1.9 кДж/моль
10. Если совершаются две или несколько реакций из одинаковых исходных состояний в различные конечные, то разница между тепловыми эффектами этих реакций представляет собой тепловой эффект перехода из одного конечного состояний в другое.
СН3ОН → СН2О; δНо298 = 122,8 кДж/моль
СН3ОН → НСО2Н; δНо298 = -184,1 кДж/моль
СН2О → НСО2Н; δНо298 = -306,9 кДж/моль
11. Теплота (энтальпия) нейтрализации – это количество теплоты, которое выделяется при нейтрализации одного моль эквивалента кислоты одним моль эквивалента основания.
Сущность реакции нейтрализации сильной кислоты сильным основанием:
Н ОН— = Н2О; Δ H0нейтр = -57,3 кДж/моль.
При нейтрализации слабой кислоты сильным основанием или наоборот слабого основания сильной кислотой теплота нейтрализации будет меньше, потому что часть теплоты будет расходоваться на диссоциацию слабого электролита.
12. Теплота (энтальпия) растворения – это количество теплоты, которое выделяется при растворении одного моль веществ в таком объеме воды, дальнейшее прибавление которой не вызывает изменения теплового эффекта.
Теплота растворения равна сумме теплоты диссоциации и теплоты гидратации:
Δ Hраств = Δ Hдис Δ Hгидр
Теплотой диссоциации называется количество теплоты, которое поглощается при полной диссоциации одного моль вещества. Теплотой гидратации называется количество теплоты, которое выделяется при полной гидратации одного моль вещества. Растворение идет с выделением теплоты, если Δ Hгидр > Δ Hдис, и с поглощением теплоты, если Δ Hгидр < Δ Hдис.
mydocx.ru — 2022-2022 year. (0.008 sec.) Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав — Пожаловаться на публикацию
§
§
Теплоту, полученную телом, считают положительной и в уравнении ставят знак « »; теплоту, отданную телом, считают отрицательной и ставят знак «-».
Тепловым эффектом химической реакции называют алгебраическую сумму поглощенной при реакции теплоты и совершённой работы за вычетом работы против сил внешнего давления (pΔV).
В соответствии с первым законом термодинамики:
Q = ΔU A, (3)
где ΔU – изменение внутренней энергии системы; A – совершенная системой работа,
тепловой эффект реакции зависит от пути и способа проведения процесса. Однако, по крайней мере, при соблюдении одного из двух условий теплота химической реакции не зависит от пути и способа осуществления взаимодействия:
1) если реакция протекает в изохорно-изотермических условиях и при этом не совершается работа (А=0; V=const; T=const), то тепловой эффект реакции равен изменению внутренней энергии системы и, следовательно, не зависит от пути процесса:
QV,T = ΔU = U2 – U1, (4)
где U2 – внутренняя энергия продуктов реакции; U1 — внутренняя энергия исходных веществ;
2) если реакция протекает в изобарно-изотермических условиях (P=const; T=const) и при этом не совершается никакой работы, кроме работы расширения, то тепловой эффект реакции равен изменению энтальпии системы и следовательно не зависит от пути процесса:
QP,T = ΔH = H2 – H1, (5)
где Н2 – энтальпия продуктов реакции; Н1 – энтальпия исходных веществ.
Измерение тепловых эффектов реакций составляет обширную область термохимии, данные которой позволяют составить правильное представление об энергетической ценности той или иной реакции, ее внутреннем механизме, возможном направлении кинетики и т. д.
Для практических измерений тепловых эффектов употребляются калориметры.
Результаты опытов по измерению тепловых эффектов очень интересны. Так, оказалось, что 1 г веществ, из которых состоит бактерия (кишечная палочка), выделяет в час около 400 кал (1 кал = 4,1868 Дж), 1 г вещества таракана выделяет 50 кал/ч, 1 г вещества улитки – около 0,5 кал/ч. Особенно поучительно сравнение этих величин с теми, которые характеризуют неживые объекты, 1 г веществ, образующих тело человека, выделяет в 10 000 раз больше теплоты, чем 1 г материи Солнца; летящая муха дрозофила выделяет за единицу времени столько же энергии, сколько автомобиль на полной скорости, а бактерия – столько же, сколько реактивный самолет (конечно, в расчете на равные веса). Эти парадоксальные результаты указывают на исключительную мощность синтетических процессов в живых организмах и необычайные энергетические возможности жизни.
Результаты термохимических измерений – тепловые эффекты реакций – принято относить к одному молю образующегося вещества. Количество теплоты, которое выделяется при образовании 1 моля соединения из простых веществ, называется теплотой образованияданного соединения. Например, выражение «теплота образования воды равна 285,8 кДж/моль» означает, что при образовании 18 г жидкой воды из 2 г водорода и 16 г кислорода выделяется 285,8 кДж.
Если элемент может существовать в виде нескольких простых веществ, то при расчете теплоты образования этот элемент берется в виде того простого вещества, которое при данных условиях наиболее устойчиво. Теплоты образования наиболее устойчивых простых веществ принимаются равными нулю. Например, при обычных условиях наиболее устойчивой формой кислорода является молекулярный кислород О2, теплота образования которого считается равной нулю. Теплота же образования озона О3 равна -142 кДж/моль, поскольку при образовании из молекулярного кислорода одного моля озона поглощается 142 кДж.
Тепловые эффекты можно включать в уравнения реакций. Химические уравнения, в которых указано количество выделяющейся или поглощаемой теплоты, называются термохимическими уравнениями. Величина теплового эффекта указывается обычно в правой части уравнения со знаком плюс в случае экзотермической реакции и со знаком минус в случае эндотермической реакции.
Например, термохимическое уравнение реакции образования жидкой воды имеет вид
2H2 O2 = 2H2O 571,6 кДж, или
H2 ½ O2 = H2O 285,8 кДж
Возможна и другая запись термохимических уравнений, в которой величина теплового эффекта указана в виде изменения энтальпии ∆H. Часто изменение энтальпии записывается как ∆H0298. Верхний индекс 0 означает стандартную величину теплового эффекта реакции, а нижний температуру, при которой идет взаимодействие. В реакциях, идущих с выделением теплоты (экзотермических), энтальпия системы уменьшается (∆H ‹ 0); в реакциях, идущих с поглощением теплоты (эндотермических), энтальпия системы увеличивается (∆H › 0 ).
Ниже приведен пример записи термохимического уравнения с учетом вышесказанного:
N2 O2 = 2NO, ∆H0298= 90,25 кДж
Данная запись означает, что реакция образования оксида азота (II) идет с поглощением теплоты (эндотермическая).
Обе формы записи правильны и возможно использование любой из них.
Важнейшей характеристикой веществ, применяемых в качестве топлива, является их теплота сгорания. Эту величину также принято относить к одному молю вещества. Таким образом, выражение «теплота сгорания ацетилена равна 1300 кДж/моль» эквивалентно термохимическому уравнению
С2H2 2 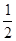 O2 = H2O 2CO2 1300 кДж
O2 = H2O 2CO2 1300 кДж
Величина теплового эффекта зависит от природы исходных веществ и продуктов реакции. Их агрегатного состояния и температуры. Для удобства сравнения различных реакций по величинам их тепловых эффектов последние обычно указывают для случая, когда температура исходных веществ и продуктов реакции равна 250С[1].
[1] Все тепловые эффекты, приводимые в таблицах термодинамических величин, относятся к 250С.
При этом также подразумевается, что участвующие в реакции вещества находятся в том агрегатном состоянии, которое устойчиво при 250С (стандартной температуре). Агрегатное состояние вещества указывается в уравнении реакции: для обозначения кристаллического состояния используется знак (к) около формулы вещества, жидкого – (ж), газообразного – (г).
Изменение давления, концентрации веществ и температуры приводит к смещению равновесия в ту или иную сторону. Направление смещения определяется известным принципом Ле-Шателье: при воздействии на систему, находящуюся в равновесии, равновесие смещается в сторону той из двух противоположных реакций (прямой или обратной), которая ослабляет эффект внешнего воздействия. Остановимся подробнее на влиянии температуры.
Реакция между кислородом и водородом сопровождается выделением тепла (уменьшением энтальпии)
2Н2 О2 = 2Н2О Q (DH<0)
Пусть все три вещества при температуре Т1 находятся в равновесии, описываемом константой К1:
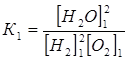 .
.
Затем температура повышается до Т2 и достигнуто новое состояние равновесия с константой К2:
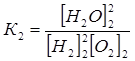 .
.
Спрашивается, как отличаются константы К1 и К2? Из принципа Ле-Шателье следует, что при повышении температуры равновесие смещается в сторону той реакции, которая ослабляет повышение температуры, а такой реакцией является процесс, идущий с поглощением тепла. Для данной системы это будет реакция диссоциации воды:
2Н2О = 2Н2 О2 – Q.
При повышении температуры равновесие смещается в сторону образования H2 и O2, т.е. с ростом температуры скорость взаимодействия кислорода и водорода замедляется, а скорость диссоциации воды возрастает, и это приводит к росту концентраций О2 и Н2 в равновесной газовой смеси.
В реакции
2Н2 О2 = 2Н2О Q
повышение температуры будет уменьшать константу равновесия, следовательно, [Н2О]1 > [ Н2О]2, [H2]1 < [H2]2, [O2]1 < [O2]2.
Отсюда вытекает общее правило: повышение температуры вызывает уменьшение константы равновесия реакции, идущей с выделением тепла (с уменьшением энтальпии) и увеличение константы равновесия реакции, сопровождающейся поглощением тепла (увеличением энтальпии).
Направление смещения химического равновесия и изменение константы (увеличение или уменьшение её) определяется знаком теплового эффекта или знаком изменения энтальпии (табл.1).
Таблица 1.
| Реакция | Тепловой эффект | Изменение энтальпии | Смещение равновесия | Изменение константы равновесия | ||
| Повышение температуры | Понижение температуры | Повышение температуры | Понижение температуры | |||
| эндотермическая | -Q | DH>0 | ® | увеличение | уменьшение | |
| экзотермическая | Q | DH<0 | ® | уменьшение | увеличение |
Степень смещения равновесия определяется величиной теплового эффекта , или величиной изменения энтальпии. Чем больше эти величины, тем значительнее влияние температуры на константу равновесия.
По степени изменения состояния равновесия при изменении температуры можно судить о тепловом эффекте реакции. Если известны две константы равновесия (К1 и К2) при двух температурах Т1 и Т2, то изменение энтальпии при протекании реакции вычисляют по следующей формуле:
Данное уравнение широко используется в физико-химических расчетах для нахождения тепловых эффектов.
Термохимические законы
Date: 2022-09-18; view: 1162; Нарушение авторских прав
§
Независимость теплоты химической реакции от пути процесса при р=const и Т=const была установлена в первой половине XIX века русским учёным Г. И. Гессом. Гесс сформулировал закон, который носит сейчас его имя: тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции.
Этот закон справедлив для тех взаимодействий, которые протекают в изобарно-изотермических (или изохорно-изотермических) условиях при том, что единственным видом совершаемой работы является работа против сил внешнего давления.
Рассмотрим пример, поясняющий закон Гесса. Раствор сульфата натрия можно приготовить из растворов серной кислоты и гидроксида натрия двумя способами:
1. Смешать раствор, содержащий два моля NaOH, с раствором, содержащим один моль H2SO4.
2. Смешать раствор, содержащий один моль NaOH, с раствором, содержащим один моль H2SO4, и к полученному раствору кислой соли (NaHSO4) добавить раствор, содержащий ещё одни моль NaOH.
Запишем термохимические уравнения этих реакций.
Первый способ:
2NaOH(водн) H2SO4(водн) = Na2SO4(водн) 2H2O 131,4 кДж
Второй способ:
NaOH(водн.) H2SO4(водн.) = NaHSO4(водн.) 2H2O 61,7 кДж
NaHSO4(водн.) NaOH(водн.) = Na2SO4(водн.) 2H2O 69,7 кДж
Символ (водн.) означает, что вещество взято в виде водного раствора.
Согласно закону Гесса, тепловой эффект в обоих случаях должен быть одним и тем же. Действительно, складывая тепловые эффекты, отвечающие двум стадиям второго способа, получаем тот же суммарный тепловой эффект, который наблюдается при первом способе проведения процесса: 61,7 69,7 = 131,4 кДж.
Таким образом, подобно обычным уравнениям химических реакций, термохимические уравнения можно складывать.
В основе большинства термохимических расчетов лежит следствие из закона Гесса:тепловой эффект химической реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования исходных веществ.
∆Hх.р. = (6)
Величины стандартных энтальпий образования веществ приведены в таблице 1.
Уравнение (6) позволяет определять как тепловой эффект реакции по известным величинам стандартных энтальпий образования веществ, участвующих в реакции, так и одну из энтальпий образования, если известны тепловой эффект реакции и все остальные энтальпии образования.
Пример 1.Рассчитать стандартный тепловой эффект реакции
½ Na2O (к) ½ Н2O (ж) = NaOH (к)
по известным величинам стандартных энтальпий образования веществ (табл.1). Записать термохимическое уравнение реакции.
Решение.
На основании следствия из закона Гесса (6) можно записать:
∆H0298 = ∆H0298обр NaOH – ( ½ ∆H0298 обр. Na2O ½ ∆H0298 обр. H2O).
Подставив в это выражение значения стандартных энтальпий образования веществ с учётом их агрегатных состояний, получим для NaOH
∆H0298 = -426,60 215,30 142,92 = -68,38 кДж/моль
Термохимическое уравнение реакции следует записать так:
½ Na2O (к) ½ Н2O (ж) = NaOH (к), ∆H0298 =-68,38 кДж/моль
или так:
½ Na2O (к) ½ Н2O (ж) = NaOH (к) 68,38 кДж/моль
Пример 2.Стандартный тепловой эффект реакции 2А В = 2С равен 150 кДж/моль В. Рассчитать стандартную теплоту (энтальпию) образования вещества А, если ∆H0298 обр.В =-45,0 кДж/моль и ∆H0298 обр.С = -60 кДж/моль.
Решение.
На основании следствия из закона Гесса (6) для рассматриваемой реакции имеем:
∆H0298 = 2∆H0298обр C – ( 2∆H0298 обр. A ∆H0298 обр. B).
Подставив в это выражение приведенные в условии задачи значения ∆H, определим величину ∆H0298 обр. A:
∆H0298 обр. A = ½ (-150-120 45) = — 112,5 кДж/моль
Date: 2022-09-18; view: 514; Нарушение авторских прав
§
В термодинамических таблицах содержатся стандартные энтальпии (изобарные тепловые эффекты, изобарные теплоты) образования химических соединений из простых веществ при 250С.
При температурах, отличных от 250С, тепловые эффекты в общем случае будут иными. Причем для различных реакций влияние температуры на тепловой эффект неодинаково. Только в одном случае, когда суммы теплоёмкостей исходных веществ и продуктов реакции равны, температура не влияет на тепловой эффект реакции. Чем сильнее отличаются теплоёмкости исходных веществ от теплоёмкостей продуктов, тем сильнее сказывается влияние температуры на тепловой эффект реакции.
Зависимость теплот химических реакций от температуры была изучена Кирхгофом. Если известен стандартный тепловой эффект реакции, то величину ∆H0Т можно рассчитать по уравнению Кирхгофа
∆H0Т = ∆H0298 , (7)
где ∆H0298 – стандартный тепловой эффект реакции при Т=289,16 К; ∆H0Т – стандартный тепловой эффект реакции при температуре Т; ΔСр – разность мольных изобарных теплоёмкостей всех продуктов реакции и мольных изобарных теплоёмкостей всех исходных веществ.
Расчеты по уравнению Кирхгофа показывают, что в том интервале температур, который может иметь практическое значение, изменение величины теплового эффекта реакции невелико. Так, например, тепловой эффект реакции Cu (к) ½ О2(г) = СuO (к), протекающий при р = 101 кПа, меняется с температурой следующим образом:
Т1=298 К; ∆H0298 = — 156,9 кДж/моль
Т2=500 К; ∆H0298 = — 155, 5 кДж/моль
Т3=1000 К; ∆H0298 = — 149, 5 кДж/моль
Тепловой эффект процесса ½ N2 ½ O2 = NO (г) при повышении температуры от 298 до 4000 К изменяется на 2,0 кДж/моль. Еще меньше влияние давления на тепловой эффект реакции. Так, для реакции синтеза аммиака из азота и водорода (все реагенты — газы) различие между величинами ∆HТ при р=101 кПа и р=50 МПа не превышает 5%. Поэтому при выполнении термохимических расчетов, допуская обычно незначительную ошибку, можно пользоваться стандартными значениями теплот образования даже тогда, когда условия протекания процесса отличаются от стандартных.
Закон Лавуазье-Ломоносова-Лапласа.
Тепловой эффект образования сложного вещества равен по величине и противоположен по знаку тепловому эффекту процесса разложения этого вещества.
Например: Н2 1/2О2 = Н2О (газ) 241,83 кДж/моль.
Н2О (газ) = Н2 ½ О2 – 241,83 кДж/моль.
Знак изменения энтальпии или внутренней энергии в тех же самых процессах противоположен, и если провести термодинамическую запись рассмотренных выше уравнений, то она будет выглядеть так:
Н2 1/2О2 = Н2О (газ) (ΔНо = –241, 83 кДж/моль)
Н2О (газ) = Н2 ½ О2 (ΔНо = 241, 83 кДж/моль)
Date: 2022-09-18; view: 318; Нарушение авторских прав
§
Закон Гесса. Тепловой эффект химических реакций, протекающих при постоянном давлении или объеме, не зависит от пути протекания реакции и определяется состоянием исходных веществ и продуктов реакции.
Следствия из закона Гесса.
Тепловой эффект обратного процесса равен по величине тепловому эффекту прямого процесса, но с противоположным знаком.
∆Hпр .= –∆Hобратн.

∆Hпр. = H2–H1
 ∆Hобрат. = H1–H2= –∆Hпр.
∆Hобрат. = H1–H2= –∆Hпр.
Тепловой эффект кругового процесса равен нулю.
∆H круг. = ∆H пр. ∆H обрат. = ∆H пр. – ∆H пр. = 0
Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ. При суммировании необходимо учитывать количество молей соответствующих веществ.
Например, для реакции
C6H12O6 (тв) 6 O2 (г) → 6 H2O(ж) 6 СO2 (г)
∆Hр = 6 ∆Hобр(H2O(ж) 6 ∆Hобр(СO2 (г)) – ∆Hобр(С6Н12O6 (тв))
ΔHобр.(О2)=0, т.к. энтальпии образования простых веществ приняты равными нулю.
Пользуясь следствием закона Гесса, можно вычислить изменение энтальпии любых реакций, исходя из значений энтальпий образования исходных веществ и продуктов. В табл. 1 приложения приведены значения изменений энтальпий образования некоторых веществ в стандартных условиях (стандартных теплот образования), ΔHº298. Используя данные табл.1, можем рассчитать ΔHр.для рассматриваемого процесса:
ΔHр. = 6 (–285,8) 6 (–393,5) – (–1273,0) = –2802,8 кДж
Величина и знак стандартных энтальпий образования веществ являются важными количественными характеристиками веществ, особенно при сравнительной оценке однотипных соединений. В целом можно утверждать: чем более отрицательное значение имеет стандартная энтальпия образования вещества, тем устойчивее вещество.
Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и теплот сгорания продуктов реакции. При суммировании необходимо учитывать количество молей соответствующих веществ.
В табл. 2 приложения приведены значения энтальпий сгорания некоторых веществ в стандартных условиях (стандартных теплот сгорания).
Например, тепловой эффект реакции
C2H4 (г) H2 (г) → C2H6 (г)
может быть определен через теплоты сгорания исходных веществ и продуктов реакции следующим образом:
ΔHºр. = ΔHºсгор.(C2H4 (г)) ΔHºсгор.(H2 (г)) – ΔHºсгор.(C2H6 (г)) = –1410,97
(–285,84) – (–1559,88)= –136,93 кДж.
С термохимическими уравнениями можно совершать алгебраические действия, их можно умножать и делить на постоянное число, складывать одно уравнение с другим и вычитать одно из другого, переносить члены уравнения из одной части уравнения в другую, изменяя при этом знак.
Подобные алгебраические действия с термохимическими уравнениями позволяют определять тепловые эффекты таких реакций, которые трудно осуществить на практике. Например:
С O2 = CO2; ΔHº1= –393,5 кДж/моль
СO ½ O2 = CO2; ΔHº2= –283,0 кДж/моль
С ½O2 = CO; ΔHºx-?
Для нахождения ΔHºx вычтем из первого термохимического уравнения второе:
С O2 – СO – ½ O2 = CO2 – CO2;
С ½ O2 = CO; ΔHº1 – ΔHº2
При сопоставлении полученного уравнения с искомым убеждаемся, что они идентичны, следовательно,
ΔHºx = ΔHº1 – ΔHº2 = –393,5 283,0 = – 110,5 кДж/моль.
2. ЭНТРОПИЯ. ВТОРОЙ И ТРЕТИЙ ЗАКОНЫ ТЕРМОДИНАМИКИ
Энтропия S является мерой свободы. С увеличением свободы неизбежно растет беспорядок, поэтому энтропию также называют мерой беспорядка.
Критерий самопроизвольности процесса устанавливается вторым законом термодинамики. Энтропия изолированной системы в самопроизвольном процессе возрастает: ΔS>0.
Чтобы разработать математический способ вычисления энтропии, Людвиг Больцман ввел понятие термодинамической вероятности состояния системы W – число микросостояний, которыми реализуется данное макросостояние. Так как 1 моль имеет NА=6,02 1023 частиц, то термодинамическая вероятность система выражается огромным числом.
Связь энтропии с термодинамической вероятностью Больцман описал формулой
S = k lnW, (5)
гдеk – постоянная величина, называемая постоянной Больцмана, которая связана с газовой постоянной R = 8,31 Дж/(моль К) соотношением
k = R/NА = 1,38 10 –23Дж/К. (6)
Энтропия растёт не только при нагревании, но и при эндотермических фазовых переходах: плавление, испарение и др. Энтропия резко возрастает при переходе вещества из жидкого состояния в газообразное.
Например, Sо298 н2о(ж) = 70,08, Sо298 н2о(г) = 188, 72 Дж/(моль К). Энтропия увеличивается при превращении вещества из кристаллического в аморфное. Чем прочнее вещество, тем упорядоченее его структура и тем меньше значение его абсолютной энтропии. Например, графит и алмаз являются модификациями углерода: графит – хрупкий, а алмаз – один из самых твердых кристаллов:
Sо298 графит = 5,740, Sо298 алмаз = 2,368 Дж/(моль К). Увеличение числа атомов в молекуле и усложнение молекул приводит к увеличению энтропии. Например, Sо298 (О)=160,9, Sо298 (О2 (г)) = 205,04, Sо298 (О3 (г)) = 238,8 Дж/(моль К).
Изменение энтропии в химической реакции определяется разностью сумм энтропий продуктов и энтропий исходных веществ.
Об изменении энтропии в химической реакции можно судить по изменению объёма системы в ходе реакции. Например, в реакции
½ С(графит) ½ СО2 (г) = СО(г), ΔSо298 = 87,8 Дж/К
наблюдается увеличение объёма (ΔV>0); следовательно, энтропия возрастает (ΔS>0). В случае же реакции образования аммиака из водорода и азота
3/2 Н2 (г) ½ N2 (г) = NН3 (г), ΔSо298 = – 103,1 Дж/К
наоборот, объём системы уменьшается (ΔV<0); следовательно, энтропия уменьшается (ΔS<0).
Если же реакция протекает между твердыми веществами, например,
Al(к) Sb(к) = AlSb(к), ΔSо298 = –5,1 Дж/К,
то изменения объёма системы и её энтропии практически не происходит. То же относится и к процессам, в которых количество (моль) газообразных веществ не изменяется, например:
С(графит) О2 (г) = СО2 (г), ΔSо298 = 2,9 Дж/К
3. ЭНЕРГИЯ ГИББСА
Согласно ΔН = ΔG TΔS теплота TΔS идет на создание беспорядка (бесполезно рассеивается в окружающую среду) и потому не может быть использована для совершения работы; её часто называют связанной энергией. Теплота ΔG может быть использована для совершения работы, и поэтому энергию Гиббса часто называют также свободной энергией:
ΔG = ΔН – TΔS
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса.
Date: 2022-09-18; view: 302; Нарушение авторских прав

