- Валентность серы.
- Валентность серы:
- Валентность элементов главной подгруппы ii группы
- Валентные возможности водорода
- Высшую валентность равную 7 проявляет 1) сера 2) кислород 3) хлор 4) углерод
- Какая валентность у серы?
- Общие сведения о валентности серы
- Степень окисления химических элементов и ее вычисление
- Электроотрицательность химических элементов
Валентность серы.
О валентности
Валентность серы
Молярная масса серы
Плотность серы
Степень окисления серы
Температура плавления серы
Температура кипения серы
Теплопроводность серы
Удельная теплоемкость серы
Удельная теплота сгорания серы
Электрическое сопротивление серы
Электропроводность серы
Все свойства атома серы
Валентность серы:
Валентность серы равна II, IV, VI. Сера проявляет переменную валентность.
карта сайта
Все свойства атома серы
Валентность элементов главной подгруппы ii группы
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем энергетическом уровне нет неспаренных электронов:
4Be1s22s2
12Mg 1s22s22p63s2
При возбуждении этих атомов спаренные s-электроны разъединяются в свободные ячейки p-подуровня этого же уровня и валентность становится равной двум (II):
Be*
Mg*
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды.
Высшую валентность равную 7 проявляет 1) сера 2) кислород 3) хлор 4) углерод
Какая валентность у серы?
Сера в своих соединениях проявляет валентности равные II, IV и VI.
Для того, чтобы определить валентность у серы можно воспользоваться двумя способами. Высшая валентность серы определяется номером группы в Периодической таблице Д.И. Менделеева. Так как сера находится в VI группе, значит её максимальная валентность равна VI.
По общепринятому способу разность между числом восемь и номером группы в Периодической таблице Д.И. Менделеева, в которой расположен химический элемент позволяет определить низшую валентность. Таким образом выясняем, что для серы также характерна валентность II (8 — 6 = 2).
Кроме этого, можно записать электронную и электронно-графическую формулы серы в основном (два) и возбужденном состояниях (четыре и шесть) и по числу неспаренных валентных электронов на внешнем энергетическом уровне найти значения валентностей данного элемента (IV – промежуточная валентность):![]() .
.
Валентность серы в конкретном соединении можно найти по следующей схеме (рассмотрим подробно на примере ![]() .
.
Валентность серы в конкретном соединении можно найти по следующей схеме (рассмотрим подробно на примере 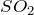 ):
):
— указываем валентность элементов, для которых это значение постоянно (известно, что валентность кислорода в оксидах всегда равна II);
— вычисляем общее число единиц валентности кислорода, умножив число атомов этого элемента в молекуле на значение валентности:![]() ;
;
— делим общее число единиц валентности кислорода на число атомов серы в соединении:![]() ;
;
— делим общее число единиц валентности кислорода на число атомов серы в соединении: .
.
Это означает, что валентность серы в ![]() равна IV.
равна IV.
Аналогичным образом определяем, что валентности серы ![]() равна IV.
равна IV.
Аналогичным образом определяем, что валентности серы 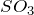 и
и ![]() равны VI и II соответственно.
равны VI и II соответственно.
Общие сведения о валентности серы
При обычном давлении сера образует хрупкие кристаллы желтого цвета, плавящиеся при температуре 112,8oС. Плотность 2,07 г/см3. Нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях.
Если расплавленную серу медленно охлаждать и в тот момент, когда она частично затвердевает слить еще не успевшую застыть жидкость можно получить длинные темно-желтые игольчатые кристаллы моноклинной системы (моноклинная модификация). Плотность 1,96 г/см3. Температура плавления 119,3oС.
Степень окисления химических элементов и ее вычисление
Степень окисления(СО)– условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
При определении СО следует руководствоваться следующими правилами:
- Сумма СО в химическом соединении всегда равна нулю, так как молекулы электронейтральны; в сложном ионе соответствует заряду иона.
- СО всех простых веществ соответствует нулю;
- Высшая положительная СО определяется по номеру группы; низшая отрицательная равна восемь минус номер группы;
- Элементы с наибольшей ЭО имеют отрицательную СО, с наименьшей – положительную;
- Постоянную СО имеют фтор (-1), щелочные металлы ( 1), щелочноземельные, а также бериллий, магний, цинк ( 2), алюминий ( 3). У кислорода СО равна -2, исключение пероксиды ( 2). У водорода 1, исключение соединения с металлами (гидриды) -1.
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
Электроотрицательность химических элементов
Электроотрицательность(ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
- В периодической системе химических элементов (ПСХЭ) ЭО в периоде увеличивается слева направо и уменьшается в главной подгруппе.
- ЭО связана с окислительно-восстановительными свойствами элементов, поэтому типичные неметаллы характеризуются высокой ЭО, а металлы – низкой. Самая высокая ЭО у фтора, потому что он самый сильный окислитель.
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
