Анализ способов дегазации серы
Дегазацию жидкой серы (рисунок 4.1) проводят в колонне с насадочным слоем (2), в котором в качестве катализатора используют носитель (3) с нанесенным на него дисульфофталоцианином кобальта. В насадочном слое колонны используют насыпной катализатор. Изобретение позволяет значительно снизить время дегазации серы.
Изобретение относится к области нефтяной и газоперерабатывающей промышленности и предназначено для очистки жидкой серы от сероводорода и его полисульфидов.

Рисунок 4.1 — Установка дегазации
Известен способ дегазации жидкой серы непосредственно из емкости сбора установки Клаус, откачивая ее насосом в специальную емкость дегазации, в которой установлены насосы для перемешивания и разбрызгивания ее через форсунки. В качестве катализатора используют аммиак, который подают на всас насоса. Данная технология используется на Астраханском газоперерабатывающем заводе [1].
Основными существенными недостатками данной технологии являются:
использование аммиака как катализатора для дегазации, который увеличивает количество выбросов в окружающую среду;
соли аммиака, являясь абразивными частицами, выводят из строя погружные насосы и распылители для дегазации серы;
трудность дальнейшего использования серы, т.к. присутствие в ней солей аммиака нарушают технологические процессы.
создание дополнительной емкости для хранения катализатора;
высокая стоимость катализатора.
Устранение данных недостатков, в т. ч. снижение времени дегазации серы (до моментального) происходит за счет проведения дегазации серы в колонне с насадочным слоем, в котором в качестве катализатора используют носитель с нанесенным на него дисульфофталоцианином кобальта при температуре серы, равной 160°С. Кроме того, в насадочной колонне используется насыпной катализатор.
Такая колонна работает следующим образом (рисунок 4.2): выводимую из технологических аппаратов жидкую серу собирали в яму дегазации серы 5, состоящую из двух секций, одна из которых (I) служит для сбора недегазированной серы, а вторая (II) для отдегазированной серы.
Из первой секции (I) погружным насосом 1 серу подавали в насадочную колонну 2, сера проходила через насадочный слой 3, который является носителем катализатора дисульфофталоцианина кобальта. Далее серу при температуре 160°С направляли в секцию (II), где с ее поверхности паровым эжектором 6 удаляли выделяющийся в процессе дегазации на насыпном слое катализатора сероводород.
Ниже в таблице показана стабильность работы катализатора по времени его использования.
Таблица 4.1 — Работа катализатора кобальта по времени его использования на носителе
Время работы носителя | Содержание H 2S (включая H2Sx) в жидкой сере, ppm |
Без катализатора | 363,75 |
1 час | 54,6 |
2 часа | 46,9 |
3 часа | 44,1 |
4 часа | 68,6 |
Горение и медленное окисление
I. Горение и медленное окисление
Горение – это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Без огня человек не сварит пищу, сталь, без него невозможно движение транспорта. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем.
Горение — реакция окисления, протекающая с достаточно большой скоростью,сопровождающаяся выделением тепла и света.
Схематически этот процесс окисления можно выразить следующим образом:

При горении идет интенсивное окисление, в процессе горения появляется огонь, следовательно, такое окисление протекает очень быстро. Если скорость реакции окажется достаточно большой? Может произойти взрыв. Так взрываются смеси горючих веществ с воздухом или кислородом. К сожалению, известны случаи взрывов смесей воздуха с метаном, водородом, парами бензина, эфира, мучной и сахарной пылью и т.п., приводящие к разрушениям и даже человеческим жертвам.
Для возникновения горения необходимы:
- горючее вещество
- окислитель (кислород)
- нагревание горючего вещества до температуры воспламенения
Температура воспламенения у каждого вещества различна.
В то время как эфир может воспламениться от горячей проволоки, для того чтобы поджечь дрова, нужно нагреть их до нескольких сот градусов. Температура воспламенения веществ различна. Сера и дерево воспламеняются при температуре около 270 °С, уголь – около 350 °С, а белый фосфор – около 40 °С.
Однако не всякое окисление непременно должно сопровождаться появлением света.
Существует значительное число случаев окисления, которые мы не можем назвать процессами горения, ибо они протекают столь медленно, что остаются незаметными для наших органов чувств. Лишь по прошествии определенного, часто весьма продолжительного времени мы можем уловить продукты окисления. Так, например, обстоит дело при весьма медленном окислении (ржавлении) металлов или при процессах гниения.
Разумеется, при медленном окислении выделяется теплота, но это выделение вследствие продолжительности процесса протекает медленно. Однако сгорит ли кусок дерева быстро или подвергнется медленному окислению на воздухе в течение многих лет, все равно – в обоих случаях при этом выделится одинаковое количество теплоты.
Медленное окисление – это процесс медленного взаимодействия веществ с кислородом с медленным выделением теплоты (энергии).
Примеры взаимодействия веществ с кислородом без выделения света: гниение навоза, листьев, прогоркание масла, окисление металлов (железные форсунки при длительном употреблении становятся тоньше и меньше), дыхание аэробных существ, т. е. дышащих кислородом, сопровождается выделением теплоты, образованием углекислого газа и воды.
Познакомимся с характеристикой процессов горения и медленного окисления приведённой в таблице.
Характеристика процессов горения и медленного окисления
Признаки реакции | Процесс | |
Горение | Медленное окисление | |
Образование новых веществ | Да | Да |
Выделение теплоты | Да | Да |
Скорость выделения теплоты | Большая | Небольшая |
Появление света | Да | Нет |
Вывод: реакции горения и медленного окисления – это экзотермические реакции, отличающиеся скоростью протекания этих процессов.
II. Задания для закрепления
№1. Лабиринт «Её величество реакция горения»
Найдите путь, который приведет вас к финишу. Начните прохождение лабиринта с верхней левой клетки. Если суждение, вписанное в эту клетку, правильно, то продолжайте путь по стрелке с обозначением «да». Если данное суждение ошибочно, то вам следует продолжать путь по стрелке с обозначением «нет».
Вашим ответом будет набор цифр.

№2. Головоломка «Не повторяющиеся буквы»
Для решения этой головоломки внимательно просмотри каждую строчку. Выбери из них ни разу не повторяющиеся буквы. Если ты сделаешь это правильно, то сможешь из этих букв составить пословицу о правилах обращения с огнем.

Домашнее задание
Задачник:
- Стр. 48 упр. 4-51, 4-56, 4-65
Горение и окисление
ХИМИЯ ВОКРУГ НАС
|/ак идёт горение в примусе и керосинке. Наиболее яр — ким примером химических реакций, идущих при участии кислорода воздуха, является горение — тот процесс, с помощью которого мы получаем тепло и свет. Какое бы
Топливо мы ни сжигали — уголь или дрова, керосин или бензии, спирт или светильный газ — главная химическая реакция при горении их одна и та же: углерод и водород, входящие в состав молекул топлива, соединяются с кислородом воздуха и образуют углекислоту и воду. Общеизвестно, что керосинка даёт жёлтое, светящее пламя, а примус — голубое или фиолетовое, почти не светящее пламя. В обоих случаях топливо одно и то же — керосин. Почему же это происходит?
Керосин — это смесь различных углеводородов, соединений углерода с водородом. Для примера возьмём один из углеводородов керосина — нонан, имеющий состав СуНго. При горении нонан соединяется с кислородом и образуются углекислота и вода. Начальное и конечное состояния этого процесса можно изобразить химическим уравнением:
С9Н20 1402 — 9 С02 10 Н20 (пар) теплота,
Написав такое уравнение, мы допустили, что углеводород сгорает полностью. Это и происходит в исправном примусе. В примусе керосин поступает в горелку под давлением. Испаряясь в нагретой горелке й вырываясь сильной струёй через форсунку, керосин хорошо перемешивается с воздухом. Смесь получается настолько богатой кислородом, что керосин сгорает полностью. Кроме того, пары керосина, проходя через раскалённую часть горелки, не только нагреваются, но и химически изменяются: сложные молекулы углеводородов при температуре 400—500 градусов распадаются на более простые, сгорающие легче. Этот распад обычно сопровождается выделением небольшого количества твёрдого углерода — кокса; кокс постепенно засоряет горелку, поэтому время от времени её нужно «прожигать».
Мы знаем, что керосинка всегда даёт копоть или сажу, то-есть очень мелкие частицы угля. Значит, в керосинке идёт неполное сгорание керосина. Керосин испаряется с поверхности фитиля и только тут смешивается с воздухом. Количество воздуха внутри пламени оказывается недостаточным. Поэтому и образуются мельчайшие раскалённые частички угля, от которых ярко светится пламя.
Почему дрова и каменный уголь, сгорая, дают пламя, а древесный уголь горит без пламени? Различные виды твёрдого топлива сгорают по-разному: дрова и каменный
Уголь образуют при горении пламя, а древесный уголь пламени не даёт. Какова же разница между ними?
Древесная масса и каменный уголь — смеси сложных веществ, богатых углеродом. Они содержат также кислород и водород. При нагревании дров и каменного угля сложные вещества расщепляются на более простые и в то же время более летучие вещества. Эти вещества, сгорая, и образуют пламя. Дрова дают большее пламя, чем каменный уголь: они образуют больше летучих веществ.
Древесный же уголь получают неполным сожжением дерева. Хороший древесный уголь — это почти чистый углерод; к нему примешаны только минеральные — вещества, дающие после сгорания золу. Поэтому древесный уголь не образует летучих продуктов и горит без пламени.
Все жидкие вещества и горючие газы, разлагающиеся при высокой температуре с выделением летучих продуктов, при горении образуют пламя. Твёрдые вещества, не способные давать летучие продукты разложения, горят без пламени. При неполном горении всегда образуется дым, состоящий из твёрдых частичек несгоревшего угля и газообразных продуктов горения — окиси углерода, углекислоты, водяных паров.
Почему керосиновая лампа коптит, а рано закрытая печка даёт угар. Мы можем управлять химическими реакциями, заставлять их протекать нужным нам образом. Примеры этому легко найти в нашем быту.
Керосиновая лампа стала коптить. Ясно, что если выделяется копоть, горение идёт не полно. Мы убавили фитиль — копоть перестала образовываться. Почему? Потому, что мы изменили условия горения. Убавив фитиль, мы уменьшили скорость испарения керосина. Количество же поступающего в лампу воздуха осталось прежним. Поэтому горение стало более полным.
А почему рано закрытая печь даёт угар? — Потому, что нарушается режим горения и вместо одной реакции идёт другая. При недостатке воздуха, поступающего в печь, горение идёт не до конца: вместо углекислоты, СО2, образуется окись углерода или, как её иначе называют, угарный газ СО. Угарный газ невидим, так как, в отличие от дыма, он не содержит твёрдых частиц. Он очень ядовит.
Окись углерода образуется и при открытой трубе, но так как приток кислорода в печь достаточный, она сгорает и образует углекислоту, уходящую в трубу
(рис. 7, А). При закрытой же трубе продукты горения выходят через печную дверцу в помещение. Если в печи осталось слишком много раскаленного угля, то притока воздуха хватает только на образование окиси углерода и в комнате появляется угар (рис. 7, £).
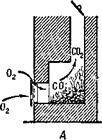
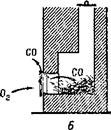
Рис. 7. А нормальное горение при открытой трубе; Б — образование угарного газа при большом количестве угля и закрытой трубе. |
![]() Эти простые примеры показывают, что, изменяя соотношения между количествами реагирующих веществ, можно управлять химической реакцией.
Эти простые примеры показывают, что, изменяя соотношения между количествами реагирующих веществ, можно управлять химической реакцией.
Чем отличается горение в печи от горения в живом организме? В печке сгорает топливо. Для организма топливом служит пища. И в организме и в печке углеродистые вещества сгорают, превращаясь в углекислоту и в воду.
В этом — сходство.
Разница же состоит в том, что в печке горение происходит при высокой температуре, а в живом организме — при низкой и значительно медленнее.
В печах, особенно промышленного типа — доменных, стекольных и др., температура превышает 1000 градусов. Тело человека имеет в среднем температуру 36,6 градуса. Химики установили, что повышение температуры на 10 градусов почти удваивает скорость реакции. Значит, горение в печи идёт во много раз быстрее, чем в организме.
Однако дело не только в этом. При высокой температуре реакция может протекать совсем иным путём. При 1000 градусов некоторая часть молекул кислорода (около 1,5 процента) распадается на атомы: 02^20. Значит, горение при высоких температурах можно объяснить тем, что с топливом вступают в реакцию свободные атомы кислорода, число которых по мере их расходования пополняется путём распада, диссоциации, новых молекул кислорода. Но в живых организмах молекулы кислорода не могут распадаться на атомы. Каким же образом происходит горение в организмах?
Общую теорию таких процессов разработал в конце прошлого столетия русский академик А. Н. Бах. Рядом опытов с простыми углеродистыми соединениями и с веществами, содержащимися в животных и растительных организмах, А. Н. Бах доказал, что при обыкновенной температуре к молекулам этих веществ присоединяются целые молекулы кислорода. При этом образуются такие соединения, которые способны окислять другие вещества так же легко, как и атомарный кислород. Эти соединения, называемые перекисями, являются промежуточными продуктами окисления.
Как же построены молекулы перекисей и какими свойствами они обладают?
Познакомимся сначала с простейшей перекисью — перекисью водорода Н202. Строение её изображается формулой Н—О—О—Н. Перекись водорода неустойчива, при хранении она медленно разлагается на воду и кислород: Н202=Н20 0. Значит, один из атомов кислорода в перекиси «подвижен»,«активен». Поэтому перекись водорода является хорошим окислителем.
В организмах животных и растений перекиси водорода нет, но с группой атомов —О—О—, характерной для перекисей, могут быть связаны атомы углерода органических соединений. Такие перекиси называют перекисями органических соединений, и они обнаружены в живых организмах. Им-то и принадлежит та исключительная роль в процессах медленного окисления в организме, на которую указал А. Н. Бах.
В организмах животных окисление пищевых материалов происходит в крови. В красных кровяных тельцах находится сложное белковое вещество, гемоглобин, окрашивающий кровь в красный цвет. В состав гемоглобина входит железо, придающее ему способность соединяться с кислородом. При дыхании гемоглобин окисляется (в лёгких) и превращается в оксигемоглобин. Сам оксигемоглобин не является настоящей перекисью, так как он отдаёт весь присоединённый кислород, а не половину, как это делают истинные перекиси. Но он легко превращает в перекиси некоторые пищевые вещества, попадающие в кровь, отдавая им свой кислород, и вновь переходит в гемоглобин. Кислород расходуется на окисление пищевых материалов, на выработку энергии, необходимой для поддержания жизни.
Есть ли разница между горением и окислением? По
Сходству с горением топлива естественно считать горением все химические процессы, протекающие с выделением тепла и света. Слово «горение» описывает внешние признаки и только одну сторону химической реакции — превращение химической энергии в тепловую и световую.
Но для химика описания только этой стороны реакции недостаточно. Он хочет знать, что происходит с каждым из атомов, входящих в состав вещества, как эти атомы изменяются во время реакции. И вот если с этой стороны посмотреть на реакции, происходящие при горении, то оказывается, что всегда какой-либо из атомов сгорающей молекулы увеличивает свою положительную валентность. Например, при сгорании СО в С02 положительная валентность углерода возрастает с 2 до 4, так как атом углерода оказывается связанным уже не с одним, а с двумя атомами кислорода. Углерод при горении окисляется. Поэтому мы называем окислением реакцию, в которой како й-л ибо элемент увеличивает свою положительную валентность.
А что делается при окислении с самим окисляющим веществом? В нашем примере окисляющим веществом служит кислород воздуха, простое вещество, которому мы условились (стр. 22) приписывать до реакции нулевую валентность. Входя в состав молекулы СОг, атом кислорода становится двухвалентным отрицательным. Реакцию, в которой атом каког о-л ибо элемента увеличивает свою отрицательную валентность, называют восстановлением. Следовательно, кислород воздуха, окисляя углерод СО, сам при этом восстанавливается. Из нашею примера мы видим, чго окисление и восстановление—два процесса — близнеца: они всегда сопровождают друг друга и невозможны один без другого.
Всякое ли окисление протекает как горение? Железо, окисляясь, ржавеет. Но разве мы можем сказать, что при этом железо горит. Конечно, нет. Разве в живом организме окисление сопровождается выделением света? — Нет, происходит только выделение тепла. Значит, окисление не всегда сопровождается горением. Но, как правило, все процессы горения являются окислением.
Могут ли горение и окисление происходить без кислорода? Окисляемый атом вовсе не обязательно должен отдавать свои валентные электроны именно атому кислорода. Очень легко это происходит и с другими элементами. Вернёмся к опыту, описанному на стр. 12. Железо, которое мы погружаем в раствор медного купороса,— простое вещество с нулевой валентностью. Железо активнее меди и вытесняет из раствора медь. В этой реакции вытеснения атом железа отдаёт атому меди 2 электрона и сам приобретает валентность 2. Значит, и здесь железо окисляется! Атом же меди, забрав у атома железа 2 электрона, изменяет валентность с 2 до нуля, восстанавливается.
Точно так же можно рассмотреть и реакцию между серой и железом (стр. 9). Оба они — простые вещества с нулевой валентностью. После реакции валентность железа 2, а серы — 2, следовательно, железо окислилось, а сера восстановилась. Вспомним, что реакция между серой и железом сопровождается выделением тепла и света, то-есть горением, хотя кислород в ней и не участвует. Значит, не только окисление, но и горение может происходить без участия кислорода.
Почему железо ржавеет, а золото и серебро — нет? Из всех металлов наиболее широко используется в технике и в быту железо. Большим недостатком железа служит то, что оно легко соединяется с кислородом воздуха и водой, ржавеет. Так как ржавчина непрочно связана с поверхностью металла, она легко стирается, распыляется, приводя к большим потерям металла. Ржавление и подобные ему процессы разрушения металлов называют кор — роз и е й.
Подсчитано, что в результате коррозии во всём мире ежегодно теряется больше 30 миллионов тонн металлов. Это настоящее бедствие. Поэтому химики и физики упорно работают над вопросами борьбы с коррозией.
Ржавчина — это смесь водной закиси железа Ре (ОН)г, окиси железа Ре203, окалины Ре304 и некоторых других веществ. То, что железо окисляется уже при низкой температуре, объясняется его значительной химической активностью.
Другое дело — серебро, золото, платина и другие благородные металлы. Их активность очень мала. Ядра их атомов цепко удерживают валентные электроны и поэтому трудно окисляются. Соединения этих металлов непрочны, они легко распадаются с выделением свободных металлов. Хлористое и бромистое серебро, например, разлагается на свету. На этой реакции основана вся фотокинопромышленность [23]).
Неустойчивость солей серебра можно доказать интересным опытом. Подогреем в стаканчике нашатырный спирт (это — водный раствор аммиака) до 50—60 градусов и нальём в него при перемешивании несколько капель раствора ляписа (азотнокислого серебра). Затем добавим несколько капель формалина или раствора виноградного сахара — глюкозы. Через несколько минут на стенках стаканчика образуется серебряное зеркало, а в растворе появится тёмная муть. Формалин или глюкоза восстанавливают серебро из его соли. Эта реакция используется для изготовления зеркал.
* *
*
Итак, мы познакомились с составом воздуха и отметили особую роль кислорода в природе, которую ему обеспечивает его большая химическая активность. Но очень многие реакции с участием кислорода шли бы совсем иначе, а некоторые — не были бы даже возможны, если бы на помощь кислороду при его воздействии на другие вещества не приходила вода. Вода, подобно кислороду, играет в природе громадную роль и обладает многими очень важными свойствами. Их мы и рассмотрим в следующем разделе.
Это ядохимикаты для сельскохозяйственной отрасли. Они предназначены для уничтожения вредителей растений на полях, в хранилищах, магазинах. Сейчас пестициды купить можно в стационарных агрокомпаниях, интернет-магазинах. Они делятся на такие группы: инсектициды …
Натрия гидроксид (Na OH), также известный как щелочь или каустическая сода, представляет собой едкое металлическое основание. Щелочь, каустическая сода обширно употребляется в почти во всех отраслях индустрии, как правило, в …
Уже прошли ситуации, когда вам нужно бегать с тяжелыми сумками, покупая хорошее чистящее средство. Существующие интернет-сайты помогут вам купить необходимые одновременно. Работники помогут выбрать, расскажут о правилах использования выбранного инструмента. …
Пожароопасные свойства серы
Тонкоизмельченная сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углём, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Средства тушения: распылённая вода, воздушно-механическая пена.
По данным В. Маршалла пыль серы относится к разряду взрывоопасных, но для взрыва необходима достаточно высокая концентрация пыли — порядка 20 г/м3 (20000мг/м3), такая концентрация во много раз превышает предельно допустимую концентрацию для человека в воздухе рабочей зоны — 6 мг/м3.
Пары образуют с воздухом взрывчатую смесь.
Горение серы протекает только в расплавленном состоянии аналогично горению жидкостей. Верхний слой горящей серы кипит, создавая пары, которые образуют слабосветящееся пламя высотой до 5 см. Температура пламени при горении серы составляет 1820 °C.
Так как воздух по объёму состоит приблизительно из 21 % кислорода и 79 % азота и при горении серы из одного объёма кислорода получается один объём SO2, то максимальное теоретически возможное содержание SO2 в газовой смеси составляет 21 %. На практике горение происходит с некоторым избытком воздуха, и объёмное содержание SO2 в газовой смеси меньше теоретически возможного, составляя обычно 14…15 %.
Обнаружение горения серы пожарной автоматикой является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Тепловыделение при пожаре приводит к температуре ниже, чем при пожарах других распространенных пожароопасных веществ. Для обнаружения горения тепловым извещателем необходимо размещать его непосредственно близко к сере. Пламя серы не излучает в инфракрасном диапазоне. Таким образом оно не будет обнаружено распространёнными инфракрасными извещателями. Ими будут обнаруживаться лишь вторичные возгорания. Пламя серы не выделяет паров воды. Таким образом детекторы ультрафиолетовых извещателей пламени, использующие соединения никеля, не будут работать.
Для эффективного обнаружения пламени рекомендуется использовать ультрафиолетовые извещатели с детекторами на основе молибдена. Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы.
Для выполнения требований пожарной безопасности на складах серы необходимо:
конструкции и технологическое оборудование должны регулярно очищаться от пыли;
помещение склада должно постоянно проветриваться естественной вентиляцией при открытых дверях;
дробление комков серы на решётке бункера должно производиться деревянными кувалдами или инструментом из неискрящего материала;
конвейеры для подачи серы в производственные помещения должны быть снабжены металлоискателями;
в местах хранения и применения серы необходимо предусматривать устройства (бортики, пороги с пандусом и т. п.), обеспечивающие в аварийной ситуации предотвращение растекания расплава серы за пределы помещения или открытой площадки;
на складе серы запрещается:
производство всех видов работ с применением открытого огня;
складировать и хранить промасленную ветошь и тряпки;
при ремонте применять инструмент из искродающего материала.
Пожары на складах серы
В декабре 1995 года на открытом складе серы предприятия, расположенного в городе Сомерсет-Уэст Западной Капской провинции Южно-Африканской Республики произошёл крупный пожар, погибли два человека.
16 января 2006 г. около пяти вечера на череповецком предприятии «Аммофос» загорелся склад с серой. Общая площадь пожара — около 250-ти квадратных метров. Полностью ликвидировать его удалось лишь в начале второго ночи. Жертв и пострадавших нет.
15 марта 2007 рано утром на ООО «Балаковский завод волоконных материалов» произошёл пожар на закрытом складе серы. Площадь пожара составила 20 кв.м. На пожаре работало 4 пожарных расчёта с личным составом в 13 человек. Примерно через полчаса пожар был ликвидирован. Никто не пострадал.
4 и 9 марта 2008 года произошло возгорание серы в Атырауской области в хранилище серы ТШО на Тенгизском месторождении. В первом случае очаг возгорания удалось потушить быстро, во втором случае сера горела 4 часа. Объём горевших отходов нефтепереработки, к каковым по казахстанским законам отнесена сера, составил более 9 тысяч килограммов.
В апреле 2008 недалеко от посёлка Кряж Самарской области загорелся склад, на котором хранилось 70 тонн серы. Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчётов и спасатели. В тот момент, когда пожарные оказались около склада, горела ещё не вся сера, а только её небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землёй и залиты водой.
В июле 2009 в Днепродзержинске горела сера. Пожар произошёл на одном из коксохимических предприятий в Баглейском районе города. Огонь охватил более восьми тонн серы. Никто из сотрудников комбината не пострадал.
Сера в химии
Сера горит синим пламенем с образованием диоксида серы, который имеет удушающий и раздражающий запах.
- Сера нерастворима в воде, но растворима в сероуглероде и, в меньшей степени, в других неполярных органических растворителях, таких как бензол и толуол.
Сера реагирует почти со всеми другими элементами, за исключением благородных газов.
- Элементарная сера нетоксична, как и большинство растворимых сульфатных солей, таких как соли Эпсома.
Растворимые сульфатные соли плохо абсорбируются и оказывают слабительное действие.
- При парентеральном введении они свободно фильтруются почками и устраняются с очень небольшой токсичностью в мультиграммовых количествах.
Когда сера горит в воздухе, она производит диоксид серы (SO2)
В воде этот газ производит серную кислоту и сульфиты; сульфиты являются антиоксидантами, которые подавляют рост аэробных бактерий и полезную пищевую добавку в небольших количествах.
- В высоких концентрациях эти кислоты вредят легким, глазам или другим тканям.
- В организмах без легких, таких как насекомые или растения, сульфит в высокой концентрации предотвращает дыхание.
Триоксид серы (получаемый в результате катализа из диоксида серы) и серная кислота одинаково сильно кислотны и вызывают коррозию в присутствии воды.
Серная кислота является сильным дегидратирующим агентом, который может удалять имеющиеся молекулы воды и компоненты воды из сахара и органических тканей.
После этой познавательной информации необходимо изучить химические свойства серы, а также ее получение, поэтому я составила таблицу для использования в подготовке к ОГЭ и ЕГЭ по химии.
Таблица: химические свойства серы
1) Получение | 1) В лаборатории | Из водных растворов: Na2SO3S 2H2SO4 (k) → 2NaHSO4 S↓ SO2 H2O |
2) В промышленности |
1) 2H2S (газ) 3O2 → 2SO2 2H2O (сжигание); 2) 2H2S SO2 → 3S↓ 2H2O (kat., Al2O3, Fe2O3); 3) 2H2S H2SO3 → 2S↓ 3H2O; 4) H2S (газ) → S↓ H2 (t > 400 C); 5) SO2 C → CO2 S↓ (t). 1) ZnS O2 → ZnO SO2 (t); 2) SO2 C → CO2 S↓ (t).
1) CaSO4 4C → 4CO↑ CaS (t); 2) CaS 4C H2O → CaCO3 H2S↑; 3) 2H2S O2 → 2S↑ 2H2O. | |
2) Химические свойства | Окислительные и | 1) С металлами: 3S 2Al → Al2S3 (t); S 2Na → Na2S (расплав); S Me → MeS Q (Me = металлы, кроме Au, Pt, Ir). 2) С неметаллами: S (тв.) H2 → H2S (150 – 350 C); S O2 → SO2 (t); 2S C → CS2 (800-900 C); 3S 2P → P2S3 (расплав); 5S 2P → P2S5 (без доступа воздуха). 3) С щелочами: 3S 6NaOH → 2NaS Na2SO3 3H2O; 4S 6NaOH → 2Na2S Na2SO3 3H2O; 3S 3Ca(OH)2 → 2CaS CaSO4 3H2O (кипячение); 2S 4NaOH 3O2 → 2Na2SO4 2H2O (расплав, t). 4) С кислотами: S 2H2SO4 → 3SO2↑ 2H2O (t); S 2HNO3 (p.) → H2SO4 2NO↑ (t); S 6HNO3 (k.) → H2SO4 6NO2↑ 2H2O (t); S 2HI → H2S I2. 5) C солями: 3S 2KClO3 → 3SO2↑ 2KCl (t); S 2KMnO4 → K2SO4 2MnO2 (в слабощелочной среде); S 3K2CO3 →2K2S K2SO3 3CO2↑. |
Сложная смесь химических соединений
Если известен элементный состав сложного горючего вещества, то состав и количество продуктов сгорания 1 кг вещества можно определить по уравнению реакции горения отдельных элементов. Для этого составляют уравнения реакции горения углерода, водорода, серы и определяют объем продуктов сгорания, приходящийся на 1 кг горючего вещества. Уравнение реакции горения имеет вид:
С О2 3,76N2 = СО2 3,76N2
При сгорании 1 кг углерода получается 22,4 / 12 = 1,86 м3 СО2 и 22,4 × 3,76/12 = 7,0 м3 N2.
Аналогично определяют объем (в м3) продуктов сгорания 1 кг серы и водорода. Полученные данные приведены ниже:
| СО2 | N2 | Н2О | SO2 | |
| Углерод | 1,86 | 7,00 | – | – |
| Водород | – | 21,00 | 11,2 | – |
| Сера | – | 2,63 | – | 0,7 |
При горении углерода, водорода и серы кислород поступает из воздуха. Однако в состав горючего вещества может входить кислород, который также принимает участие в горении. В этом случае воздуха на горение вещества расходуется соответственно меньше.
В составе горючего вещества могут находиться азот и влага, которые в процессе горения переходят в продукты сгорания. Для их учета необходимо знать объем 1 кг азота и паров воды при нормальных условиях.
Объем 1 кг азота равен 0,8 м3, а паров воды 1,24 м3. В воздухе при 0 °С и давлении 101325 Па на 1 кг кислорода приходится 3,76 × 22,4 / 32 = 2,63 м3 азота.
На основании приведенных данных определяют состав и объем продуктов сгорания 1 кг горючего вещества.
Например, чтобы определить объем и состав влажных продуктов сгорания 1 кг каменного угля, состоящего из 75,8 % С, 3,8 % Н, 2,8 % О, 1,1 % N, 2,5 % S, W = 3,8 %, A = 11,0 %.
Объем продуктов сгорания будет следующий, м3:
| Состав продуктов сгорания | СО2 | Н2О | N2 | SO2 |
| Углерод | 1,86 × 0,758 = 1,4 | – | 7 × 0,758 = 5,306 | – |
| Водород | – | 11,2 × 0,038 = 0,425 | 21 × 0,038 = 0,798 | – |
| Сера | – | – | 2,63 × 0,025 = 0,658 | 0,7 × 0,025 = 0,017 |
| Азот в горючем веществе | – | – | 0,8 × 0,011 = 0,0088 | – |
| Влага в горючем веществе | – | 1,24 × 0,03 = 0,037 | – | – |
| Сумма | 1,4 | 0,462 | 6,7708 – 0,0736 = 6,6972 | 0,017 |
Из общего объема азота вычитают объем азота, приходящийся на кислород в составе каменного угля 0,028 × 2,63 = 0,0736 м3. Итог указывает состав продуктов сгорания каменного угля: объем влажных продуктов сгорания 1 кг каменного угля равен:
Vп.с. = 1,4 0,462 6,6972 0,017 = 8,576 м3/кг.
Способы получения
1. Серную кислоту в промышленностипроизводят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравненяи реакций |
| Печь для обжига | 4FeS2 11O2 → 2Fe2O3 8SO2 Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 O2 ↔ 2SO3 Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. nSO3 H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота.
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
H2SO4 ⇄ H HSO4–
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4– ⇄ H SO42–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, серная кислота взаимодействует с оксидом магния:
H2SO4 MgO → MgSO4 H2O
Еще пример: при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
H2SO4 КОН → KHSО4 H2O
H2SO4 2КОН → К2SО4 2H2O
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3H2SO4 2Al(OH)3 → Al2(SO4)3 6H2O
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например, серная кислота взаимодействует с гидрокарбонатом натрия:
Н2SO4 2NaHCO3 → Na2SO4 CO2 H2O
Или с силикатом натрия:
H2SO4 Na2SiO3 → Na2SO4 H2SiO3
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
NaNO3(тв.) H2SO4 → NaHSO4 HNO3
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например, хлорида натрия:
NaCl(тв.) H2SO4 → NaHSO4 HCl
4. Также серная кислота вступает в обменные реакции с солями.
Например, серная кислота взаимодействует с хлоридом бария:
H2SO4 BaCl2 → BaSO4 2HCl
5.Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется сульфат железа (II):
H2SO4(разб.) Fe → FeSO4 H2
Серная кислота взаимодействует с аммиакомс образованием солей аммония:
H2SO4 NH3 → NH4HSO4
Концентрированнаясерная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
6H2SO4(конц.) 2Fe → Fe2(SO4)3 3SO2 6H2O
6H2SO4(конц.) 2Al → Al2(SO4)3 3SO2 6H2O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H2SO4(конц.) Cu → CuSO4 SO2 ↑ 2H2O
2H2SO4(конц.) Hg → HgSO4 SO2 ↑ 2H2O
2H2SO4(конц.) 2Ag → Ag2SO4 SO2↑ 2H2O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg 4H2SO4 → 3MgSO4 S 4H2O
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H2SO4(конц.) 4Zn → 4ZnSO4 H2S↑ 4H2O
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 Na2SO4 → BaSO4↓ 2NaCl
Видеоопытвзаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7.Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например, концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
5H2SO4(конц.) 2P → 2H3PO4 5SO2↑ 2H2O
2H2SO4(конц.) С → СО2↑ 2SO2↑ 2H2O
2H2SO4(конц.) S → 3SO2 ↑ 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) 2KBr → Br2↓ SO2↑ 2KHSO4 2H2O
5H2SO4(конц.) 8KI → 4I2↓ H2S↑ K2SO4 4H2O
H2SO4(конц.) 3H2S → 4S↓ 4H2O
Химические свойства сероводорода
1.В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S 2NaOH → Na2S 2H2OH2S NaOH → NaНS H2O
2.Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S O2 → 2S 2H2O
В избытке кислорода:
2H2S 3O2 → 2SO2 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S Br2 → 2HBr S↓
H2S Cl2 → 2HCl S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S 4Cl2 4H2O → H2SO4 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S 2HNO3(конц.) → S 2NO2 2H2O
При кипячении сера окисляется до серной кислоты:
H2S 8HNO3(конц.) → H2SO4 8NO2 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S SO2 → 3S 2H2O
Соединения железа (III) также окисляют сероводород:
H2S 2FeCl3 → 2FeCl2 S 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S K2Cr2O7 4H2SO4 → 3S Cr2(SO4)3 K2SO4 7H2O
2H2S 4Ag O2 → 2Ag2S 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S H2SO4(конц.) → S SO2 2H2O
Либо до оксида серы (IV):
H2S 3H2SO4(конц.) → 4SO2 4H2O
4.Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S Pb(NO3)2 → PbS 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопытвзаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства сульфидов
1. Растворимые сульфиды гидролизуютсяпо аниону, среда водных растворов сульфидов щелочная:
K2S H2O ⇄ KHS KOHS2– H2O ⇄ HS– OH–
2. Сульфиды металлов, расположенных в ряду напряжений левее железа (включительно), растворяются в сильных минеральных кислотах.
Например, сульфид кальция растворяется в соляной кислоте:
CaS 2HCl → CaCl2 H2S
А сульфид никеля, например, не растворяется:
NiS HСl ≠
3. Нерастворимые сульфиды растворяются в концентрированной азотной кислоте или концентрированной серной кислоте. При этом сера окисляется либо до простого вещества, либо до сульфата.
Например, сульфид меди (II) растворяется в горячей концентрированной азотной кислоте:
CuS 8HNO3 → CuSO4 8NO2 4H2O
или горячей концентрированной серной кислоте:
CuS 4H2SO4(конц. гор.) → CuSO4 4SO2 4H2O
4.Сульфиды проявляют восстановительныесвойства и окисляются пероксидом водорода, хлором и другими окислителями.
Например, сульфид свинца (II) окисляется пероксидом водорода до сульфата свинца (II):
PbS 4H2O2 → PbSO4 4H2O
Еще пример: сульфид меди (II) окисляется хлором:
СuS Cl2 → CuCl2 S
5.Сульфиды горят(обжиг сульфидов). При этом образуются оксиды металла и серы (IV).
Например, сульфид меди (II) окисляется кислородом до оксида меди (II) и оксида серы (IV):
2CuS 3O2 → 2CuO 2SO2
Аналогично сульфид хрома (III) и сульфид цинка:
2Cr2S3 9O2 → 2Cr2O3 6SO2
2ZnS 3O2 → 2SO2 ZnO
6. Реакции сульфидов с растворимыми солями свинца, серебра, меди используют как качественныена ион S2−.
Сульфиды свинца, серебра и меди — черные осадки, нерастворимые в воде и минеральных кислотах:
Na2S Pb(NO3)2 → PbS↓ 2NaNO3
Na2S 2AgNO3 → Ag2S↓ 2NaNO3
Na2S Cu(NO3)2 → CuS↓ 2NaNO3
7.Сульфиды трехвалентных металлов (алюминия и хрома) разлагаются водой (необратимый гидролиз).
Например, сульфид алюминия разлагается до гидроксида алюминия и сероводорода:
Al2S3 6H2O → 2Al(OH)3 3H2S
Разложение происходит и взаимодействии солей трехвалентных металлов с сульфидами щелочных металлов.
Например, сульфид натрия реагирует с хлоридом алюминия в растворе. Но сульфид алюминия не образуется, а сразу же необратимо гидролизуется (разлагается) водой:
3Na2S 2AlCl3 6H2O → 2Al(OH)3 3H2S 6NaCl

