§6.2 получение кислорода
§6.2 Получение кислорода.
Большое количество кислорода используется в промышленности, в медицине, в других областях человеческой деятельности. Промышленные количества кислорода получают из жидкого воздуха. Сначала воздух сжимают мощными компрессорами – при этом он, как любой сжимаемый газ, сильно нагревается. Если вам приходилось энергично накачивать велосипедную камеру, то вы должны помнить, что корпус насоса и шланг нагреваются довольно заметно.
Сжатый воздух в больших баллонах-емкостях охлаждается. Затем его подвергают быстрому расширению через узкие каналы, снабженные турбинками для дополнительного отбора энергии у молекул газа. Эти устройства называются турбодетандерами. При расширении любого газа всегда происходит его охлаждение. Если газ был сжат очень сильно, то его расширение может привести к такому сильному охлаждению, что часть воздуха сжижается. Жидкий воздух собирают в специальные сосуды, называемые сосудами Дьюара (рис. 6-2).
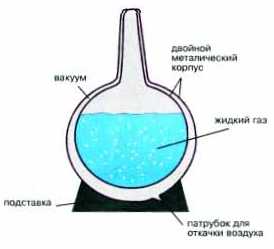
Рис. 6-2. Сосуд Дьюара для хранения и транспортировки сжиженных газов и его устройство. Из пространства между внутренней и внешней стенками сосуда откачан воздух. Вакуум практически не проводит тепло, поэтому жидкий газ, даже имея очень низкую температуру, может сохраняться в таком сосуде длительное время.
Как вы уже знаете, жидкий кислород кипит при более «высокой» температуре (-183 оС), чем жидкий азот (-196 оС). Поэтому при «нагревании» жидкого воздуха, когда температура этой очень холодной жидкости медленно повышается от -200 оС до -180 оС, прежде всего при -196 оС перегоняется азот (который опять сжижают) и только следом перегоняется кислород. Если такую перегонку жидких азота и кислорода произвести неоднократно, то можно получить весьма чистый кислород. Обычно его хранят в сжатом виде в стальных баллонах, окрашенных в голубой цвет. Характерная голубая окраска баллонов нужна для того, чтобы нельзя было спутать кислород с каким-нибудь другим сжатым газом.
Аппаратура для промышленного получения кислорода, как мы видим, очень сложна и энергоемка. В лаборатории кислород удобнее получать из его соединений с другими элементами.
 Чаще всего кислород получают нагреванием таких веществ (в состав которых кислород входит в связанном виде), как перманганат калия (марганцовка), хлорат калия (бертолетова соль), нитрат калия (селитра):
Чаще всего кислород получают нагреванием таких веществ (в состав которых кислород входит в связанном виде), как перманганат калия (марганцовка), хлорат калия (бертолетова соль), нитрат калия (селитра):
2 KMnO4 | = | K2MnO4 | MnO2 | O2 | ||
перманганат калия | нагревание | манганат калия | диоксид марганца | кислород |
2 KClO3 | = | 2 KCl | 3 O2 | |
хлорат калия | нагревание | хлорид калия | кислород |
2 KNO3 | = | 2 KNO2 | O2 | |
нитрат калия | нагревание | нитрит калия | кислород |
Удобно получать кислород в лаборатории из пероксида водорода:
2 H2O2 | = | 2 H2O | O2 | |
пероксид водорода | катализатор | кислород |
Пероксид водорода обычно используется в виде 3%-ного водного раствора. Многие из вас знакомы с ним, потому что такой раствор применяется как дезинфицирующее средство при обработке царапин и мелких ран. Он мало устойчив и уже при стоянии медленно разлагается на кислород и воду. Попав на
царапину или ранку, пероксид начинает выделять кислород гораздо интенсивнее (сильно пузырится, шипит). Дело здесь в том, что кровь содержит особые вещества (катализаторы), которые ускоряют реакцию разложения пероксида водорода. Катализаторы – это вещества, способные ускорять химические превращения, сами оставаясь при этом неизменными (более подробно о них рассказывается в следующей книге).
Катализаторами разложения Н
2О2 могут служить многие вещества, в том числе и неорганические: диоксид марганца (MnO2), древесный уголь (углерод), железный порошок. Существуют и «антикатализаторы» – то есть вещества, замедляющие химическое превращение. Такие замедлители химических реакций называются ингибиторами. Например, фосфорная кислота Н3РО4 по каким-то причинам препятствует разложению пероксида водорода.
Интересен способ получения кислорода из пероксидов металлов, который раньше применяли на подводных лодках, потому что одновременно с выделением кислорода происходит поглощение углекислого газа:
2 Na2O2 | 2 CO2 | = | 2 Na2CO3 | O2 | ||
пероксид натрия | углекислый газ | сода | кислород |
На современных атомных подводных лодках, где имеется мощный и почти неисчерпаемый источник электрической энергии, есть возможность получать кислород разложением воды под действием электрического тока (электролизом воды):
2 H2O | = | 2 H2 | O2 | |
электрический ток | водород | кислород |
** История открытия кислорода интересно переплетается с историей появления подводных лодок. Есть сведения, что кислород был открыт еще в XVII веке голландским ученым К. Дреббелем. Он использовал этот газ для дыхания в подводной лодке собственной конструкции. Но это открытие относилось к военной технике и держалось в секрете, поэтому не оказало никакого влияния на дальнейшие исследования.
До официального открытия кислорода химики, вероятно, уже получали этот газ разными способами, но не знали, что держат в руках новый элемент.
Первооткрывателями кислорода считаются шведский химик Карл Шееле и английский естествоиспытатель Джозеф Пристли. Шееле получил кислород несколько раньше, но опубликовал свои исследования позднее, чем Пристли.
Карл Шееле по профессии был аптекарем, а по призванию
– химиком-экспериментатором. В течение многих лет он изучал разложение нагреванием множества веществ (среди которых была и селитра KNO3) и получил газ, который поддерживал дыхание и горение. Свои исследования он опубликовал в 1777 году в книге «Химический трактат о воздухе и огне».
Джозеф Пристли был священником, а в естественных науках его интересовала прежде всего «пневмохимия», т.е. изучение свойств различных газов. Он был первым, кто специально растворил газ в воде и обнаружил, что вода стала удивительно вкусной. Так была изобретена газированная вода.
Затем Пристли, как и Шееле, стал изучать газы, выделяемые различными веществами при нагревании. Получаемый газ он выводил через трубку в сосуд, заполненный не водой, а ртутью. Пристли уже убедился в том, что вода слишком хорошо растворяет газы.
Среди веществ, разложение которых изучил Пристли, оказалось одно, известное еще алхимикам под названием «меркуриус кальцинатус пер се» или жженая ртуть. Это вещество на современном химическом языке называется оксидом ртути, а уравнение его разложения при нагревании выглядит следующим образом:
2 HgO | = | 2 Hg | O2 | |
оксид ртути | нагревание | ртуть | кислород |
Вы можете теперь представить, как трудно было изучать химию во времена, когда химические формулы еще не были изобретены. То, что мы только что записали коротким химическим уравнением, Пристли описал в 1774 году следующим образом: «Я поместил под перевернутой банкой, погруженной в ртуть, немного порошка «меркуриус кальцинатус пер се». Затем я взял небольшое зажигательное стекло и направил лучи Солнца прямо внутрь банки на порошок. Из порошка стал выделяться воздух, который вытеснил ртуть из банки. Я принялся изучать этот воздух. И меня удивило, даже взволновало до глубины моей души, что в этом воздухе свеча горит лучше и светлее, чем в обычной атмосфере».
Разумеется, такое описание реакции выглядит весьма поэтично по сравнению с обычным химическим уравнением. Зато уравнение точнее и короче отражает суть произошедшей химической реакции, его легче понять и запомнить.
Задачи.
6.1. Человеку для дыхания требуется примерно 1 моль кислорода в час. Рассчитайте, сколько нужно взять с собой пероксида натрия Na2O2 для суточного путешествия в одноместной подводной лодке.
6.2. Сколько кислорода (в молях) содержится в заправленном кислородном баллоне, если его емкость составляет 40 л, давление в нем 150 атм и температура газа 20 оС? Какое количество воздуха (м3) оказалось переработанным в кислород (содержание O2 в воздухе примите 21 объемн. %)?
6.3. Сколько граммов селитры KNO3 требуется разложить нагреванием для того, чтобы заполнить кислородом сосуд емкостью 5л (при н.у.)?
6.4. В лаборатории имеется по 10 граммов следующих реактивов: KMnO4, KClO3, KNO3. Сколько кислорода (в литрах при н.у.) можно получить из каждого?
** 6.5. Тлеющая лучинка самопроизвольно вспыхивает в воздухе, если количество кислорода в нем не менее 28 объемных %. Какое минимальное количество оксида ртути HgO требуется разложить в закрытой литровой банке с воздухом, чтобы тлеющая лучинка, внесенная в эту банку, вспыхнула?
_________________
Горение и виды горючих веществ
Реакция, протекающая с участием кислорода и сопровождающаяся выделением большого количества света и тепла, называется горением.
В чистом кислороде, по сравнению с воздухом, вещества горят во много раз быстрее (рис. 22). В обоих случаях выделяется равное количество теплоты, но в кислороде этот процесс протекает быстрее и выделяющаяся теплота не расходуется, как в случае с воздухом, на нагревание азота.
Температура при горении в чистом кислороде выше, чем в воздухе. Опуская тлеющую лучину в сосуд с чистым кислородом, можно увидеть, как она сразу загорается. А в воздухе тлеющая лучина может вскоре и потухнуть. Если эта лучина зажжена, то она продолжает гореть на воздухе, потому что выделяющееся при горении тепло требует большей температуры, чем температура воспламенения лучины.
Рис. 22. Горение магния в чистом кислороде
Рис. 23. Тушение пламени
Температура, необходимая для поджигания вещества на воздухе, называегся температурой воспламенения.
Значит, для обеспечения горения веществ, нужно нагревать их до температуры воспламенения и подавать кислород в достаточном количестве.
Для того чтобы потушить пламя, необходимо ликвидировать факторы, обеспечивающие его появление, т.е. охладить вещество до температуры ниже температуры возгорания и прекратить подачу кислорода (рис. 23).
Чтобы потушить горящую вещь, сначала следует понизить температуру, используя невоспламеняющиеся средства, затем накрыть источник возгорания одеялом или брезентом, чтобы прекратить подачу воздуха.
В непредвиденных ситуациях для тушения пожара необходимо использовать специальные средства, а если их нет, то применять указанный выше способ.
Вообще процесс горения имеет огромное значение в промышленности и в повседневной жизни.
От твердого топлива остается минеральный осадок — пепел. Жидкое и газообразное топливо такого недостатка не имеет. Но любое топливо независимо от места добычи, промышленного объема, экономической эффективности имеет только свое место применения, и возможности по его взаимозамещению ограничены.
Неправильное сжигание топлива приносит вред народному хозяйству.
Топливо позволяет спокойно переносить холод, варить пищу, которая не употребляется в сыром виде, получать металлы из руд путем их выплавки, обеспечивать движение транспорта, получать другие виды энергии.
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
- 2HgO →ot 2Hg O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Круговорот кислорода в природе
О том, что кислород в большом количестве находится в литосфере, гидросфере и атмосфере, мы говорили в предыдущих разделах учебника (табл. 5).
Круговорот кислорода на Земле несущественно отличается от его круговорота в атмосфере, литосфере и гидросфере. На Земле круговорот в основном протекает в процессе фотосинтеза и дыхания. В процессе фотосинтеза углекислый газ, взаимодействуя с водой, образует органические вещества и кислород. В результате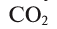
При дыхании, разложении умерших организмов и горении кислород из биосферы возвращается обратно в гидросферу и атмосферу:
В биомассе Земли кислород полностью меняется каждые 20—30 лет. В литосферу кислород переходит из атмосферы в виде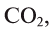
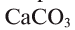
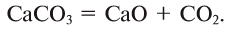
Эта реакция наблюдается в основном в зонах повышенной вулканической деятельности, тем самым постепенно обновляя углекислый газ в атмосфере.
Нахождение в природе

Накопление O
2
в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1
. (3,85—2,45 млрд лет назад) — O
2
не производился
2
. (2,45—1,85 млрд лет назад) O
2
производился, но поглощался океаном и породами морского дна
3
. (1,85—0,85 млрд лет назад) O
2
выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4
. (0,85—0,54 млрд лет назад) все горные породы на суше окислены, начинается накопление O
2
в атмосфере
5
. (0,54 млрд лет назад — по настоящее время) современный период, содержание O
2
в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад, в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы).
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2022 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Оксиды
Продуктами всех реакций, рассмотренных в параграфе, являются бинарные соединения элементов с Оксигеном.
Соединение, образованное двумя элементами, одним из которых является Оксиген, называют оксидом.
Общая формула оксидов — 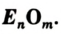
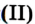
Таблица 4Формулы и названия некоторых оксидов
Выводы:
Кислород — химически активное вещество. Он взаимодействует с большинством простых веществ, а также со сложными веществами. Продуктами таких реакций являются соединения элементов с Оксигеном — оксиды.
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Реакция с серой
Это химическое превращение осуществляет каждый, когда зажигает спичку; сера входит в состав ее головки. В лаборатории реакцию серы с кислородом проводят в вытяжном шкафу. Небольшое количество серы (светло-желтый порошок или кристаллы) нагревают в железной ложке. Вещество сначала плавится, потом загорается в результате взаимодействия с кислородом воздуха и горит едва заметным синим пламенем (рис. 56, б). Появляется резкий запах продукта реакции — сернистого газа (этот запах мы ощущаем в момент загорания спички). Химическая формула сернистого газа — 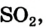
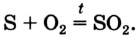
Рис. 56. Сера (а) и ее горение на воздухе (б) и в кислороде (в)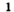
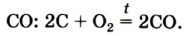
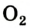
Рис. 57.Красный фосфор (а) и его горение на воздухе (б) и в кислороде (в)
Способы получения кислорода
В обычных условиях кислород представляет собой газ без цвета и запаха, плохо растворимый в воде. Температуры плавления и кипения соответственно равны (![]() ) и (
) и (![]() ) и (
) и ( ). Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
). Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
В промышленности кислород получают из воздуха. Для этого воздух сильным охлаждением сначала сжижается, а затем жидкий воздух подвергается испарению. Азот воздуха улетучивается раньше кислорода, а кислород остается в жидком состоянии.
Получение кислорода в лаборатории основано на разложении богатых им, но сравнительно непрочных веществ. Обычно применяется хлорноватистый калий («бертолетова соль»), распадающийся при нагревании на хлористый калий и кислород:
![]() .
.
Кислород может быть получен в лаборатории также рядом других методов, из которых наиболее удобны: а) слабое накаливание перманганата калия; б) приливание по каплям раствора перманганата калия к подкисленному серной кислотой раствору перекиси водорода; в) действие воды в присутствии солей кобальта на перекись натрия; г) действие разбавленной азотной кислоты на смесь равных весовых частей оксида бария и оксида свинца (IV); д) разложение воды, содержащей серную кислоту или гидроксид натрия, постоянным электрическим током (одновременно образуется также водород).
![]() ;
;![]() ;
; ;
;![]() ;
;![]() ;
; ;
;![]() .
.
Так как кислород несколько тяжелее воздуха и малорастворим в воде, его можно собирать двумя способами: над водой и вытеснением воздуха из сосуда.
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя(с большинством химических элементов) и свойства восстановителя(только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремниемс образованием оксидов:
S O2 → SO2
Si O2 → SiO2
1.3.Фосфоргорит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P 5O2 → 2P2O5
1.4.С азотомкислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca O2 → 2CaO
Однако при горении натрияв кислороде преимущественно образуется пероксид натрия:
2Na O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe O2→ 2FeO
4Fe 3O2→ 2Fe2O3
3Fe 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS 7O2→ 2Fe2O3 4SO2
Al4C3 6O2→ 2Al2O3 3CO2
Ca3P2 4O2→ 3CaO P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S 3O2→ 2H2O 2SO2
Аммиакгорит с образованием простого вещества, азота:
4NH3 3O2→ 2N2 6H2O
Аммиакокисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 5O2→ 4NO 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 3O2→ CO2 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 O2 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 2O2→ CO2 2H2O
2CH4 3O2→ 2CO 4H2O
CH4 O2→ C 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 O2 → 2CH3-CH=O
