В производных нафталина — мегаобучалка
В реакциях замещения в производных нафталина вступление электрофильной частицы происходит в соответствии со следующими правилами:
1) Электронодонорная группа направляет электрофильный реагент в то кольцо, в котором она находится. Если эта группа находится в положении 1, электрофильная частица замещает водород в положение 2 или в положение 4, электронодонорная группа в положении 2 направляет электрофильную частицу в положение 1.
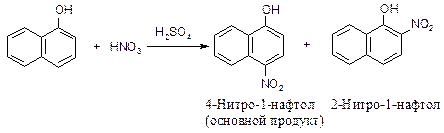
2) Электроноакцепторная группа направляет электрофильный реагент в другое незамещенное кольцо (в положение 5 или 8 при галогенировании и нитровании).
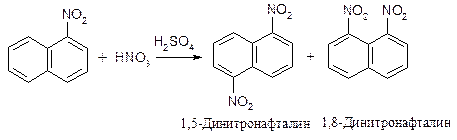
Такое направление замещения можно объяснить следующим образом. Ориентант оказывает наибольшее влияние на то кольцо, с которым он связан. Поэтому наиболее успешной является атака электрофилом EÅ кольца с электронодонорной группой G, в котором может лучше распределиться положительный заряд.
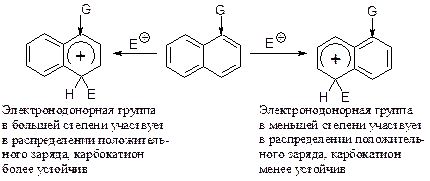
Восстановление и окисление нафталина
При окислении нафталина в присутствии пятиокиси ванадия разрушается одно кольцо и образуется фталевый ангидрид.
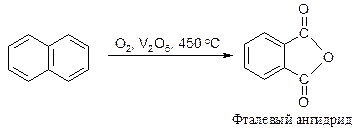
Нафталин окисляется смесью K2Cr2O7 и H2SO4 до фталевой кислоты.
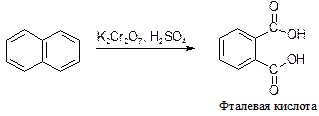
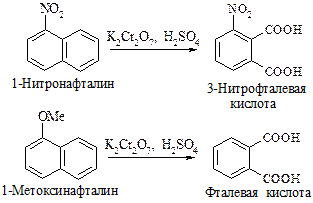
Если в одном из колец есть заместитель, то окисляется кольцо с повышенной электронной плотностью.
В отличие от бензола нафталин можно восстановить химическими восстановителями.
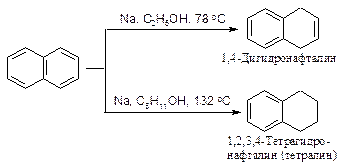
Бензольное кольцо в тетралине восстанавливается только в жёстких условиях.
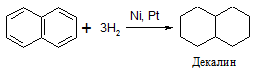
Антрацен и фенантрен
Антрацен и фенантрен являются ароматическими соединениями. Они представляют собой плоские циклические структуры, содержащие замкнутое p-электронное облако, расположенное ниже и выше плоскости колец. Число p-электронов в соответствии с правилом Хюккеля равно 4n 2 = 4 × 3 2 = 14.

Антрацен можно рассматривать как резонансный гибрид структур I-IV.

Его энергия резонанса составляет 352 кДж/моль.
Фенантрен можно представить резонансным гибридом структур V-IX.
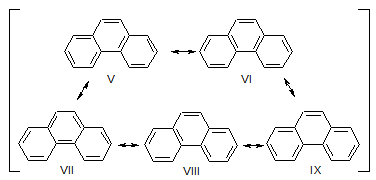
Резонансная энергия фенантрена 386 кДж/моль.
Антрацен и фенантрен вступают в реакции электрофильного замещения. Их активные положения 9 и 10 находятся в среднем кольце, так как при атаке в эти положения сохраняется ароматичность двух боковых бензольных систем с энергией резонанса 153×2=306 кДж/моль. При атаке в боковые кольца сохраняется ароматичность одного нафталинового фрагмента с энергией резонанса 256 кДж/моль.

Вывод об активности положений 9 и 10 справедлив как для электрофильного замещения, так и для реакций окисления и восстановления.

§
10.1.1. Строение
Простейшие пятичленные гетероциклы: пиррол, фуран, тиофен — содержат один гетероатом.
В соответствии с представленными формулами каждое из этих соединений будет обладать свойствами сопряженного диена и соответственно — свойствами амина R-NH-R, простого эфира R-O-R и тиоэфира (сульфида) R-S-R. Однако пиррол не обладает основными свойствами, типичными для аминов, тиофен не вступает в реакции окисления, типичные для сульфидов. Для них характерна способность вступать в реакции электрофильного замещения: нитрование, сульфирование, галогенирование, ацилирование по Фриделю-Крафтсу. Числовые значения теплот сгорания указывают на наличие значительной энергии резонансной стабилизации — 67-117 кДж/моль. Это несколько меньше, чем энергия резонанса бензола (153 кДж/моль), но гораздо больше, чем аналогичная величина для большинства сопряженных диенов (13 кДж/моль). Следовательно, эти соединения являются ароматическими.
Рассмотрим строение пятичленных гетероциклов на примере пиррола. Четыре атома углерода и атом азота находятся в sp2-гибридном состоянии и затрачивают три гибридные орбитали на образование двух s-связей с другими атомами кольца и одним атомом водорода. У каждого атома углерода остается один электрон, а у атома азота — два на р-орбитали. При p-перекрывании р-орбиталей образуются p-облака выше и ниже плоскости кольца, содержащие шесть электронов, — ароматический секстет.
Структура пиррола может быть представлена резонансным гибридом структур I-V.
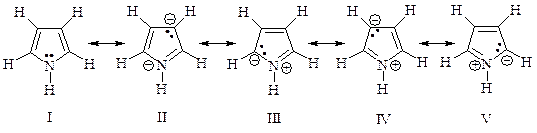
Сравнение дипольных моментов пирролидина 5,18×10-30 Кл×м (1,57Д) и пиррола 5,94×10-30 Кл×м (1,8Д) показывает, что структуры II-V вносят значительный вклад в резонансный гибрид.
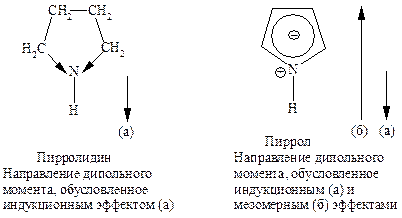
Данные, полученные при измерении длин связей в молекуле пиррола, дипольных моментов, УФ-спектров, теплот сгорания, подтверждают наличие делокализованной p-электронной системы.
Следствием делокализации четырех p-электронов атомов углерода и двух электронов гетероатома является склонность к реакциям электрофильного замещения, в которых сохраняется p-электронная система.
В отличие от вторичных алифатических аминов, для которых КВ»10-3-10-4, пиррол — более слабое основание (КВ =2,5×10-14). Это объясняется тем, что свободная пара электронов азота, которая обусловливает основные свойства азотсодержащих соединений, вовлечена в p-электронное облако и не может быть предоставлена для образования связи с протоном.
Высокая электронная плотность в кольце пиррола обусловливает высокую реакционную способность пиррола в реакциях электрофильного замещения.
Структуры фурана и тиофена аналогичны структуре пиррола. Атом кислорода в фуране и атом серы в тиофене подают два электрона в p-электронное облако и ведут себя как высокореакционноспособные соединения, подобные бензолу.
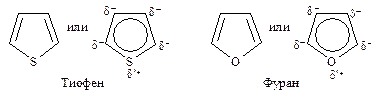
Сравнивая электроотрицательность серы, азота и кислорода, можно ожидать, что вклад структур, подобных II — V, будет наиболее значительным для тиофена и наименее — для фурана, содержащего наиболее электроотрицательный элемент — кислород. Действительно, ароматический характер усиливается при переходе от фурана к пирролу и далее к тиофену, энергии резонанса составляют соответственно 67·103, 88·103, 117·103 Дж/моль. Фуран, наименее ароматичный из этих трех соединений, вступает в реакции диенового синтеза в качестве диена.
Химические свойства
Пиррол, фуран и тиофен, как и другие ароматические соединения, вступают в реакции электрофильного замещения: нитрование, сульфирование, галогенирование, ацилирование по Фриделю-Крафтсу.
Пиррол и фуран более реакционноспособные соединения, чем бензол, и сходны с наиболее активными производными бензола: аминами и фенолами. Тиофен менее реакционноспособен, чем пиррол и фуран, но более активен, чем бензол.
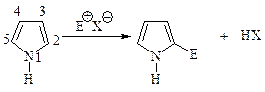
Электрофильное замещение происходит в положение 2.
В реакции электрофильного замещения лимитирующей стадией является стадия образования s-комплекса в результате присоединения электрофильного реагента к атому углерода кольца.
Распределение заряда в ионе, образующемся при атаке в положе- ние 2 — (s-комплекс-2), может быть показано с помощью трех граничных структур I-III. Распределение заряда в s-комплексе, возникающем при атаке в положение 3, изображено структурами IV-V. Это означает, что s-комплекс-2 более устойчив и, следовательно, легче образуется, чем s-комплекс-3.
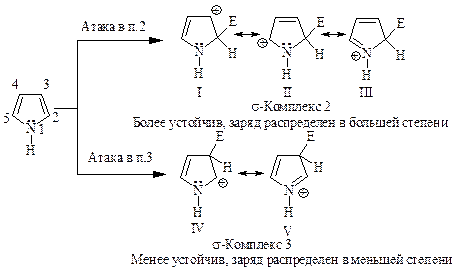
Реакции электрофильного замещения в пирроле представлены на рис. 10.1.
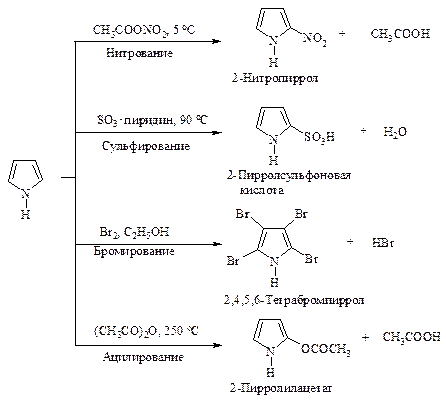
Рис. 10.1. Реакции электрофильного замещения в пирроле
Нитрование и сульфирование пиррола из-за чувствительности к протонным кислотам (это свойство называется ацидофобностью) проводят в отсутствие протонных кислот. Реакция бромирования и ацилирования по Фриделю-Крафту протекает без участия катализатора.
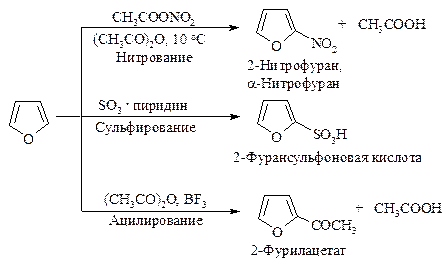
Фуран в реакциях электрофильного замещения напоминает пиррол. Как и пиррол, он является ацидофобным соединением: в присутствии протонных кислот кольцо фурана раскрывается. Хлорирование и бромирование фурана протекает очень бурно и с трудом поддается контролю. Ацилирование требует применения в качестве катализатора мягкой кислоты Льюиса.
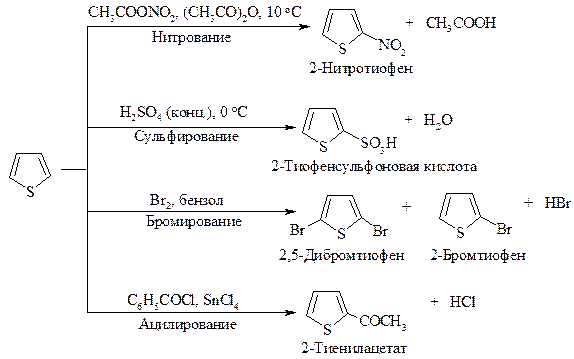
Тиофен менее реакционноспособен по сравнению с фураном и пирролом, он может сульфироваться в условиях высокой кислотности. Бромирование может проводиться направленно с образованием 2-бром- и 2,4-дибромтиофена.
10.1.3. Способы получения
Некоторые замещенные фурана, тиофена и пиррола могут быть получены из ациклических соединений через реакцию циклизации, например:
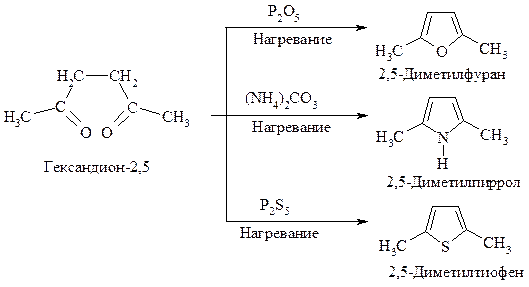
Фуран, тиофен, пиррол могут взаимно превращаться друг в друга (Ю.К. Юрьев) в токе Н2О, Н2S и NH3 соответственно при температуре 400-500 оС в присутствии Al2O3.
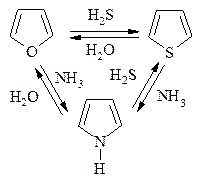
Пиридин
Пиридин является шестичленным ароматическим гетероциклом.
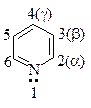
Строение пиридина
В пиридине атом азота, как и все атомы углерода, находится в sp2—cостоянии. Каждый из пяти атомов углерода и атом азота связаны с соседними атомами кольца с помощью двух sp2—гибридизованных орбиталей, третья sp2—гибридизованная орбиталь атома углерода затрачивается на образование связи с атомом водорода, а на третьей sp2—гибридизованной орбитали атома азота находится пара электронов. Пять негибридизованных р-облаков атомов углерода и одно р-облако атома азота, перекрываясь, образуют единую p-электронную систему: два облака — над и под плоскостью кольца.
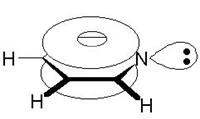
В плоском шестиугольнике пиридина все углерод-углеродные связи имеют одинаковую длину (13,9·10-2 нм), промежуточную между длиной простой Csp2–Csp2(14,8·10-2 нм) и двойной C=C связей (13,4·10-2 нм). Обе связи азот-углерод также имеют одинаковую длину (13,7·10-2 м), меньшую, чем длина простой связи С-N (14,7·10-2 нм), но большую, чем длина двойной связи С=N (12,8·10-2 нм).
Делокализация шести р-электронов кольца пиридина обусловливает значительную устойчивость p-электронного облака. Действительно, теплота сгорания пиридина указывает на существенную энергию резонанса 96 кДж/моль.
Строение пиридина можно изобразить резонансным гибридом граничных структур I-V.
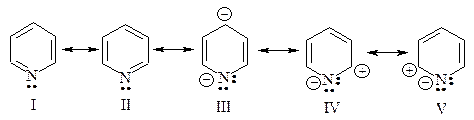
Биполярные структуры III-V вносят значительный вклад в резонансный гибрид, так как дипольный момент пиридина, равный 7,45×10-30 Кл×м (2,26 Д), значительно больше, чем дипольный момент пиперидина 3,86×10-30 Кл×м (1,17 Д).
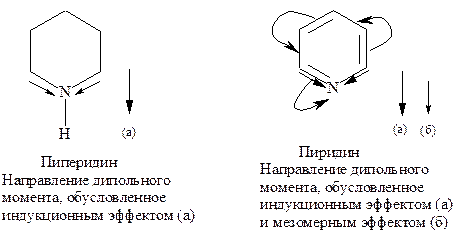
Для пиридина, как для ароматического соединения, характерны реакции электрофильного замещения, в которых сохраняется устойчивая p-электронная система.
Химические свойства
В реакциях электрофильного замещения пиридин ведет себя как сильно дезактивированное производное бензола, подобно нитробензолу. Он нитруется, сульфируется и галогенируется только в очень жестких условиях (более жестких, чем нитробензол). Замещение происходит в положение 3.
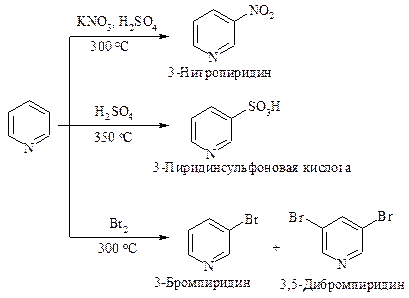
Атака в положение 3 обусловлена следующим: в медленной стадии при атаке в положение 3 образуется более устойчивый катион (распределение заряда изображено тремя граничными структурами I-III), чем катион, образующийся при атаке в положение 4 (структуры IV-VI).

s-Комплекс, образующийся при атаке в положение 3
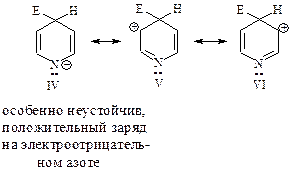
s-Комплекс, образующийся при атаке в положение 4
Низкая реакционная способность пиридина, как и нитробензола, объясняется тем, что образующиеся при атаке электрофилом любого положения кольца карбокатионы менее устойчивы, чем карбокатион, возникающий при атаке бензольного ядра, из-за присутствия в кольце электроотрицательного азота. Кроме того, в кислой среде кольцо еще более дезактивируется из-за образования иона пиридиния C6H5NHÅ.
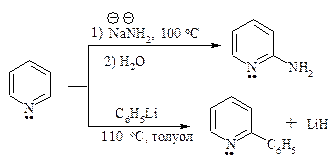
Реакционная способность пиридина в реакциях нуклеофильного замещения настолько велика, что замещению подвергается даже гидрид-ион НӨ. Примером нуклеофильного замещения в пиридине являются реакции Чичибабина: аминирование амидом натрия и арилирование (или алкилирование) с помощью литийорганических соединений.
Атака нуклеофила протекает преимущественно в положение 2 и 4, так как при этом образуется более устойчивый анион: отрицательный заряд частично несет электротрицательный азот; s-комплекс, возникающий при атаке в положение 3, менее устойчив: ни в одной из граничных структур отрицательный заряд не принадлежит азоту (изобразите s-комплекс-3 самостоятельно).
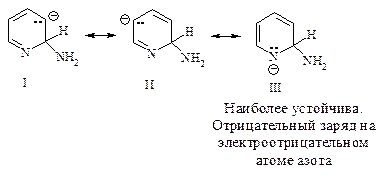
Все эти s-комплексы более устойчивы, чем анион, через образование которого происходит нуклеофильное замещение в бензоле. Это обусловлено присутствием в ядре пиридина электроотрицательного азота.
Таким образом, одна и та же причина определяет более низкую реакционную способность пиридина в реакциях электрофильного замещения и более высокую реакционную способность его в реакциях нуклеофильного замещения по сравнению с бензолом.
В пиридине на атоме азота имеется неподеленная пара электронов, которая может обобществляться с протоном. Пиридин является более слабым основанием (КВ=2,3·10-9), чем алифатические амины R1R2NH (КВ~ 10-4). Для объяснения такой зависимости основности от строения можно провести аналогию между электроотрицательностью атома углерода в различных гибридных состояниях и электроотрицательностью атома азота в sp3— и sp2— состояниях:
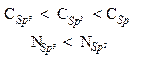
¾¾¾¾¾¾¾®
Электроотрицательность увеличивается
Пара электронов, обусловливающая основность пиридина, занимает sp2-орбиталь атома азота, она находится ближе к ядру. Электроны удерживаются ядром сильнее и менее доступны для обобществления с протоном, чем пара электронов sp3-гибридизованного атома азота.
Благодаря наличию пары электронов на атоме азота пиридин является нуклеофилом и реагирует с галогеналканами с образованием четвертичных солей.
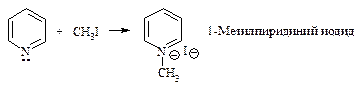
Восстановление. При каталитическом гидрировании пиридина образуется пиперидин С5Н11N.
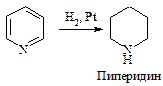
Хинолин
Хинолин представляет собой конденсированную систему, содержащую бензольное и пиридиновое кольца.
Свойства хинолина соответствуют свойствам нафталина, содержащего электроноакцепторную группу в положении 1.
Хинолин вступает в реакции электрофильного замещения. При взаимодействии со смесью концентрированных азотной и серной кислот происходит нитрование в положения 5 и 8.
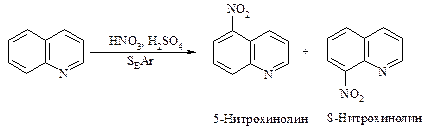
При обработке хинолина дымящей серной кислотой образуются сульфоновые кислоты.
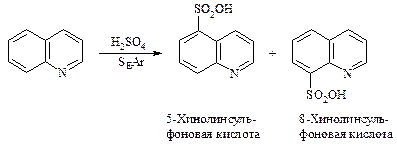
Хинолин так же, как и пиридин, вступает в реакции нуклеофильногозамещения: взаимодействует с амидом натрия и фениллитием.
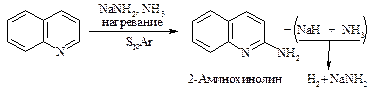
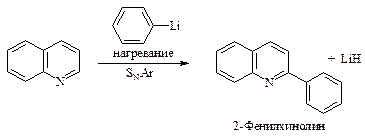
При окислении перманганатом калия образуется дикарбоновая кислота.
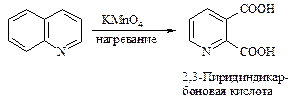
Наиболее удобным путем получения хинолина является метод Скраупа: взаимодействие анилина с глицерином и нитробензолом в присутствии серной кислоты и сульфата железа (II).
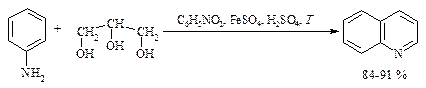
Синтез состоит из следующих стадий.
1). Дегидратация глицерина под действием концентрированной серной кислоты.
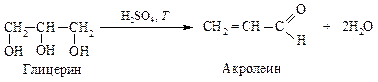
2). Нуклеофильное присоединение анилина к акролеину.

3). Электрофильная атака ароматического кольца электронодефицитным углеродом с последующей дегидратацией образовавшегося спирта.
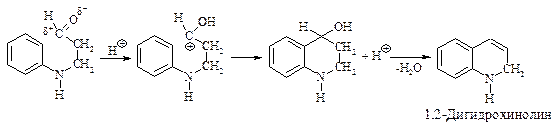
4). Окисление нитробензолом.
Сульфат железа FeSO4 сдерживает бурное течение реакции.
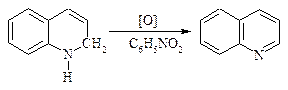
ГАЛОГЕНАЛКАНЫ
Галогеналканы имеют общую формулу СnH2n 1Х, где X — F, Cl, Br, I. Вследствие высокой электроотрицательности галогена связь галоген — углерод является сильно полярной Сd ®Хd—. Галоген, связанный с электронодефицитным углеродом, можно легко заменить на частицу, богатую электронами, — нуклеофил Nu («ядро любящий»).
| Нуклеофил — частица, имеющая пару электронов, которую она может отдать атому, несущему целый или частичный положительный заряд. |
Нуклеофильными реагентами являются отрицательно заряженные ионы и нейтральные молекулы, имеющие свободную пару электронов.
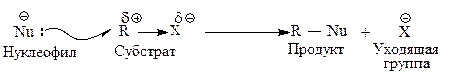
Такие реакции называются реакциями нуклеофильного замещения — SN.
Другой характерный тип превращений галогеналканов — реакции отщепления (элиминирования Е) под действием основания с образованием алкенов. Под влиянием электроотрицательного галогена связанный с ним атом углерода (Сa) приобретает некоторый положительный заряд, на соседнем атоме (Сb) также возникает заряд, но меньший. Тем не менее под влиянием частично заряженного b-углерода находящийся около него водород становится кислотным и под действием сильного основания В: может отщепиться в виде протона (dÅ>d¢Å).
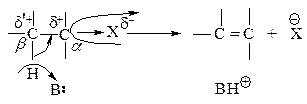
Таким образом, для галогеналканов характерны два главных типа превращений: нуклеофильное замещение и элиминирование. Кроме того, галогеналканы дают магнийорганические соединения R-MgX, важные в синтетическом отношении.
§
Благодаря доступности галогеналканов и легкости, с которой они вступают в реакции, круг этих реакций очень широк. Наиболее важные из них приведены в таблице 11.1.
Таблица 11.1
Реакции нуклеофильного замещения
Метилгалогениды CH3-X, первичные RCH2-X, вторичные R1R2CH-X, третичные R1R2R3С-X алкилгалогениды взаимодействуют с нуклеофильными реагентами по разным механизмам в зависимости от строения алкила.
Бимолекулярное нуклеофильное замещение
Типичный механизм взаимодействия метилгалогенидов и первичных алкилгалогенидов с Nu— бимолекулярное нуклеофильное замещение SN2. По такому механизму протекает реакция бромметана с едким натром (гидролиз бромметана).
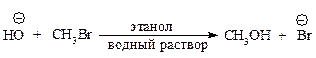
Стадии процесса.Нуклеофил атакует атом углерода с тыла, со стороны, наиболее удаленной от брома (рис. 11.1, а). Если сталкивающиеся частицы имеют достаточную энергию, то начинает образовываться связь углерод-кислород, а связь углерод-бром растягивается, атом углерода переходит в sp2-состояние. В этом состоянии атом углерода связан сразу с пятью атомами. Три атома водорода и углерод лежат в одной плоскости, а группы НО– и Br– располагаются на прямой, перпендикулярной этой плоскости (рис. 11.1, б). Отрицательный заряд на атоме кислорода уменьшился, так как кислород уже подал свою пару электронов на атом углерода, а отрицательный заряд на атоме брома увеличился, поскольку бром в определенной мере оттянул на себя пару электронов от углерода. Реакция заканчивается отщеплением иона брома и образованием ковалентной связи углерод-кислород, атом углерода опять становится тетраэдрическим (рис. 11.1, в).
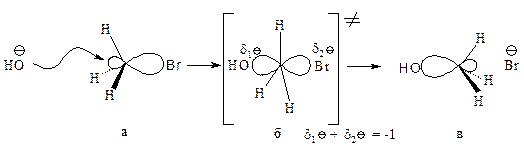
Рис. 11.1. Бимолекулярное нуклеофильное замещение:
а — исходные соединения: заряд локализован на атоме кислорода; б — переходное состояние (активированный комплекс), отрицательный заряд распределен между атомом кислорода и атомом брома; в — продукты реакции.
Энергетическая диаграмма реакции (рис. 11.2) изображает изменение потенциальной энергии в ходе реакции нуклеофильного замещения.

Рис. 11.2. Диаграмма изменения потенциальной энергии в реакции
бимолекулярного нуклеофильного замещения, SN2 — процесс
согласованный одностадийный:
а — энергия исходных веществ, б — энергия переходного состояния, в — энергия продуктов реакции
Скорость реакции.Гидролиз бромистого метила является реакцией второго порядка, скорость его зависит от концентрации двух веществ и определяется по формуле v = k [R-Hal]·[Nu]. Термин «бимолекулярное замещение» означает, что в стадии, определяющей скорость реакции, участвуют две частицы. Поскольку разрыв связи углерод-уходящая группа и образование связи нуклеофил-углерод происходят одновременно, бимолекулярное нуклеофильное замещение называют согласованным процессом.
Концентрация нуклеофильного реагента. Увеличение концентрации нуклеофила увеличивает скорость SN2- реакции.
Растворитель. Выбор растворителя диктуется следующимиусловиями:
а) достаточно хорошая растворимость реагентов,
б) лучшая сольватация переходного состояния по сравнению с исходными соединениями,
в) предотвращение побочных реакций.
Реакции, в которых из нейтральных молекул образуется полярное переходное состояние, значительно ускоряются при увеличении полярности растворителя: более полярный растворитель в большей степени стабилизирует полярное переходное состояние (АК), чем исходную систему (рис. 11.3, а).
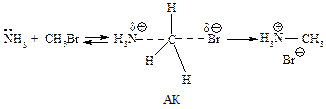
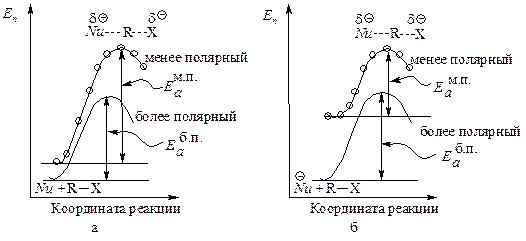
Рис. 11.3. Влияние полярности растворителя на скорость SN2:
а — повышение полярности растворителя стабилизирует АК в большей степени, чем исходное соединение, энергия активации уменьшается, скорость реакции увеличивается,
б — повышение полярности растворителя стабилизирует исходную систему в большей степени, чем АК, энергия активации увеличивается, скорость реакции уменьшается
Если в исходной системе имеется нуклеофил с полным отрицательным зарядом, то в присутствии полярного растворителя этот нуклеофил стабилизируется в результате электростатического притяжения между молекулами полярного растворителя и ионом NuӨ .
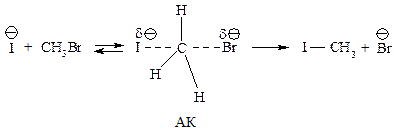
В активированном комплексе заряд распределен между атомом, образующим новую связь, и уходящей группой. Полярный растворитель будет стабилизировать и активированный комплекс и исходное состояние. Однако активированный комплекс будет стабилизироваться в меньшей степени. Увеличение полярности растворителя несколько замедлит реакцию, так как замена менее полярного растворителя на более полярный увеличит в большей степени стабильность исходного соединения (NuӨ), в меньшей — активированного комплекса (рис. 11.3, б).
Наиболее подходящими для синтеза соединений и изучения механизма SN2 являются апротонные биполярные растворители, т.е. растворители с высокой диэлектрической проницаемостью, но не способные к образованию водородных связей:

Апротонные растворители хорошо сольватируют катионы. Они не могут сольватировать анионы ни за счёт образования водородных связей с ними, ни за счёт связи с положительным зарядом растворителя, т.к. он находится внутри молекулы растворителя. Поэтому химики называют такие анионы «голыми». Биполярные апротонные растворители особенно необходимы для осуществления реакций SN2 в случае применения малоактивных нуклеофилов. В реакции бромэтана с гидроксид-анионом (SN2) лучшим растворителем является водный раствор этанола с массовой долей 80 %. Добавление воды к этанолу необходимо для предотвращения побочной реакции отщепления бромоводорода и улучшения растворимости щелочи.
Сила нуклеофила. Чем сильнее атом удерживает пару электронов, тем меньше его способность выступать в качестве нуклеофила. Активность аниона выше, чем активность нейтральной молекулы.
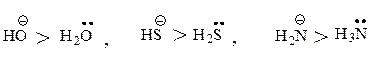
Нуклеофильный реагент, предоставляющий пару электронов электронодефицитному атому углерода, способен подавать эту пару водороду и отщеплять его, превращаясь в кислоту, т.е. каждый нуклеофильный реагент является основанием. Нуклеофильность и основность изменяются параллельно только для реагентов, у которых пара электронов находится на одном и том же атоме или неподеленная пара электронов находится у атомов элементов, принадлежащих одному периоду.
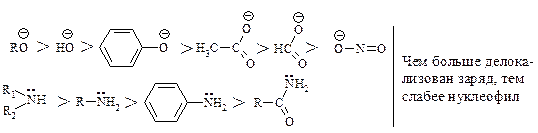
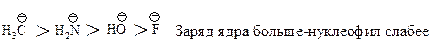
В апротонных растворителях (ДМФА, ДМСО) реакционная способность нуклеофилов с атомами, находящимися в одной группе, зависит от положения элемента в этой группе: чем меньше размер Иона, тем выше электронная плотность и тем больше его нуклеофильная сила.
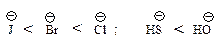
Однако в протонных растворителях этот ряд инвертируется: нуклеофильность аниона тем выше, чем больше размер иона.
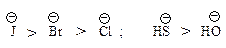
Такой порядок изменения нуклеофильности в протонном растворителе объясняется тем, что анионы разного размера в протонном растворителе в различной степени сольватированы за счет образования водородных связей: анион малого размера с концентрированным зарядом сольватируется сильнее и стабилизирован в большей степени, чем анион большего размера, в котором отрицательный заряд распределен в большей степени.
Уходящие группы. В субстратах «хорошими» уходящими группами (нуклеофугами) являются те группы, которые, оторвавшись от атома углерода, образуют устойчивые анионы. Сильные основания являются обычно «плохими» уходящими группами, слабые основания — «хорошими» уходящими группами.
В ряду IӨ, BrӨ, ClӨ, FӨ сила основания увеличивается, а способность быть хорошей уходящей группой уменьшается. Наилучшими уходящими группами являются ионы — сопряженные основания[1] сильных кислот, так как они являются очень слабыми основаниями (отрицательный заряд распределен).
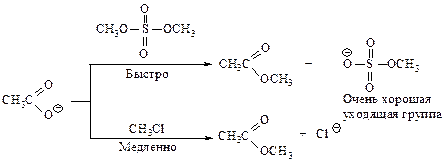
Cтереохимия. Бимолекулярное нуклеофильное замещение у хирального реакционного центра протекает с полным обращением конфигурации (инверсия), т.е. происходит обращение конфигурации каждой реагирующей молекулы.
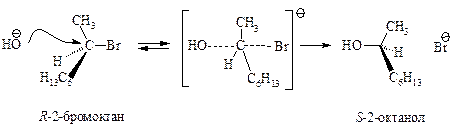
Конфигурация исходного 2-бромоктана при атаке хирального атома углерода с тыла меняется на противоположную, молекула субстрата «выворачивается». Полное обращение конфигурации хирального углерода может служить доказательством SN2-механизма.
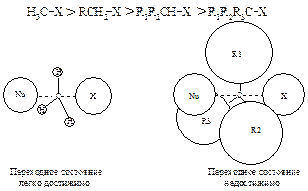
Реакционная способность. При рассмотрении реакционной способности галогеналканов в реакциях нуклеофильного замещения следует изучать влияние, главным образом, двух факторов: пространственного (стерического) и электронного. В случае бимолекулярного нуклеофильного замещения наиболее важную роль играет стерический фактор. По мере увеличения числа и объема заместителей у атома углерода — реакционного центра — возможность достижения переходного состояния (АК) уменьшается. Это могут быть как алифатические, так и ароматические заместители, или те и другие.
В SN2-реакциях реакционная способность уменьшается в ряду:
§
Третичные алкилгалогениды реагируют по механизму SN1 (мономолекулярное нуклеофильное замещение).
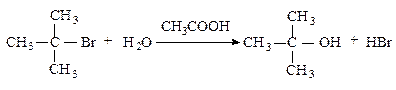
Cтадии процесса.Реакция протекает в две стадии. Первая стадия — гетеролитический разрыв связи углерод-галоген — медленная.
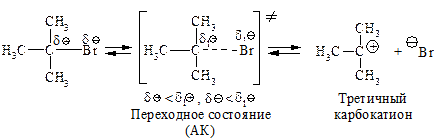
Вторая стадия — образовавшийся карбокатион практически мгновенно взаимодействует с нуклеофилом — молекулой воды.

В отличие от механизма SN2, разрыв связи С–Х и образование новой связи С–Nu протекает не одновременно, а последовательно.
Электрофильный катализ. Соли тяжелых металлов, в частности, серебра, ртути, меди катализируют SN1-реакции. Функция иона тяжелого металла состоит в образовании комплекса за счет неподеленных электронов галогена, вследствие чего уходящей группой становится галогенид металла, а не галогенид-анион.
Энергетическая диаграмма реакцииизображает изменение потенциальной энергии в ходе двухстадийного мономолекулярного замещения (рис.11.4).

Рис. 11.4. График изменения потенциальной энергии в ходе
мономолекулярного нуклеофильного замещения. SN1-двухстадийный процесс
Скорость реакции.В медленной стадии, определяющей скорость реакции, принимает участие только одна молекула, поэтому механизм называют мономолекулярным замещением. Скорость реакции зависит только от концентрации галогеналкана и определяется по формуле v= k[R-Hal].
Концентрация нуклеофильного реагента. Скорость реакции не должна зависеть от концентрации нуклеофила.
Перегруппировка.В медленной стадии реакции образуется карбокатион — частица, способная к перегруппировке. Галогеналканы могут реагировать по механизму SN1 через стадию перегруппировки первоначально образующегося карбокатиона: если в результате 1,2-сдвига отрицательно заряженной частицы образуется более устойчивый карбокатион, то происходит перегруппировка.
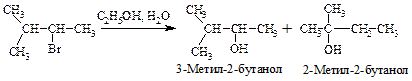
Механизм перегруппировки.
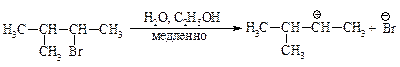


Перегруппировка считается признаком SN1-механизма.
Растворитель. Переходное состояние SN1-реакции более полярно, чем исходное состояние. Увеличение полярности растворителя способствует усилению сольватации переходного состояния по сравнению с сольватацией исходного соединения. Это приводит к росту скорости реакции (рис. 11.5).
При проведении SN1-реакции используют протонные растворители с высокой диэлектрической проницаемостью, способные образовывать водородные связи. Водородная связь возникает за счёт электростатического притяжения между электроотрицательным атомом одной молекулы и атомом водорода другой молекулы, который связан с электроотрицательным атомом, оттягивающим на себя электронное облако и оставляющим открытым ядро водорода. Атом водорода служит мостиком между двумя электроотрицательными атомами, причём с одним из них он связан ковалентной связью, а с другим – электростатическими силами притяжения.
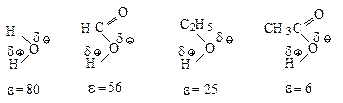
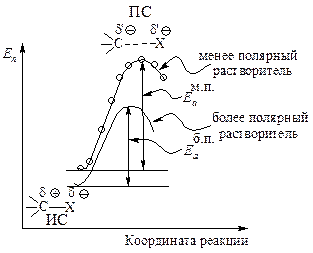
Рис. 11.5. Влияние полярности растворителя на скорость реакции
§
Переходное состояние более полярное d΄Ө>dӨ и d΄Å>dÅ. Более полярный
растворитель сильнее сольватирует ПС, чем ИС.
В растворителе, имеющем высокую диэлектрическую проницаемость, легче протекает ионизация галогеналкана, но, в отличие от апротонных растворителей, в протонном сольватируется не только карбокатион, но и ион галогена, образуя с растворителем водородные связи.
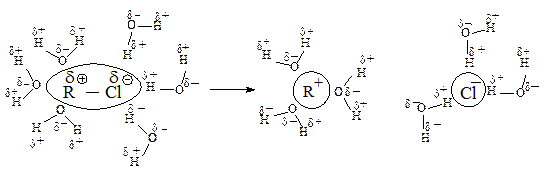
Сольватация сопровождается выделением значительного количества энергии, которая может быть затрачена на ионизацию новых исходных молекул, что приводит к ускорению реакции.
Cольватация нуклеофила не влияет на скорость реакции, так как даже стабилизированный сольватацией нуклеофил быстро реагирует с карбокатионом.
Стереохимия.В карбокатионе, образующемся в медленной стадии, связи sp2 -гибридизованного атома углерода расположены в одной плоскости. Если SN1-замещение протекает у хирального атома углерода, то образующийся плоский карбокатион становится ахиральным.
Последующая атака нуклеофильного реагента происходит с одинаковой вероятностью с обеих сторон плоского карбокатиона. Следовательно, половина образующихся молекул будет иметь ту же конфигурацию, что и исходное соединение, а половина — будет его зеркальным изображением, т.е. образуется эквимолекулярная смесь энантиомеров — рацемат. Такая реакция приводит к оптически неактивному продукту.
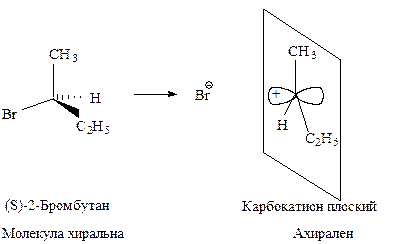
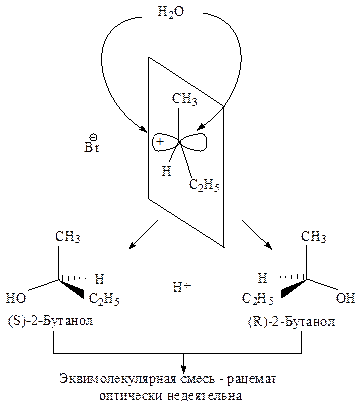
В том случае, если уходящий галогенид-ион не успевает отойти от реакционного центра, он затрудняет атаку нуклеофила со своей стороны. Это приводит к образованию большего количества изомера с конфигурацией, противоположной конфигурации исходного соединения. Тогда имеет место частичная рацемизация.
Более точное объяснение этого явления основывается на идее о том, что формирование карбокатиона в реакции SN1 происходит через образование нескольких форм ионных пар различного строения.
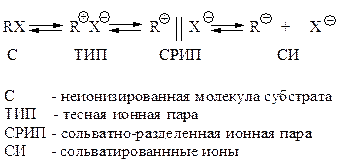
Тесная ионная пара – ионы расположены рядом и находятся в клетке растворителя. СРИП – ионы, разделенные хотя бы одной молекулой растворителя.
Нуклеофил может взаимодействовать с любой из приведенных частиц. При взаимодействии Nu с RX реакция протекает в соответствии с механизмом SN2. Механизм SN1 реализуется, когда субстрат диссоциирует и Nu атакует карбокатион (СИ). Это два предельных случая нуклеофильного замещения: обращение конфигурации (инверсия) или рацемизация. Взаимодействия ТИП Nu и СРИП Nu приводят к частичной рацемизации (или частичному обращению конфигурации, что то же самое).
Реакционная способность. Главным фактором, определяющим реакционную способность в SN1-реакции, является электронный фактор – устойчивость карбокатиона, образующегося в медленной стадии реакции. Чем устойчивее карбокатион, тем легче он образуется, тем быстрее протекает замещение.
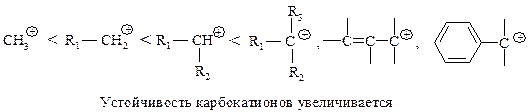
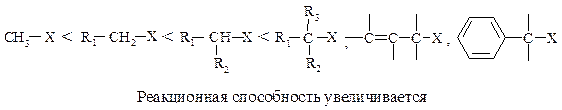
11.1.3. Сравнение реакций SN 1 и SN 2
Каждый из этих механизмов в чистом виде встречается редко. Реакционная способность в SN2-реакции уменьшается при переходе от СН3-Х к первичным RCH2-X, для вторичных — она гораздо меньше и появляется значительный вклад SN1-реакций. При переходе от вторичных к третичным галогеналканам реакционная способность в SN1-реакции резко возрастает.
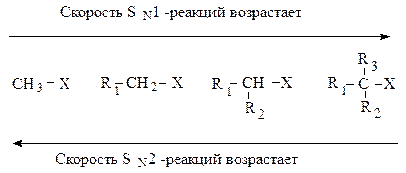
Изменяя условия протекания реакций, можно направить процесс преимущественно по тому или иному механизму.
Таблица 11.2
§
Механизмов
| Механизм | Растворитель | Сила нуклеофила | Концентрация нуклеофила |
| SN1 | Протонный | Более слабый | Мéньшая |
| SN2 | Апротонный | Более сильный | Бóльшая |
Например, неопентилбромид реагирует с этоксид-ионом по SN2-механизму, а с этиловым спиртом – по SN1-механизму. Сильный нуклеофил (сильное основание), этоксид-ион, выталкивает ион галогена из молекулы, тогда как слабый нуклеофил (этиловый спирт) атакует реакционный центр, после того как галогенид-анион отойдет от реакционного центра и сформируется карбокатион.
Амбидентные ионы
Некоторые нуклеофильные реагенты обладают несколькими реакционными центрами. Примеры таких ионов представлены ниже:
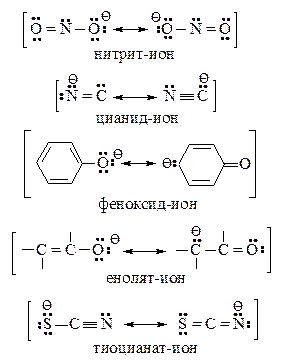
Их называют амбидентными ионами. В амбидентных ионах на атомах с большей электроотрицательностью сосредоточена большая электронная плотность (на атоме кислорода большая электронная плотность — по сравнению с атомами углерода или азота, на атоме азота – по сравнению с атомом углерода). Атомы с меньшей электроотрицательностью обладают большей нуклеофильной силой, т.е. способностью предоставлять свою пару электронов для образования новой ковалентной связи. В соответствии с правилом Корнблюма амбидентные ионы в реакциях SN2-типа атакуются по месту наибольшей нуклеофильности, а в реакциях SN1 – по месту наибольшей электронной плотности.
Замещение с участием таких нуклеофильных реагентов приводит к смеси продуктов. Например, енолят-ионы дают продукты О-алкилирования — виниловые эфиры и С-алкилирования — карбонильные соединения.
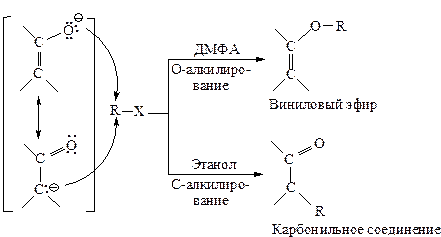
Относительная нуклеофильность обоих центров, а следовательно, и соотношение продуктов реакции определяются не только распределением электронной плотности в амбидентном ионе, но и внешними факторами: растворителем, структурой субстрата R-Х.
Влияние растворителя.При взаимодействии бромистого аллила с феноксид-ионом возможно С- и О-алкилирование. В диметиловом эфире этиленгликоля (ДМЭЭ) CH3–O–CH2–CH2–O–CH3 (апротонный растворитель) образуется аллилфениловый эфир с выходом 100 %, в феноле (протонный растворитель) в основном образуется С-аллил-фенол (77 %) а выход эфира только 23 %.
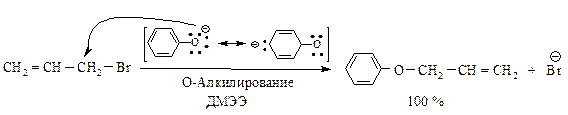
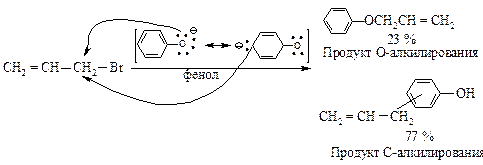
Различная нуклеофильная способность С- и О-атомов обусловлена различной сольватацией в обоих растворителях. В протонном растворителе атом кислорода (атом с большей электронной плотностью) сильнее сольватирован из-за образования водородных связей, чем атом углерода. В результате его нуклеофильная реакционная способность снижена, реакция протекает по менее сольватированному атому углерода.
В апротонном растворителе, в котором отрицательно заряженный ион практически не сольватирован, более активным нуклефильным центром является кислородный атом; протекает преимущественно О-замещение.
Природа алкильного радикала.На соотношение продуктов реакции большое влияние оказывает природа алкильного радикала R в субстрате. При взаимодействии нитрита серебра с алкилбромидом в диэтиловом эфире выход нитроалканов падает при переходе от первичного к третичному алкилгалогениду, и соответственно увеличивается выход эфира азотистой кислоты. Это является следствием изменения механизма реакции.
Первичные галогеналканы реагируют по SN2-механизму. Реакцонный центр, несущий частичный положительный заряд, атакуется атомом, обладающим большей нуклеофильностью (низкой электронной плотностью, высокой поляризуемостью). При взаимодействии первичных галогеналканов образуются преимущественно нитроалканы.
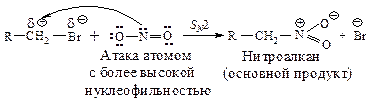
В реакциях вторичных иод- и бромалканов с нитритом серебра в эфире (реакция происходит преимущественно по SN1- механизму) выход нитросоединения составляет лишь 15 %. Третичные галогениды не дают нитроалканов, в реакции образуются эфиры азотистой кислоты (продукты SN1-реакции) и олефины (продукты Е1-реакции). Образующийся карбокатион взаимодействует с атомом, обладающим наибольшей электронной плотностью (низкой поляризуемостью), так как этот атом в состоянии сильнее электростатически притянуть образующийся карбокатион.
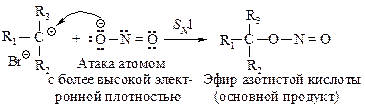
При взаимодействии алкилгалогенидов с цианидами щелочных металлов (синтез нитрилов по Кольбе) так же, как в реакции с нитритами, обычно образуется смесь двух продуктов: нитрилов и изонитрилов.
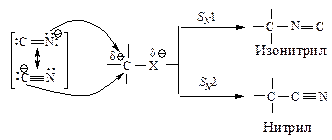
Реакции первичных алкилгалогенидов с цианидами щелочных металлов в апротонных растворителях протекают по механизму SN2, главным продуктом реакции являются нитрилы. Подобным образом можно провести реакцию с вторичными галогеналканами, но с более низкими выходами нитрилов. Третичные галогеналканы не реагируют в этом направлении.
§
Реакция элиминирования — это реакция отщепления от молекулы субстрата двух фрагментов, в результате которой образуется измененный субстрат и две более мелкие частицы. Атом углерода, при котором находится типичная уходящая группа, обозначается греческой буквой альфа — Сa, соседний и последующие атомы обозначаются Сb, Сg и т. д.
Процесс называется a-элиминированием, если оба фрагмента отщепляются от одного и того же атома углерода.
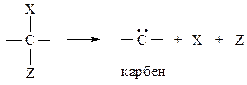
Если группы X и Z связаны с соседними атомами углерода, то происходит b-элиминирование, при этом образуется алкен.
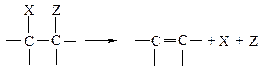
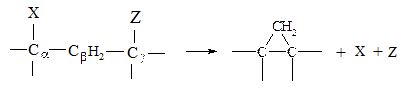
При отщеплении групп, расположенных у атомов углерода, отстоящих друг от друга на одну и более групп -СН2-, образуется циклическое соединение.
В ходе реакции элиминирования от молекулы галогеналкана отщепляются два фрагмента: ион галогена (уходящая группа) от Сa и водород — от соседнего атома углерода Сb. Эта реакция называется b-элиминирование.

11.2.1. Бимолекулярное отщепление Е2
Реакция отщепления галогеноводорода от первичных галогеналканов протекает по бимолекулярному механизму Е2.
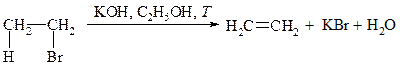
Механизм Е2. Основание НОӨ атакует водород (рис. 11.6,а) при Сb, подает ему пару электронов и начинает образовывать с ним связь, связь Сb–Н ослабевает, пара электронов, связывавшая углерод и водород, освобождается и атакует атом с тыла, одновременно растягивается связь Сa–Br (процесс согласованный). Возникает активированный комплекс: атомы углерода Сa и Сb переходят из sp3-гибридного состояния в состояние, близкое к sp2-состоянию, освобождающаяся пара электронов начинает образовывать p-связь (рис. 11.6,б). Затем связи углерод–водород и углерод–галоген разрываются, атомы углерода переходят в sp2-состояние, образуется p-связь (рис. 11.6,в).
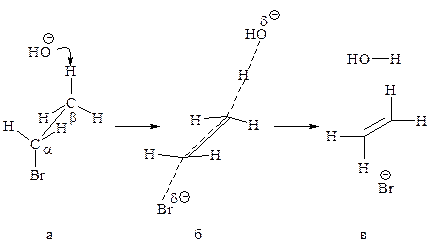
Рис. 11.6. Механизм реакции бимолекулярного элиминирования:
а – антикопланарное расположение связей Сa—Br и Сb—H, б – переходное
состояние, в – конечные продукты
Для проведения реакции Е2 требуются сильные основания. В ряду оснований их эффективность изменяется в соответствии с их силой:
ӨNH2 > ӨOC2H5 > ӨOH > ӨOCOCH3 .
Это следует учитывать при планировании синтеза, в случае сильно основных агентов преимущественно протекает реакция Е2, в случае слабоосновных — SN2. Отщепление преобладает над замещением при повышенных температурах.
В галогеналкане R-X cкорость отщепления возрастает в ряду: I ˉ > Br ˉ > Cl ˉ > F ˉ.
Энергетическая диаграмма реакцииизображена на следующем графике:
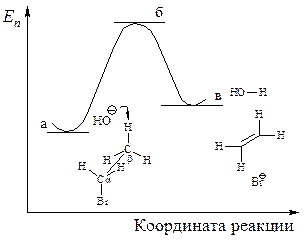
Рис. 11.7. График изменения потенциальной энергии в ходе Е2
Связи, разрывающиеся в активированном комплексе, должны быть в транс-положении друг к другу. Такая геометрия позволяет электронной паре, освобождающейся при связывании протона с основанием, атаковать с тыла атом углерода Сa и вытеснять галоген. Копланарность двух связей субстрата Сa –Br и Сb –Н, которые разрываются в активированном комплексе, обеспечивает максимальное перекрывание р-орбиталей, то есть способствует процессу образования p-связи. Такая комбинация условий называется стереоэлектронным требованием.
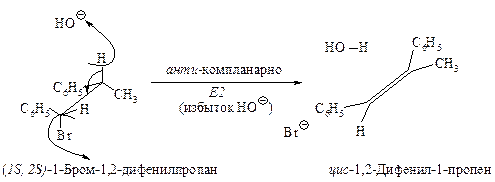
Ниже эта реакция изображена в проекциях Ньюмена.
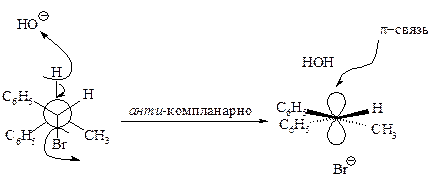

В результате реакции из данного стереоизомерного соединения получается в качестве продукта только один стереоизомер. Она является стереоспецифической реакцией.
Уравнение cкорости реакцииЕ2 имеет такой же вид, как и уравнение скорости реакции SN2. Они отличаются только значениями констант скоростей реакций.
V(SN2)= k[R-Br] [OНӨ]
V(E2)= k΄ [R-Br] [OНӨ]
Направление элиминирования — правило Зайцева.
| Основным продуктом реакции отщепления от галогеналканов с двумя не эквивалентными Сb -атомами является наиболее устойчивый (наиболее алкилированный) алкен. |
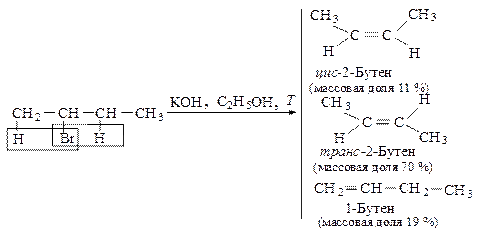
Основным продуктом реакции элиминирования 2-хлорбутана является транс-2-бутен (соотношение цис- и транс-изомеров 1:6). Активированный комплекс, возникающий при образовании транс-изомера, менее пространственно затруднен и более устойчив, и, следовательно, скорее образуется, чем активированный комплекс, ведущий к цис-изомеру.
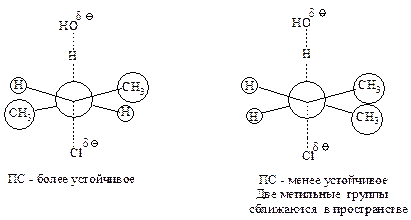
В некоторых случаях в качестве основного продукта реакции образуются наименее замещенные алкены, о таких реакциях говорят, что они протекают по Гофману. Отступление от правила Зайцева имеет место в случае возникновения больших стерических затруднений в переходном состоянии.
Бóльший по сравнению с галогенами объем уходящей группы способствует увеличению количества продукта по Гофману (табл. 11.3, 11.4).
Таблица 11.3
Состав продуктов Е2-реакции 2-замещенных пентанов
(под действием C2H5OӨKÅ)
Количество продукта Гофмана в реакци Е2 возрастает с увеличением объема основания.
Таблица 11.4
§
с алкоголятами калия ROӨKÅ(70-75о С)
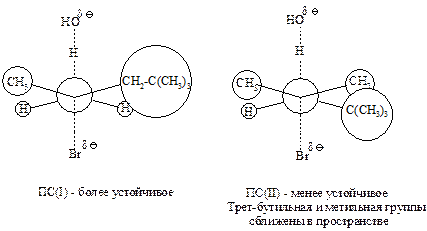
Объемные группы при Сb-атоме создают пространственные затруднения для атаки водорода основанием при наиболее алкилированном атоме углерода (что вело бы к продукту элиминирования в соответствии с правилом Зайцева), и реакции отщепления протекают по Гофману.
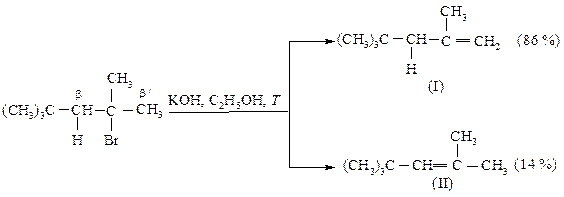
Реакционная способность галогеналканов в реакциях Е2 изменяется в ряду:
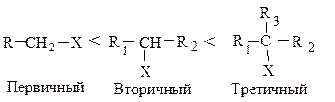
Такое увеличение реакционной способности галогеналканов при переходе от первичных к третичным обусловлено увеличением устойчивости образующихся алкенов.
5.2.2. Мономолекулярное отщепление Е1
Третичные галогеналканы реагируют по мономолекулярному механизму.
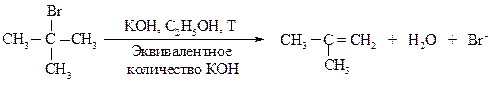
Механизм.Реакция протекает в две последовательные стадии. Первая стадия аналогична первой стадии мономолекулярного нуклеофильного замещения:
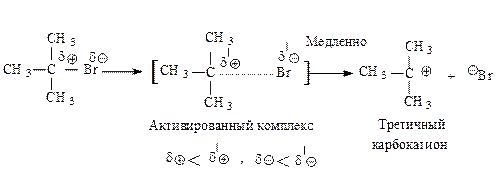
На второй стадии основание атакует водород при Сb — атоме.

Уравнение cкорости реакции. Скорость реакции Е1 не зависит от концентрации основания.
v(E1)= k[R-Br]
Реакционная способностьгалогеналканов увеличивается при переходе от первичных к третичным. Это обусловлено увеличением устойчивости карбокатионов, образующихся в медленной стадии.
Сравнение реакций нуклеофильного замещения
И элиминирования
В реакциях замещения донор электронной пары отдает свою пару электронов атому углерода Сa, связанному с галогеном — в этом случае он является нуклеофилом в реакциях замещения. Тот же донор электронов может отдавать свою электронную пару атому водорода, связанному с Сb — в этом случае он является основанием в реакциях элиминирования.
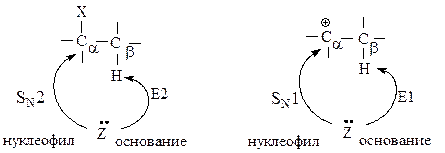
Реакции элиминирования и нуклеофильного замещения являются конкурирующими. При переходе от первичных к вторичным и далее третичным галогеналканам элиминирование происходит все в большей степени.
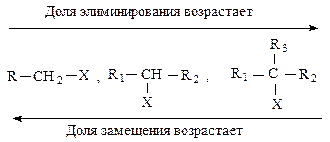
Хотя трудно точно предвидеть, каким образом будет протекать реакция в результате атаки частицы с неподеленной парой электронов атома углерода, несущего положительный заряд, существуют правила, которые могут подсказать главное направление превращений.
В случае сильноосновных и слабополяризуемых агентов, подобно ӨNH2, ӨOC2H5, существует тенденция к преимущественному протеканию реакции Е2, слабоосновные реагенты, подобные иодид- или ацетат-иону, благоприятствуют SN2-реакции. С повышением температуры выход продуктов элиминирования увеличивается за счет продуктов замещения.
Более полярный растворитель в большей степени способствует реакции бимолекулярного замещения по сравнению с реакцией Е2. Сравнение переходных состояний для реакций SN2 и Е2 показывает, что в переходном состоянии реакции Е2 заряд делокализован в большей степени, чем в переходном состоянии реакции SN2.
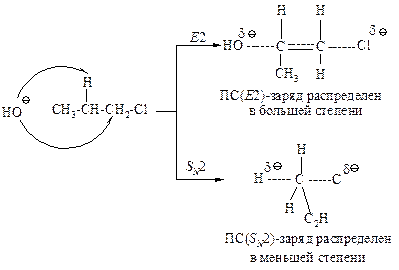
Вследствие этого более полярный растворитель, в одинаковой степени сольватируя исходные состояния реакций Е2 и SN2 (они одинаковы), в большей степени сольватирует переходное состояние SN2-реакции, чем переходное состояние Е2-реакци. Это приводит к возрастанию скорости образования продукта замещения. Поэтому в Е2-реакциях используют спиртовой раствор щелочи, а в SN2 — более полярный растворитель — водный раствор щелочи.
Карбокатионы (в реакциях SN1 и Е1) дают больше продуктов замещения, чем элиминирования. Замещение при Сα способствует Е2-реакции в большей степени, чем SN2, и облегчает Е1, но это направление не становится главным по сравнению с SN1. Замещение при Сβ способствует реакции элиминирования, т.к. благоприятствует образованию наиболее устойчивых алкенов.
§
Галогенирование алканов
Присоединение галогеноводородов к олефинам
Замещение гидроксильной группы спиртов на галоген
Реакция проводится действием на спирты галогенводородов


или галогенидов фосфора

или хлористым тионилом
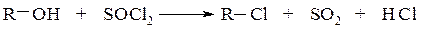
Галогенарены
Галогенаренами называются соединения, содержащие атом галогена, связанный непосредственно с ароматическим кольцом.
Причина низкой реакционной способности галогенаренов
Галогенарены нереакционноспособны в реакциях нуклеофильного замещения, которые характерны для галогеналканов. Низкая реакционная способность галогенаренов обусловлена двумя факторами: 1) делокализацией электронов вследствие резонанса и 2) более высокой энергией s-связи.
1). Хлорбензол можно представить как гибрид граничных структур I-V, причем в структурах III, IV и V хлор связан с атомом углерода двойной связью.
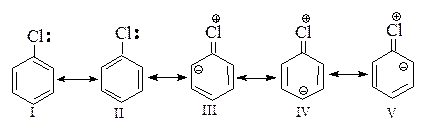
Вклад структур III, IV и V показывает, что углерод и хлор связаны более чем одной парой электронов, следовательно, связь углерод — хлор является не простой, а кратной.
2). В галогеналканах углерод, соединенный с галогеном, находится в sp3-гибридном состоянии. В галогенаренах атом углерода, связанный с галогеном, находится в sp2-cостоянии, поэтому связь углерод-галоген в галогенаренах короче и прочнее, чем в галогеналканах.
Подобным же образом можно объяснить низкую реакционную способность винилгалогенидов CH2 = CH-X.
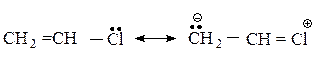
Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
Нуклеофильное замещение галогена в галогенаренах происходит в жестких условиях. Если хлорбензол ввести в реакцию с очень сильным основанием NH2— в жидком аммиаке, то он превращается в анилин.

Реакция протекает в две стадии.
Первая стадия — отщепление хлороводорода с образованием дегидробензола.
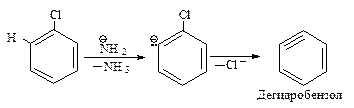
В дегидробензоле дополнительная связь образована между атомами углерода за счет бокового перекрывания sp2-орбиталей, эта связь мало взаимодействует с p-электронным облаком кольца.
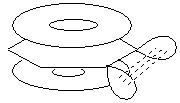
Новая связь довольно слабая и дегидробензол очень реакционноспособен.
Вторая стадия — присоединение аммиака к дегидробензолу.

Подтверждением указанного механизма служит следующий факт: хлорбензол с меченым атомом углерода 14С (обозначенным С*) в реакции с амидом натрия превращается в анилин, в котором половина молекул содержит аминогруппу при углероде 14С, а половина — при соседнем углероде.
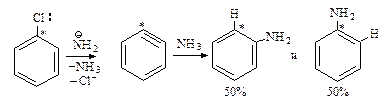
Бимолекулярное нуклеофильное замещение путем
§
Присутствие электроноакцепторных групп (например нитрогруппы), особенно в орто— или пара-положении к хлору резко увеличивает его подвижность.

Другие электроноакцепторные группы, расположенные в орто-, пара-положениях, подобно нитрогруппе, активируют галоген. Наоборот, электронодонорные группы будут дезактивировать ароматическое кольцо в реакциях нуклеофильного замещения.
Бимолекулярное нуклеофильное замещение в ароматическом ядре включает две стадии.
Первая стадия — медленная: атака нуклеофильного реагента по атому углерода, связанному с галогеном, и образование s-комплекса — карбаниона.
В карбанионе шесть p-электронов делокализованы на р-орбиталях пяти атомов углерода, находящихся в sp2-гибридном состоянии; избыточная электронная плотность распределена между углеродами в орто-, пара-положениях кольца (I, II и III структуры) и кислородом нитрогуппы (IV).

Вторая стадия — быстрая: отщепление аниона галогена, восстановление ароматического шести-p-электронного секстета.
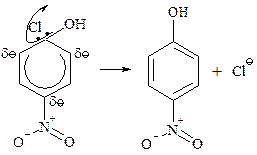
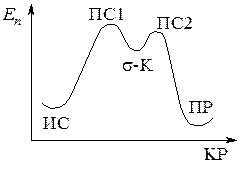
Рис. 12.1. Энергетическая диаграмма реакции SNAr
Реакция нуклеофильного замещения в ароматическом ядре протекает через две стадии: 1) нуклеофильного присоединения и 2) последующего отщепления аниона галогена подобно тому, как электрофильное замещение протекает через стадии: 1) электрофильного присоединения и 2) последующего отщепления протона (рис. 12.1).
В реакциях SN2Ar наиболее реакционноспособными являются фторзамещенные арены. Например,относительная реакционная способность п-галогеннитробензолов по отношению к метоксиду натрия при 50 оС изменяется в следующем порядке: F (312) >> Cl (1) > Br (0,74) > I (0,36).
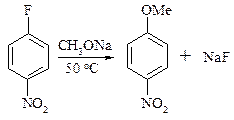
При нуклеофильном ароматическом замещении прочность связи С–Hal не играет решающей роли, поскольку разрыв связи происходит не на стадии, определяющей скорость замещения. Сильно электроотрицательный фтор стабилизирует переходное состояние скорость определяющей реакции присоединения более эффективно, чем другие галогены, и поэтому ускоряет реакцию.
Другие электроноакцепторные группы, такие как циано –CN, ацетил –COCH3, трифторметильная –CF3, также повышают реакционную способность кольца, но в меньшей степени.
В реакциях нуклеофильного ароматического замещения распространенными уходящими группами являются галогены, нитрогруппа –NO2, тозилатная –O–SO2–C6H4–CH3—п, алкилсульфонильная –SO2–R, сульфогруппа –SO3H.
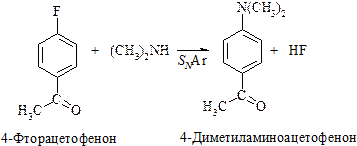
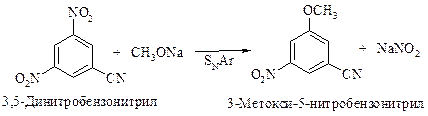
Ориентация при нуклеофильном замещении
§
Магнийорганические соединения присоединяются к карбонильным соединениям по двойной связи углерод — кислород.
Для синтеза первичных спиртов используют в качестве карбонильного соединения муравьиный альдегид.
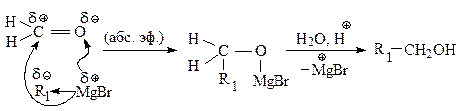
Для получения первичных спиртов, содержащих на два атома углерода больше, чем в магнийорганическом исходном соединении, используют окись этилена.
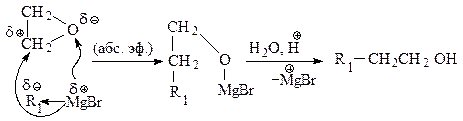
Для получения вторичных спиртов в качестве карбонильного соединения используют соответствующий альдегид.
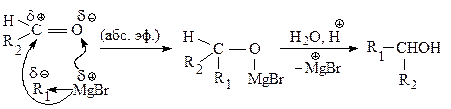
В случае синтеза третичных спиртов исходное карбонильное соединение — кетон.

Как выбрать карбонильное соединение для синтеза определенного спирта? Предположим, необходимо получить 2-фенил-2-бутанол. Мысленно расщепляем молекулу спирта около углерода, несущего спиртовую группу. Та часть молекулы, которая содержит кислород, входила в исходное карбонильное соединение, другая — в реактив Гриньяра.
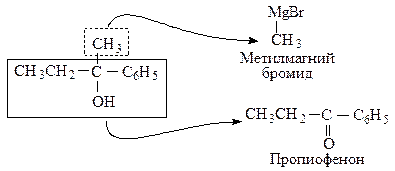
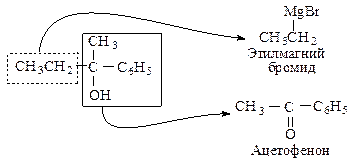

Таким образом, для синтеза указанного спирта можно выбрать три пары соединений.
Получение карбоновых кислот.При взаимодействии реактива Гриньяра с углекислым газом происходит присоединение его по двойной связи, как и в реакции с карбонильными соединениями, в результате образуется соль, из которой карбоновую кислоту выделяют действием разбавленного раствора минеральной кислоты.
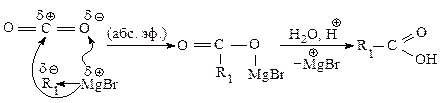
Библиографический список
1. Моррисон, Р. Органическая химия. – М. : Мир, 1974. – 1132 с.
2. Терней, А. Современная органическая химия : 2 т. – М. : Мир, 1991. – Т. 1. – 670 с.; Т. 2. – 615 с.
3. Робертс, Дж. Основы органической химии : в 2 т. / Дж. Моррисон, М. Кассерио. – 2-е изд. – М. : Мир, 1978. – Т. 1. – 842 с.; Т. 2. – 888 с.
4. Шабаров, Ю. С. Органическая химия : в 2 кн. – М. : Химия, 1994. – 848 с.
5. Травень, В. Ф. Органическая химия : 2 т. – М. : ИКЦ Академкнига, 2004. – Т. 1. – 727 с.; Т. 2. – 582 с.
ОГЛАВЛЕНИЕ
| 1.АЛКАНЫ…………………………………………………….. | |
| 1.1. Гомологический ряд, изомеры……………………………….. | |
| 1.2. Строение метана ……………………………………………… | |
| 1.3. Строение этана ………………………………………………… | |
| 1.4. Вращение вокруг простой углерод-углеродной связи. Конформации………………………………………………… | |
| 1.5. Физические свойства …………………………………………. | |
| 1.6. Химические свойства ………………………………………… | |
| 1.7. Методы синтеза алканов …………………………………….. | |
| 2. СТЕРЕОИЗОМЕРИЯ. ЭНАНТИОМЕРИЯ ………………. | |
| 2.1. Энантиомеры. Хиральность. Условия хиральности …………. | |
| 2.2. Плоскополяризованный свет. Оптическая активность …….. | |
| 2.3. Строение молекул и оптическая активность ………………… | |
| 2.4. Обозначение конфигураций………………………………….. | |
| 2.5. Соединения с несколькими хиральными центрами. Диастереомеры. Рацемат. Мезо-формы ……………………… | |
| 2.6. Методы разделения энантиомеров …………………………… | |
| 3. ЦИКЛОАЛКАНЫ ………………………………………………. | |
| 3.1. Номенклатура. Изомерия ……………………………………… | |
| 3.2. Физические свойства …………………………………………. | |
| 3.3. Строение ………………………………………………………. | |
| 3.4. Химические свойства ………………………………………… | |
| 3.5. Способы получения …………………………………………… | |
| 4. АЛКЕНЫ …………………………………………………… | |
| 4.1. Изомерия алкенов ……………………………………………… | |
| 4.2. Строение этена ……………………………………………….. | |
| 4.3. Физические свойства …………………………………………. | |
| 4.4. Химические свойства …………………………………………. | |
| 4.5. Способы получения алкенов ………………………………………. | |
| 5.АЛКИНЫ ………………………………………………….. | |
| 5.1. Строение ацетилена …………..……………………………. | |
| 5.2. Физические свойства ……………………………………….. | |
| 5.3. Химические свойства ..…………………………………….. | |
| 5.4. Способы получения ………..………………………………. | |
| 6. ДИЕНЫ ……………………………………………………… | |
| 6.1. Устойчивость сопряженных диенов ……………………….. | |
| 6.2. Химические свойства ……………………………………….. | |
| 6.3. Способы получения …………………………………………. | |
| 7. АРЕНЫ ………………………………………………………… | |
| 7.1. Сравнение свойств бензола со свойствами алкенов ……… | |
| 7.2. Теплота гидрирования. Энергия резонанса ……………….. | |
| 7.3. Строение бензола ………..…………………………………. | |
| 7.4. Ароматичность ………………..……………………………. | |
| 7.5. Физические свойства ……………………………………….. | |
| 7.6. Химические свойства ……………………………………….. | |
| 7.7. Методы синтеза ………………………..…………………… | |
| 8. ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ В ПРОИЗВОДНЫХ БЕНЗОЛА …………………………………………………… | |
| 8.1. Влияние заместителей на реакционную способность бензольного кольца ……………………………………………… | |
| 8.2. Механизм ориентации — влияние заместителей на выбор места электрофильной атаки | |
| 9. МНОГОЯДЕРНЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ | |
| 9.1. Нафталин …………………………………………………….. | |
| 9.2. Антрацен и фенантрен ……………………………………… | |
| 10. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ….………….. | |
| 10.1. Пятичленные гетероциклы ……..………………………… | |
| 10.2. Пиридин ……..…………………………………………….. | |
| 10.3 Хинолин …………………………………………………….. | |
| 11. ГАЛОГЕНАЛКАНЫ ……………………………………… | |
| 11.1. Нуклеофильное замещение …………..…………………… | |
| 11.2. Реакции отщепления (элиминирование) ………..……….. | |
| 11.3. Методы синтеза галогеналканов ………………………….. | |
| 12. ГАЛОГЕНАРЕНЫ …………………………………………… | |
| 12.1 Причина низкой реакционной способности галогенаренов | |
| 12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление — присоединение | |
| 12.3. Бимолекулярное нуклеофильное замещение путем присоединения — отщепления ……………………………….… | |
| 12.4. Ориентация при нуклеофильном замещении в ароматическом кольце ……………………………………………… | |
| 13. МАГНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ………….. | |
| 13.1. Получение и строение магнийорганических соединений . | |
| 13.2. Синтез спиртов и кислот …………..……………………… | |
| БИБЛИОГРАФИЧЕСКИЙ СПИСОК ..……………………… |
Учебное издание
УГЛЕВОДОРОДЫ.

