- Характеристика кислорода как химического элемента
- Закрепление изученного материала
- Горение и виды горючих веществ
- История открытия
- Кислород, его общая характеристика и нахождение в природе. получение кислорода и его физические свойства
- Оксиды
- Получение кислорода
- Реакция с серой
- Строение и физические свойства простых веществ
- Физические свойства
- Химические свойства
Характеристика кислорода как химического элемента
(слайды 5-8)
- Химический знак – О,
- латинское название – Оxygenium,
- Аr(O) = 16;
- валентность – II,
- степень окисления в соединениях: – 2;
- содержание в земной коре – I место – более 49% ,
- самые распространённые оксиды: оксид водорода (вода) – H2O, оксид кремния – SiO2 , оксид алюминия – Al2O3 .
Демонстрация минералов:
- кварц – SiO2– эту устойчивую при низких температурах модификацию обычно называют просто кварцем; происхождение названия остается неизвестным. Кварц является одним из наиболее распространенных в земной коре.
- аметист –SiO2
- горный хрусталь – SiO2
- агат – SiO2
- рубин – Аl2О3 – одна из разновидностей корунда
- изумруд – Be3Al2[Si6O18] – одна из разновидностей берилла. Химический состав:SiO2 66,9%.Al2O3 19,0 %, BeO 14,1%, в виде примесей содержатся Na2O, K2O, Li2O, иногда Rb2O, Cs2O.
- александрит – BeAl2O4 – разновидность хризоберилла «хризос» по гречески – золото. Химический состав. Al2O380,2 %. BeO 19,8 %, Всегда присутствуют примеси: FeO (3,5-6%), иногда TiO2 (до 3%) и Cr2O3 (до 0,4%), с чем связана окраска александрита. Цветалександрита изумрудно-зеленый, а при электрическом освещении – фиолетово-красный.
Закрепление изученного материала
(слайды 23-25)
(химический тест):
Кто назвал кислород «огненным», а азот « испорченным» воздухом?
А) Лавуазье, В) Пристли, С) Шееле.Какие вещества образует химический элемент кислород?
А) только простые вещества, В) простые и сложные вещества, С) только сложные вещества.Как называются бинарные соединения, молекулы которых образованы атомами какого-либо химического элемента и кислорода:
А) сульфиды, В) хлориды, С) оксиды.В 1774 году один учёный после проведённого эксперимента написал: «Но что поразило меня больше всего – это то, что свеча горела в этом воздухе удивительно блестящим пламенем…» Это был:
А) Лавуазье, В) Пристли, С) Шееле.Название «Оxygenium» предложил:
А) Лавуазье, В) Пристли, С) Шееле.Кислород в воде:
А) хорошо растворим, В)малорастворим, С)вообще не растворяется.При вдувании кислорода в пламя температура пламени:
А) не изменяется, В) понижается, С) повышается.Оксид железа (III) имеет формулу:
А) Fe2O3, В) FeO, С) FeO2.В каком уравнении коэффициенты расставлены правильно:
А) 2P O2 = P2O5; В) 2P 5O2 = P2O5, С) 4P 5O2 = 2P2O5В каком ряду все три формулы написаны правильно:
А) P2O5, Al2O, H2O; В) MgO, Al2O3 , CO2; С) CO2, FeO2, P2O5
Проверка диктанта. (слайд 26-27)
| Номер вопроса | Буква ответа | Правильно Неправильно — |
| 1 | С | |
| 2 | В | |
| 3 | С | |
| 4 | В | |
| 5 | А | |
| 6 | В | |
| 7 | С | |
| 8 | А | |
| 9 | С | |
| 10 | В |
Итого:Оценка:
Критерии оценки:
- «5» – 10-9 правильных ответов
- «4» – 8-7 правильных ответов
- «3» – 6-5 правильных ответов
Горение и виды горючих веществ
Реакция, протекающая с участием кислорода и сопровождающаяся выделением большого количества света и тепла, называется горением.
В чистом кислороде, по сравнению с воздухом, вещества горят во много раз быстрее (рис. 22). В обоих случаях выделяется равное количество теплоты, но в кислороде этот процесс протекает быстрее и выделяющаяся теплота не расходуется, как в случае с воздухом, на нагревание азота.
https://www.youtube.com/watch?v=kursoteka.ruplayer
Температура при горении в чистом кислороде выше, чем в воздухе. Опуская тлеющую лучину в сосуд с чистым кислородом, можно увидеть, как она сразу загорается. А в воздухе тлеющая лучина может вскоре и потухнуть. Если эта лучина зажжена, то она продолжает гореть на воздухе, потому что выделяющееся при горении тепло требует большей температуры, чем температура воспламенения лучины.
Рис. 22. Горение магния в чистом кислороде
Рис. 23. Тушение пламени
Температура, необходимая для поджигания вещества на воздухе, называегся температурой воспламенения.
Значит, для обеспечения горения веществ, нужно нагревать их до температуры воспламенения и подавать кислород в достаточном количестве.
Для того чтобы потушить пламя, необходимо ликвидировать факторы, обеспечивающие его появление, т.е. охладить вещество до температуры ниже температуры возгорания и прекратить подачу кислорода (рис. 23).
Чтобы потушить горящую вещь, сначала следует понизить температуру, используя невоспламеняющиеся средства, затем накрыть источник возгорания одеялом или брезентом, чтобы прекратить подачу воздуха.
В непредвиденных ситуациях для тушения пожара необходимо использовать специальные средства, а если их нет, то применять указанный выше способ.
Вообще процесс горения имеет огромное значение в промышленности и в повседневной жизни.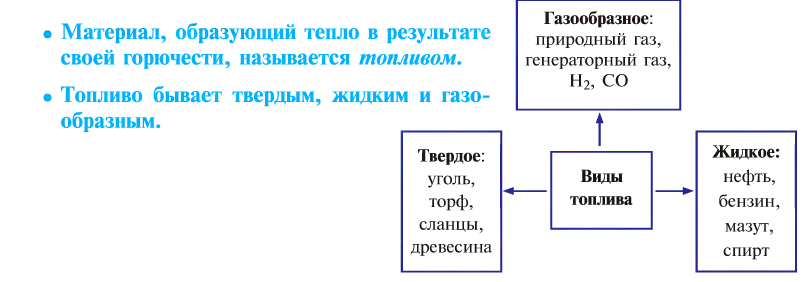
От твердого топлива остается минеральный осадок — пепел. Жидкое и газообразное топливо такого недостатка не имеет. Но любое топливо независимо от места добычи, промышленного объема, экономической эффективности имеет только свое место применения, и возможности по его взаимозамещению ограничены.
Неправильное сжигание топлива приносит вред народному хозяйству.
Топливо позволяет спокойно переносить холод, варить пищу, которая не употребляется в сыром виде, получать металлы из руд путем их выплавки, обеспечивать движение транспорта, получать другие виды энергии.
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли первого августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
- 2HgO (t) → 2Hg O2↑
https://www.youtube.com/watch?v=_EING_B8boA
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье провел опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Кислород, его общая характеристика и нахождение в природе. получение кислорода и его физические свойства
Наш урок посвящен химическому элементу, который занимает особое место в жизни человека и всего живого. Речь пойдет о кислороде. Вы познакомитесь с общей характеристикой химического элемента – кислорода по его положению в ПСХЭ, рассмотрим нахождение кислорода в природе, изучим способы получения кислорода и его физические свойства.
Также данный урок посвящен изучению истории открытия одного из самых известных неорганических веществ – кислорода. Из материалов урока вы узнаете, кому принадлежит приоритет открытия кислорода и кто дал название этом веществу.
Эпиграф урока
“Кислород — это вещество, вокруг которого вращается земная химия”.
Я. Берцелиус.
I. Познавательный фильм: “Кислород”
II. Общая характеристика кислорода как химического элемента по положению его в ПСХЭ

Кислород — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным порядковым номером 8.
Обозначается символом O (лат. Oxygenium).
Относительная атомная масса химического элемента кислорода равна 16, т.е. Ar(O)=16.
Относительная молекулярная масса равна 32, т.е. Мr(O2)=32.
III. Валентность кислорода, физические свойства
В соединениях кислород обычно двухвалентен (в оксидах), валентность VI не существует. В свободном виде встречается в виде двух простых веществ: О2 («обычный» кислород) и О3 (озон). О2 — газ без цвета и запаха, с относительной молекулярной массой =32. О3 – газ без цвета с резким запахом, с относительной молекулярной массой =48.
Температура кипения сжиженного кислорода -183 С, температура плавления твердого кислорода -219 С. Интересно, что кислород притягивается магнитом.
Кислород поддерживает дыхание и горение. Причем, если внести в сосуд с кислородом тлеющую лучинку, то она вспыхнет ярким пламенем.
Это интересно: “Какого цвета твердый кислород”
При температуре 90 K газ кислород превращается в бледно-голубую жидкость, а при температуре 54 K становится твёрдым. Но твёрдый кислород твёрдому кислороду рознь: в интервале давлений от 0 до приблизительно 130 гигапаскалей (1,3 млн атмосфер) кислород может существовать по крайней мере в шести модификациях (их обозначают греческими буквами γ, β, α, δ, ε и ζ). Эти модификации отличаются друг от друга кристаллической решёткой, магнитными и электрическими свойствами, а также цветом. Например, при давлении 5,4 гПа (это примерно в 52 тысячи раз выше атмосферного) твёрдый кислород имеет бледно-голубой цвет. При дальнейшем повышении давления (до 10 гПа) твёрдый кислород становится красным. Некоторые модификации твёрдого кислорода даже называют по их характерному цвету. Например, δ-O2 называют оранжевым кислородом, а ε-O2 — красным кислородом.
IV. Кислород в природе
 Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 49% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по объёму и 23% по массе. Более 1500 соединений земной коры в своем составе содержат кислород.
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 49% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по объёму и 23% по массе. Более 1500 соединений земной коры в своем составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 20 %, по массовой доле — около 65 %.
V. Открытие и получение кислорода
Открытие кислорода приходится на XVIII век. До этого времени считалось, что любой газ – это разновидность воздуха. Началом изучения газов послужило, казалось бы, незначительное изобретение. Английский ученый Гейлс предложил прибор для сбора газов. Заполненную водой колбу он опустил горлом вниз в сосуд с водой, в горло колбы поместил изогнутый ружейный ствол, по которому в колбу, вытесняя воду, поступали газы. Вот с этого прибора все и началось…
Приоритет открытия кислорода принадлежит англичанину Джозефу Пристли.В 1774 г. он обнаружил, что при разложении оксида ртути образуется газообразное вещество, в атмосфере которого тлеющая лучина вспыхивает ярким пламенем, а дышать этим газом особенно легко. Это был кислород. Уравнение реакции разложения оксида ртути:
2HgO = 2Hg O2
Пристли поделился своим открытием с А.Лавуазье, и тот дал газу название «кислород».
Интересно, что еще до работ Дж. Пристли в 1771 г. опыты по разложению оксида ртути проделал шведский химик Карл Шееле. Но результаты его исследований были опубликованы только в 1775 г., поэтому Пристли о них ничего не знал.
Есть еще один интересный исторический факт. Оказывается голландский химик Корнелиус Дреббел примерно за 150 лет до Пристли и Шееле получил кислород при нагревании нитрата калия:
2KNO3 = 2KNO2 O2
Он описал свойства полученного газообразного вещества: тлеющий уголек в нем вспыхивал, в атмосфере этого газа легко дышалось. Свое открытие ученый даже использовал на изобретенном им подводном судне. Однако в то время ученые не интересовались газами, и открытие Дреббела даже не заметили.
VI. Получение кислорода
Промышленный способ получения кислорода
В промышленных целях кислород необходимо получать в больших объёмах и максимально дешёвым способом. Такой способ получения кислорода был предложен лауреатом Нобелевской премии Петром Леонидовичем Капицей. Он изобрёл установку для сжижения воздуха. Как известно, в воздухе находится около 21% по объему кислорода. Кислород можно выделить из жидкого воздуха методом перегонки, т.к. все вещества, входящие в состав воздуха имеют разные температуры кипения. Температура кипения кислорода — -183°С, а азота — -196°С. Значит, при перегонке сжиженного воздуха первым закипит и испарится азот, а затем – кислород.
Лабораторные способы получения кислорода
В лаборатории кислород требуется не в таких больших количествах, как в промышленности. Обычно его привозят в голубых стальных баллонах, в которых он находится под давлением. В некоторых случаях всё же требуется получить кислород химическим путём. Для этого используют реакции разложения.
1. Разложение пероксида водорода
При комнатной температуре пероксид водорода разлагается медленно (признаков протекания реакции мы не видим), но этот процесс можно ускорить, если добавить в раствор несколько крупинок оксида марганца(IV). Вокруг крупинок черного оксида сразу начинают выделяться пузырьки газа. Это кислород. Как бы долго ни протекала реакция, крупинки оксида марганца(IV) в растворе не растворяются. То есть, оксид марганца(IV) участвует в реакции, ее ускоряет, но сам в ней не расходуется.
Вещества, которые ускоряют реакцию, но не расходуются в реакции, называют катализаторами.
Реакции, ускоряемые катализаторами, называют каталитическими.
Ускорение реакции катализатором называют катализом.
Таким образом, оксид марганца (IV) в реакции разложения пероксида водорода служит катализатором. В уравнении реакции формула катализатора записывается сверху над знаком равенства. Запишем уравнение проведенной реакции. При разложении пероксида водорода выделяется кислород и образуется вода. Выделение кислорода из раствора показывают стрелкой, направленной вверх:
2. Разложение перманганата калия
В повседневной жизни вы наверняка сталкивались с веществом, которое в быту называется «марганцовкой». Химическое название этого вещества — перманганат калия, его химическая формула KMnO4.
При нагревании перманганат калия разлагается с образованием кислорода.
В пробирку насыпают кристаллический перманганат калия. При нагревании перманганат калия разлагается, выделяющийся кислород поступает по газоотводной трубке в колбу-приемник. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Если опустить тлеющую лучину в колбу с собранным кислородом, то она ярко вспыхнет.
Уравнение проведенной реакции:
2 KMnO4 = K2MnO4 MnO2 O2 ↑
3. Разложение бертолетовой соли
Для получения кислорода к бертолетовой соли всегда примешивают оксид марганца МпО2 или другое вещество, каталитически ускоряющее процесс разложения. Если нагревать более или менее значительные количества чистой соли, то на поверхности расплава может образоваться корка тугоплавкого хлорида калия, под которой скопляется кислород, в результате чего происходит взрыв. В присутствии оксида марганца MnO2 бертолетова соль начинает разлагаться раньше, чем она расплавится (около 200 ºС).
2KClO3 t˚C , MnO2=2KCl 3O2↑
Это интересно
Кислород мало растворим в воде и тяжелее воздуха, поэтому его можно получать двумя способами:

- вытеснением воздуха (кислород будет собираться на дне сосуда)

ЦОРы
Познавательный фильм: “Кислород”
Видео: “Разложение пероксида водорода”
Видео: “Разложение перманганата калия”
Домашнее задание
- Параграф 22
- Стр. 75 упр. 4-6 (письменно)
Оксиды
Продуктами всех реакций, рассмотренных в параграфе, являются бинарные соединения элементов с Оксигеном.
Соединение, образованное двумя элементами, одним из которых является Оксиген, называют оксидом.
Общая формула оксидов — 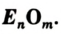
Таблица 4Формулы и названия некоторых оксидов
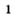
Выводы:
Кислород — химически активное вещество. Он взаимодействует с большинством простых веществ, а также со сложными веществами. Продуктами таких реакций являются соединения элементов с Оксигеном — оксиды.
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:
2Н
2
О → 2Н
2
О
2

2.
В лаборатории кислород получают:
1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na
2
SO
4
и др.)
2. Термическим разложением перманганата калия KMnO
4
:
2KMnO
4
= K
2
MnO4 MnO
2
O
2
↑,
Бертолетовой соли KClO
3
:
2KClO
3
= 2KCl 3O
2
↑ (катализатор MnO
2
)
Оксида марганца ( 4) MnO
2
:
4MnO
2
= 2Mn
2
O
3
O
2
↑ (700
o
C),
3MnO
2
= 2Mn
3
O
4
O
2
↑ (1000
o
C),
3. Разложением пероксида водорода:
2H
2
O
2
= H
2
O O
2
↑ (катализатор MnO
2
)
4. Разложение нитратов:
2KNO
3
→ 2KNO
2
O
2
На космических кораблях и подводных лодках кислород получают из смеси K
2
O
2
и K
2
O
4
:
2K
2
O
4
2H
2
O = 4KOH 3O
2
↑
4KOH 2CO
2
= 2K
2
CO
3
2H
2
O
Суммарно:
2K
2
O
4
2CO
2
= 2K
2
CO
3
3О
2
↑
Когда используют K
2
O
2
, то суммарная реакция выглядит так:
2K
2
O
2
2CO
2
= 2K
2
CO
3
O
2
↑
Если смешать K
2
O
2
и K
2
O
4
в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО
2
выделится один моль О
2.
Реакция с серой
Это химическое превращение осуществляет каждый, когда зажигает спичку; сера входит в состав ее головки. В лаборатории реакцию серы с кислородом проводят в вытяжном шкафу. Небольшое количество серы (светло-желтый порошок или кристаллы) нагревают в железной ложке. Вещество сначала плавится, потом загорается в результате взаимодействия с кислородом воздуха и горит едва заметным синим пламенем (рис. 56, б). Появляется резкий запах продукта реакции — сернистого газа (этот запах мы ощущаем в момент загорания спички). Химическая формула сернистого газа — 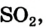
Рис. 56. Сера (а) и ее горение на воздухе (б) и в кислороде (в)
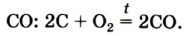
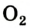
Рис. 57.Красный фосфор (а) и его горение на воздухе (б) и в кислороде (в)
Строение и физические свойства простых веществ
С простым веществом кислородом вы уже познакомились в курсе химии 7-го класса. Напомним, что простое вещество кислород в природе существует в виде двух аллотропных модификаций — обычного кислорода 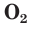 озона
озона 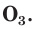
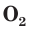
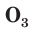
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Небольшие количества озона в воздухе оказывают целебное действие на людей. Однако сильное обогащение воздуха озоном может стать опасным для здоровья. Увеличение содержания озона в воздухе выше предельно допустимой концентрации приводит к появлению головных болей, раздражению дыхательных путей и глаз, а затем к ослаблению сердечной деятельности.
Источниками озона являются работающие приборы, в которых происходит высоковольтный электрический разряд — копировальные установки и лазерные принтеры, а также источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы, необходимо часто проветривать.
Озон сосредоточен в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от жесткого ультрафиолетового излучения Солнца. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов.
Кислород и озон в воде мало растворимы. При 20 °С в 100 объемах 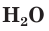
Физические свойства
При нормальных условиях кислород это газ без цвета, вкуса и запаха. 1л его весит 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C) и спирте (2,78 мл/100г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (темп. кипения −182,98 °C) это бледно-голубая жидкость.
Твердый кислород (темп. плавления −218,79 °C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53° .β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
Ещё три фазы образуются при высоких давлениях:δ-О2 интервал температур до 300 К и давление 6-10 ГПа, оранжевые кристаллы;ε-О2 давление от 10 и до 96 ГПа, цвет кристаллов от темно красного до чёрного, моноклинная сингония;
Химические свойства
Сильный окислитель, взаимодействует, практически, со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:4K O2 → 2K2O2Sr O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:2NO O2 → 2NO2
Окисляет большинство органических соединений:CH3CH2OH 3O2 → 2CO2 3H2O
При определенных условиях можно провести мягкое окисление органического соединения:CH3CH2OH O2 → CH3COOH H2O
Кислород не окисляет Au и Pt, галогены и инертные газы.
Кислород образует пероксиды со степенью окисления −1.— Например, пероксиды получаются при сгорании щелочных металлов в кислороде:2Na O2 → Na2O2
— Некоторые окислы поглощают кислород:2BaO O2 → 2BaO2
— По принципам горения, разработанным А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:H2 O2 → H2O2
Надпероксиды имеют степень окисления −1/2, то есть один электрон на два атома кислорода (ион O2-). Получают взаимодействием пероксидов с кислородом при повышенных давлениям и температуре:Na2O2 O2 → 2NaO2
Озониды содержат ион O3- со степенью окисления −1/3. Получают действием озона на гидроксиды щелочных металлов:КОН(тв.) О3 → КО3 КОН O2
Ион диоксигенил O2 имеет степень окисления 1/2. Получают по реакции:PtF6 O2 → O2PtF6
Фториды кислородаДифторид кислорода, OF2 степень окисления 2, получают пропусканием фтора через раствор щелочи:2F2 2NaOH → OF2 2NaF H2O
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления 1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C.
Пропуская тлеющий разряд через смесь фтора с кислородом при определенных давлении и температуре получаются смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.


