- Вредность и опасность кислорода
- История открытия кислорода
- Кислород в баллоне
- Коэффициент перевода объема и массы o2 при т=15°с и р=0,1 мпа
- Коэффициенты перевода объема и массы o2 при т=0°с и р=0,1 мпа
- Определите плотность кислорода, находящегося в баллоне под давлением 1 мпа при температуре 300 к. — помощь студентам
- Определить плотность кислорода находится в баллоне под давлением 3 атмосферы при температуре 17 градусов
- Определить плотность кислорода находится в баллоне под давлением 3 атмосферы при…
- Определить плотность кислорода находится в баллоне под… —
- Первый тип задач: нет изменения массы
- Применение кислорода
- Применение кислорода в сварке
- Расчет ацетилена в баллонах
- Расчет двуокиси углерода (углекислота) в баллонах
- Расчет кислорода в баллонах
- Расчет пропана-бутана в баллонах
- Способы получения кислорода
- Характеристики кислорода
- Хранение и транспортировка кислорода
Вредность и опасность кислорода
За внешней безобидностью скрывается очень опасный газ, но об этом на нашем сайте опубликована статья про маслоопасность и взрывоопасность кислорода и мы не будем здесь дублировать информацию.
История открытия кислорода
Открытие кислорода приписывают Джозефу Пристли (Joseph Priestley). У него была лаборатория, оборудованная приборами для собирания газов. Он испытывал его физиологическое действие на себе и на мышах. Пристли установил, что после вдыхания газа некоторое время ощущается приятная легкость.
Мыши в герметически закрытой банке с воздухом задыхаются быстрей, чем в банке с O2. Поскольку Пристли был приверженцем флогистонной теории он так и не узнал, что оказалось у него в руках. Он только описал этот газ, даже не догадываясь, что он описал. А вот лавры открытия кислорода принадлежат Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier), который и дал ему имя.
Лавуазье, поставил свой знаменитый опыт, продолжавшийся 12 дней. Он нагревал ртуть в реторте. При кипении образовывалась ее красная окись. Когда реторту охладили, оказалось, что воздуха в ней убыло почти на 1/6 его объема, а остаток ртути весил меньше, чем перед нагревом. Но когда разложили окись ртути сильным прокаливанием, все вернулось: и недостача ртути, и «исчезнувший» кислород.
Впоследствии Лавуазье установил, что этот газ входит в состав азотной, серной, фосфорной кислот. Он ошибочно полагал, что O2 обязательно входит в состав кислот, и поэтому назвал его «оксигениум», что значит «рождающий кислоты». Теперь хорошо известны кислоты, лишенные «оксигениума» (например: соляная, сероводородная, синильная и др.).
Кислород в баллоне
Благодаря этой таблице теперь можно легко дать ответы на вопросы, которые очень часто задают сварщики:
Для того, чтобы приблизительно узнать сколько кислорода в баллоне, нужно вместимость баллона (м3) умножить на давление (МПа). Например, если вместимость баллона 40 литров (0,04 м3), а давление газа 15 МПа, то объем кислорода в баллоне равен 0,04×15=6 м3.
Коэффициент перевода объема и массы o2 при т=15°с и р=0,1 мпа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м3 | Жидкость, л | |
| 1,337 | 1 | 1,172 |
| 1,141 | 0,853 | 1 |
| 1 | 0,748 | 0,876 |
Коэффициенты перевода объема и массы o2 при т=0°с и р=0,1 мпа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м3 | Жидкость, л | |
| 1,429 | 1 | 1,252 |
| 1,141 | 0,799 | 1 |
| 1 | 0,700 | 0,876 |
Определите плотность кислорода, находящегося в баллоне под давлением 1 мпа при температуре 300 к. — помощь студентам
| 🎓 Заказ №: 21916 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Физика |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 149 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие 37% решения:
Определите плотность кислорода, находящегося в баллоне под давлением 1 МПа при температуре 300 К.
Решение Запишем уравнение Менделеева-Клайперона (1) Где – давление газа; – газа; R – универсальная газовая постоянная, R =8,31 Дж/(моль⋅К); T – абсолютная (термодинамическая) температура газа; М – молярная масса газа; – масса газа. Разделим правую и левую часть уравнения (1) на : (2) Согласно определению плотность газа равна: (3)

Готовые задачи по физике которые сегодня купили:
- На расстоянии 20 см находятся два точечных заряда –40 нКл и 60 нКл.
- Какова должна быть первоначальная температура газа, чтобы при нагревании на 900 С средняя квадратичная скорость молекул газа увеличилась вдвое?
- Кинетическая энергия релятивистской частицы равна ее энергии покоя.
- При какой скорости кинетическая энергия любой элементарной частицы равна ее энергии покоя? с = 3∙108 м/с.
- Определите число молекул в единице объема воздуха на высоте h = 2 км над уровнем моря при температуре 10 С, если давление на уровне моря Р0 = 101 кПа.
- Определите скорость звука в воде, если колебания с периодом 0,005 с порождают звуковую волну длиной 7,125 м.
- Расстояние между стенками дьюаровского сосуда l = 10 мм.
- Электрическое поле создано двумя одинаковыми положительными зарядами 1 q и 2 q .
- Зная функцию распределения молекул по скоростям, определите среднюю арифметическую скорость молекул.
- Шарик массой 100 г, подвешенный к пружине с коэффициентом жесткости k = 10 Н/м, совершает гармонические колебания, амплитуда которых А = 4∙ 10-2 м .
Определить плотность кислорода находится в баллоне под давлением 3 атмосферы при температуре 17 градусов
Определить плотность кислорода находится в баллоне под давлением 3 атмосферы при…
определить плотность кислорода находится в баллоне под давлением 3 атмосферы при температуре 17 градусов
Определить плотность кислорода находится в баллоне под… —
Из уравнения состояния идеального газа концентрация равна n = p / kT
k — постоянная Больцмана л = 1,38*10^-23 Дж/К
Т = 273,15 t = 273.15 17 = 290.15 K
Давление в 3 атм = 3 * 101325 Па = 303975 Па
Тогда n = 303975 / (1,38*10^-23 * 290.15) = 7,59*10^25 молекул.
Плотность кислорода при н.у. (О2) = 15,99•2/22,4 = 1,43 г/л.
Можно составить пропорцию: 6,022*10^23 — 1,43
7,59*10^25 — х
х = 7,59*10^25 * 1,43 / 6,022*10^23 = 180,3 г/л
Первый тип задач: нет изменения массы
 Определить давление кислорода в баллоне объемом V = 1 м3 при температуре t=27 °С. Масса кислорода m = 0,2 кг.
Определить давление кислорода в баллоне объемом V = 1 м3 при температуре t=27 °С. Масса кислорода m = 0,2 кг.
 Баллон емкостью V= 12 л содержит углекислый газ. Давление газа Р = 1 МПа, температура Т = 300 К. Определить массу газа.
Баллон емкостью V= 12 л содержит углекислый газ. Давление газа Р = 1 МПа, температура Т = 300 К. Определить массу газа.
 При температуре Т = 309 К и давлении Р = 0,7 МПа плотность газа ρ = 12 кг/м3. Определить молярную массу газа.
При температуре Т = 309 К и давлении Р = 0,7 МПа плотность газа ρ = 12 кг/м3. Определить молярную массу газа.
 Какова плотность водорода при нормальном атмосферном давлении и температуре 20°С.
Какова плотность водорода при нормальном атмосферном давлении и температуре 20°С.
 До какой температуры Т1 надо нагреть кислород, чтобы его плотность стала равна плотности водорода при том же давлении ,но при температуре Т2 = 200 К?
До какой температуры Т1 надо нагреть кислород, чтобы его плотность стала равна плотности водорода при том же давлении ,но при температуре Т2 = 200 К?
 В сосуде объемом 4·10-3 м3 находится 0,012 кг газа при температуре 177°С. При какой температуре плотность этого газа будет равна 6·10-6 кг /см3, если давление газа остается неизменным.
В сосуде объемом 4·10-3 м3 находится 0,012 кг газа при температуре 177°С. При какой температуре плотность этого газа будет равна 6·10-6 кг /см3, если давление газа остается неизменным.
Смесь газов
 В баллоне объемом 25 литров находится 20 г азота и 2 г гелия при 301К. Найдите давление в баллоне.
В баллоне объемом 25 литров находится 20 г азота и 2 г гелия при 301К. Найдите давление в баллоне.
 Определить плотность смеси, состоящей из 4 граммов водорода и 32 граммов кислорода при давлении 7°С и давлении 93кПа?
Определить плотность смеси, состоящей из 4 граммов водорода и 32 граммов кислорода при давлении 7°С и давлении 93кПа?
 Сосуд емкостью 2V разделен пополам полупроницаемой перегородкой. В одной половине находится водород массой mВ и азот массой mА. В другой половине вакуум. Во время процесса поддерживается постоянная температура Т. Через перегородку может диффундировать только водород. Какое давление установиться в обеих частях сосуда?
Сосуд емкостью 2V разделен пополам полупроницаемой перегородкой. В одной половине находится водород массой mВ и азот массой mА. В другой половине вакуум. Во время процесса поддерживается постоянная температура Т. Через перегородку может диффундировать только водород. Какое давление установиться в обеих частях сосуда?
 Вакуумированный сосуд разделен перегородками на три равных отсека, каждый объемом V. В средний отсек ввели одинаковые массы кислорода, азота и водорода. В результате чего давление в этом отсеке стало равно Р. Перегородка I проницаема только для молекул водорода, перегородка II проницаема для молекул всех газов. Найти давления Р1 Р2 и Р3, установившиеся в каждом отсеке, если температура газа поддерживается постоянной и равной Т.
Вакуумированный сосуд разделен перегородками на три равных отсека, каждый объемом V. В средний отсек ввели одинаковые массы кислорода, азота и водорода. В результате чего давление в этом отсеке стало равно Р. Перегородка I проницаема только для молекул водорода, перегородка II проницаема для молекул всех газов. Найти давления Р1 Р2 и Р3, установившиеся в каждом отсеке, если температура газа поддерживается постоянной и равной Т.
С химическими реакциями
 В сосуде находится смесь азота и водорода. При температуре Т, когда азот полностью диссоциирован на атомы, давление равно Р (диссоциацией водорода можно пренебречь). При температуре 2Т, когда оба газа полностью диссоциированы, давление в сосуде 3Р. Каково отношение масс азота и водорода в смеси?
В сосуде находится смесь азота и водорода. При температуре Т, когда азот полностью диссоциирован на атомы, давление равно Р (диссоциацией водорода можно пренебречь). При температуре 2Т, когда оба газа полностью диссоциированы, давление в сосуде 3Р. Каково отношение масс азота и водорода в смеси?
 В герметично закрытом сосуде находится 1 моль неона и 2 моля водорода. При температуре Т1=300К, когда весь водород молекулярный, атмосферное давление в сосуде Р1=105 Па. При температуре Т2=3000К давление возросло до Р2=1,5∙105 Па. Какая часть молекул водорода диссоциировала на атомы?
В герметично закрытом сосуде находится 1 моль неона и 2 моля водорода. При температуре Т1=300К, когда весь водород молекулярный, атмосферное давление в сосуде Р1=105 Па. При температуре Т2=3000К давление возросло до Р2=1,5∙105 Па. Какая часть молекул водорода диссоциировала на атомы?
 В закрытом баллоне находится смесь из m1= 0,50 г водорода и m2 = 8,0 г кислорода при давлении Р1= 2,35∙105 Па. Между газами происходит реакция с образованием водяного пара. Какое давление Р установится в баллоне после охлаждения до первоначальной температуры? Конденсации пара не происходит.
В закрытом баллоне находится смесь из m1= 0,50 г водорода и m2 = 8,0 г кислорода при давлении Р1= 2,35∙105 Па. Между газами происходит реакция с образованием водяного пара. Какое давление Р установится в баллоне после охлаждения до первоначальной температуры? Конденсации пара не происходит.
§
 На дне сосуда, заполненного воздухом, лежит шарик радиусом r и массой m. До какого давления надо сжать воздух в сосуде, чтобы шарик поднялся вверх. Температура воздуха Т известна.
На дне сосуда, заполненного воздухом, лежит шарик радиусом r и массой m. До какого давления надо сжать воздух в сосуде, чтобы шарик поднялся вверх. Температура воздуха Т известна.
 Тонкостенный резиновый шар массой 50г наполнен азотом и погружен в озеро на глубину 100 м. Найти массу азота, если шар находится в положении равновесия. Атмосферное давление 760мм. рт. ст. Температура воды в озере на глубине 100м равна 4°С.
Тонкостенный резиновый шар массой 50г наполнен азотом и погружен в озеро на глубину 100 м. Найти массу азота, если шар находится в положении равновесия. Атмосферное давление 760мм. рт. ст. Температура воды в озере на глубине 100м равна 4°С.

Надувной шарик, заполненный гелием, удерживают на нити. Найдите натяжение нити, если масса оболочки шарика 2г, объем 3литра, давление гелия 105 Па, температура 27°С. Плотность воздуха 1,3 кг/м3
| mоб=2г Р=105Па t=27°С μгел=0,004кг/моль Vшара=3л μвоз=0,029 кг/моль | 0,002кг Т=300К 0,003м3 | Запишем второй закон Ньютона в проекции на вертикальную ось х. 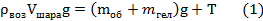 | |
| Т-? | |||
Объем шара равен объему гелия в нем, а значит 3литра; Запишем уравнение Менделеева-Клапейрона для воздуха (среда, в которой находится шар), и введем в него плотность воздуха: Тогда уравнение (1) принимает вид: 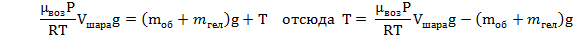 Теперь надо записать уравнение Менделеева-Клапейрона для гелия и выразить из него массу гелия. Надо учесть, что объем азота равен объему шара. А так же температура окружающего воздуха и температура гелия равны, как равны и давления воздуха и гелия. Теперь надо записать уравнение Менделеева-Клапейрона для гелия и выразить из него массу гелия. Надо учесть, что объем азота равен объему шара. А так же температура окружающего воздуха и температура гелия равны, как равны и давления воздуха и гелия.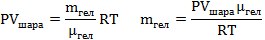 С учетом определенной массы гелия, сила натяжения равна: 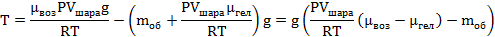  |
 В вертикально расположенном цилиндре находится кислород массой m= 64 г, отделенный от атмосферы поршнем, который соединен с дном цилиндра пружиной жесткостью k = 830 H/м. При температуре T1= 300 К поршень располагается на расстоянии h = 1 м от дна цилиндра. До какой температуры T2 надо нагреть кислород, чтобы поршень расположился на высоте H = 1,5м от дна цилиндра? Универсальная газовая постоянная R= 8,31 Дж/(моль∙ К), молярная масса кислорода μ = 32 г/моль.
В вертикально расположенном цилиндре находится кислород массой m= 64 г, отделенный от атмосферы поршнем, который соединен с дном цилиндра пружиной жесткостью k = 830 H/м. При температуре T1= 300 К поршень располагается на расстоянии h = 1 м от дна цилиндра. До какой температуры T2 надо нагреть кислород, чтобы поршень расположился на высоте H = 1,5м от дна цилиндра? Универсальная газовая постоянная R= 8,31 Дж/(моль∙ К), молярная масса кислорода μ = 32 г/моль.
§
 Температуру воздуха в комнате подняли с t1 = 7 °С до t2 = 27 °С. Какая масса воздуха должна выйти из комнаты, чтобы давление осталось неизменным, Р = 105 Па? Объем воздуха в комнате V = 50 м3.
Температуру воздуха в комнате подняли с t1 = 7 °С до t2 = 27 °С. Какая масса воздуха должна выйти из комнаты, чтобы давление осталось неизменным, Р = 105 Па? Объем воздуха в комнате V = 50 м3.
 Стеклянная колба закрыта пробкой и взвешена при температуре t1 = 15 °С. Открыв пробку, колбу нагрели до температуры t2 = 80 °С. При следующем взвешивании масса колбы оказалась на m = 0,25 г меньше. Чему равен объем колбы?
Стеклянная колба закрыта пробкой и взвешена при температуре t1 = 15 °С. Открыв пробку, колбу нагрели до температуры t2 = 80 °С. При следующем взвешивании масса колбы оказалась на m = 0,25 г меньше. Чему равен объем колбы?
| μ = 0,029кг/моль t1 = 15°C t2 = 80°C Р =105 Па ∆m=0,25 г | Т1=288К Т2=353К 0,25∙10-3кг | Масса стеклянной колбы не меняется, меняется масса газа в ней, так как есть утечка: при нагревании все тела расширяются, а колба не герметична, следовательно, масса воздуха в ней при нагревании уменьшается, но при этом, понятно, что объем газа не меняется и остается равным объему колбы. Будем считать, что атмосферное давление нормальное. Для каждого состояния газа запишем уравнение Менделеева-Клапейрона, и определим из них массу воздуха в колбе при разной температуре.  |
| V -? | 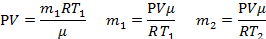 | |
 Выразим отсюда объем колбы: 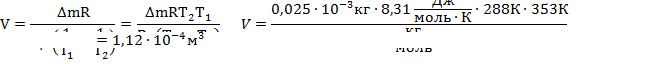 |
 В баллоне емкостью V = 12 л находится азот массой m1 = 1,5 кг при температуре t1 = 37°С. Каким станет давление в баллоне при температуре t2 =50 °С, если выпустить 35% азота? Первоначальное давление считать нормальным.
В баллоне емкостью V = 12 л находится азот массой m1 = 1,5 кг при температуре t1 = 37°С. Каким станет давление в баллоне при температуре t2 =50 °С, если выпустить 35% азота? Первоначальное давление считать нормальным.
 В сосуде объемом V = 1 л находится идеальный газ. В сосуде объемом V = 1 л находится идеальный газ. Сколько молекул газа нужно выпустить из сосуда, чтобы при понижении температуры в k=2 раза его давление уменьшилось в z =4 раза?
В сосуде объемом V = 1 л находится идеальный газ. В сосуде объемом V = 1 л находится идеальный газ. Сколько молекул газа нужно выпустить из сосуда, чтобы при понижении температуры в k=2 раза его давление уменьшилось в z =4 раза?
 Когда из сосуда выпустили некоторое количество газа, давление в нем упало на 40%, а абсолютная температура на 20%. Какую часть газа выпустили?
Когда из сосуда выпустили некоторое количество газа, давление в нем упало на 40%, а абсолютная температура на 20%. Какую часть газа выпустили?
 В сосуде объемом V = 0,5 л находится идеальный газ при давлении Р1=1 атм. и температуре t = 27 °С. Сколько молекул газа нужно выпустить из сосуда, чтобы давление в нем уменьшилось в 2 раза? Температура газа не изменяется.
В сосуде объемом V = 0,5 л находится идеальный газ при давлении Р1=1 атм. и температуре t = 27 °С. Сколько молекул газа нужно выпустить из сосуда, чтобы давление в нем уменьшилось в 2 раза? Температура газа не изменяется.
 В пустой сосуд объемом V нагнетают воздух при помощи поршневого насоса, объем цилиндра которого V0. Каким будет давление воздуха в сосуде после N качаний?
В пустой сосуд объемом V нагнетают воздух при помощи поршневого насоса, объем цилиндра которого V0. Каким будет давление воздуха в сосуде после N качаний?
| V N V0 | Задачи про насосы решаются так же на основе уравнения Менделеева-Клапейрона. Надо записать уравнение для накаченной массы, то есть той, что поступила в сосуд. И так же записать уравнение Менделеева-Клапейрона для газа, поступающего в рабочий резервуар насоса. И учесть, что вся масса газа, попавшая в сосуд – это масса газа, попадавшая в резервуар насоса N раз. Будем считать, что в насос газ поступает при атмосферном давлении |
| Р-? | |
Запишем уравнение Менделеева-Клапейрона для газа, поступившего в цилиндр насоса: 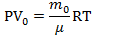 Запишем уравнение Менделеева-Клапейрона для газа, поступившего в сосуд: 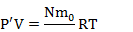 Поделим второе уравнение на первое: 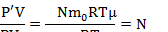 |
 Компрессор засасывает из атмосферы каждую секунду 3 литра воздуха, которые подаются в баллон емкостью 45 литров. Через сколько времени давление в баллоне будет превышать атмосферное в 9 раз? Начальное давление в баллоне равно атмосферному.
Компрессор засасывает из атмосферы каждую секунду 3 литра воздуха, которые подаются в баллон емкостью 45 литров. Через сколько времени давление в баллоне будет превышать атмосферное в 9 раз? Начальное давление в баллоне равно атмосферному.
§
 На диаграмме РT изображен цикл идеального газа постоянной массы. Изобразите его на диаграмме Р,V.
На диаграмме РT изображен цикл идеального газа постоянной массы. Изобразите его на диаграмме Р,V.
 Для постоянной массы идеального газа представлен цикл на диаграмме РV. Изобразить этот цикл на диаграмме VT.
Для постоянной массы идеального газа представлен цикл на диаграмме РV. Изобразить этот цикл на диаграмме VT.
 Изобразите на диаграмме РТ цикл постоянной массы идеального газа, представленный на диаграмме РV.
Изобразите на диаграмме РТ цикл постоянной массы идеального газа, представленный на диаграмме РV.
 Какая из двух линий графика соответствует большему давлению данной массы идеального газа?
Какая из двух линий графика соответствует большему давлению данной массы идеального газа?

Прежде всего установим, что это за линии. Эти линии выражают прямо пропорциональную зависимость между объемом газа и его температурой, а это возможно для идеального газа только при изобарическом процессе, следовательно, изображенные линии графика – изобары.
Проведем изотерму до пересечения с обеими изобарами, а точки их пересечения спроецируем на ось ординат (объемов). Из построения видно, что V2 > V1. Поскольку при изотермическом процессе газ подчиняется закону Бойля–Мариотта: Р1V1 = Р2V2, то Р1 > Р2.
 При нагревании идеального газа постоянной массы получена зависимость Р(T) при переходе из состояния 1 в состояние 2. Как при этом переходе менялась плотность газа?
При нагревании идеального газа постоянной массы получена зависимость Р(T) при переходе из состояния 1 в состояние 2. Как при этом переходе менялась плотность газа?

Прежде всего обратим внимание на то, что линия графика не описывается ни одним из изопроцессов («неявная форма»). Проведем через начальную и конечную точки линии графика две изохоры. Проведя еще изобару (или, как вариант, изотерму) и, спроецировав точки ее пересечения с изохорами на ось Т, убедимся, что Т2 > Т1.
При изобарическом процессе, по закону Гей-Люссака, V ~ T, следовательно, V2 > V1. А так как плотность и объем связаны обратной зависимостью (при данной массе), то ρ1 > ρ2, откуда следует, что газ расширялся, а значит, его плотность уменьшилась.
 Как менялась температура постоянной идеального массы газа на протяжении цикла?
Как менялась температура постоянной идеального массы газа на протяжении цикла?
 Идеальный газ с молярной массой М участвует в изотермическом процессе. При этом получена зависимость между объемом V и давлением р. Представьте этот цикл на диаграмме V, m.
Идеальный газ с молярной массой М участвует в изотермическом процессе. При этом получена зависимость между объемом V и давлением р. Представьте этот цикл на диаграмме V, m.
§
При решении аналитических задач на газовые законы надо:
1.Убедиться, что при изменении состояния масса газа остается постоянной.
2.Сделать схематический чертеж, на котором условно отметить состояния газа параметрами Р, V, Т. Записать закон Клапейрона для данных двух состояний.
3.Если какой-либо параметр при переходе газа из одного состояния в другое остается неизменным (могут меняться все три параметра), то уравнение Клапейрона перевести в закон Бойля — Мариотта, Гей-Люссака или Шарля.
4.В случае, когда газ заключен в цилиндрический сосуд и объем газа меняется только за счет изменения высоты его столба h, уравнение Клапейрона можно сразу записывать в виде: 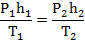
5.Используя условия задачи, определить термодинамические параметры, выразив их через заданные величины. И если газ граничит с жидкостью, то особое внимание следует обратить на определение давления. Для его определения тех случаях, когда газ производит давление на жидкость, следует использовать закон Паскаля: провести нулевой уровень через границу, отделяющую газ от жидкости, и записать уравнение равновесия жидкости.
6.Полученную систему уравнений решить относительно неизвестной величины.
P.S.
§ Если в задаче рассматривают состояния нескольких газов, отделенных друг от друга поршнями или входящих в состав смеси, то все указанные действия нужно проделать для каждого газа отдельно.
§ В задачах на газовые законы используется только абсолютная температура.
 При увеличении абсолютной температуры газа в 2 раза давление увеличилось на 25%. во сколько раз изменился объем газа?
При увеличении абсолютной температуры газа в 2 раза давление увеличилось на 25%. во сколько раз изменился объем газа?
 Газ изотермически сжат от объема V1 = 8 л до объема V2 = 6 л. Давление при этом возросло на DР = 4∙103 Па. Определить первоначальное давление.
Газ изотермически сжат от объема V1 = 8 л до объема V2 = 6 л. Давление при этом возросло на DР = 4∙103 Па. Определить первоначальное давление.
Запишем уравнение Клапейрона и, так как процесс изотермический, переведем его в закон Бойля-Мариотта
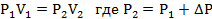
Поэтому можно записать:
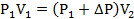
Отсюда находим первоначальное давление:
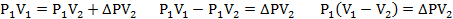
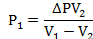
И объемы газов можно оставить в литрах, не переводить в систему СИ.
 При нагревании газа при постоянном давлении на 1К его объем увеличился на 5% от первоначального. При какой температуре находился газ?
При нагревании газа при постоянном давлении на 1К его объем увеличился на 5% от первоначального. При какой температуре находился газ?
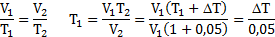
 Сколько ртути войдет в стеклянный баллончик объемом V0, нагретый до Т0, если плотность ртути при температуре Т равна ρ.
Сколько ртути войдет в стеклянный баллончик объемом V0, нагретый до Т0, если плотность ртути при температуре Т равна ρ.
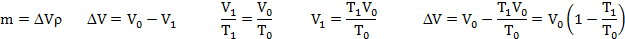
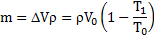
 Закрытый с обоих концов цилиндрический сосуд разделен на две равные части теплонепроницаемым поршнем. Длина каждой части 42см. В обеих половинках находится одинаковое количество азота при температуре 27°С и давлении 1 атмосфера. На сколько надо нагреть газ в одной части сосуда, чтобы поршень переместился на 2 см?
Закрытый с обоих концов цилиндрический сосуд разделен на две равные части теплонепроницаемым поршнем. Длина каждой части 42см. В обеих половинках находится одинаковое количество азота при температуре 27°С и давлении 1 атмосфера. На сколько надо нагреть газ в одной части сосуда, чтобы поршень переместился на 2 см?
Для газа в отделе I: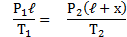
Для газа в отделе II: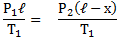
Отсюда следует:
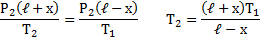
 Объем баллона, содержащего газ под давлением 1,2·105 Па составляет 6 литров. Каким станет давление газа, если этот баллон соединить с другим баллоном объем которого 10 литров и он практически не содержит газа.
Объем баллона, содержащего газ под давлением 1,2·105 Па составляет 6 литров. Каким станет давление газа, если этот баллон соединить с другим баллоном объем которого 10 литров и он практически не содержит газа.
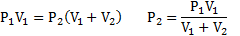
 Два одинаковых стеклянных шара соединены трубкой. При 0° С капелька ртути находится посередине трубки. Объем воздуха в каждом шаре и части трубки У= 200 см3 . На какое расстояние х сместится капелька, если один шар нагреть на 2° С, а другой на столько же охладить? Поперечное сечение трубки S=20 мм2
Два одинаковых стеклянных шара соединены трубкой. При 0° С капелька ртути находится посередине трубки. Объем воздуха в каждом шаре и части трубки У= 200 см3 . На какое расстояние х сместится капелька, если один шар нагреть на 2° С, а другой на столько же охладить? Поперечное сечение трубки S=20 мм2
Для газа в отделе I: 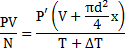

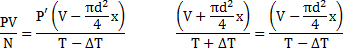
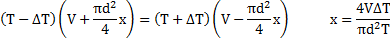
 Температура воздуха в цилиндре 7°С. На сколько переместиться поршень при нагревании воздуха на 20К, если ℓ1=14см?
Температура воздуха в цилиндре 7°С. На сколько переместиться поршень при нагревании воздуха на 20К, если ℓ1=14см?
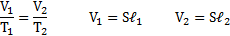
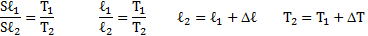
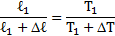

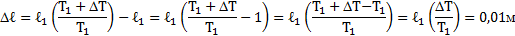
Газ граничит с жидкостью
 Электрическая лампа наполнена азотом при давлении Р= 600 мм рт. ст. Объем лампы V = 500 см3. Какая масса воды войдет в лампу, если у нее отломить кончик под водой? Атмосферное давление 760 мм рт. ст.?
Электрическая лампа наполнена азотом при давлении Р= 600 мм рт. ст. Объем лампы V = 500 см3. Какая масса воды войдет в лампу, если у нее отломить кончик под водой? Атмосферное давление 760 мм рт. ст.?
Объем воды, поступившей в сосуд равен изменению объема газа при изотермическом процессе. Вода будет заходить в колбу до тех пор, пока давление внутри колбы не станет равным давлению наружному, то есть атмосферному.
Запишем закон Бойля-Мариотта для газа в колбе:%
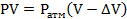
Отсюда определим изменение объема:
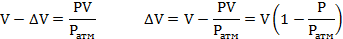
Масса поступившей воды равна:
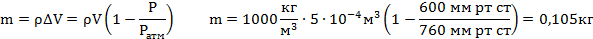
 Объем пузырька воздуха по мере всплывания со дна озера на поверхность увеличивается в 3 раза. Какова глубина озера?
Объем пузырька воздуха по мере всплывания со дна озера на поверхность увеличивается в 3 раза. Какова глубина озера?
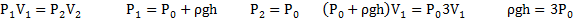
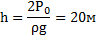
 Открытую стеклянную трубку длиной ℓ=1м наполовину погружают в ртуть.Затем трубку закрывают пальцем и вынимают из ртути. Какой длины столбик ртути останется в трубке? атмосферное давление нлормальное.
Открытую стеклянную трубку длиной ℓ=1м наполовину погружают в ртуть.Затем трубку закрывают пальцем и вынимают из ртути. Какой длины столбик ртути останется в трубке? атмосферное давление нлормальное.
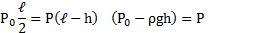
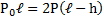
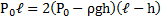
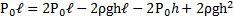
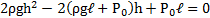
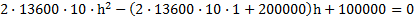
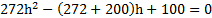
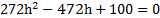
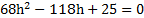
 Узкая вертикальная цилиндрическая трубка длиной L,закрытая с одного конца, содержит воздух, отделенный от наружного воздуха столбиком ртути длиной h. Плотность ртути ρ. Трубка расположена открытым концом вверх. Какова была длина ℓ столбика воздуха в трубке, если при перевертывании трубки открытым концом вниз, из трубки вылилось половина ртути. атмосферное давление Р0
Узкая вертикальная цилиндрическая трубка длиной L,закрытая с одного конца, содержит воздух, отделенный от наружного воздуха столбиком ртути длиной h. Плотность ртути ρ. Трубка расположена открытым концом вверх. Какова была длина ℓ столбика воздуха в трубке, если при перевертывании трубки открытым концом вниз, из трубки вылилось половина ртути. атмосферное давление Р0
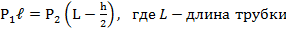

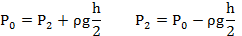
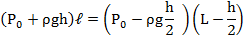
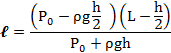
 В стеклянной трубке, запаянной с одного конца и расположенной горизонтально, находится столбик воздуха длиной 300мм, закрытый столбиком ртути длиной 200мм. На сколько изменится длина воздушного столбика, если трубку расположить открытым концом вверх? Атмосферное давление нормальное.
В стеклянной трубке, запаянной с одного конца и расположенной горизонтально, находится столбик воздуха длиной 300мм, закрытый столбиком ртути длиной 200мм. На сколько изменится длина воздушного столбика, если трубку расположить открытым концом вверх? Атмосферное давление нормальное.

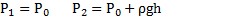
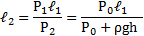
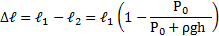
 Длинная пробирка открытым концом погружена в сосуд с ртутью. При температуре t1 = 47 °С уровни ртути в пробирке и в сосуде совпадают. Над уровнем ртути остается часть пробирки длины L = 76см. На какую высоту ℓ поднимется ртуть в пробирке, если ее охладить до температуры t2 = -33 °С? Атмосферное давление Р0 = 0,1 МПа.
Длинная пробирка открытым концом погружена в сосуд с ртутью. При температуре t1 = 47 °С уровни ртути в пробирке и в сосуде совпадают. Над уровнем ртути остается часть пробирки длины L = 76см. На какую высоту ℓ поднимется ртуть в пробирке, если ее охладить до температуры t2 = -33 °С? Атмосферное давление Р0 = 0,1 МПа.
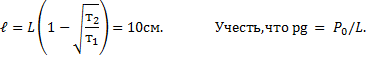
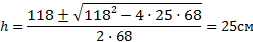
 Посередине откачанной и запаянной с обоих концов горизонтально расположенной трубки длины L = 1 м находится столбик ртути длины h = 20 см. Если трубку поставить вертикально, столбик ртути сместится на расстояние ℓ = 10 см. До какого давления Р была откачана трубка? Плотность ртути ρ= 13,6∙103 кг/м3.
Посередине откачанной и запаянной с обоих концов горизонтально расположенной трубки длины L = 1 м находится столбик ртути длины h = 20 см. Если трубку поставить вертикально, столбик ртути сместится на расстояние ℓ = 10 см. До какого давления Р была откачана трубка? Плотность ртути ρ= 13,6∙103 кг/м3.
В обоих концах трубки воздух первоначально занимал объем
V = S(L — h)/2,
где S — площадь поперечного сечения трубки, и имел давление Р.
Когда трубку поставили вертикально, объем воздуха в верхней части трубки стал
V1 = S[(L — h)/2 ℓ],
а давление стало Р1;
В нижней части трубки объем стал V2 = S[(L — h)/2 — ℓ], а давление стало равным Р2
Согласно закону Бойля-Мариотта для верхней части трубки PV = P1V2
Откуда (L — h) P =(L-h 2ℓ)P1;
Для нижней части трубки
PV = P2V2, откуда (L-h)P = (L-h-2ℓ)Р2.
С другой стороны, столбик ртути находится в равновесии, когда давление воздуха в нижней части трубки равно сумме давлений воздуха в верхней части трубки и столбика ртути, т.е.
P2=P1 ρgh
Исключив Р1 иР2 из уравнений, найдем = 50 кПа.
Применение кислорода
Помимо того, что все живые существам в природе, за исключением немногих микроорганизмов, при дыхании потребляют кислород, он широко применяется во многих отраслях промышленности: металлургической, химической, машиностроении, авиации, ракетостроении и даже в медицине.
В химической промышленности его применяет:
В металлургии его используют:
В медицинских целях больным, у которых нарушена нормальная деятельность органов дыхания или кровообращения, искусственно увеличивают содержание O2 в воздухе или дают дышать непродолжительное время чистым O2. Медицинский кислород, выпускаемый ГОСТ 5583, особенно тщательно очищают от всех примесей.
Применение кислорода в сварке
Сам по себе O2 является негорючим газом, но из-за свойства активно поддерживать горение и увеличения интенсивности (интенсификации) горения газов и жидкого топлива его используют в ракетных энергетических установках и во всех процессах газопламенной обработки.
В таких процессах газопламенной обработки, как газовая сварка, поверхностная закалка высокая температура пламени достигается путем сжигания горючих газов в O2, а при газовой резке благодаря ему происходит окисление и сгорание разрезаемого металла.
При полуавтоматической сварке (MIG/MAG) кислород O2 используют как компонент защитных газовых смесей с аргоном (Ar) или углекислым газом (CO2).
Кислород добавляют в аргон при полуавтоматической сварке легированных сталей для обеспечения устойчивости горения дуги и струйного переноса расплавленного металла в сварочную ванну. Дело в том, что как поверхностно активный элемент он уменьшает поверхностное натяжение жидкого металла, способствуя образованию на конце электрода более мелких капель.
При сварке низколегированных и низкоуглеродистых сталей полуавтоматом O2 добавляют в углекислый газ для обеспечения глубокого проплавления и хорошего формирования сварного шва, а также для уменьшения разбрызгивания.
Чаще всего кислород используют в газообразном виде, а в виде жидкости используют только при его хранении и транспортировке от завода-изготовителя до потребителей.
Расчет ацетилена в баллонах
Параметры и размеры баллонов для ацетилена можно посмотреть по ГОСТ 949-73 «Баллоны стальные малого и среднего для газов на Рр ≤ 19,7МПа». Наиболее популярными являются баллоны объемами 5, 10 и 40 литров. Корпус ацетиленового баллона отличается от корпуса кислородного баллона меньшим размером.
При давлении 1,0 МПа и температуре 20 °С в 40л баллоне вмещается 5 – 5,8 кг ацетилена по массе ( 4,6 – 5,3 м3 газа при температуре 20 °С и 760 мм.рт.ст.).
Приближенное количество ацетилена в баллоне (определяется взвешиванием) можно определить по формуле:
Va = 0,07 • Е • (Р – 0,1)
0,07– коэф., который учитывает количество ацетона в баллоне и растворимость ацетилена.
Е – водяной объем баллона в куб.дм;
Р – давление в баллоне, МПа (давлении 1,9 МПа (19,0 кгс/см2) при 20 °С по ГОСТ 5457-75 «Ацетилен растворенный и газообразный технический»);
0,1 – атмосферное давление в МПа;
Вес 1 м3 ацетилена при температуре 0°С и 760 мм.рт.ст. составляет – 1,17 кг.
Вес 1 куб.м ацетилена при температуре 20°С и 760 мм.рт.ст. составляет 1,09 кг.
Посчитаем объем ацетилена в баллоне объемом 40л с рабочим давлением 1,9МПа (19кгс/см2) при температуре 20°С:
Va = 0,07 • 40 • (1,9 – 0,1) = 5,04м3
Вес ацетилена в баллоне объемом 40л с рабочим давлением 1,9МПа (19кгс/см2) при температуре 20°С:
5,04 • 1,09 = 5,5кг
Вывод (для рассматриваемого случая): 1 баллон = 40л = 5,5кг = 5,04м3
Данный газ доступен у нас: ацетилен (C2H2)
Расчет двуокиси углерода (углекислота) в баллонах
Углекислота (по ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая») применяется как защитный газ для электросварочных работ. Состав смеси: СО2; Ar CO2 ; Ar CO2 O2. Еще производители могут маркировать ее как смесь MIX1 – MIX5.
Параметры и размеры баллонов для ацетилена можно посмотреть по ГОСТ 949-73 «Баллоны стальные малого и среднего для газов на Рр ≤ 19,7МПа». Наиболее популярными являются баллоны объемами 5, 10 и 40 литров.
При рабочем давлении углекислоты в баллоне 14,7 МПа (150 кгс/см2) коэффициент заполнения: 0,60 кг/л; при 9,8 МПа (100 кгс/см2) – 0,29 кг/л; при 12,25 МПа (125кгс/см2) – 0,47 кг/л.
Объемный вес углекислоты в газообразном состоянии равен 1.98 кг/м³, при нормальных условиях.
Посчитаем вес углекислоты в самом распространенном баллоне в строительстве: объемом 40л с рабочим давлением 14,7 МПа (150 кгс/см2).
40л • 0,6 = 24кг
Посчитаем объем углекислоты в газообразном состоянии:
24кг / 1,98 кг / м3 = 12,12м3
Вывод (для рассматриваемого случая): 1 баллон = 40л = 24кг = 12,12м3
Данный газ доступен у нас: двуокись углерода (углекислота)
Расчет кислорода в баллонах
Параметры и размеры кислородных баллонов можно посмотреть по ГОСТ 949-73 «Баллоны стальные малого и среднего для газов на Рр ≤ 19,7МПа». Наиболее популярными являются баллоны объемами 5, 10 и 40 литров.
По ГОСТ 5583-78 «Кислород газообразный технический и медицинский» (приложение 2), объем газообразного кислорода в баллоне (V) в кубических метрах при нормальных условиях вычисляют по формуле:
V = K1•Vб,
Vб — вместимость баллона, дм3;
K1 — коэффициент для определения объема кислорода в баллоне при нормальных условиях, вычисляемый по формуле
К1 = (0,968Р 1) * *
Р — давление газа в баллоне, измеренное манометром, кгс/см2;
0,968 — коэффициент для пересчета технических атмосфер (кгс/см2) в физические;
t — температура газа в баллоне, °С;
Z — коэффициент сжигаемости кислорода при температуре t.
Значения коэффициента К1 приведены в таблице 4, ГОСТ 5583-78.
Посчитаем объем кислорода в самом распространенном баллоне в строительстве: объемом 40л с рабочим давлением 14,7МПа (150кгс/см2). Коэффициент К1 определяем по таблице 4, ГОСТ 5583-78 при температуре 15°С:
V = 0,159 • 40 = 6,36м3
Вывод (для рассматриваемого случая): 1 баллон кислорода = 40л = 6,36м3
Таблица 4. ГОСТ 5583-78.
Температура газа в баллоне, °С | Значение коэффициента Ki при избыточном давлении, МПа (кгс/см2) | ||||||||||||||
| 13,7 (140) | 14,2 (145) | 14,7 (150) | 15,2 (155) | 15,7 (160) | 16,2 (165) | 16,7 (170) | 17,2 (175) | 17,7 (180) | 18,1 (185) | 18,6 (190) | 19,1 (195) | 19,6 (200) | 20,1 (205) | 20,6 (210) | |
| -50 | 0,232 | 0,242 | 0,251 | 0,260 | 0,269 | 0,278 | 0,286 | 0,296 | 0,303 | 0,311 | 0,319 | 0,327 | 0,335 | 0,342 | 0,349 |
| -40 | 0,212 | 0,221 | 0,229 | 0,236 | 0,245 | 0,253 | 0,260 | 0,269 | 0,275 | 0,284 | 0,290 | 0,298 | 0,305 | 0,312 | 0,319 |
| -35 | 0,203 | 0,211 | 0,219 | 0,226 | 0,234 | 0,242 | 0,249 | 0,257 | 0,264 | 0,272 | 0,278 | 0,286 | 0,293 | 0,299 | 0,306 |
| -30 | 0,195 | 0,202 | 0,211 | 0,217 | 0,225 | 0,232 | 0,239 | 0,248 | 0,253 | 0,261 | 0,267 | 0,274 | 0,281 | 0,288 | 0,294 |
| -25 | 0,188 | 0,195 | 0,202 | 0,209 | 0,217 | 0,223 | 0,230 | 0,238 | 0,243 | 0,251 | 0,257 | 0,264 | 0,270 | 0,277 | 0,283 |
| -20 | 0,182 | 0,188 | 0,195 | 0,202 | 0,209 | 0,215 | 0,222 | 0,229 | 0,235 | 0,242 | 0,248 | 0,255 | 0,261 | 0,267 | 0,273 |
| -15 | 0,176 | 0,182 | 0,189 | 0,196 | 0,202 | 0,208 | 0,215 | 0,221 | 0,227 | 0,234 | 0,240 | 0,246 | 0,252 | 0,258 | 0,263 |
| -10 | 0,171 | 0,177 | 0,183 | 0,189 | 0,195 | 0,202 | 0,208 | 0,214 | 0,220 | 0,226 | 0,232 | 0,238 | 0,244 | 0,250 | 0,255 |
| -5 | 0,165 | 0,172 | 0,178 | 0,184 | 0,190 | 0,195 | 0,202 | 0,207 | 0,213 | 0,219 | 0,225 | 0,231 | 0,236 | 0,242 | 0,247 |
| 0 | 0,161 | 0,167 | 0,172 | 0,179 | 0,184 | 0,190 | 0,196 | 0,201 | 0,207 | 0,213 | 0,219 | 0,224 | 0,229 | 0,235 | 0,240 |
| 5 | 0,157 | 0,162 | 0,168 | 0,174 | 0,179 | 0,185 | 0,190 | 0,196 | 0,201 | 0,207 | 0,212 | 0,217 | 0,223 | 0,228 | 0,233 |
| 10 | 0,153 | 0,158 | 0,163 | 0,169 | 0,174 | 0,180 | 0,185 | 0,191 | 0,196 | 0,201 | 0,206 | 0,211 | 0,217 | 0,222 | 0,227 |
| 15 | 0,149 | 0,154 | 0,159 | 0,165 | 0,170 | 0,175 | 0,180 | 0,186 | 0,191 | 0,196 | 0,201 | 0,206 | 0,211 | 0,216 | 0,221 |
| 20 | 0,145 | 0,150 | 0,156 | 0,160 | 0,166 | 0,171 | 0,176 | 0,181 | 0,186 | 0,191 | 0,196 | 0,201 | 0,206 | 0,211 | 0,215 |
| 25 | 0.142 | 0,147 | 0,152 | 0,157 | 0,162 | 0,167 | 0,172 | 0,177 | 0,182 | 0,186 | 0,191 | 0,196 | 0,201 | 0,206 | 0,210 |
| 30 | 0,139 | 0,143 | 0,148 | 0,153 | 0,158 | 0,163 | 0,168 | 0,173 | 0,177 | 0,182 | 0,187 | 0,192 | 0,196 | 0,201 | 0,206 |
| 35 | 0,136 | 0,140 | 0,145 | 0,150 | 0,154 | 0,159 | 0,164 | 0,169 | 0,173 | 0,178 | 0,182 | 0,187 | 0,192 | 0,196 | 0,201 |
| 40 | 0,133 | 0,137 | 0,142 | 0,147 | 0,151 | 0,156 | 0,160 | 0,165 | 0,170 | 0,174 | 0,178 | 0,183 | 0,188 | 0,192 | 0,196 |
| 50 | 0,127 | 0,132 | 0,136 | 0,141 | 0,145 | 0,149 | 0,154 | 0,158 | 0,163 | 0,167 | 0,171 | 0,175 | 0,180 | 0,184 | 0,188 |
Расчет пропана-бутана в баллонах
Параметры и размеры кислородных баллонов для пропана, бутана и их смесей можно посмотреть по ГОСТ 15860-84. В настоящее время применяются четыре типа данных изделий, объемами 5, 12, 27 и 50 литров.
При нормальных атмосферных условиях и температуре 15°С плотность пропана в жидком состоянии составляет 510 кг/м3, а бутана 580 кг/м3. Пропана в газовом состоянии при атмосферном давлении и температуре 15°С равна 1,9 кг/м3, а бутана — 2,55 кг/м3. При нормальных атмосферных условиях и температуре 15°С из 1 кг жидкого бутана образуется 0,392 м3 газа, а из 1 кг пропана 0,526 м3.
Посчитаем вес пропанобутановой смеси в самом распространенном баллоне в строительстве: объемом 50 с максимальным давлением газа 1,6МПа. Доля пропана по ГОСТ 15860-84 должна быть не менее 60% (примечание 1 к табл.2):
50л = 50дм3 = 0,05м3;
0,05м3 • (510 • 0,6 580 •0,4) = 26,9кг
Но из-за ограничения давления газа 1,6МПа на стенки в баллон этого типа не заправляют более 21кг.
Посчитаем объем пропанобутановой смеси в газообразном состоянии:
21кг • (0,526 • 0,6 0,392 •0,4) = 9,93м3
Вывод (для рассматриваемого случая): 1 баллон = 50л = 21кг = 9,93м3
Данные газы доступны у нас: пропан C3H8
Способы получения кислорода
В основном кислород получают тремя способами:
Из атмосферного воздуха его получают методом глубокого охлаждения, как побочный продукт при получении азота.
Также O2 добывают путем пропускания электрического тока через воду (электролиз воды) с попутным получением водорода.
Химические способ получения малопроизводителен, а, следовательно, и неэкономичен, он не нашел широкого применения и используются в лабораторной практике.
Наверно многие помнят химический опыт, когда в колбе нагревают марганцовку (перманганат калия KMnO4), а потом выделяющийся в процессе нагрева газ собирают в другую колбу?
2KMnO4 = K2MnO4 MnO2 O2 ↑
Характеристики кислорода
Характеристики O2 представлены в таблицах ниже:
Хранение и транспортировка кислорода
Кислород газообразный технический и медицинский выпускают по ГОСТ 5583.
Хранят и транспортируют его в стальных баллонах ГОСТ 949 под давлением 15 МПа. Кислородные баллоны окрашены в синий цвет с надписью черными буквами «КИСЛОРОД».
Жидкий кислород выпускается по ГОСТ 6331. O2 находится в жидком состоянии только при получении, хранении и транспортировке. Для газовой сварки или газовой резки его необходимо снова превратить в газообразное состояние.

