- Щелочной гидролиз галогеналканов
- 1. Взаимодействие с раствором щелочей
- 2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 3. Взаимодействие с гидроксидом меди (II)
- Гидратация алкенов
- 1. Взаимодействие с галогеноводородами
- 2. Взаимодействие с аммиаком
- 3. Этерификация (образование сложных эфиров)
- 4. Взаимодействие с кислотами-гидроксидами
- Гидрирование карбонильных соединений
- Кумольный способ
- Реакции замещения группы ОН
- 1. Внутримолекулярная дегидратация
- 2. Межмолекулярная дегидратация
- Окисление алкенов холодным водным раствором перманганата калия
- Окисление спиртов
- 1. Окисление оксидом меди (II)
- 2. Окисление кислородом в присутствии катализатора
- 4. Горение спиртов
- Дегидрирование спиртов
- Промышленное получение метанола из «синтез-газа»
- Получение этанола спиртовым брожением глюкозы
- Гидролиз жиров – способ получения многоатомных спиртов
- I. реакции с участием гидроксильной группы (кислотные свойства)
- I. реакции с участием гидроксильной группы
- Ii. реакции, с участием бензольного кольца
- Iii. реакции замещения с участием бензольного ядра
- Iii. реакция окисления
- Iv. качественная реакция! — обнаружение фенола
- V. качественная реакция с хлоридом железа (iii)
- Vi. реакции окисления
- Водородные связи и физические свойства спиртов
- Классификация по строению углеводородного радикала
- Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
- Номенклатура спиртов
- Номенклатура фенолов
- По числу гидроксильных групп:
- Простейшие одноатомные фенолы
- Строение молекулы фенола
- Строение спиртов и фенолов
- Строение фенолов
- Структурная изомерия
- Физические свойства фенолов
- Химические свойства спиртов
Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
| Например, глицерин можно получить щелочным гидролизом 1,2,3-трихлорпропана: |
1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода. |
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотретьздесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
| Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди: |
Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
| Реакционная способность одноатомных спиртов в реакциях с галогеноводородами уменьшается в ряду: третичные > вторичные > первичные > CH3OH. |
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
| Например, этиленгликоль реагирует с бромоводородом: |
2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля: |
4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат: |
Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
Кумольный способ
Наряду с фенолом образуется имеющий важное практическое значение кетон — ацетон.
Фенол и ацетон разделяют путем ректификации (фракционной перегонки).
Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир: |
Окисление алкенов холодным водным раствором перманганата калия
Алкены реагируют с водным раствором перманганата калия без нагревания. При этом образуются двухатомные спирты (гликоли).
Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
| Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
Третичные спирты окисляются только в жестких условиях.
2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, при окислении пропанола-1 образуется пропаналь |
Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
| Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона |
Третичные спирты окисляются только в жестких условиях.
4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n 1ОН 3n/2O2 → nCO2 (n 1)H2O Q
| Например, уравнение сгорания метанола: |
2CH3OH 3O2 = 2CO2 4H2O
Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
| Например, при дегидрировании этанола образуется этаналь |
| Например, при дегидрировании этиленгликоля образуется диальдегид (глиоксаль) |
Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
CO 2H2 ⇄ CH3OH
Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Гидролиз жиров – способ получения многоатомных спиртов
Под действием кислоты жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
| Например: при гидролизе тристеарата глицерина образуется глицерин и стеариновая кислота |
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
| Например: при щелочном гидролизе тристеарата глицерина образуется глицерин и соль стеариновой кислоты (стеарат) |
I. реакции с участием гидроксильной группы (кислотные свойства)
(реакция нейтрализации, отличие от спиртов)
Фенол — очень слабая кислота, поэтому феноляты разлагаются не только сильными кислотами, но даже такой слабой кислотой, как угольная:
I. реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Кислотные свойства
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:![]()
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2- , Br- )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
Ii. реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях ( М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол!):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: Реакции присоединения
Реакции присоединения
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
Iii. реакции замещения с участием бензольного ядра
Образование белого осадка трибромфенола иногда рассматривается как качественная реакция на фенол.
Iii. реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
Iv. качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Фенолы
V. качественная реакция с хлоридом железа (iii)
Одноатомные фенолы FeCl3 (р-р) → Сине-фиолетовая окраска, исчезающая при подкислении.
Многоатомные фенолы FeCl3 (р-р) → Окраска различных оттенков.
Vi. реакции окисления
При окислении фенола кислородом воздуха образуется гидрохинон

Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярныеводородные связи.Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола 64,5оС). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Классификация по строению углеводородного радикала
- Предельные спирты – группа ОН соединена с предельным радикалом. Например, пропанол-1: СН3–СН2–СН2–ОН.
- Непредельные спирты – группа ОН соединена с непредельным радикалом. Например, алкенолы: СН2=СН–СН2–ОН.
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.
- Ароматические спирты – содержат в радикале ароматическое кольцо, не связанное непосредственно с группой ОН. Например, бензиловый спирт.
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
- Первичные спирты – группа ОН соединена с первичным атомом углерода. Например, этанол СН3–СН2–ОН.
- Вторичные спирты – группа ОН соединена с вторичным атомом углерода. Например, пропанол-2: СН3–СН(СН3)–ОН.
- Третичные спирты – группа ОН соединена с третичным атомом углерода. Например, 2-метилпропанол-2: (СН3)3С–ОН.
- Метанол не относится ни к первичным, ни к вторичным, ни к третичным спиртам.
Номенклатура спиртов
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-ОЛ» и цифру, указывающую номер атома углерода, к которому присоединена гидроксильная группа.
Нумерация ведется от ближайшего к ОН-группе конца цепи.
- По радикально-функциональной номенклатуре названия спиртов составляют от названий углеводородных радикалов, соединенных с группой ОН, с добавлением слова «спирт».
Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
- В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол при наличии трех ОН-групп и т.д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
Например, пропандиол-1,2 (пропиленгликоль):
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие
номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования,
нитрования протекают в орто- и пара-положениях.
По числу гидроксильных групп:
- одноатомные спирты — содержат одну группу -ОН. Общая формула CnH2n 1OH или CnH2n 2O.
- двухатомные — содержат две группы ОН. Общая формула CnH2n(OH)2 или CnH2n 2O2.
- трехатомные спирты — содержат три группы ОН. Общая формула CnH2n-1(OH)3 или CnH2n 2O3.
Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы, от них легко отрывается вода и образуется карбонильное соединение.
Простейшие одноатомные фенолы

С6Н5ОН — фенол (гидроксибензол), тривиальное название — карболовая кислота.
Строение молекулы фенола
В молекуле фенола гидроксил непосредственно связан с атомом углерода бензольного ароматического ядра.
Вспомним строение групп атомов, образующих молекулу фенола.
Ароматическое кольцо состоит из шести атомов углерода, образующих правильный шестиугольник, вследствие sр2-гибридизации электронных орбиталей шести атомов углерода. Эти атомы связаны σ-связями. Не участвующие в образовании σ-связей р-электроны каждого атома углерода, перекрывающиеся по разные стороны плоскости σ-связей, образуют две части единого шестиэлектронного π-облака, охватывающего всё бензольное кольцо (ароматическое ядро).
Ковалентная связь между атомами кислорода и водорода гидроксильного радикала сильно полярна. Общее электронное облако связи О—H смещено в сторону атома кислорода. В результате на атоме кислорода возникает частичный отрицательный заряд, а на атоме водорода — частичный положительный заряд. Кроме того, атом кислорода в гидроксильной группе имеет две неподелённые, принадлежащие только ему электронные пары: 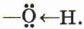
В молекуле фенола гидроксильный радикал взаимодействует с ароматическим ядром, при этом неподелённые электронные пары атома кислорода взаимодействуют с л-облаком бензольного кольца, образуя единую электронную систему. Такое взаимодействие неподелённых электронных пар и облаков π-связей называют, как вы знаете, р,π-сопряжением (см. с. 148).
В результате сопряжения неподелённой электронной пары атома кислорода гидроксигруппы с электронной системой бензольного кольца уменьшается электронная плотность на атоме кислорода. Это снижение компенсируется за счёт большей поляризации связи О—Н, что, в свою очередь, приводит к увеличению положительного заряда на атоме водорода.
Следовательно, водород гидроксильной группы в молекуле фенола имеет кислотный характер.
Сопряжение электронов бензольного кольца и гидроксильной группы сказывается не только на её свойствах, но и на реакционной способности бензольного кольца.
В самом деле, как вы помните, сопряжение неподелённых пар атома кислорода с π-облаком бензольного кольца приводит к перераспределению электронной плотности в нём (рис. 43, б). Она понижается у атома углерода, связанного с ОН-группой (сказывается влияние электронных пар атома кислорода), и повышается у соседних с ним атомов углерода, т. е.
в положениях 2 и 6, или орто-положениях. Очевидно, что повышение электронной плотности у этих атомов углерода бензольного кольца приводит к локализации (сосредоточению) отрицательного заряда на них. Под влиянием этого заряда происходит дальнейшее перераспределение электронной плотности в ароматическом ядре — смещение её от 3-го и 5-го атомов (мета-положение) к 4-му (орто-положение). Эти процессы можно выразить формулой.
Таким образом, наличие гидроксильного радикала в молекуле фенола приводит к изменению π-облака бензольного кольца, увеличению электронной плотности у 2, 4 и б-го атомов углерода (орто-, пара-положения) и уменьшению электронной плотности у 3-го и 5-го атомов углерода (мета-положения).
Локализация электронной плотности в орто- и пара-положениях делает их наиболее вероятными для атак электрофильных частиц при взаимодействии с другими веществами.
Следовательно, влияние радикалов, составляющих молекулу фенола, взаимно, и оно определяет его характерные свойства.
Продолжение >>>
Строение спиртов и фенолов
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp3-гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Строение фенолов
Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. В зависимости от этого свойства вещества, вероятно, будут существенно отличаться друг от друга из-за взаимного влияния групп атомов (вспомните одно из положений теории А. М. Бутлерова).
И действительно, органические соединения, содержащие ароматический радикал фенил С6Н5—, непосредственно связанный с гидроксильной группой, проявляют особые свойства, отличные от свойств спиртов. Такие соединения называют фенолами.
Так же как и спирты, фенолы классифицируют по атомности, т. е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу.
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы.
Существуют и другие многоатомные фенолы, содержащие три и более гидроксильные группы в бензольном кольце.
Познакомимся подробнее со строением и свойствами простейшего представителя этого класса — фенолом С6Н5ОН (рис. 42). Название этого вещества и легло в основу названия всего класса — фенолы.
Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
| Например. Формуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n 2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
Физические свойства фенолов
Твёрдое бесцветное кристаллическое вещество с резким характерным запахом, tпл = 43 °С, tкип = 181 °С. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Тривиальное название фенола — карболовая кислота. При попадании на кожу он вызывает ожоги, поэтому с фенолом необходимо обращаться осторожно.
Химические свойства спиртов
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ , на атоме углерода также частичный положительный заряд δ , а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |

