- Взаимодействие азота с металлами
- Взаимодействие азота с неметаллами
- Взаимодействие азота со сложными веществами
- Взаимодействие фосфора с металлами
- Взаимодействие фосфора со сложными веществами
- Оксид фосфора (iii), триоксид фосфора (p2o3)
- Оксид фосфора (v), пентаоксид фосфора, фосфорный ангидрид (р2о5)
- Онлайн урок: фосфор по предмету химия 8 класс |
- Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
- Соли фосфористой кислоты (фосфиты)
- Фосфиды
- Фосфин (ph3)
- Фосфор и его соединения
- Фосфорные кислоты
- Фосфорные удобрения
- Химические свойства азота
- Химические свойства фосфора
- Эксперимент по химии: горение фосфора в кислороде
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 оС и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Взаимодействие фосфора с металлами
Фосфор реагирует при нагревании с активными металлами и металлами средней активности образуя фосфиды:
Взаимодействие фосфора со сложными веществами
Фосфор окисляется кислотами окислителями, в частности, концентрированными азотной и серной кислотами:
Следует знать, что белый фосфор реагирует с водными растворами щелочей. Однако, ввиду специфичности умение записывать уравнения таких взаимодействий на ЕГЭ по химии пока еще не требовалось.
Оксид фосфора (iii), триоксид фосфора (p2o3)
Способы полученияоксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
4Р 3О2 = 2Р2О3
Физические свойстваоксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде
димеров Р4О6.
!Очень ядовит
Химические свойстваоксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Р2О3 ЗН2О =2H3PO3
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3вгорячей воде:
2Р2О3 6Н2О = РН3 ЗH3PO4
- При взаимодействии Р2О3 с щелочами образуются соли фосфористой кислоты:
Р2О3 4NaOH = 2Na2HPO3 Н2О
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Р2О3 О2 = Р2О5
Окисление галогенами:
Р2О3 2Cl2 5Н2О = 4HCl 2H3PO4
Оксид фосфора (v), пентаоксид фосфора, фосфорный ангидрид (р2о5)
Способы полученияфосфорного ангидрида
Сжигание фосфора в избытке воздуха:
4Р 5О2 = 2Р2О5
Физические свойствафосфорного ангидрида
При комнатной
температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде
димеров Р4О10.
Очень гигроскопична, при
соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и
водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойствафосфорного ангидрида
Р2О5проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
Р2О5 Н2О = 2HPO3 метафосфорная
Р2О5 2Н2О = Н4Р2О7 пирофосфориая
(дифосфорная)
Р2О5 ЗН2О = 2H3PO4 ортофосфорная
- с основными оксидами, с образованием фосфатов
Р2О5 ЗВаО = Ва3(PO4)2
- с щелочами, с образованием средних и кислых солей
Р2О5 6NaOH = 2Na3PO4 ЗН2О
Р2О5 4NaOH = 2Na2HPO4 Н2О
Р2О5 2NaOH = 2NaH2PO4 Н2О
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду. Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Р2О5 2HNО3 = 2HPO3 N2О5
Р2О5 2НСlО4 = 2HPO3 Сl2О7
P2O5 H2SO4 → 2HPO3 SO3
P2O5 2CH3COOH → 2HPO3 (CH3CO)2O
ВидеоопытВзаимодействие оксида фосфора с водой
Онлайн урок: фосфор по предмету химия 8 класс |
Соединения фосфора – обязательная составляющая растительных и животных организмов.
В растениях фосфор сосредоточен главным образом в семенах и плодах.
В организме человека и животных – в скелете, мышечной и нервной тканях.
Наверняка вы ни один раз слышали, что фосфор очень полезен для мозга. Это действительно так, он очень важен для правильного функционирования нервной ткани.
Твёрдость скелету придаёт фосфат кальция.
Поступивший с пищей фосфор попадает в кости уже через 4-6 ч.
В среднем тело человека содержит около 1,5 кг фосфора, из которых большинство приходится на кости.
Работа мозга и сокращение мышц также связаны с химическими превращениями соединений фосфора.
Источником фосфора является растительная пища.
Растения извлекают фосфор из почвы, а животные получают его с растительной пищей.
После отмирания растений и животных органические соединения, содержащие фосфор, под действием фосфоробактерий превращаются в фосфаты кальция и магния.
Так осуществляется круговорот фосфора в природе.
Этот круговорот нарушается при удалении соединений фосфора с урожаем сельскохозяйственных культур.
Недостаток фосфора практически не восполняется естественным путём, поэтому необходимо вносить в почву фосфорные удобрения.
Красный фосфор применяют в производстве спичек.
Как же устроена современная спичка?
Масса спичечной головки на 60% состоит из бертолетовой соли, а также из горючих веществ: серы или каких-нибудь сульфидов металлов.
Чтобы воспламенение головки происходило медленно и равномерно, без взрыва, к массе добавляют так называемые наполнители, например, стеклянный порошок.
Связующим материалом служит клей. А намазка шкурки?
Здесь основной компонент – красный фосфор.
К нему также добавляют толченое стекло и клей.
При трении происходит воспламенение:
Также фосфор идёт на получение ядохимикатов (дихлофос, хлорофос), дымовых снарядов.
Фосфорная кислота входит в состав синтетических моющих и чистящих средств, средств для растворения накипи, огнеупорных красок.
Из фосфатов получают специальные цементы, например, цинкофосфатный цемент применяют для пломбирования зубов.
Фосфорную кислоту также очень широко используют в качестве пищевой добавки.
Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы полученияфосфатов
Получают
кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства
ортофосфорной кислоты)
Физические свойствафосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO43- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO42- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4— | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойствафосфатов
- Имеют свойства, характерные для солей.
Na3РO4 Н2О = Na2HPO4 NaOH
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
NaH2PO4 = NaPO3 H2O
Na2HPO4 = Na4P2O7
H2O
(NH4)3PO4 = 3NH3 H2O
Соли фосфористой кислоты (фосфиты)
Способы полученияфосфитов
- Взаимодействие фосфористой кислоты с щелочами:
Н2[НРО3] NaOH = NaH[HРО3] Н2О
Н2[НРО3] 2NaOH = Na2[HРО3] 2Н2О
- взаимодействие фосфористой кислоты с металлами с выделением Н2
Н2[НРО3] Ca = Ca[HРО3] Н2
- взаимодействие фосфористой кислоты с оксидами металлов
Н2[НРО3] CaO = Ca[HРО3] Н2O
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
P4 8NaOH(конц) 4H2O = Na2[HРО3] 6H2
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
PCl3 5NaOH(разб) = Na2[HРО3] 3NaCl 2H2O
Физические свойствафосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо
растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты
плохо растворимы.
Химические свойствафосфитов
Имеют
химические свойства, характерные для солей
Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
2P 3Mg → Mg3P2
2P 3Ca → Ca3P2
P 3Na → Na3P
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия
фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойствафосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Ca3P2 6H2O → 3Са(ОН)2 2PH3↑
Mg3P2 6HCl → 3MgCl2 2PH3↑
Фосфин (ph3)
Способы полученияфосфина
Прямым синтезом PH3 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
Ca3P2 6H2O → 3Са(ОН)2 2PH3↑
Mg3P2 6HCl → 3MgCl2 2PH3↑
- Реакция диспропорционирования фосфора в щелочах:
4P 3KOH 3H2O → 3KH2PO2 PH3↑
- Разложение солей фосфония (Температура выше 80ºС):
P4I ↔ HI PH3↑
Физические свойствафосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.
PH3— Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами –
окислителями:
PH3 8H2SO4(конц) = H3PO4 8SO2↑ 3H2O
PH3 8HNO3(конц. гор) = H3PO4 8NO2↑ 4H2O
- С безводными кислотами образует соли:
HI PH3↑ = P4I
- Окисляется кислородом. При Т ~ 150ºС самовозгорается:
РН3 2О2 = P2O5 H2O (Н3РО4)
Практического значения фосфин не имеет.
Фосфор и его соединения
Видеоурок позволяет узнать о строении атома фосфора, его возможных степенях окисления в соединениях. В виде таблицы собран материал по аллотропным модификациям фосфора. Здесь рассматриваются физические и химические свойства не только фосфора, но и его соединений: фосфина, оксида фосфора (V), фосфорной кислоты. Кроме этого, приведены названия кислых солей фосфорной кислоты, качественная реакция на фосфат-ион в виде демонстрации, круговорот фосфора в природе, а также применение фосфора и его соединений.
Фосфор и его соединения
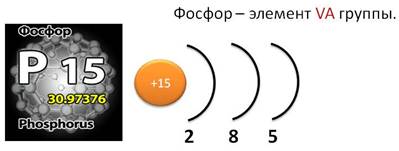
Фосфор,
как и азот – элемент V A
группы. Значит, на внешнем энергетическом уровне у него 5
электронов. Атом фосфора в соединениях может проявлять различные степени
окисления: от -3 до 5. Атомы фосфора по сравнению с атомами азота имеют
больший радиус, меньшее значение электроотрицательности. Фосфор чаще проявляет
в соединениях степень окисления 5.
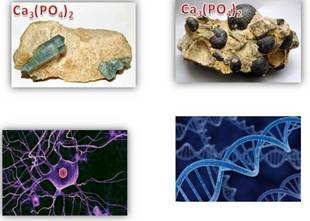
В природе
фосфор встречается только в виде соединений, важнейшими из которых являются
минералы фосфориты и апатиты, содержащие фосфат кальция – Ca3(PO4)2.
Часть
фосфора в организме человека распределена в мышечной, нервной и мозговой
тканях. В виде производной фосфорной кислоты фосфор входит в состав нуклеиновых
кислот – ДНК и РНК, осуществляющих передачу наследственных свойств
организма. Из фосфора, поступающего в организм человека с пищей, главным
образом с яйцами, мясом, молоком и хлебом, строится АТФ –
аденозинтрифосфорная кислота.
Фосфор
был открыт немецким алхимиком Брандом в 1669 году и
получил своё название за способность светиться в темноте (от
греческого фосфор – светоносный).


Химический
элемент фосфор образует несколько аллотропных модификаций, различающихся
между собой по строению, физическим свойствам и химической активности.
Белый
фосфор состоит из молекул P4,
имеющих форму тэтраэдра. Молекулярное строение этого вещества
обуславливает его легкоплавкость и летучесть. Этот фосфор не растворим в воде,
но хорошо растворим в сероуглероде. На воздухе легко окисляется, а в
порошкообразном состоянии даже воспламеняется.

Белый
фосфор очень ядовит. Он светится в темноте и его хранят под
водой.
Красный
фосфор имеет атомную структуру, в которой каждый атом
фосфора связан с тремя другими атомами ковалентными связями. При
нагревании красного фосфора в пробирке, закрытой ватным тампоном, он превращается
в белый фосфор.


Красный
фосфор – порошок тёмно-красного цвета, он неядовит, не растворяется ни в
каких растворителях, нелетуч и в химическом отношении менее активен, чем белый.
При
нагревании под давлением, белый фосфор переходит в чёрный, который имеет
атомную кристаллическую решетку. Чёрный фосфор по своим физическим свойствам похож
на металл: он проводит электрический ток и блестит. По внешнему виду он
похож на графит и жирен на ощупь.
При
взаимодействии с кислородом фосфор проявляет восстановительные
свойства, а в реакциях с металлами – окислительные. В
реакциях фосфора с металлами образуются соединения – фосфиды. Например,
в реакции с фосфором образуется фосфид кальция.
В
этой реакции кальций повышает свою степень окисления с 0 до 2, а фосфор
понижает с 0 до -3. Каждый атом кальция отдаёт по 6 электронов молекуле
фосфора. При этом кальция является восстановителем, а фосфор – окислителем.

Белый фосфор
самовоспламеняется на воздухе, а красный горит при поджигании. При этом
образуется оксид фосфора (V).

В
этой реакции фосфор повышает свою степень окисления с 0 до 5, а кислород
понижает с 0 до -2. Фосфор выступает в роли восстановителя, а кислород – в роли
окислителя.
С
водородом фосфор не реагирует, но его водородное соединение – фосфин
– PH3 можно получить из фосфидов действием на них кислот. Например,
при взаимодействии фосфида кальция с соляной кислотой образуется соль – хлорид
кальция и фосфин.

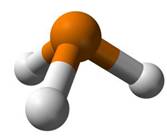
Фосфин
– это ядовитый газ с неприятным запахом. Он легко
воспламеняется на воздухе.
Появление
блуждающих огней на старых кладбищах и болотах вызвано воспламенением на
воздухе фосфина и других соединений фосфора с водородом. Эти газообразные
вещества образуются при разложении органических соединений, содержащих фосфор.
На воздухе продукты соединения фосфора с водородом самовоспламеняются с
образованием светящегося пламени и капелек фосфорной кислоты – продукта
взаимодействия оксида фосфора (V) с водой. Эти капельки создают размытый контур
«привидения».

Красный
фосфор используют для производства спичек, фосфорной
кислоты, которая идёт на производство фосфорных удобрений и кормовых добавок
для животных, его применяют для производства ядохимикатов.

Фосфор
образует оксид фосфора (V) и оксид фосфора (III), а также
кислородсодержащие кислоты, среди которых наиболее важное промышленное
применение находит фосфорная кислота.
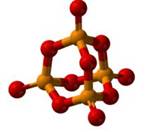
Оксид
фосфора (V) образуется при
сгорании фосфора в кислороде.
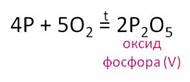
При недостатке
кислорода образуется оксид фосфора (III).
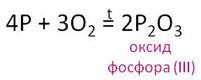
Оксид
фосфора (V)
представляет собой белый порошок, энергично поглощает пары воды из воздуха и
постепенно превращается в прозрачную расплывшуюся массу. Благодаря этому свойству
оксид фосфора (V) способен
отнимать воду и у других веществ. Поэтому он широко используется как осушитель.
Многие органические вещества обугливаются при действии на них этого оксида,
кроме того, при попадании на кожу он может вызвать сильные ожоги.
Оксид
фосфора (V) – типичный кислотный
оксид, он взаимодействует с основными оксидами и щелочами, образуя соли
фосфорной кислоты – фосфаты.
Так,
в реакции оксида фосфора (V)
с оксидом кальция образуется соль – фосфат кальция. В реакции оксида
фосфора (V) с гидроксидом
натрия образуется соль – фосфат натрия и вода.
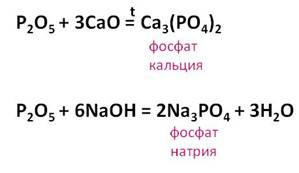
При
взаимодействии оксида фосфора (V)
с избытком воды образуется фосфорная кислота.

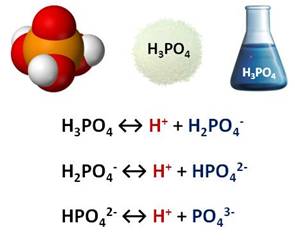
Фосфорная
кислота представляет собой твёрдое прозрачное
кристаллическое вещество, хорошо растворимое в воде в любых соотношениях. Это
слабая кислота, поэтому в водном растворе диссоциирует ступенчато: на
первой ступени образуется катион водорода и дигидрофосфат-ион, на второй
ступени опять образуется катион водорода и гидрофосфат-ион, а на третьей
ступени образуется катион водорода и фосфат-ион.
Фосфорная
кислота проявляет свойства, характерные для кислот. Она взаимодействует с
металлами, стоящими в ряду активности до водорода. Например, в реакции
фосфорной кислоты с цинком, образуется соль – дигидрофосфат цинка и выделяется
газ – водород.
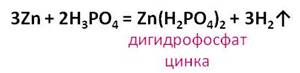
Фосфорная
кислота вступает во взаимодействие с основными оксидами. Так в реакции
оксида лития с фосфорной кислотой образуется соль – фосфат лития и вода.
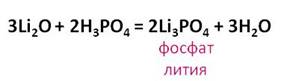
Фосфорная
кислота реагирует и с основаниями. В реакции гидроксида натрия с
фосфорной кислотой образуется соль – фосфат натрия и вода.
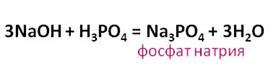
Фосфорная
кислота – трёхосновная кислота, поэтому она может образовывать кроме
средних солей кислые соли. Например, Ca3(PO4)2–
средняя соль, она называется фосфат кальция, CaHPO4
– кислая соль и называется гидрофосфат кальция, Ca(H2PO4)2
тоже кислая соль и называется дигидрофосфат кальция. Фосфаты всех металлов в воде
нерастворимы (исключение – фосфаты щелочных металлов), дигидрофосфаты всех
металлов хорошо растворимы, а гидрофосфаты занимают промежуточное положение.
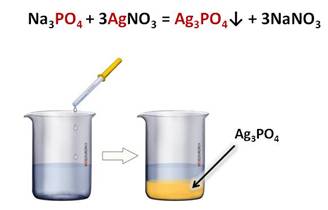
Качественной
реакцией на фосфат-ион является реакция с нитратом
серебра, при этом образуется фосфат серебра (I) – осадок жёлтого цвета и соль –
нитрат натрия.
В
природе постоянно происходит круговорот фосфора. Фосфор из почвы
извлекается растениями, а животные получают фосфор с растительной пищей. После
отмирания растительных и животных организмов фосфор снова переходит в почву.
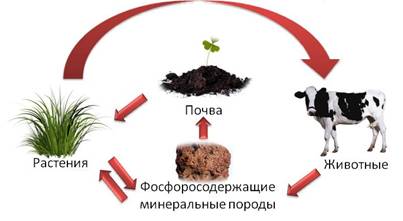
Фосфорная
кислота используется как катализатор в органическом синтезе,
для производства кормовых добавок, придании кисловатого вкуса безалкогольным
напиткам, осветления сахара. Но основная часть фосфорной кислоты расходуется на
производство фосфатов, использующихся в качестве минеральных удобрений. Фосфаты
применяются и в медицине, для пропитки тканей, древесины и пластмасс с целью
придания им огнестойкости, также при производстве стиральных порошков.

Таким
образом, фосфор является элементом V Aгруппы.
На внешнем энергетическом уровне у него 5 электронов, для него характерны
степени окисления от -3 до 5, но наиболее типична 5. В природе он встречается
в виде соединений – фосфоритов и апатитов. Фосфор образует несколько
аллотропных модификаций: белый, красный и чёрный фосфор. Наиболее
распространёнными соединениями фосфора являются – оксид фосфора (III), оксид
фосфора (V), фосфин и фосфорная кислота. В реакциях с металлами фосфор
проявляет окислительные свойства, а в реакции с кислородом – восстановительные.
Фосфорная кислота – трёхосновная кислота, которая образует три вида солей:
фосфаты, гидрофосфаты и дигидрофосфаты. Качественным реактивом на фосфат-ион
является нитрат серебра один, потому что в результате взаимодействия образуется
осадок жёлтого цвета. Фосфор и его соединения имею большое значение в
химической промышленности.
Фосфорные кислоты
Фосфор
образует только 2 устойчивых оксида, в которых он находится в степенях
окисления 5 и 3. Однако существует большое число кислот, в которых фосфор
имеет валентность равную V (пять ковалентных связей) и степени окисления 5,
4, 3, 1.
Строение
наиболее известных кислот выражается следующими формулами:
Наибольшее
практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая
(фосфористая) кислоты.
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
Химические свойства азота
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2. Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом.
Химические свойства фосфора
Существует несколько аллотропных модификаций фосфора., в частности белый фосфор, красный фосфор и черный фосфор.
Белый фосфор образован четырехатомными молекулами P4, не является устойчивой модификацией фосфора. Ядовит. При комнатной температуре мягкий и подобно воску легко режется ножом. На воздухе медленно окисляется, и из-за особенностей механизма такого окисления светится в темноте (явление хемилюминесценции). Даже при слабом нагревании возможно самопроизвольное воспламенение белого фосфора.
Из всех аллотропных модификаций белый фосфор наиболее активен.
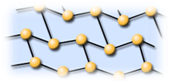
Красный фосфор состоит из длинных молекул переменного состава Pn. В некоторых источниках указывается то, что он имеет атомное строение, но корректнее все-таки считать его строение молекулярным. Вследствие особенностей строения является менее активным веществом по сравнению с белым фосфором, в частности в отличие от белого фосфора на воздухе окисляется значительно медленнее и для его воспламенения требуется поджиг.
Черный фосфор состоит из непрерывных цепей Pn и имеет слоистую структуру схожую со структурой графита, из-за чего и внешне похож на него. Данная аллотропная модификация имеет атомное строение. Самый устойчивый из всех аллотропных модификаций фосфора, наиболее химически пассивен. По этой причине, рассмотренные ниже химические свойства фосфора следует относить прежде всего к белому и красному фосфору.
Эксперимент по химии: горение фосфора в кислороде
На видео представлен процесс горения фосфора в кислороде – смотрите подробности в ролике.
Описание.