- Что такое воздух, его значение, свойства и химический состав?
- Благородные газы
- Воздух – друг человека
- Все тесты
- Где о кислороде говорится как о элементе, а где о простом веществе
- Загрязнение воздуха
- История открытия углекислого газа
- Кислород
- Польза воздуха для живых организмов
- Применение углекислого газа
- Применение углекислоты для сварки
- Смесь воздуха в разных климатических условиях
- Состав воздуха
- Сухой лед
- Углекислый газ в атмосфере
- Физические свойства воздуха:
- Химический состав воздуха:
- Хранение и транспортировка углекислого газа
Что такое воздух, его значение, свойства и химический состав?
Если кратко, то Воздух, это газовая смесь состоящая на 98-99% из азота и кислорода, образующая газовую оболочку вокруг планеты Земля, её ещё называют — Атмосфера Земли.
Масса воздуха всей атмосферы Земли составляет примерно 5.13х1015 тонн и оказывает давление на поверхность Земли на уровне моря равное в среднем около 1,0333 кг на 1 см2.
Объём атмосферы Земли подсчитать достаточно сложно. Можно было бы умножить площадь поверхности Земли 5,1×108 км2 на её высоту. Но что считать высотой? Известно, что на больших высотах воздух практически отсутствует, а его плотность плавно уменьшается с набором высоты.
Так, если на уровне моря плотность воздуха составляет 1,2250 кг/м³, то на высоте 10 км она составляет 0,4135 кг/м³, на высоте 100 км — 5,55⋅10−7кг/м³, а на высоте 1000 км — 3,56⋅10−15, но воздух присутствует и там. Если принять за высоту атмосферы высоту, на которой плотность воздуха уменьшается в 1000 раз по отношению к его плотности на уровне моря (это примерно 50 км), то в этом случае объём атмосферы составляет около 2,5×1010 км3.
Благородные газы
Благородные газы — это 6 элементов 8-й группы периодической таблицы. Они чрезвычайно инертны химически. Только они существуют в виде отдельных атомов, не образующих молекулы. Из-за их пассивности некоторыми из них наполняют лампы.
Ксенон практически не используется человеком, зато аргон накачивают в электролампочки, а криптоном наполняют люминесцентные лампы. Неон вспыхивает красно-оранжевым светом при прохождении электрического разряда. Он используется в натриевых уличных лампах и неоновых лампах.
Радон радиоактивен. Он образуется в результате распада металла радия. Никакие соединения гелия науке неизвестны, и гелий считается абсолютно инертным. Его плотность в 7 раз меньше плотности воздуха, поэтому им наполняют дирижабли. Наполненные гелием воздушные шары оснащаются научной аппаратурой и запускаются в верхние слои атмосферы.
Воздух – друг человека
В повседневной жизни люди часто используют изобретения, которые работают благодаря физическим свойствам атмосферного воздуха. Например, в древности его использовали в мореплавании: ветер надувал паруса и корабли могли двигаться в нужном направлении. С давних пор люди начали строить и ветряные мельницы, принцип работы которых заключается во вращении лопастей благодаря потокам атмосферного воздуха.
Физические свойства воздуха активно применяются и в современной промышленности. Хорошим доказательством этого служит такое изобретение, как водолазный колокол, который позволяет выполнять различные работы под водой. Колокол опускают в воду, но благодаря сопротивлению воздуха в нем всегда остается кислород, как в том эксперименте про стакан, о котором говорилось ранее.
Это свойство позволяет человеку опускаться на глубину без специального снаряжения и при том совершенно безопасно для здоровья. Такая технология часто применяется для ремонта мостов, осмотра и починки морских и речных судов, а также для помощи водолазам в поисках на большой глубине.
В настоящее время человечество нашло множество применений воздуха для своей повседневной жизни. Так им накачивают шины, моют автомобили, очищают помещения и одежду от пыли и мелких частиц грязи.
Все тесты
- Тест на темуАнализ стихотворения «Не с теми я, кто бросил землю» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Перемена» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Петербурге» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Стихи к Блоку» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Клеветникам России» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Завещание» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Москве» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Молитва» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «И. И. Пущину!» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «День и ночь» Ф. Тютчева5 вопросов
- Тест на темуАнализ стихотворения «Весна в лесу» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Журавли» Р. Гамзатова5 вопросов
- Тест на темуАнализ стихотворения «Люблю» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Когда на меня навалилась беда» К. Кулиева5 вопросов
- Тест на темуАнализ стихотворения «Гамлет» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Русь» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Ночь» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения К. Симонова «Ты помнишь, Алёша, дороги Смоленщины…»5 вопросов
- Тест на темуАнализ стихотворения Жуковского «Приход весны»5 вопросов
- Тест на темуАнализ стихотворения Анны Ахматовой «Сероглазый король»5 вопросов
- Тест на темуАнализ стихотворения «Июль – макушка лета…»5 вопросов
- Тест на темуАнализ стихотворения «Мелколесье. Степь и дали…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Не позволяй душе лениться» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «На дне моей жизни» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Нивы сжаты, рощи голы…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Бабушкины сказки» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снежок» Н. Некрасова1 вопрос
- Тест на темуАнализ стихотворения «По вечерам» Н. Рубцова5 вопросов
- Тест на темуАнализ стихотворения «Вчерашний день, часу в шестом…» Н. Некрасова5 вопросов
- Тест на темуАнализ стихотворения «Цветы последние милей…» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Я знаю, никакой моей вины…» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Я не ищу гармонии в природе»Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Разбуди меня завтра рано» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снега потемнеют синие» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Осень» Н. Карамзина5 вопросов
- Тест на темуАнализ стихотворения «Молитва» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Вечер» А. Фета5 вопросов
- Тест на темуАнализ стихотворения «Не жалею, не зову, не плачу» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Тучи» М. Лермонтова5 вопросов
- Тест на темуАнализ стихотворения «Книга» Г. Тукая5 вопросов
- Тест на темуАнализ стихотворения «Необычайное приключение, бывшее с Владимиром Маяковским летом на даче» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Деревня» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Летний вечер» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Я убит подо Ржевом» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Элегия» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Зимнее утро» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Троица» И. Бунина5 вопросов
- Тест на темуАнализ стихотворения «Бабушке» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «О весна без конца и краю» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Море» В. Жуковского5 вопросов
Где о кислороде говорится как о элементе, а где о простом веществе
Чем отличается вещество от химического элемента?
Химический элемент:
б) молекулы воды состоят из двух атомов водорода и одного атома кислорода (понятно, что атом в составе молекулы простым веществом быть не может – смотри определение простого вещества);
г) кислород входит в состав углекислого газа (аналогично предыдущему, т.к. угарный газ это химическое соединение с формулой CO).
Простое вещество:
а) кислород малорастворим в воде (растворимость – свойство веществ, а не атомов);
в) в воздухе содержится 21% кислорода (в воздухе содержится кислород O2, а не просто химический элемент).
Лабораторный опыт № 1
1. Филео (греч.) означает «люблю», фобос – «боюсь». Дайте объяснение терминов «хемофилия» и «хемофобия», отражающих резко противоположное отношение групп людей к химии. Кто из них прав? Обоснуйте свою точку зрения.
2. Обязательный атрибут бесконечного множества шпионских и прочих детективных произведений – цианистый калий, точнее, цианид калия, который обладает свойством парализовывать нервную систему, приводя тем самым жертву к мгновенной смерти. Приведите примеры свойств других веществ, которые используются в литературных произведениях.
3. Выпишите отдельно названия веществ и названия тел из приведённого перечня: медь, монета, стекло, стакан, ваза, керамика, проволока, алюминий. Воспользуйтесь подсказкой: к названию тела – существительному – можно подобрать относительное прилагательное, образованное от названия вещества, например: железо и гвоздь – железный гвоздь.
4. Выпишите качественные прилагательные: лёгкий, круглый, длинный, тяжёлый, твёрдый, пахучий, растворимый, увесистый, вогнутый, мягкий, жидкий, прозрачный, – которые могут быть отнесены: а) к веществам; б) к телам; в) и к телам и к веществам.
5. Сравните понятия «простое вещество» и «сложное вещество». Найдите сходство и различие.
6. Определите, какие из веществ, модели молекул которых изображены на рисунке 2 на с. 5, относят: а) к простым веществам; б) к сложным веществам.
7. Какое понятие более широкое – «химический элемент» или «простое вещество»? Дайте доказательный ответ.
9. Укажите, где о водороде говорится как о химическом элементе, а где – как о простом веществе: а) водород входит в состав большинства органических соединений; б) водород – самый лёгкий газ; в) водородом заполняют воздушные шары; г) молекула метана содержит четыре атома водорода.
10. Рассмотрите связь между свойствами вещества и его применением на примере: а) стекла; б) полиэтилена; в) сахара; г) железа.
Загрязнение воздуха
Копоть и ядовитые газы — угарный газ, диоксид азота, диоксид серы — загрязняют атмосферу. Угарный газ образуется при горении. Многие вещества сгорают так быстро, что не успевают присоединить достаточно кислорода и вместо углекислого газа (СО2) образуется угарный газ (СО).
Угарный газ очень ядовит; он мешает крови животных переносить кислород. В молекуле угарного газа только один атом кислорода. Выхлопные газы автомобилей содержат угарный газ, а также диоксид азота, вызывающий кислотные дожди. Диоксид серы выделяется при сгорании ископаемого топлива, в особенности угля.
Он ядовит и затрудняет дыхание. К тому же он растворяется в воде и служит причиной кислотных дождей. Частицы пыли и копоти, выбрасываемые в атмосферу предприятиями, также загрязняют воздух; мы вдыхаем их, они оседают на растениях. В бензин для лучшего сгорания добавляют свинец (правда, сейчас многие автомобили работают на бензине без свинца).
История открытия углекислого газа
Углекислый газ – это первый газ, который был описан как дискретное вещество. В семнадцатом веке, фламандский химик Ян Баптист ван Гельмонт (Jan Baptist van Helmont) заметил, что после сжигания угля в закрытом сосуде масса пепла была намного меньше массы сжигаемого угля. Он объяснял это тем, что уголь трансформируется в невидимую массу, которую он назвал «газ».
Свойства углекислого газа были изучены намного позже в 1750г. шотландским физиком Джозефом Блэком (Joseph Black).
Он обнаружил, что известняк (карбонат кальция CaCO3) при нагреве или взаимодействии с кислотами, выделяет газ, который он назвал «связанный воздух». Оказалось, что «связанный воздух» плотнее воздуха и не поддерживает горение.
CaCO3 2HCl = СО2 CaCl2 H2O
Пропуская «связанный воздух» т.е. углекислый газ CO2 через водный раствор извести Ca(OH)2 на дно осаждается карбонат кальция CaCO3.
Джозеф Блэк использовал этот опыт для доказательства того, что углекислый газ выделяется в результате дыхания животных.
CaO H2O = Ca(OH)2
Ca(OH)2 CO2 = CaCO3 H2O
Кислород

Кислород необходим для жизни. Животные дышат им, с его помощью усваивают пищу и получают
. Днем в растениях происходит процесс
фотосинтеза
, и растения выделяют кислород. Кислород также необходим для сгорания; без кислорода ничто не может гореть. Почти 50% соединений в земной коре и
содержат кислород. Обычный песок — это соединение кремния с кислородом. Кислород используют в дыхательных аппаратах водолазов и в больницах. Кислород также используется при производстве стали (см. статью «
») и ракетной технике (см. статью «
»).
В верхних слоях атмосферы атомы кислорода соединяются по три, образуя молекулу озона (О3). Озон — это аллотропная модификация кислорода. Озон — ядовитый газ, но в атмосфере озоновый слой защищает нашу планету, поглощая большую часть вредного ультрафиолетового излучения Солнца (подробнее в статье «Воздействие Солнца на Землю»).
Польза воздуха для живых организмов
Воздух необходим для жизни всех организмов планеты Земля, в том числе и для людей. За один день человек совершает 20 тысяч вздохов и столько же выдохов. При вздохе происходит насыщение организма кислородом. Так, с помощью крови он быстро распространяется по всему телу и дает каждой клеточке необходимую для работы энергию.
Воздух необходим и для жизни животных, ведь от него зависит их рост и развитие, пол и размер, даже возраст и ежедневная активность. Животные очень остро реагируют на недостаток кислорода: у них учащается дыхание и ускоряется ток крови, при этом в их организмах замедляются жизненно важные процессы. Все это приводит к появлению у животных беспокойства и серьезных заболеваний.
Воздух является неотъемлемой частью жизни и для растений. Для дыхания им также необходим кислород, а вот для питания – углекислый газ. Без кислорода растения не смогли бы прорастать из земли. Этот элемент необходим всему организму: корням, стеблям и листьям. А количество углекислого газа напрямую влияет на качество жизни растения – чем его больше, тем лучше.
Немаловажно для растений и движение воздушных потоков в атмосфере. Если воздух движется вертикально, то он способствует распространению семян, пыльцы и создает комфортную температуру. А вот если направление воздуха горизонтальное, то растения начнут сохнуть и вянуть.
Таким образом, можно смело утверждать, что воздух является жизненно необходимым элементом для людей, животных и растений. Особенно важно его количество и чистота.
Применение углекислого газа
Что такое углекислота с практической точки зрения? Это – газовая защита от окружающего воздуха и вызываемых им процессов:
- перевозка и хранение различных пищевых продуктов (полуфабрикаты, мясо, рыба), при этом наблюдается отсутствие появления плесени и гнили органики;
- внесение в напитки для придания им полезных свойств – отмечается благоприятное действие на организм газированной минеральной или сладкой воды;
- создание пищевых добавок для повышения сроков и условий хранения пищевых продуктов (к примеру, разрыхлитель Е290);
- изготовление кофе без кофеина (участвует в технологическом процессе удаления растворенного вещества);
- организация целебных ванн с углекислотой для поддержания и восстановления здоровья сердечно-сосудистой системы;
- целый спектр специализированных задач в медицине – к примеру, работа с образованиями в тканях, стимуляция дыхания;
- проверка морозоустойчивости резинотехнических изделий (в частности – автомобильные покрышки, которые испытываются с сухим льдом);
- испытания различного оборудования, механизмов и инструментов на предмет пониженных температур;
- изготовление и перезаправка углекислотных огнетушителей (наиболее эффективное средство тушения огня на электрооборудовании и горючих жидкостях);
- рабочая среда в пневматическом оружии;
- применение в качестве реагента для химических реакций с целью синтеза и производства солей, полимеров и различных волокон;
- очистка сточных вод от загрязнений;
- защита расплавленного металла сварочной ванны.
Также интересно использование для авиационного и судостроительного моделирования как вид источника энергии для двигателей с различным объёмом (до десятков см3).
Полезная статья — Как варить нержавейку электродом
Применение углекислоты для сварки
Плотность углекислого газа достаточно высока, что позволяет обеспечивать защиту реакционного пространства дуги от соприкосновения с газами воздуха и предупреждает азотирование металла шва при относительно небольших расходах углекислоты в струе. Низкий потенциал ионизации и теплопроводность способствуют образованию горячей зоны в центре столба дуги и как следствие более глубокое проплавление и меньшую ширину шва.
Молекула углекислого газа CO2, попадая в зону сварочной дуги распадается на атомарный кислород О и угарный газ СО. В результате происходит выгорание легирующих элементов металла сварочной ванны и окисление основного металла (возникает окалина, шлак и дым). Реакция окисления расплавленного металла сварного шва имеет следующий вид:
Fe CO2 = FeO CO
Ранее препятствием для применения углекислоты в качестве защитной среды являлось образование большого количества дефектов в сварных швах (преимущественно пор). Поры при сварке возникают в результате кипения затвердевающего металла сварочной ванны от выделения окиси углерода (СО) из-за недостаточной его раскисленности.
При этом поверхность сварного шва сильно окислена и имеет большое количество шлака ввиду окисляющей атмосферы внутри сварочной дуги. Помимо неудовлетворительного эстетического вида, при необходимости дальнейшего нанесения защитного покрытия потребуется дополнительная операция зачистки поверхности.
При высоких температурах углекислый газ диссоциирует с образованием весьма активного свободного, одноатомного кислорода:
CO2=CO O
Окисление металла шва выделяющимся при сварке из углекислого газа свободным кислородом нейтрализуется содержанием дополнительного количества легирующих элементов с большим сродством к кислороду, чаще всего кремнием и марганцем (сверх того количества, которое требуется для легирования металла шва) или вводимыми в зону сварки флюсами (сварка порошковой проволокой).
Как двуокись, так и окись углерода практически не растворимы в твердом и расплавленном металле. Свободный активный кислород окисляет элементы, присутствующие в сварочной ванне, в зависимости от их сродства к кислороду и концентрации по уравнению:
Мэ O = МэO, где Мэ — металл (марганец, алюминий или др.).
Кроме того, и сам углекислый газ реагирует с этими элементами. В результате этих реакций при сварке в углекислоте наблюдается значительное выгорание алюминия, титана и циркония, и менее интенсивное — кремния, марганца, хрома, ванадия и др.
Особенно энергично окисление примесей происходит при полуавтоматической сварке. Это связано с тем, что при сварке плавящимся электродом взаимодействие расплавленного металла с газом происходит при пребывании капли на конце электрода и в сварочной ванне, а при сварке вольфрамовым электродом — только в ванне.
Как известно, взаимодействие газа с металлом в дуговом промежутке происходит значительно интенсивнее вследствие высокой температуры и большей поверхности контактирования металла с газом. Для компенсации выгорания легирующих элементов в сварном шве, необходимо применять сварочную проволоку с повышенным содержанием раскислителей (кремния и марганца).
Уже давно известна зависимость, чем больше сила сварочного тока, тем больше размер капель расплавленного металла. В свою очередь увеличение размера капель электродного металла увеличивает разбрызгивание.
В настоящее время ввиду большого разбрызгивания металла сварочной ванны при сварке в углекислоте все чаще применяют сварочные смеси с аргоном. Производители сварочного оборудования не остались в стороне от данной проблемы и предусматривают специальный режим на сварочных полуавтоматах, при котором уменьшается эффект разбрызгивания.
Еще один путь решения данного вопроса – это использование специальных спреев или жидкостей, которые не позволяют прикипать брызгам к металлу свариваемой детали. В любом случае применение любого из данных методов с лихвой окупит затраты времени и расходных материалов на удаление брызг путем механической зачистки.
При сварке тонких деталей применением оптимальных режимов сварки возможно добиться короткозамкнутого переноса электродного металла и тем самым получить минимальное разбрызгивание. Например, при использовании сварочной проволоки ? 1 мм, силе сварочного тока 150 А и напряжения дуги 16-23 В происходит перенос металла небольшими каплями за счет поверхностного натяжения.
Для MAG сварки толстостенных конструкций целесообразно применение проволоки большого диаметра и, следовательно увеличение силы сварочного тока, увеличение разбрызгивания, что ведет к уменьшению скорости наплавки электродного металла. Для уменьшения разбрызгивания уменьшают скорость подачи сварочной проволоки.
Поэтому применение чистой углекислоты оказывает негативное влияние на производительность сварки и качества сварного шва. Углекислоту в качестве защитного газа рационально применять при сварке порошковой проволокой (FCAW) углеродистых сталей поскольку обеспечивается короткозамкнутый перенос и хорошее качество сварного шва.
Ввиду химической активности углекислого газа по отношению к вольфраму сварку в этом газе ведут только плавящимся электродом.
При выборе защитного газа стоит учитывать не только его стоимость, но и влияние потерь на разбрызгивание, последующую зачистку и общую трудоемкость процесса.
Смесь воздуха в разных климатических условиях
Следует отметить, что состав воздуха не везде одинаков. Например:
- Высоко в горах, разряженный воздух, с пониженным содержанием кислорода. Поэтому в условиях высокогорья дышится тяжелее, и альпинисты, совершая восхождения на горные вершины, используют кислородные маски. Но в то же время люди, живущие в предгорьях и вдыхающие свежий горный воздух, меньше болеют и дольше живут.
- Морской воздух, с постоянно пополняющимся химическим составом, за счет испарения морской воды содержит фитонциды, отрицательно заряженные аэроны, среди которых ионы йода и другие жизненно важные элементы. Морской воздух полезен тем, кто имеет заболевания дыхательных путей (туберкулез, бронхит и т.д.). Заряженные частицы – ионы, входящие в состав воздуха играют важную роль в процессах обмена веществ, причем наиболее важны отрицательно заряженные частицы. Русский ученый А. Л. Чижевский провел серию экспериментов и определил положительное действие этих частиц на здоровье человека.
- Лесной воздух богат компонентами на основе трав, цветов, эфирных масел сосны, пихты и т.д. Помимо общеукрепляющего действия, он обладает бактерицидным действием. Когда мы дышим в лесу, получаем “порцию лекарства”.
Важно! Следовательно, не существует универсальной формулы химического состава воздуха. Для каждой климатической зоны она будет индивидуальна.
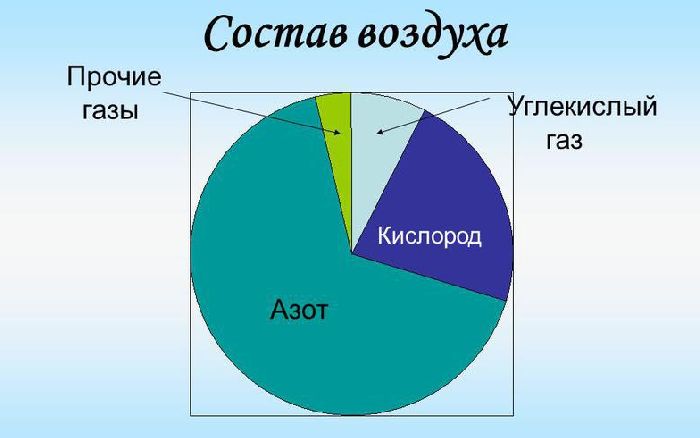
Состав воздуха
Воздух необходим для дыхания всем живым организмам. Он состоит из азота, кислорода, аргона, углекислого газа и ряда примесей. Состав атмосферного воздуха может меняться в зависимости от условий и местности. Так в городской среде уровень углекислого газа в воздухе по сравнению с лесной полосой повышается из-за обилия транспортных средств.

Если говорить о составе воздуха в процентах, то основным его компонентом является азот. Азот занимает 78% от всего объема воздуха. Процентное соотношение кислорода в молекуле воздухе составляет 20,9%. Азот и кислород – 2 основные элемента воздуха. Содержание остальных веществ значительно меньше и не превышает 1%.
Сухой лед
- Твердая двуокись углерода (сухой лед)
- по внешнему виду напоминает снег и лед. Содержание углекислого газа, получаемого из брикета сухого льда, высокое — 99,93-99,99%. Содержание влаги в пределах 0,06-0,13%. Сухой лед, находясь на открытом воздухе, интенсивно испаряется, поэтому для его хранения и транспортировки используют контейнеры. Получение углекислого газа из сухого льда производится в специальных испарителях. Твердая двуокись углерода (сухой лед), поставляемая по ГОСТ 12162.
При чрезмерно быстром отборе газа, понижении давления в баллоне и недостаточном подводе теплоты углекислота охлаждается, скорость ее испарения снижается и при достижении «тройной точки» она превращается в сухой лед, который забивает отверстие в понижающем редукторе, и дальнейший отбор газа прекращается.
При нагреве сухой лед непосредственно превращается в углекислый газ, минуя жидкое состояние. Для испарения сухого льда необходимо подвести значительно больше теплоты, чем для испарения жидкой двуокиси углерода — поэтому если в баллоне образовался сухой лед, то испаряется он медленно.
Углекислый газ в атмосфере
Углекислый газ в атмосфере находится в количестве до 0,045% — или порядка 800 миллиардов тонн только в виде газа. В воде и почве его ещё больше.
Сегодня это составляет порядка 400 ppm (400 миллионных частей). Для сравнения: 300-350 лет назад, до начала Великой индустриальной революции, когда в 17 веке был начато кардинальное преобразование мировой экономики в сторону индустриализации, этот параметр составлял около 250 ppm.
Интересно, что в черте города показатель доходит до 450-470 ppm, а в публичных заведениях по типу школы – 1000-1200 и более. Это говорит о негативном влиянии транспорта и скопления людей.
Несмотря на своё крошечное количество СО2 играет значительную роль для биосферы и экологии. Основная форма влияния – воздействие в качестве парникового газа:
- газ препятствует выходу инфракрасного излучения с планеты в окружающее пространство;
- температура атмосферы год за годом увеличивается;
- происходят изменения природных явлений и климата;
- текущий формат этих преобразований – ускоренное таяние ледниковых «шапок», повышение уровня Мирового океана и изменения в составе биосферы.
Учёные рассчитали, что без присутствия этого эффекта среднегодовая температура на поверхности планеты находилась бы ниже на 25-30°С.
Физические свойства воздуха:
Воздух абсолютно прозрачен и не имеет цвета, запаха и вкуса. Он хорошо сжимаем и упруг.
Воздух имеет свойство сжиматься при охлаждении и расширяться при нагревании, поэтому теплый воздух легче холодного.
Воздух плохо проводит тепло и хорошо удерживает его.
Он заполняет собой весь свободный объём любого пустого пространства.
Воздух, благодаря присутствию в нём кислорода, поддерживает горение горючих веществ.
| Наименование параметра | Значение |
| Цвет | бесцветный |
| Вкус | без вкуса |
| Запах | без запаха |
| Прозрачность | полностью прозрачен |
| Средняя молярная масса (средняя масса одного моля вещества), г/моль | 28,98 |
| Плотность сухого воздуха, кг/м3 | 1,29 |
| Плотность сухого воздуха, г/см3 | 0,00129 |
| Температура кипения воздуха, оС | -192 |
| Температура плавления воздуха, оС | -213 |
| Средняя удельная теплоемкость, кДж / (кг·К) | 1,006 |
| Средняя удельная теплоемкость при постоянном объеме, кДж/(кг·К) | 0,717 |
| Показатель адиабаты воздуха (отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме) | 1,40 |
| Теплопроводность воздуха при 0 ℃, Вт / (м·К) | 0,0243 |
| Скорость звука в воздухе при 0 ℃, м/с (км/ч) | 331 (1193) |
| Средний коэффициент теплового расширения воздуха в интервале температур 0-100°C (изменение объема при постепенном увеличении температуры), 1/К | 3,67·10−3 |
| Коэффициент динамической вязкости воздуха при нормальных условиях и нормальном атмосферном давлении (динамическая вязкость – внутреннее сопротивление молекул движению внутри вещества согласно закону Ньютона), мкПа·с | 17,2 |
| Растворимость воздуха в воде, см3/л | 29,18 |
| Показатель преломления воздуха при нормальных условиях и нормальном атмосферном давлении (показатель преломления означает изменение угла движения световых и любых других волн в веществе) | 1,0002926 |
| Коэффициент изменения показателя преломления (при нормальных условиях), 1/Pa | 2,8·10−9 |
| Средняя поляризуемость молекулы (при нормальных условиях) | 1,7·10−30 |
(При нормальном атмосферном давлении – 101 325 Па или 1 атм.)
Химический состав воздуха:
В 1754 году Джозеф Блэк в результате экспериментов доказал, что воздух – это смесь газов.
Состав воздуха в разных местностях может несколько отличаться, усреднённый его состав приведён в таблице:
| Химическое вещество | Обозначение вещества | По объему*, % | По массе*, % |
| Азот | N2 | 78,1 | 75,5 |
| Кислород | O2 | 20,9 | 23,15 |
| Аргон | Ar | 0,934 | 1,292 |
| Углекислый газ | CO2 | 0,0314 | 0,046 |
| Неон | Ne | 0,00182 | 0,0014 |
| Метан | CH4 | 0,0002 | 0,000084 |
| Гелий | He | 0,000524 | 0,000073 |
| Криптон | Kr | 0,000114 | 0,003 |
| Водород | H2 | 0,00005 | 0,00008 |
| Ксенон | Xe | 0,0000087 | 0,00004 |
| Водяной пар** | H2O | от 0,0001 до 5 | 0,25 |
Примечание:* в пересчете на сухой воздух (без водяного пара).** объёмное содержание водяного пара в воздухе находится в зависимости от температуры, давления и других условий и составляет примерно от 0,0001 % в холодных частях атмосферы до 5% в горячих и влажных воздушных слоях (в пересчете на сухой воздух).
В воздухе обычно в некоторых количествах содержатся взвешенные вещества (аэрозоли) — это пыль, пыльца растений, споры грибов, вулканический пепел. В крупных промышленных городах в воздухе может присутствовать вся таблица химических элементов в виде различных соединений. Наличие и состав разнообразных примесей в воздухе сильно зависит от места, погодных условий и времени года.
Азот – главный компонент воздуха, один из самых распространённых элементов на Земле. В воздухе представлен как двухатомный газ без цвета, запаха и вкуса. Азот химически инертен, тем не менее в естественных условиях он встречается и в виде различных соединений органических и неорганических.
Азот входит в состав различных соединений составляющих живые организмы, поэтому он жизненно необходим для существования растений и животных.
Азот в промышленных масштабах получают разделяя воздух на составляющие. Технология криогенного разложения газовой смеси уже более 100 лет применяется в промышленности для получения инертных газов. Более ¾ промышленного азота используется для синтеза аммиака.
Кислород – по содержанию в воздухе занимает второе место после азота. В воздухе его содержится около 21 % по объему и более 23 % по массе. Эти два газа составляют более 99% в составе атмосферного воздуха.
Кислород – это самый распространённый элемент в земной коре, на его долю приходится около 47 % от массы земной тверди. Вода в своём составе также содержат огромное количество кислорода – около 86 % (по массе).
Кислород – химически активный газ без цвета, запаха и вкуса. В атмосфере присутствует как простое вещество, его молекула состоит из двух атомов кислорода (O2). Во время грозы и в под воздействием солнечного ультрафиолетового излучения в атмосфере образуется озон (O3) трёхатомная модификация кислорода – газ голубого цвета с резким характерным запахом.
Кислород присутствует во многих органических соединениях из которых состоят живых организмы. По массовой доле в живых клетках он составляет – около 65%.
Биологическая роль кислорода заключается в том, что большинство живых организмов усваивают его при дыхании и далее он используется при синтезе энергии.
Доля кислорода в составе атмосферы Земли постоянно пополняется за счёт фотосинтеза его растениями, зелеными водорослями и цианобактериями. Считается, что до 70% кислорода вырабатывают морские зеленые водоросли и цианобактерии.
Аргон и другие Инертные газы – инертные одноатомные газы без цвета, запаха и вкуса, содержание аргона в воздухе составляет около процента по объему и около 1,3% по массе, Неон, Гелий и Криптон содержатся в воздухе в пренебрежимо малых количествах.
Углекислый газ (двуокись углерода или диоксид углерода) – бесцветный газ почти без запаха (при высокой концентрации имеет запах газированной воды) в 1,5 раза тяжелее воздуха. Углекислый газ способен растворяться в воде и образовывать в соединении с ней углекислоту. Концентрация углекислого газа в атмосфере непостоянна и зависит от местности, времени года и прочих условий.
Углекислый газ и является одним из находящихся в атмосфере парниковых газов (также метан и водяной пар), он прозрачен для ультрафиолетового излучения и видимой части солнечного света, которые попадают на Землю от нашего светила и нагревают её. Но он поглощает излучаемое в результате нагрева Землёй инфракрасное излучение, поэтому, как считается, принимает участие в процессе глобального потепления.
Считается, что непрерывный рост содержания этого газа в атмосфере происходит с начала индустриальной эпохи. Однако, парниковым эффектом обладает не только углекислый газ, и связывать глобальное потепление с одним лишь накоплением в атмосфере углекислого газа в результате жизнедеятельности человека видимо не совсем правильно.
В значительно большей степени накопление углекислого газа в атмосфере связано с сокращением площадей лесов и зелёных насаждений, которые часто называют лёгкими планеты. А такие парниковые газы, как метан или водяной пар в огромных количествах производятся самой планетой – болотами и океанами, извержениями вулканов, разломами и движением тектонических плит.
Углекислый газ вырабатывается в результате метаболизма в тканях живых организмов, после чего он переносится венозной кровью от тканей в лёгкие и выбрасывается в атмосферу при выдохе. За сутки организм человека выделяет около 1 кг углекислого газа. Углекислый газ нетоксичен, но дышать им нельзя и его относят к удушающим газам.
Углекислый газ используется растениями при фотосинтезе. Поэтому в тёплое время года вследствие фотосинтеза зелёными растениями содержание СО2 в атмосфере падает, а в холодное время – повышается.
Хранение и транспортировка углекислого газа
Углекислый газ поставляется по ГОСТ 8050. Для получения качественных швов используют газообразную и сжиженную двуокись углерода высшего и первого сортов.
Углекислоту транспортируют и хранят в стальных баллонах по ГОСТ 949 или цистернах большой емкости в жидком состоянии с последующей газификацией на заводе, с централизованным снабжением сварочных постов через рампы.
В стандартный баллон с водяной емкостью 40 л заливается 25 кг жидкой углекислоты, которая при нормальном давлении занимает 67,5% объема баллона и дает при испарении 12,5 м3 углекислого газа.
В верхней части баллона вместе с газообразной углекислотой скапливается воздух. Вода, как более тяжелая, чем жидкая двуокись углерода, собирается в нижней части баллона.
Для снижения влажности углекислого газа рекомендуется установить баллон вентилем вниз и после отстаивания в течение 10…15 мин осторожно открыть вентиль и выпустить из баллона влагу. Перед сваркой необходимо из нормально установленного баллона выпустить небольшое количество газа, чтобы удалить попавший в баллон воздух. Часть влаги задерживается в углекислоте в виде водяных паров, ухудшая при сварке качество шва.
При выпуске газа из баллона вследствие эффекта дросселирования и поглощения теплоты при испарении жидкой двуокиси углерода газ значительно охлаждается. При интенсивном отборе газа возможна закупорка редуктора замерзшей влагой, содержащейся в углекислоте, а также сухим льдом.
Во избежание этого при отборе углекислого газа перед редуктором устанавливают подогреватель газа. Окончательное удаление влаги после редуктора производится специальным осушителем, наполненным стеклянной ватой и хлористым кальцием, силикогелием, медным купоросом или другими поглотителями влаги.
Баллон окрашен в черный цвет, с надписью желтыми буквами «УГЛЕКИСЛОТА».

