Гдз (ответы) химия 10 класc габриелян о.с. , остроумов и.г., сладков с.а., 2022, §13 фенол
ГДЗ (ответы) Химия 10 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2022, §13 Фенол
Во всех упражнениях красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1
Приведите молекулярную и структурную формулы фенола.
Молекулярная формула фенола: C6H5OH.
Структурная формула фенола: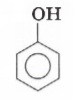
Найдите черты сходства и различия в строении молекул фенола и этанола.
Сходство:
молекулы имеют в своём составе гидроксильную группу ОН, которая связана с атомом углерода.
Различия:
в молекуле фенола гидроксильная группа связана с ароматическим радикалом, а в этаноле ― с алкильным радикалом.
Задание 2 Как взаимное влияние фенильного радикала и гидроксильной группы отражается на свойствах фенола? Ответ проиллюстрируйте уравнениями химических реакций.
Влияние фенильного радикала –C6H5 на гидроксильную группу выражается в значительном усилении кислотных свойств, так, например, фенол, в отличие от спиртов, вступает в реакцию нейтрализации со щелочами:
C6H5OH NaOH ⟶ C6H5ONa H2O
Влияние гидроксильной группы на фенильный радикал –C6H5 выражается в значительном облегчении протекания реакции по фенильному радикалу, так, например, для бромирования фенола, в отличие от бензола, не требуется катализатор и замещаются сразу три атома водорода в положениях 2, 4 и 6 с образованием белого нерастворимого осадка 2,4,6-трибромфенола: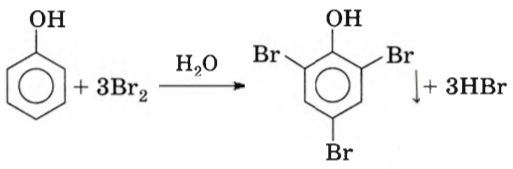
Задание 3
В настоящее время вместо фенола в качестве дезинфицирующего средства используют 2,4,6-трихлорфенол. Предложите способ его получения исходя из бензола. Напишите уравнения соответствующих реакций.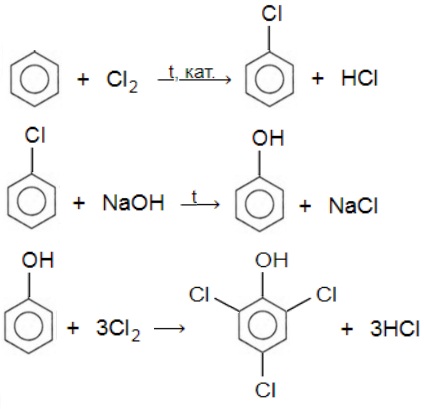
или
С6H6 Cl2t,кат.⟶ C6H5Cl HCl
C6H5Cl NaOH t⟶ C6H5OH NaCl
C6H5OH 3Cl2 ⟶ C6H2Cl3OH 3HCl
Задание 4
В результате взаимодействия 47 г водного раствора фенола с бромной водой выпало 1,655 г осадка. Рассчитайте массовую долю фенола в исходном растворе.
Дано: m(раствора)=47 г,m(C6H2Br3OH)=1,655 г
Найти: ω(C6H5OH)—?
Решение
1. Количество вещества осадка рассчитываем по формуле: n=m/M, где M ― молярная масса.
M(C6H2Br3OH)=331 г/моль
n(C6H2Br3OH)=m(C6H2Br3OH)/M(C6H2Br3OH)=1,655 г : 331 г/моль=0,005 моль
2. Составим химическое уравнение:
C6H5OH 3Br2 = C6H2Br3OH↓ 3HBr
По уравнению реакции n(C6H5OH):n(C6H2Br3OH)=1:1, количество вещества одинаковое, поэтому
n(C6H5OH)=n(C6H2Br3OH)=0,005 моль
3. Рассчитываем массу фенола количеством вещества 0,005 моль по формуле: m=n•M, где M ― молярная масса.
M(C6H5OH)=94 г/моль
m(C6H5OH)=n(C6H5OH)•M(C6H5OH)=0,005 моль • 94 г/моль=0,47 г
4. Рассчитываем массовую долю фенола в растворе:
ω(C6H5OH)=(m(C6H5OH):m(раствора))•100%=(0,47 г : 47 г) •100%=1%
Ответ: 1%
Задание 5
В трёх пробирках без подписи находятся водные растворы пропанола-1, глицерина и фенола. С помощью каких реагентов можно определить каждый из растворов?
Качественной реакцией на фенол является реакция с бромной водой при комнатной температуре, в результате образуется белый осадок.
Качественной рекцией на глицерин (мноатономный спирт) является реакция со свежеполученным осадком гидроксида меди (II), в результате которой образуется раствор ярко-синего цвета.
Определить раствор пропанола-1 можно при помощи оксида меди (II), при его добавлении, наблюдается окисление спирта до альдегида, и раствор приобретает фруктовый запах.
Задание 6
Фенолят натрия взаимодействует с углекислым газом с образованием гидрокарбоната натрия и фенола согласно уравнению C6H5ONa CO2 H2O ⟶ C6H5OH NaHCO3 Какой вывод относительно кислотных свойств фенола и угольной кислоты можно сделать на основании этой реакции? Фенол является слабой кислотой, при этом кислотные свойства фенола настолько слабые, что даже такая слабая кислота, как угольная, вытесняет фенол из раствора его солей.
Задание 7
Опишите физические свойства фенола.
Фенол ― бесцветные кристаллы, розовеющие при хранении на воздухе, с температурой плавления 41°C и температурой кипения 181,2°C, летучие, имеют специфический стойкий запах (запах гуаши, или так называемый «карболовый запах»). При комнатной температуре фенол растворим в воде незначительно, а при нагревании до 70°С растворяется полностью.
Найдите в Интернете данные о растворимости фенола в воде при различных температурах. Постройте график температурной зависимости растворимости фенола в воде.
В справочнике химика нашли, що 1 г кристаллического фенола растворяется в 15 г воды при 200С, поэтому в 100 г воды при 200С растворится 6,6 г фенола, следовательно первая координата (20;6,6). Остальные координаты берем из других справочников в интернете: (16;6,2); (36;8); (50;10,71); (60;14,97).
Построили график температурной зависимости растворимости фенола в воде: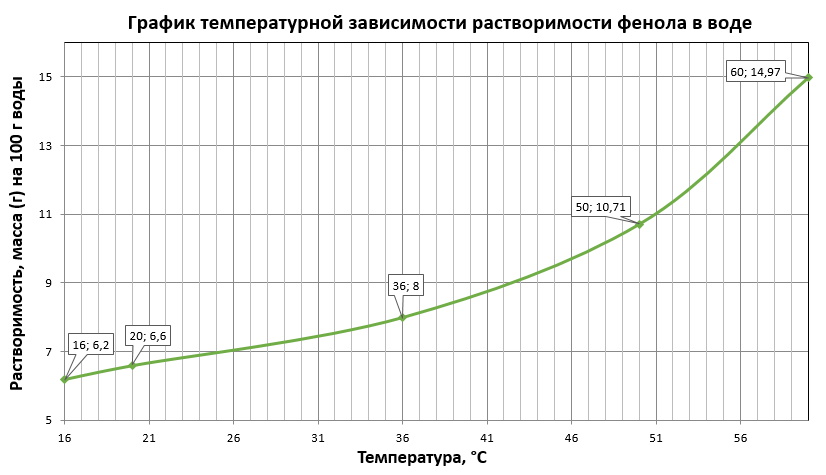
Строение молекулы фенола
В молекуле фенола гидроксил непосредственно связан с атомом углерода бензольного ароматического ядра.
Вспомним строение групп атомов, образующих молекулу фенола.
Ароматическое кольцо состоит из шести атомов углерода, образующих правильный шестиугольник, вследствие sр2-гибридизации электронных орбиталей шести атомов углерода. Эти атомы связаны σ-связями. Не участвующие в образовании σ-связей р-электроны каждого атома углерода, перекрывающиеся по разные стороны плоскости σ-связей, образуют две части единого шестиэлектронного π-облака, охватывающего всё бензольное кольцо (ароматическое ядро).
Ковалентная связь между атомами кислорода и водорода гидроксильного радикала сильно полярна. Общее электронное облако связи О—H смещено в сторону атома кислорода. В результате на атоме кислорода возникает частичный отрицательный заряд, а на атоме водорода — частичный положительный заряд. Кроме того, атом кислорода в гидроксильной группе имеет две неподелённые, принадлежащие только ему электронные пары: 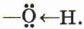
В молекуле фенола гидроксильный радикал взаимодействует с ароматическим ядром, при этом неподелённые электронные пары атома кислорода взаимодействуют с л-облаком бензольного кольца, образуя единую электронную систему. Такое взаимодействие неподелённых электронных пар и облаков π-связей называют, как вы знаете, р,π-сопряжением (см. с. 148).
В результате сопряжения неподелённой электронной пары атома кислорода гидроксигруппы с электронной системой бензольного кольца уменьшается электронная плотность на атоме кислорода. Это снижение компенсируется за счёт большей поляризации связи О—Н, что, в свою очередь, приводит к увеличению положительного заряда на атоме водорода.
Следовательно, водород гидроксильной группы в молекуле фенола имеет кислотный характер.
Сопряжение электронов бензольного кольца и гидроксильной группы сказывается не только на её свойствах, но и на реакционной способности бензольного кольца.
В самом деле, как вы помните, сопряжение неподелённых пар атома кислорода с π-облаком бензольного кольца приводит к перераспределению электронной плотности в нём (рис. 43, б). Она понижается у атома углерода, связанного с ОН-группой (сказывается влияние электронных пар атома кислорода), и повышается у соседних с ним атомов углерода, т. е.
в положениях 2 и 6, или орто-положениях. Очевидно, что повышение электронной плотности у этих атомов углерода бензольного кольца приводит к локализации (сосредоточению) отрицательного заряда на них. Под влиянием этого заряда происходит дальнейшее перераспределение электронной плотности в ароматическом ядре — смещение её от 3-го и 5-го атомов (мета-положение) к 4-му (орто-положение). Эти процессы можно выразить формулой.
Таким образом, наличие гидроксильного радикала в молекуле фенола приводит к изменению π-облака бензольного кольца, увеличению электронной плотности у 2, 4 и б-го атомов углерода (орто-, пара-положения) и уменьшению электронной плотности у 3-го и 5-го атомов углерода (мета-положения).
Локализация электронной плотности в орто- и пара-положениях делает их наиболее вероятными для атак электрофильных частиц при взаимодействии с другими веществами.
Следовательно, влияние радикалов, составляющих молекулу фенола, взаимно, и оно определяет его характерные свойства.
Продолжение >>>
Фенолы
Гидроксильные производные углеводородов, у которых гидроксильная группа находится при углероде sр2-гибридизации, входящем в цикл ароматического углеводорода, называют фенолами.
По числу гидроксильных групп фенолы делятся на одноатомные, двухатомные, трех- и полиатомные.
Фенолы существенно отличаются по своим физическим и химическим свойствам от спиртов. Главной причиной этих отличий является различный характер электронных взаимодействий гидроксильной группы с углеводородным радикалом. В фенолах гидроксильная группа связана с углеродом ароматического кольца и поэтому наряду с отрицательным индуктивным эффектом (-J) имеет место и положительный мезомерный эффект ( М) (р,р-сопряжение).
По заместительной номенклатуре ИЮПАК названия фенолов образуют от названий соответствующих аренов с добавлением гидрокси-. Для многих фенолов используют тривиальные названия. В качестве основы названий гомологов фенола чаще всего используют слово -фенол.
Например:

фенол, 2-метилфенол 3-метилфенол 4-метилфенол
гидроксибензол о-метилфенол м-метилфенол п-метилфенол
о-крезол м-крезол п-крезол
Природным источником фенола является каменноугольная смола. Чаще фенолы получают синтетическими методами а) кумольным способом, б) с помощью серной кислоты, в) окислительным декарбоксилированием ароматических карбоновых кислот и г) из солей арилдиазония.
Все возможные реакции фенолов можно подразделить на реакции с участием связи О-Н (реакции замещения водорода), связи С-О (реакции нуклеофильного замещения), арильного радикала (реакции электрофильного замещения), а также реакции восстановления и окисления. Однако вследствие р,р-сопряжения неподеленной пары электронов атома кислорода с р-электронной системой ароматического ядра прочность связи С-О у фенолов значительно выше, чем у спиртов. Поэтому реакции фенолов с разрывом связи С-О протекают редко.
Фенолы более сильные О-Н кислоты, чем спирты. Это вызвано тем, что неподеленная пара электронов атома кислорода в молекуле фенола смещена к ядру ( М), что приводит к образованию частичного положительного заряда на атоме кислорода и увеличению поляризации связи О-Н по сравнению со спиртами. Кроме того, образующийся фенолят-ион имеет повышенную стабильность за счет делокализации отрицательного заряда по ароматическому радикалу:

основание кислота сопряженная феноксид-ион
кислота (сопряженное основание)
Доказательством более сильных кислотных свойств фенолов по сравнению со спиртами может служить их реакция с водными растворами щелочей с образованием фенолятов:
С6Н5ОН NaOH C6H5ONa Н2О
На кислотность фенола значительное влияние оказывают заместители в ароматическом ядре. Введение в пара-положение бензольного ядра молекулы фенола электроноакцепторных заместителей (-NO2, -CN, -Hal и др.) усиливают кислотные свойства фенола, а введение электронодонорных заместителей (-NH2, -OCH3 и др.) понижают.
Двухатомные фенолы являются более сильными кислотами, чем фенол. Поэтому они способны образовывать соли не только с щелочными, но и с тяжелыми металлами. Для многоатомных фенолов характерны те же реакции, что и для одноатомных. Они легко галогенируются, нитруются, сульфируются и т.д.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы следующих соединений: а) о-нитро-фенол, б) п-крезол, в) пирокатехин, г) резорцин, д) гидрохинон, е) пикриновая кислота.
2. Напишите схемы получения фенола, используя а) бензолсульфокислоту, б) хлорбензол, в) кумол. Укажите условия реакций. В чем преимущество кумольного способа получения фенола?
3. Напишите схемы реакций, позволяющие синтезировать: а) резорцин из бензола, б) п-крезол из п-толуидина.
4. Напишите схемы реакции взаимодействия фенолята натрия с изопропилхлоридом и хлорангидридом масляной кислоты. Назовите полученные продукты.
5. Какие соединения образуются при действии на бензиловый спирт металлического натрия, уксусной кислоты, окислителей?
6. Напишите реакцию действия брома на 3,5-диметил-1-гидроксибензол.
7. Напишите схемы возможных химических реакций, позволяющих отличить следующие соединения: а) пирогаллол, фенол, гидрохинон, б) пирокатехин и резорцин.
8. Составьте уравнения по следующей схеме превращений:
NaNO2, HCl H2O, t NaOH, H2O CO2, t,p HCl NaHCO3
Анилин А Б В Д E K
9. Синтезируйте из бензола п-нитрофенол, трибромфенол.
10. Сравните основные и кислотные свойства этанола и фенола и напишите соответствующие реакции.
11. Напишите структурные формулы всех изомерных фенолов состава С8Н10О, С7Н8О2, имеющих один алкильный радикал.
12. Напишите уравнения реакций п-аминофенола со следующими реагентами: а) HCl, б) NaOH (H2O), в) CH3J, г) CH3COCl.
13. Сравните отношение к действию окислителей одно-, двухатомных фенола и бензола. Напишите соответствующие уравнения реакций.
14. Охарактеризуйте отношение фенола, п-нитрофенола и 2,4,6-тринитро-фенола к действию а) NaOH (H2O), б) NaHCO3 (H2O). Напишите уравнения реакций.
15. Напишите схемы реакций резорцина со следующими реагентами: а) NaOH, б) Br2, в) CH3COCl.
16. Сравните отношения фенола и бензилового спирта к действию следующих реагентов: а) Na, б) NaOH (H2O), в) PCl5, г) Br2. Напишите соответствующие уравнения реакций и назовите продукты.
17. Составьте уравнения реакций по следующей схеме превращений:
O2 10% H2SO4 Na CH3COCl
п-диизопропилбензол А В C Д
CH3Cl
Е
ПРАКТИКУМ
Опыт 51. ОБРАЗОВАНИЕ ФЕНОЛЯТА НАТРИЯ
Р е а к т и в ы: фенол кристаллический, 10% раствор гидроксида натрия
В пробирку помещают около 0,5 г кристаллического фенола и прибавляют 5 мл 10% раствора гидроксида натрия. Фенол полностью растворяется с образованием прозрачного раствора фенолята натрия.
С6Н5ОН NaOH C6H5ONa Н2О
Фенол является слабой кислотой, поэтому он легко растворяется в щелочах.
Раствор фенолята натрия оставляют для последующих реакций.
Опыт 52. РАЗЛОЖЕНИЕ ФЕНОЛЯТА НАТРИЯ КИСЛОТОЙ
Р е а к т и в ы: раствор фенолята натрия, 10% раствор хлороводородной кислоты
В пробирку с прозрачным раствором фенолята натрия, полученного в предыдущем опыте, добавляют 1-2 капли 10%-ного раствора хлороводородной кислоты, наблюдают помутнение жидкости вследствие выделения свободного фенола:
С6Н5ONa HCl C6H5OH NaCl
Феноляты как соединения, образованные слабой кислотой, разлагаются более сильными кислотами.
Опыт 53. ВЗАИМОДЕЙСТВИЕ ФЕНОЛА С СОЛЯМИ УГОЛЬНОЙ КИСЛОТЫ
Р е а к т и в ы: фенол кристаллический, раствор карбоната натрия, раствор бикарбоната натрия
В две пробирки помещают по кристаллику фенола. В одну из них добавляют 2 мл водного раствора карбоната натрия, в другую — 2 мл бикарбоната натрия. Пробирки встряхивают. Полное растворение фенола с образованием фенолята натрия наблюдается в растворе карбоната натрия.
С6Н5ОН Nа2СО3 C6H5ONa NaHCO3
В результате гидролиза раствор карбоната натрия образует достаточно большое количество гидроксильных ионов и хорошо растворяет фенол.
Nа2СО3 НОН NaОН NaHCO3
Угольная кислота более ионизирована, чем фенол. Она способна вытеснять из раствора фенолята натрия фенол. Поэтому фенол не растворяется в растворе бикарбоната натрия.
Опыт 54. ЦВЕТНЫЕ РЕАКЦИИ ФЕНОЛОВ С ХЛОРИДОМ ЖЕЛЕЗА (III)
Р е а к т и в ы: 1% водные растворы фенолов, хлорид железа (III)
В пробирки помещают по 2 мл водных растворов фенолов и добавляют по несколько капель 1% раствора хлорида железа (III). Растворы фенола и резорцина образуют интенсивное фиолетовое окрашивание, раствор пирогаллола — буровато-красное, раствор о-крезола — интенсивно фиолетовое, быстро переходящее в грязно-желтое, м-крезол — фиолетовое, п-крезол — темно-синее. Раствор пирокатехина дает интенсивное зеленое окрашивание, переходящее при сильном разбавлении водой в фиолетово-синее. Раствор гидрохинона сначала зеленеет, затем буреет.
Реакция с хлоридом железа является качественной реакцией на фенолы, химизм этой реакции трактуют по-разному. Одни рассматривают гидроксил как енольную группу С=С-ОН, дающую реакцию окрашивания с хлоридом железа (III) за счет образования окрашенного соединения С6Н5ОFеС12. По мнению других, хлорид железа (III) взаимодействует с фенолами с образованием соединений типа фенолятов.
С6Н5ОН FeCl3 (C6H5О)3Fe
Считают также, что окрашивание является результатом образования сильно диссоциированных комплексных фенолятов трехвалентного железа, образующихся по уравнению:
FeCl3 6С6Н5ОН 6Н [Fe(OC6H5)6]3- 3С1-
Опыт 55. ВЗАИМОДЕЙСТВИЕ ФЕНОЛА С БРОМОМ
Р е а к т и в ы: фенол,бромная вода
К нескольким кристалликам фенола в сухой пробирке добавляют по каплям раствор брома. Наблюдается выделение белого осадка 2,4,6-трибромфенола, бром быстро обесцвечивается на холоду и в обильном количестве выделяется бромистый водород:

При последующем добавлении избытка бромной воды наблюдают превращение белого осадка в светло-желтый (за счет окисления 2,4,6-три-бромфенола и образования 2,4,4,6-тетрабромциклогексадиен-2,5-она-1).

Гидроксильная группа в молекуле фенола, оказывая сильное электронодонорное влияние, активирует бензольное кольцо в реакции бромирования и способствует одновременному замещению атомов водорода в положениях 2,4,6 в отсутствие катализатора. Данная реакция используется для идентификации фенолов со свободными орто- и пара-положениями.
Опыт 56. ОКИСЛЕНИЕ ФЕНОЛОВ КИСЛОРОДОМ ВОЗДУХА В ЩЕЛОЧНОЙ СРЕДЕ
Р е а к т и в ы: 1%-ные водные растворы фенолов (пиракатехин, пирогаллол, гидрохинон), 5% раствор гидроксида натрия
На полоску фильтровальной бумаги (20х4) наносят через равные промежутки по 1-2 капле растворов фенолов. В центр полученных пятен добавляют по 1 капле раствора гидроксида натрия. В центре каждого пятна появляется окрашивание: у пирокатехина — зеленое, у пирогаллола — темно-коричневое, у гидрохинона — желтое с зеленой каймой. Резорцин образует окрашенное пятно коричневого цвета спустя некоторое время.
Под влиянием кислорода воздуха фенолы способны окисляться с образованием очень сложной смеси окрашенных продуктов. Щелочная среда значительно облегчает и ускоряет этот процесс. Окислители действуют одновременно на функциональную группу и бензольное ядро фенолов, что приводит к глубоким изменениям молекулы фенола. Выделить определенные продукты невозможно.
Легкость, с которой ароматическое ядро подвергается окислению, является результатом влияния гидроксильной группы (бензол окисляется с трудом). Вступая в сопряжение с подвижной р-электронной системой бензольного ядра, свободная электронная пара кислорода оказывается частично в тянутой в ядро, повышает электронную плотность в нем, а следовательно, облегчает вступление в реакции электрофильного замещения и в частности реакции окисления.
Опыт 57. ДЕЙСТВИЕ ПЕРМАНГАНАТА КАЛИЯ НА ФЕНОЛ
Р е а к т и в ы: 1% раствор фенола, 5% раствор карбоната натрия, 1% раствор перманганата калия
К раствору фенола в пробирке добавляют половинное количество 5% раствора карбоната натрия и при энергичном встряхивании прикапывают раствор перманганата калия. Раствор быстро обесцвечивается вследствие легко идущего сжижения фонола с образованием сложной смеси продуктов окисления.
Опыт 58. ДЕЙСТВИЕ НИТРАТА СЕРЕБРА НА ФЕНОЛЫ
Р е а к т и в ы: 1%-ные растворы фенолы, 1% раствор нитрата серебра
В пробирки вносят no 1 мл водного раствора многоатомных фенолов и добавляют по нескольку капель 1% раствора нитрата серебра. Появляется коричневое окрашивание раствора, выпадает темный осадок серебра.
С6Н5OH AgNО3 Agv …
Многоатомные фенолы являются сильными восстановителями, они легко выделяют свободное серебро из раствора нитрата серебра. Наиболее легко выделяет серебро пирогаллол, значительно медленнее — резорцин.
Опыт 59. НИТРОЗОРЕАКЦИЯ ФЕНОЛОВ (реакция Либермана)
Р е а к т и в ы: 10% раствор фенола, 10% раствор нитрита натрия, концентрированная серная кислота, 5% гидроксида натрия
В пробирку помещают 0,5 мл концентрированной серной кислоты, 2-3 капли 10%-ного раствора фенола и 1 каплю 10%-ного раствора нитрита натрия. При встряхивании смесь окрашивается в сине-фиолетовый цвет. Окрашенную смесь выливают в стакан с 5 мл воды — появляется розово-красная окраска раствора. При добавлении 5%-ного раствора гидроксида натрия раствор окрашивается в синий цвет:

п-нитрозофенол п-бензохинонмонооксим

раствор синего цвета

раствор розово-красного цвета раствор синего цвета
Реакция основана на конденсации фенола (п-бензохинонмонооксима) с избытком фенола в присутствии концентрированной серной кислоты. Образующийся индофенол относится к группе хинониминовых красителей и изменяет окраску в зависимости от рН среды. Реакция Либермана характерна для фенолов, незамещенных в орто- и пара-положениях.
Опыт 60. ВЗАИМОДЕЙСТВИЕ ФЕНОЛА С РАЗБАВЛЕННОЙ АЗОТНОЙ КИСЛОТОЙ
Р е а к т и в ы: фенол, разбавленная азотная кислота
В пробирке с водой растворяют небольшое количество фенола до образования однородной маслянистой жидкости. В другой пробирке смешивают при охлаждении 2 мл концентрированной азотной кислоты и 3 мл воды. Разбавленную (1:1) кислоту очень медленно по каплям приливают к фенолу, все время сильно встряхивая и охлаждая пробирку. Реакция идет бурно. Добавив всю кислоту, выливают реакционную смесь в трехкратный объем воды, встряхивают. На дне стаканчика выделяется тяжелое масло, представляющее собой смесь о- и п-нитрофенолов.

Гидроксильная группа, стоящая в бензольном ядре, являясь заместителем I рода, активирует о- и п- водород бензольного ядра.
Реакция замещения у фенолов протекает легче, чем ароматических углеводородов. Поэтому реакция нитрования фенола происходит и при действии разбавленной азотной кислоты.
Опыт 61. ВЗАИМОДЕЙСТВИЕ ФЕНОЛА С КОНЦЕНТРИРОВАННОЙ АЗОТНОЙ КИСЛОТОЙ
Р е а к т и в ы: фенол, концентрированная азотная кислота
В небольшую коническую колбу наливают 5 мл азотной кислоты (уд. вес 1,3) и по каплям при размешивании приливают около 0,5 г расплавленного фенола. После взбалтывания смесь нагревают до кипения.
После охлаждения выпадают кристаллы пикриновой кислоты. Их можно отделить фильтрованием через сталунный фильтр.
ОН О2N ОН NO2
3НNO3 (конц.) 3Н2О
NO2
Опыт 62. СВОЙСТВА ТРИНИТРОФЕНОЛА
Р е а к т и в ы: насыщенный раствор тринитрофенола (пикриновая кислота), 10% раствор гидроксида натрия, 10% раствор серной кислоты, 1% раствор хлорида железа (III).
а) К насыщенному водному раствору пикриновой кислоты добавляют несколько капель раствора щелочи — светло-желтая окраска переходит в темную желто-оранжевую.
При подкислении щелочного раствора серной кислотой жидкость снова приобретает светло-желтую окраску.
б) К раствору пикриновой кислоты добавляют 1-2 капли раствора хлорида железа — окраска смеси не меняется.
При введении в ароматическое ядро нитрогруппы усиливаются кислотные свойства фенолов. Нитрофеноляты щелочных металлов по свойствам близки к настоящим солям. В растворах они окрашены в ярко-желтый цвет. Это углубление окраски нитрофенолов в щелочном растворе обусловлено изменением структуры нитрофенола по сравнению с его нейтральной молекулой.
Большинство нитрофенолов не дает характерного для многих фенолов окрашивания с хлорным железом.
Опыт 63. ВОССТАНОВЛЕНИЕ ПИКРИНОВОЙ КИСЛОТЫ
Р е а к т и в ы: пикриновая кислота, глюкоза, раствор гидрокарбоната натрия
Несколько кристалликов пикриновой кислоты растворяют в 3-4 мл раствора гидрокарбоната натрия и добавляют на кончике ножа глюкозу. При кипячении смеси в течение 2-3 мин оранжевый раствор пикрата натрия постепенно окрашивается в кроваво-красный цвет. При подкислении охлажденной жидкости разбавленной серной кислотой красное окрашивание переходит в оранжево-желтое.
Глюкоза, легко окисляющаяся в щелочном растворе, восстанавливает одну из нитрогрупп пикриновой кислоты до аминогруппы.
Образующаяся пикраминовая кислота, как и другие нитрофенолы, дает со щелочами окрашенные феноляты.
III.9. ПРОСТЫЕ ЭФИРЫ
Производные спиртов, фенолов, образующиеся в результате замещения атома водорода гидроксильной группы углеводородным остатком, называют простыми эфирами.
R — O — R?.
Радикалы в простых эфирах могут быть одинаковыми (симметричные эфиры) или разными (несимметричные или смешанные эфиры):
C2H5-О-C2H5 CH3-O-C2H5
C6H5-O-C6H5 CH3-O-C6H5
симметричные несимметричные
Названия простых эфиров по радикало-функциональной номенклатуре обычно образуют из названий углеводородных радикалов, связанных с кислородом, и суффикса -овый. В заместительной номенклатуре ИЮПАК их рассматривают как производные углеводородов, в которых один из атомов водорода замещен алкоксигруппой (RО-). За родоначальную структуру принимается более сложный по структуре радикал, например:
СН3-О-СН-СН2-СН3 СН3-СН2-О-СН2-СН-СН3
СН3 СH3
метилвтор.бутиловый эфир (Р.Ф.) этилизобутиловый эфир (Р.Ф.)
2-метоксибутан (ИЮПАК) 2-метил-1-этоксипропан (ИЮПАК)
Получают простые эфиры взаимодействием алкоголятов и фенолятов с галогеналканами (реакция Вильямсона) и межмолекулярной дегидратацией из спиртов.
В химическом отношении простые эфиры являются весьма инертными веществами. Разведенные минеральные кислоты и щелочи на холоду с ними не реагируют. За счет наличия на атоме кислорода неподеленных пар электронов простые эфиры проявляют слабые основные свойства. Под действием иодоводородной и концентрированной серной кислот простые эфиры подвергаются расщеплению. Концентрированные минеральные кислоты (НСl, H2SO4, НNO3) образуют с простыми эфирами оксониевые соли. Протон кислоты присоединяется за счет неподеленной пары электронов атома кислорода. При длительном пребывании на воздухе простые эфиры окисляются с образованием взрывоопасных гидропероксидов R-О-ОН и пероксидов R-O-O-R?.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы следующих соединений и назовите их по международной номенклатуре: а) метилэтиловый эфир, б) метил-изопропиловый эфир, в) дипропиловый эфир, г) метилфениловый эфир, д) монометиловый эфир этиленгликоля, е) дифениловый эфир.
2. Назовите приведенные соединения по радикало-функциональной и систематической номенклатуре:
а) (СН3)3С-О-СН-СН3 б) СН3-СН2-О-СН2-СН-СН3
СН3 СH3
в) СН3-СН2-О-СН-СН2-СН3 г) СН3-О-СН2-СH2-СН3
СН3
д) С6Н5-О-СН-СН3 к) СН3-СН2-О-С6Н5
СН3
3. Напишите схемы реакций, позволяющих получить: а) диизопропиловый эфир из пропана, б) ди-втор-бутиловый эфир из бутилхлорида.
4. Напишите уравнения реакций, подтверждающих наличие слабых основных свойств простых эфиров.
5. Приведите два способа получения диэтилового эфира и напишите уравнения реакций его взаимодействия со следующими реагентами: а) конц. НСl, б) конц. H2SO4, в) HI, г) О2, д) Nа. Назовите полученные продукты.
6. Какие соединения образуются при расщеплении йодоводородной кислотой на холоду и при нагревании следующих простых эфиров: а) метилэтиловый эфир, б) метилизопропиловый эфир? Напишите соответствующие уравнения реакций.
7. Какими реакциями можно проверить чистоту диэтилового эфира?
8. С помощью каких химических реакций можно отличить диэтиловый эфир от изомерного бутилового спирта?
9. С помощью каких реакций можно получить а) из пропилена диизопропиловый эфир, б) из бензола метилфениловый эфир. Приведите соответствующие уравнения реакций.
10. Составьте уравнения по следующим схемам превращения:
? ? ?
а) СН СН СН3 — СНО С2Н5ОН СН3-СН2-О-С2Н5
Н2О, Н PСl5 CH3ONa Na, t
б) пропилен 1 2 3 4
HI, t
5
HCl
6
11. Приведите все возможные структурные формулы простых эфиров, имеющих формулу С4Н10О. Назовите соединения.
12. Какие соединения образуются при нагревании следующих эфиров с концентрированной HI, взятой в избытке: а) н-пропиловый, б) метилбутиловый?
13. Напишите уравнение расщепления диизобутилового эфира при нагревании с концентрированной серной кислотой.
14. Как действуют щелочные металлы на простые эфиры на холоду и при нагревании?
ПРАКТИКУМ
Опыт 64. ПОЛУЧЕНИЕ ДИЭТИЛОВОГО ЭФИРА
Р е а к т и в ы: этиловый спирт, концентрированна серная кислота
В сухую пробирку наливают смесь равных объемов этилового спирта и концентрированной серной кислоты. Пробирку нагревают на песчаной бане до 130-1400 и чрезвычайно осторожно, по каплям добавляют спирт. При этом ощущается запах диэтилового эфира.
СНЗСН2ОН НОSО2ОН СН3СН2ОSО2OН H2O
1300
СНЗСН2ОSО2ОН НОСН2СН3 СН3СН2ОСН2СН3 H2S04
Опыт 65. РАСТВОРИМОСТЬ ЭФИРА
Р е а к т и в ы: диэтиловый эфир, этиловый спирт
В одну из двух пробирок наливают 1 мл воды, в другую — 1 мл спирта, добавляют по 1 мл эфира. В первой пробирке эфир всплывает, а во второй образуется однородный раствор.
Эфир легче воды, почти не растворяется в ней. Со спиртом он смешивается в любых соотношениях.
Опыт 66. РАСТВОРИМОСТЬ ОРГАНИЧЕСКИХ ВЕЩЕСТВ В ЭФИРЕ
Р е а к т и в ы: диэтиловый эфир, растительное масло
В пробирку вносят 0,5 мл растительного масла и 2-3 мл эфира. При взбалтывании масло легко растворяется. Эфир — хороший растворитель. Он широко применяется для растворения многих органических веществ.
Опыт 67. ОПРЕДЕЛЕНИЕ ЧИСТОТЫ ДИЭТИЛОВОГО ЭФИРА
Р е а к т и в ы: эфир чистый (в стандартной упаковке), эфир загрязненный, раствор йодида калия, фуксинсернистая кислота
Опыт проводят с чистым и загрязненным эфиром. Эфир смешивают в пробирке с раствором йодида калия. При этом загрязненный эфир вследствие выделения йода окрашивается в желтый цвет.
КI НОН НI КОН
НI C2H5O-С2Н5 I2 Н2О (С2Н5)2O
Эфир смешивают в пробирке с раствором фуксинсернистой кислоты, если эфир чист, окрашивание не появляется (отсутствие уксусного альдегида).
При длительном хранении на свету в присутствии воздуха этиловый эфир, как и другие простые эфиры, легко подвергается самоокислению (аутоокисление). Процесс протекает медленно при участии молекулярного кислорода воздуха, при этом образуются перекисные и гидроперекисные соединения.
ОН
О-ОН
О2 СН3СН2-О СН3СН-О
С2Н5-О-С2Н5 СН3СНО-СН2СН3 или
СН3СН2-О СН3СН-О
ОН
ОН
ОН ОН О
СН3-СН-О
НОН СН3-СН-О-ОН СН3-СН-ОН 2 СН3-С-Н
СНз-СН-О
ОН
Опыт 68. ВЗАИМОДЕЙСТВИЕ ДИЭТИЛОВОГО ЭФИРА С КИСЛОТАМИ
Р е а к т и в ы: эфир, концентрированные серная и соляная кислоты, 5% раствор гидроксида натрия
В одну из двух пробирок наливают 2 мл концентрированной серной кислоты, в другую — 2 мл соляной кислоты. Охладив их до 00, осторожно, малыми порциями, добавляют в каждую пробирку по 1 мл охлаждeного эфира, все время взбалтывая и охлаждая реакционную смесь. У образующихся гомогенных растворов запах эфира отсутствует. Обе смеси осторожно разливают по двум пробиркам, содержащим по 5 мл холодной воды с кусочками льда. Появляется запах и эфир всплывает над водой. При осторожном добавлении нескольких капель разбавленного раствора щелочи для нейтрализации части кислоты слой эфира заметно увеличивается.
—
C2H5-О-С2Н5 H2SO4 [C2H5-О-С2Н5]HSO4
H
-____
C2H5-О-С2Н5 HCl[C2H5-О-С2Н5]Cl
H
Комплексный ион оксония образуется за счет присоединения протона водорода кислоты к cвободной паре электронов атома кислорода. Новая ковалентная связь по механизму образования является координационной или донорно — акцепторной. Ион оксония связан с анионом хлора электровалентной связью. Соли замещенного оксония непрочны и при прибавлении воды полностью разлагаются на исходные соединения.
H2O
[C2H5-О-С2Н5]HSO4—C2H5-О-С2Н5 H2SO4
H
— H2O
[C2H5-О-С2Н5]ClC2H5-О-С2Н5 HCl
H


