- Введение в курс дела
- Основные свойства аминокислот
- Амины
- Библиографическая ссылка
- Взаимодействие анилина с азотистой кислотой
- Взаимодействие анилина с галогенами
- Взаимодействие анилина с кислотами
- Взаимодействие с галогеналканами
- Взаимодействие с кислотами
- Глицин — предшественник гема
- Глицин в белках и пептидах
- Глицин как участник других жизненно важных реакций
- Образование внутренних солей аминокислот в водном растворе
- Общие особенности строения аминов
- Откуда берется глицин в организме?
- Реакции алкилирования анилина
- Химические свойства аминокислот
- Химические свойства анилина
- Химические свойства предельных аминов
- Этерификация аминокислот
Введение в курс дела
Аминокислоты — это одни из самых важных веществ в живой природе. Будучи довольно небольшими молекулами, они играют огромную роль в живых организмах. Подобно жемчужинам в ожерелье, они слагают большие молекулы — белки, из которых построены все живые существа — от мала до велика.
Эта статья посвящена глицину — самой маленькой из всех теоретически возможных аминокислот. Но, несмотря на свою крохотную боковую группу, представленную одним протоном, глицин — неотъемлемый компонент белков и участник нескольких важных процессов. Поговорка «мал, да удал» — это про глицин!
В первой части статьи мы рассмотрим некоторые белки и пептиды, для которых глицин имеет большое значение, а также разберем, откуда глицин в организме вообще берется и в чем, кроме белков, используется. Мы не будем претендовать на абсолютную полноту картины функций глицина, но остановимся на наиболее важных моментах.
Основные свойства аминокислот
1. Образование солей при взаимодействии с кислотами
NH2CH2COOH HCl → [NH3CH2COOH] Cl—
2. Взаимодействие с азотистой кислотой
NH2-CH2-COOH HNO2 → НО-CH2-COOH N2↑ H2O
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
3. Алкилирование
NH2CH2COOH CH3I → [CH3NH2CH2COOH] I—
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
И аланина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Амины
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
По характеру углеводородных заместителей амины делят на
Библиографическая ссылка
Юлдашев Н.М., Акбарходжаева Х.Н., Зиямутдинова З.К., Султанходжаев У.Л., Сулайманова Г.Г. ВЛИЯНИЕ ГЛИЦИНА НА СТЕПЕНЬ ГИПОКСИИ В ОРГАНИЗМЕ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ИНФАРКТЕ МИОКАРДА // Современные проблемы науки и образования. – 2022. – № 5.
;
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
Получение аминов:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты.
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Глицин — предшественник гема
Почему кровь красная? Потому что в ней есть гемоглобин — красный белок, имеющий в своем составе гем. Это железосодержащая порфириновая система, на которую и садится кислород, от легких с кровью поступающий к разным тканям. Глицин является одним из предшественников гема у животных. Реакция с участием глицина представлена на рисунке 5.
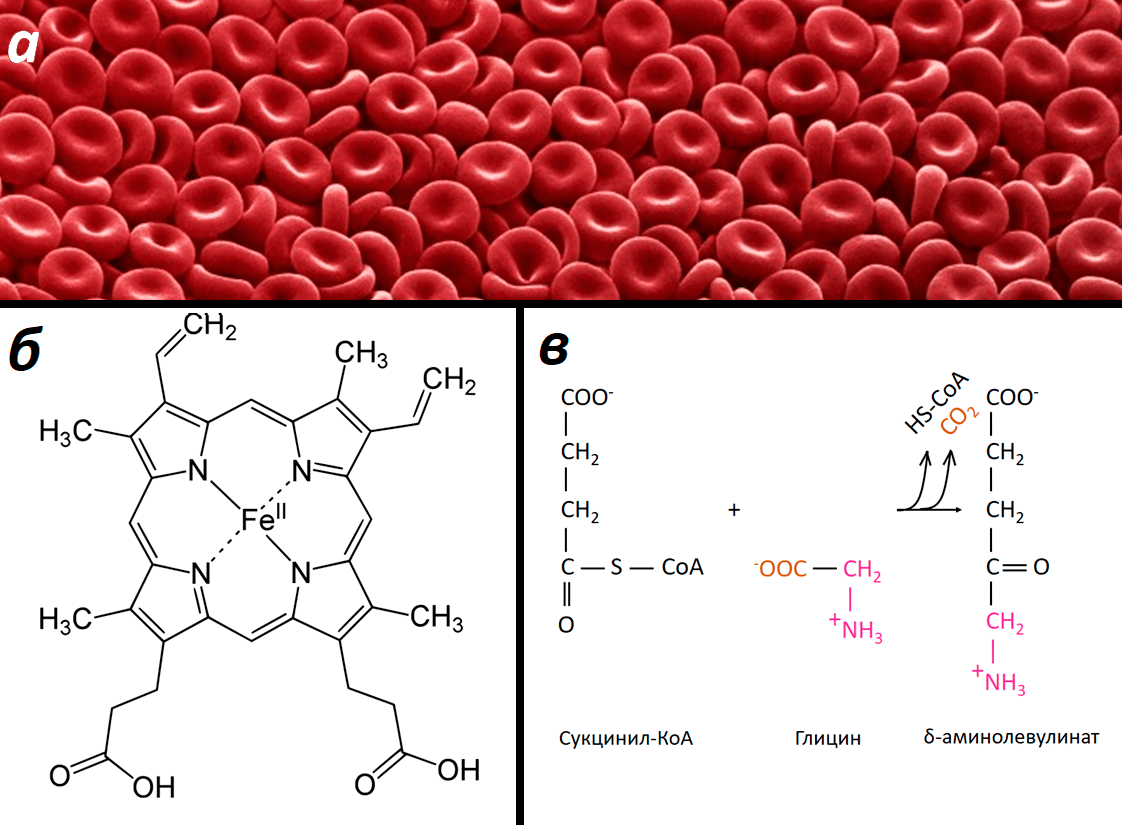
Рисунок 5. Роль глицина в синтезе гема.а — Эритроциты («красные кровяные тельца») — клетки, содержащие красный белок гемоглобин. б — Цвет гемоглобина, а также его транспортная функция обеспечиваются присутствием гема. в — Синтез дельта-аминолевулиновой кислоты из сукцинил-КоА и глицина — первая реакция в синтезе порфириновых систем у животных.
Spark gene therapy nearly eliminates bleeding episodes in hemophilia B patients и «Википедия»
Синтез порфиринов — отдельная большая «опера», причем глицин участвует только в первой «арии», и в этой статье мы не будем изучать полную «партитуру». Тем не менее роль глицина в этом фундаментальном процессе огромна.
Глицин в белках и пептидах
Глицин — вещество не редкое. Почти ни один белок не обходится без него. В среднем глицин составляет чуть больше 7% аминокислотных остатков («жемчужин») в белках [1]. При этом давайте учтем, что разнообразие белковых аминокислот довольно велико, поэтому названная цифра — почти рекорд! А уж где глицина действительно много — так это в коллагене.
Коллаген — сложно устроенный белок, являющийся одним из основных компонентов соединительной ткани. Он присутствует в сухожилиях, коже, кровеносных сосудах, роговице, костях и хрящах, а также в чешуе рыб и шерсти млекопитающих, выполняя структурную роль и составляя до 30% массы позвоночных животных [2]. Таким образом, это один из самых распространенных животных белков. Существует несколько типов коллагена.
Коллаген обеспечивает прочность соединительных тканей, а потому и сам обладает свойством устойчивости к растяжению, и это качество определяется его структурой (рис. 2) [2].
Но причем же тут глицин? Дело в том, что полипептидные нити молекул коллагена, как орнамент, состоят из повторяющегося «узора» — паттерна из трех аминокислотных остатков: Gly—Pro—X и Gly—X—Hyp [3]. Здесь Gly — глицин, Pro — пролин, Hyp — 4-гидроксипролин, X — другая аминокислота.
Из этой формулы видно, что глицин составляет треть аминокислот коллагена! Природа не стала бы играть такими цифрами просто забавы ради. Присутствие глицина — одна из предпосылок к формированию прочных фибрилл и волокон коллагена, необходимых для многих тканей.
Три нити, формирующие коллагеновую суперспираль, переплетаются настолько плотно, что между ними нет свободного пространства. И только лишь один глицин со своей крохотной боковой группой способен интегрироваться в эту систему, как кусочек мозаики. Замена глицина на какую-то другую аминокислоту, имеющую более объемную боковую группу (например, серин), может привести к серьезным патологиям, например, к синдрому Элерса—Данлоса (это гетерогенная группа наследственных нарушений соединительной ткани) [4], [5].
Глицином богат еще один структурный белок — фиброин — основной компонент паутины и шелка. Почти половина аминокислотных остатков фиброина — глицин! Как и в случае с коллагеном, там он входит в состав повторяющейся последовательности.
Белкам близка еще одна группа биологических веществ — пептиды. Они тоже сложены из аминокислот, только меньше белков по размерам (но граница между белками и пептидами размыта).

Рисунок 3. Pyrrhocoris apterus. Это известный многим клоп-солдатик — яркий (во всех смыслах этого слова) представитель отряда полужесткокрылые, или клопы (Hemiptera). При внедрении бактерий в его гемолимфе обнаруживаются несколько антимикробных пептидов, включая богатый глицином гемиптерицин [8]. Не только он, но и многие другие животные борются с патогенами с помощью глицин-богатых пептидов.
«Википедия»
Посмотрим на так называемые антимикробные пептиды. Это, как правило, положительно заряженные (катионные) молекулы, которые участвуют в иммунном ответе, воздействуя на мембраны бактерий или других патогенов [6]. С помощью этих относительно небольших молекул человек и другие животные, включая разнообразных букашек, борются с болезнетворными организмами, которым удалось пробраться во внутреннюю среду.
До сих пор не разработано единой классификации антимикробных пептидов, но известно, что те или иные из них характеризуются определенными структурными особенностями. В частности, в них может в большом количестве присутствовать какая-то аминокислота, в том числе и глицин.
К глицин-богатым антимикробным пептидам относят акалолептины из гемолимфы жука-дровосека Acalolepta luxuriosa, акантоскуррин из гемоцитов паука Acanthoscurria gomesiana, аттацины из насекомых отрядов чешуекрылые и двукрылые, гемиптерицин из известного многим клопа-солдатика Pyrrhocoris apterus (рис. 3) и другие (гименоптецин, гловерины, колеоптерицины, риноцерозин, холотрицин-2 и −3). Глицин-богатые домены имеют пептиды гиастатин и крустины[7], [8].
Конечно, глицин присутствует и во многих других белках и пептидах. Это делает его одной из самых распространенных природных аминокислот.
Глицин как участник других жизненно важных реакций
Что такое ДНК? Правильно! Химический субстрат наследственности. Это знают все. Но не все знают, что каждая из цепей ДНК состоит из «кирпичиков», называемых нуклеотидами. Каждый нуклеотид включает в себя, помимо прочего, азотистое основание. Азотистые основания ДНК бывают двух типов — пуриновые (аденин и гуанин) и пиримидиновые (тимин и цитозин). Глицин принимает участие в синтезе нуклеотидов с пуриновыми основаниями (рис. 6).
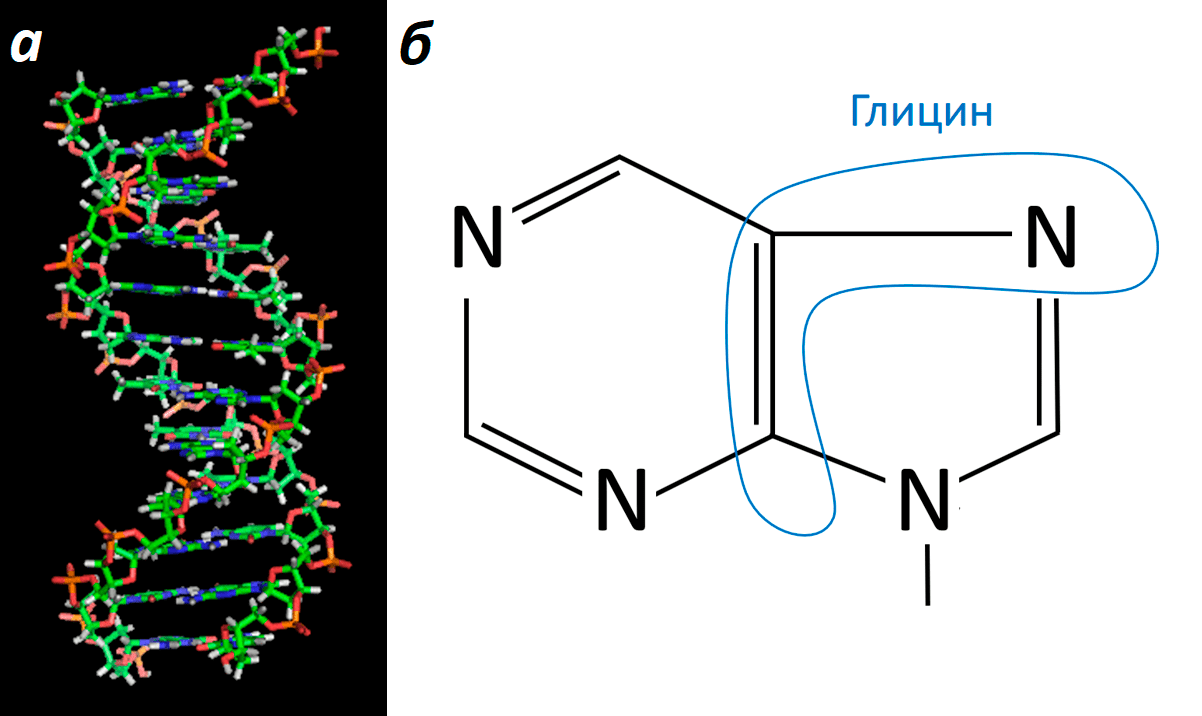
Рисунок 6. ДНК и схема пуринового азотистого основания.а — Модель знаменитой «двойной спирали», на которой хорошо видны «кирпичики» (нуклеотиды), формирующие каждую из двух цепей. б — Схема пуринового азотистого основания, которое соединяется с пентозой в составе нуклеотида; часть этой конструкции формируется за счет глицина.
Wikipedia
При синтезе пуриновых нуклеотидов de novo азотистое основание «садится» на уже готовую связь с пентозой и наращивается постепенно. На одном из начальных этапов в дело вступает глицин, благодаря которому в состав структуры входят два углеродных атома и один азотный.
Разнообразие комбинаций азотистых оснований в молекуле ДНК является основой биологического разнообразия на планете.
Кроме этого, глицин участвует в синтезе креатина (рис. 7) — вещества-аккумулятора энергии в мышцах и нервных клетках, то есть в тех местах организма, где требуется поддерживать высокий уровень энергии.
- Doolittle R.F. Redundancies in protein sequences. In: Predictions of protein structure and the principles of protein conformation / ed. by Fasman G.D. NY: Plenum Press, 1989. — P. 599–623;
- Vincent R. Sherman, Wen Yang, Marc A. Meyers. (2022). The materials science of collagen. Journal of the Mechanical Behavior of Biomedical Materials. 52, 22-50;
- Paul Szpak. (2022). Fish bone chemistry and ultrastructure: implications for taphonomy and stable isotope analysis. Journal of Archaeological Science. 38, 3358-3372;
- Нельсон Д. и Кокс М. Основы биохимии Ленинджера (т. 1, изд. 3, испр.). М.: «Лаборатория знаний», 2022. — 696 с.;
- Paolo Narcisi, Allan J.Richards, Stanley D. Ferguson, F.Michael Pope. (1994). A family with Ehlers — Danlos syndrome type III/articular hypermobility syndrome has a glycine 637 to serine substitution in type III collagen. Hum Mol Genet. 3, 1617-1620;
- Кокряков В.Н. Очерки о врожденном иммунитете. СПб.: «Наука», 2006. — стр. 137–146;
- С. В. Баландин, Т. В. Овчинникова. (2022). Антимикробные пептиды беспозвоночных. Часть 1. Строение, биосинтез и эволюция (Обзорная статья). Биоорган. химия. 42, 255-275;
- S Cociancich, A Dupont, G Hegy, R Lanot, F Holder, et. al.. (1994). Novel inducible antibacterial peptides from a hemipteran insect, the sap-sucking bugPyrrhocoris apterus. Biochem. J.. 300, 567-575;
- Ivano Amelio, Francesca Cutruzzolá, Alexey Antonov, Massimiliano Agostini, Gerry Melino. (2022). Serine and glycine metabolism in cancer. Trends in Biochemical Sciences. 39, 191-198.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным ( I) эффектом.
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается.
Откуда берется глицин в организме?
Конечно, эта чудесная аминокислота попадает к нам с пищей в составе белков. Тем не менее основной источник глицина — процессы синтеза, проходящие в нашем теле, что позволяет отнести глицин к заменимым аминокислотам.
Главный его предшественник — серин. Это тоже аминокислота, только в ее молекуле на один атом углерода больше. Что же с ним сделать? Здесь природа идет по проторенной дорожке: она передает его на вещество-кофермент тетрагидрофолат, который «любит» одноуглеродные фрагменты. В результате реакции на свет рождается глицин (рис. 4).
У позвоночных животных, включая и нас любимых, есть еще один любопытный способ произвести глицин. Исходными веществами в реакции, катализируемой ферментом глицинсинтазой, являются довольно простые вещества — углекислый газ и аммиак (в виде иона). Эта реакция тоже не обходится без уже известного нам «любителя» одноуглеродных фрагментов:
Voilà! (Извините за мой французский.) Образовавшийся глицин поступает на службу организму.
Гиперактивация серинглицинового биосинтетического пути способна привести к развитию рака, ведь этот путь важен для получения большого количества «строительных» веществ (нуклеиновых кислот, белков, липидов), которые так необходимы активно делящимся раковым клеткам. Антифолатная химиотерапия широко используется в лечении рака [9].
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных.
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
NH2CH2COOH CH3OH → NH2CH2COOCH3 H2O

