— § 1. сера
Будучи известной еще древним египтянам, сера играла большую роль в
теоретических представлениях алхимиков, так как считалась наиболее совершенным
выразителем одного из «основных начал» природы – горючести. По содержанию в
земной коре (0,03%) она относится к весьма распространенным элементам.
Формы
нахождения серы в природе разнообразны. Иногда она встречается в самородном
состоянии, но основная ее масса связана с металлами в
составе различных минералов, которые могут быть разбиты на две большие группы:
сернистых и сернокислых соединений. Из минералов первого типа особое значение
для технологии серы имеет пирит (FeS2 ).
К минералам второго типа относится, например, гипс (CaSO4 . 2Н2 О). Кроме того, соединения серы обычно присутствуют в вулканических газах и воде некоторых минеральных
источников. Сера входит также в состав белковых веществ и поэтому всегда
содержится в организмах животных и растений.
Мировое
потребление серы составляет около 4 млн. т ежегодно. Довольно значительная
часть этого количества расходуется для борьбы с вредителями сельского
хозяйства. Промышленными потребителями серы являются производства:
сернокислотное, бумажное, резиновое, спичечное и др. Сера широко используется также
в пиротехнике «и отчасти в медицине.
Свободная сера
может быть получена либо из ее самородных месторождений, либо из соединений.
Почти вся миро
вая выработка осуществляется по первому
варианту, причем технологический процесс сводится к отделению серы от смешанных
с нею пород (песка, глины и т. п.). Это достигается обычно путем плавлениясеры
в результате обработки руды нагретым до 140–150°С водяным паром.
Получаемая из
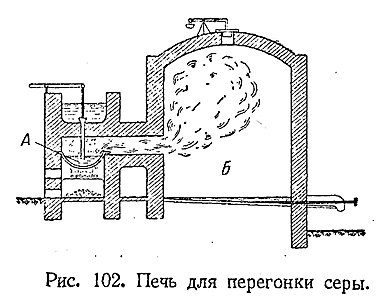
природных месторождений сера почти всегда родержит примеси. Для очистки ее подвергают
перегонке в специальных печах (рис. 102). Парсеры, нагреваемый в чаше А,
попадая в камеру Б, быстро охлаждается и сера оседает на стенках в виде
мельчайших пылинок («серного цвета»). Если камера Б нагрета выше 120 °С, то
получается жидкая сера, которая затем нацело затвердевает. Такая сплавленная
сера обычно и поступает в продажу.
Чистая сера
представляет собой желтое кристаллическое вещество с плотностью около 2,
плавящееся при 119°С и кипящее при 445°С. Она очень плохо проводит тепло и
электричество. В водесера нерастворима. Лучшим ее растворителем является
сероуглерод (CS2 ).
1) Для твердой
элементарной серы типичны две аллотропические формы. Ниже 95,6 °С устойчива
обычная желтая сера с плотностью 2,07, имеющая т. пл. 112,8 °С (при быстром нагревании).
Напротив, выше 95,6 °С устойчива почти бесцветная модификация с плотностью 1,96
и т. пл. 119,3°С. Различие обеих форм обусловлено их разной кристаллической
структурой.
2) Плавлениесеры сопровождается заметным увеличением ее объема (примерно на 15%).
Расплавленная сера представляет собой желтую, легкоподвижную жидкость, которая
выше 160 °С буреет и при 190 °С превращается в темно–коричневую вязкую массу.
Выше 190 °С вязкость ее начинает уменьшаться и около 400°С расплавленная сера,
оставаясь темно–коричневой, вновь становится легкоподвижной.
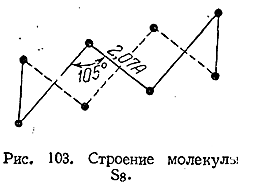
Эти переходы
свойств при нагревании обусловлены изменением внутреннего строения серы. Для
нее при обычных условиях характерны восьмиатомныекольцевые
молекулы (рис. 103). Выше 160 °С кольца S8 начинают разрываться, переходя в открытые цепи, что
сопровождается повышением вязкости (и изменением цвета). Дальнейшее нагревание
выше 190 °С ведет к уменьшению средней длины подобных цепей, вследствие чего
вязкость вновь понижается.
3) Чистая сера
не ядовита. Прием внутрь небольших ее количеств способствует рассасыванию нарывов и
полезен, в частности, при геморрое. Организм человека не обнаруживает
привыкания к сере. Очень мелко раздробленная (осажденная) сера входит в состав
ряда мазей, предназначаемых для ухода за кожей и лечения кожных заболеваний.
На холоду сера
довольно инертна (энергично соединяется только с фтором), но при нагревании
становится весьма химически активной – реагирует с галоидами (кроме иода),
кислородом, водородом и почти со всеми металлами. В результате реакций
последнего типа образуются соответствующие сернистые соединения, например, по
уравнению:
Fe S = >FeS 23 ккал
С водородомсера в обычных условиях не соединяется. Лишь при нагревании имеет место
обратимая реакция
Н2 S = > H2 S 5 ккал
равновесие
которой около 350 °С смещено вправо, а при дальнейшем повышении температуры
смещается влево. Практически сероводород (H2 S) получают обычно действием разбавленных кислот на
сернистые металлы по реакции, например:
FeS 2HCl = >FeCl2 H2 S
4) Удобный
способ добывания H2 S состоит в
нагревании приблизительно до 300 °С смеси серы с парафином (2:1 по весу) и
измельченным асбестом. При охлаждении реакция прекращается, но может быть вновь
вызвана нагреванием.
Сероводород
представляет собой бесцветный газ (т. пл. –86 СС, т. кип. –60 °С).
Уже 1 ч. H2 S на 100 000 ч.
воздуха обнаруживается по его характерному запаху (тухлых яиц). Сероводород
весьма ядовит. Будучи подожжен на
воздухе, он сгорает по одному из следующих уравнений:
2H2 S
ЗО2 = 2H2 О 2SO2 (при избытке кислорода)
2H2 S
O2 = 2H2 O
2S (при недостатке
кислорода)
Один объем воды растворяет при обычных
условиях около 3 объемов сероводорода (с образованием приблизительно 0,1 М
раствора). При стоянии на воздухе водный раствор H2 S («сероводородная вода») постепенно
мутнеет вследствие выделения серы по второй из приведенных выше реакций. Иод
легко восстанавливается сероводородом по уравнению:
J2 H2 S = 2HJ S
Аналогично действует сероводород и на
многие другие вещества. Он является, таким образом, сильным восстановителем. В
водном растворе H2 S ведет себя как весьма слабая кислота. Средние соли этой
сероводородной кислоты (с анионом S2-) называются сернистыми или сульфидами, кислые соли (с анионом
HS–) – кислыми сернистыми или гидросульфидами. Несмотря
на бесцветность самих ионов S» и HS’, многие солисероводородной кислоты окрашены в характерные цвета.
Подавляющее большинство сульфидов (за исключением производных Na, К и немногих других катионов) очень
труднорастворимо в воде. Напротив, большая часть гидросульфидов хорошо
растворима (и известна лишь в растворе).
5)
Сероводородная кислота (К1 = 9·10–8
и К2 = 4·10–13) несколько слабее угольной. Помимо прямого
соединения металла с серой и реакциинейтрализации, многие ее соли могут быть
получены обменным разложением солей соответствующего металла с H2 S или (NH4 )2 S. Часто применяемый в лабораториях раствор
последней соли готовят обычно, насыщая сероводородомраствор NH4 OH (что дает NH4 SH) и смешивая его затем с равным объемом NH4 OH.
6) На различной растворимости
сернистых соединений отдельных металлов основан обычный систематический ход
качественного анализакатионов. Одни из них (Na·, К·, Ва·· и др.) образуют сульфиды,
растворимые в воде, другие (Fe · Mn’,
Zn» и др.)–не растворимые в воде, но растворяющиеся в разбавленной
НСl, наконец, третьи (Cu··, Pb·· H··и др.)–не растворимые ни в воде, ни в
разбавленных кислотах. Поэтому, действуя на раствор смеси катионовсероводородом сначала в кислой среде, затем в слабощелочной, можно отделить
рассматриваемые группы катионов друг от друга и дальше вести анализ уже в
пределах каждой из них отдельно.
7) При внесении
в крепкий растворсульфида мелко растертой серы она растворяется с образованием
соответствующего полисульфида (многосернистого соединения), например: (NH4 )2 S ( x– 1)S = (NH4 )2 Sx . Обычно
образуется смесь полисульфидов с различным содержанием серы. По мере увеличения
х цвет соединения меняется от желтого через оранжевый к красному. Интенсивно
красную окраску имеет и самое богатое серой соединение этого типа– (NH4 )2 S9 . Из встречающихся
в природе полисульфидов наиболее известен минералпирит (FeS2 ), представляющий собой железную соль
двусернистого водорода.
8) Если крепкий
растворполисульфида вылить в избыток раствора НСl, на дне сосуда собирается тяжелое
масло, представляющее собой смесь многосернистых водородов общей формулы H2 Sx . В
индивидуальном состоянии были выделены все члены ряда вплоть до Н2 S6 .
Они представляют собой очень неустойчивые маслянистые желтые жидкости с резким
запахом.
Сродство серы к
галоидам по ряду F–Сl–Вr–J настолько
быстро уменьшается, что ее йодистое производное получить вообще не удается. С
остальными галоидами она более или менее легко соединяется. Из образующихся
соединений наиболее интересна газообразная при обычных условиях шестифтористая
сера (SF6 ). Она бесцветна,
не имеет запаха и не ядовита. От других галоге–нидов серы SF6 отличается своей исключительной
химической инертностью. Как газообразный изолятор, она находит применение в
высоковольтных установках. Жидкая при обычных условиях хлористая сера (S2 CI2 ) используется в
резиновой промышленности.
9) Некоторые
свойства галоидных соединений серы сопоставлены ниже:

Большинство этих
соединений образуется при непосредственном взаимодействии элементов и легко
разлагается водой.
Заметное взаимодействие серы с кислородом
наступает лишь при нагревании. Будучи подожжена на воздухе, она сгорает синим
пламенем с образованием двуокиси по реакции:
S O2
= SO2 71 ккал
Молекула O = S = O полярна (длина диполя 0,33 А). Атомы ее
располагаются в углах равнобедренного треугольника с S при вершине [d(SO) = 1,43 А, а (альфа) = 120°]. Двуокись серы (иначе,
сернистый газ) представляет собой бесцветный газ с характерным резким запахом
(т. пл, –73°С, т. кип. –10°С). Растворимость его составляет при обычных
условиях около 40 объемов на 1 объем воды.
Сернистый газ химически весьма активен.
Характерные для него реакции можно разбить на три группы: а) протекающие без
изменения валентностисеры, б) связанные с ее понижением и в) идущие с ее повышением.
Процессом первого типа является прежде
всего взаимодействие сернистого газа с водой, ведущее к образованию сернистой
кислоты (H2 SO3 ). Последняя, будучи кислотой средней силы, вместе с тем малоустойчива.
Поэтому в водном растворесернистого газа одновременно имеют место следующие
равновесия:
H2 O
SO2 < = > H2 SO4 < = > H·
HSO’3 < = > 2H· SO’’3
Постоянное
наличие значительной доли химически не связанного с водойсернистого газа
обусловливает резкий запах растворовсернистой кислоты, В безводном состоянии
она не выделена.
При нагревании
растворовсернистой кислоты SO2 улетучивается и
приведенные выше равновесия смещаются влево. Кипячением раствора можно добиться
полного удаления SO2 . Напротив, при
прибавлении щелочейравновесия смещаются вправо (вследствие связывания ионов Н·) и жидкость, содержащая теперь уже
соответствующие солисернистой кислоты (называемые сернистокислыми), перестает
пахнуть сернистым газом.
Будучи
двухосновной, сернистая кислота дает два ряда солей: средние (сульфиты) и кислые
(бисульфиты). Подобно самим ионам SO’’3 и НSО’з , и те и
другие, как правило, бесцветны. Бисульфиты устойчивы только в растворах, а из
сульфитов обычных металлов растворимы лишь солинатрия и калия.
10) Равновесие
между безводной и гидратированной формами сернистого газа в растворе
определяется соотношением: [SO2 ][H2O]/[H2 SO3 ]
= 16. Для сернистой кислоты (K1 =
2·10–2и К2 = 6·10–8) принимают возможность
существования двух структур:
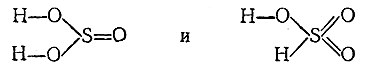
Самой кислоте и
большинству ее средних солей отвечает, по–видимому, первая из них, некоторым
солям (наименее активных металлов) и многим органическим производным – вторая.
Последняя вероятна также для кислых солей.
11) Соли H2 SO3 получают обычно
взаимодействием SO2 с гидроокисями
или карбонатамиметаллов в водной среде. Наибольшее значение из них имеет
известный только в растворебисульфиткальция [Са(НОз)2 ], который под названием «сульфитного щелока» в громадных
количествах потребляется целлюлозной промышленностью для извлечения из
древесинылигнина.
При накаливании
сульфитов активных металлов они около 600°С разла· гаются с образованием
соответствующих солей серной и сероводородной кислот, например, пе реакции:
4K2 SO3 = 3K2 SO4 K2 S
Процесс этот
аналогичен образованию перхлоратов и хлоридов при накаливании хлоратов.
Химические
процессы, сопровождающиеся понижением валентностисеры, для сернистого газа
сравнительно малохарактерны. Практически важно быстро идущее в присутствии
катализатора (боксит) при 500 °С восстановление SO2окисью углерода:
SO2 2CO = 2СО2 S
Рассматриваемый
процесс находит применение для извлечения серы из отходящих газов некоторых
металлургических заводов.
Другим
интересным случаем является взаимодействие SO2 с сероводородом по уравнению:
SO2 2H2 S = 2H2 O 3S
Реакция эта
самопроизвольно протекает уже при обычных усло.–виях, однако с заметной
скоростью лишь в присутствии следов (т. е. очень малых количеств) воды.
12) В
присутствии больших количеств воды взаимодействие SO2 и H2 S идет весьма
сложно: кроме свободной серы, образуется смесь кислот общей формулы H2 Sx O6 (где х = 3–6), называемых
политионовым. Атомысеры в них непосредственно связаны друг с другом, образуя
цепочку. Например, тетратионовой кислоте (H2 S4 O6 ) отвечает строение НО–SO2 –S–S–SO2 –ОН. Политионовые кислоты сравнительно
неустойчивы и известны только в водном растворе (где довольно сильно
диссоциированы), но некоторые их соли были выделены. Все они хорошо растворимы
в воде.
13) При
обработке сернистым газом водной суспензиицинка по схеме Zn 2SO2 = ZnS2 O4 образуется
цинковая соль гидросернистой кислоты (H2 S2 O4 ).
Исходя
из этой соли, обменным разложением могут быть получены и некоторые другие
гидросульфиты. Они бесцветны, легко растворимы в воде (за исключением CaS2 O4 ) и обладают
сильными восстановительными свойствами. Свободная H2 S2 O4 (K1 = 5·10–1, K2 = 4·10–3)
крайне неустойчива – постепенно разлагается даже в разбавленных растворах и
легко окисляется кислородомвоздуха.
Наиболее характерны для производных
четырехвалентной серыреакции, связанные с повышением ее валентности: и сама
сернистая кислота и ее соли являются сильными восстановителями. Растворы их уже
при стоянии на воздухе постепенно (очень медленно) присоединяют кислород:
2Na2 SO3 О2 = 2Na2 SO4
Несравненно быстрее (практически
моментально) протекает окислениесернистой кислоты и сульфитов при действии
таких окислителей, как КМnО4 , Вr2 , J2 и т. п. В результате
окисления образуется серная кислота или ее соль, например, по реакции:
J2 Н2 О Na2 SO3
= 2HJ Na2 SO4
Наряду с кислородомсульфиты способны
присоединять также серу, переходя при этом в соли серноватистой (иначе –
тиосерной) кислоты по реакции, например:
Na2 SO3
S = Na2 S2 O3
Как я в случае кислорода, присоединение
серы идет медленно и для получения серноват истокислых солей (иначе –
тиосульфатов) приходится реакционную смесь кипятить.
Серноватистой
кислоте отвечает структурная формула:

Атомысеры в
ней имеют разную валентность ( 6 и –2). Это необходимо учитывать при
составлении уравнений реакций, протекающих с участием H2 S2 O3 или ее солей.
По силе
серноватистая кислота близка к серной, но сама она совершенно неустойчива
(распадается на сернистую кислоту и серу). Напротив, многие ее соли (из которых
известны лишь средние) вполне устойчивы. Как правило, они бесцветны и хорошо
растворимы в воде. Наибольшее значение имеет Na2 S2 O3 ·5H2 O т.н. гипосульфит). Соль эта используется главным
образом в фотографии и как «антихлор». Последнее применение основано на
восстановительных свойствах гипосульфита, легко окисляющегося под действием
хлора до серной кислоты:
Na2 S2 O3 4Cl2
5Н2 О = 2H2 SO4
2NaCl 6HCl
Гипосульфит
используется и в медицине (при лечении чесотки и т. д.).
14) Подобно
свободному хлору, другие сильные окислители (НОСl, Вr2 и т. п.) окисляют гипосульфит до серной кислоты и ее солей.
Иначе, а именно с образованием соли тетратионовой кислоты, протекает окислениегипосульфита сравнительно слабыми (или медленно действующими) окислителями, в
частности иодом: J2 2Na2 S2 O3
= > 2NaJ Na2 S4 O6 . Реакция эта
имеет большое значение для аналитической химии.
Для самого сернистого
газа процессы, ведущие к повышению валентностисеры, протекают значительно
труднее, чем для сернистой кислоты и ее солей. Наиболее важными из подобных
реакций являются взаимодействия SO2 с хлором и
кислородом.
С хлоромсернистый газ соединяется только на прямом солнечном свету или в присутствии
катализатора (камфора) по реакции
SO2 Сl2 = >SO2 Cl2
с образованием
хлористого сульфурила (SO2 CI2 ).
Последний
представляет собой бесцветную жидкость с резким запахом. Водой он разлагается
(холодной–лишь медленно)
с образованием серной и соляной кислот:
SO2 Cl2 2Н2 О
– H2 SO4 2HCl
Вещество,
дающее при взаимодействии с водой смесь галоидоводородной и какой–либо другой
кислоты, называется галоидоангидридом последней. Хлористый сульфурил является,
следовательно, хлорангидридомсерной кислоты.
15) Если
хлористый сульфурил (т. пл. –54 °С, т. кип. 69 °С) можно рассматривать как
серную кислоту, в которой на хлор заменены оба гидроксила, то продуктом
замещения только одного из них является хлорсульфоновая кислота:
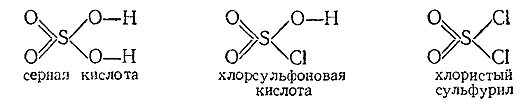
Хлорсульфоновая
кислота представляет собой бесцветную, дымящую на воздухе и резко пахнущую
жидкость (т. пл. –80 °С, т. кип. 155 °С с разложением), бурно взаимодействующую
с водой по реакции
SO2 (OH)Cl H2 O = H2 SO4 HCl
Получают ее
обычно действием газообразного НСl на раствор SОз в серной кислоте: SO3 HCl
= SO2 (OH)Cl. Наряду с хлористым сульфурилом, хлорсульфоновая
кислота находит применение при органических синтезах.
Еще труднее,
чем с хлором, идет соединение SO2 с кислородом,
хотя сама по себе реакция эта сильно экзотермична:
2SO2 О2 = 2SO3 46 ккал
Процесс
протекает только в присутствии катализаторов.
Молекула SОз имеет структуру плоского треугольника с
атомомсеры в центре [d(SO) = l,43 А]. При
сгущениипара трехокисисеры образуется
похожая на лед бесцветная масса.
Эта форма SОз при хранении медленно переходит в другую
форму, которая представляет собой белые шелковистые кристаллы, около 50 °С
возгоняющиеся. Обе модификации очень гигроскопичны и дымят на воздухе.
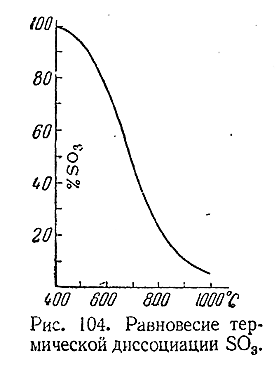
Термическая диссоциациясерного ангидрида (на SO2 и О2 ) становится заметной около 400 °С и
протекает тем в большей степени, чем выше температура , (рис. 104).
Трехокись серы
характеризуется сильными окислительными свойствами:
при
соприкосновении с ней фосфор вос пламеняется, из йодистого калия выделяется
свободный иод и т. д. С другой стороны, она является кислотным ангидридом,
причем образование H2 SO4 из
серного ангидрида (SO3 ) и воды
сопровождается большим выделением тепла:
Н2 О
SO3 = H2 SO4
19
ккал
Чистая 100%–ная
серная кислота (т. н. моногидрат) представляет собой бесцветную маслянистую
жидкость, застывающую в кристаллическую массу при 10 °С. Реактивная концентрированная кислота имеет обычно плотность
1,84 и содержит около 95% H2 SO4 . Затвердевает
она лишь ниже –20°С. Растворение концентрированной серной кислоты в воде
сопровождается значительным выделением тепла.
Концентрированная
серная кислота энергично притягивает влагу и поэтому часто применяется для
осушения газов. От многих органических веществ, содержащих в своем составе
водород – и кислород, она отнимает воду, что нередко используется в технике.
С этим же (а
также с окислительными свойствами крепкой H2 SO4 связано ее разрушающее действие на растительные
и животные ткани. Попавшую при работе на кожу или платье серную 1 кислоту
следует тотчас же смыть большим количеством воды. Пострадавшее место полезно
затем смочить разбавленным растворомJаммиака и вновь
промыть водой.
Концентрированная
H2 SO4 является
довольно сильным окислителем, особенно при нагревании (восстанавливается обычно
до SO2 ). Например, она
окисляет HJ и частично НВr (но не НСl) до свободных галоидов. Окисляются ею и многие металлы–Cu, Hg и др. (тогда
как золото и платина по отношению к H2 SO4 устойчивы).
Например, взаимодействие с медью идет по уравнению:
Cu 2H2 SO4 = CuSO4 SO2 2Н2 О
Практически
важно то обстоятельство, что очень крепкая (выше 93%) серная кислота не
действует на железо. Это позволяет перевозить ее в стальных цистернах.
Напротив, разбавленная H2 SO4 легко
растворяет железо с выделением водорода. Окислительные свойства для нее вовсе
не характерны.
Как сильная
двухосновная кислота, H2 SO4 дает
два ряда солей: средние (сульфаты) и кислые (бисульфаты), причем последние в
твердом состоянии выделены лишь для немногих одновалентных металлов (Na, К и др.). Большинство сернокислых солей бесцветно, хорошо кристаллизуется и
легкорастворимо в воде. Из производных наиболее обычных металлов малорастворим CaSO4 , еще менее PbSO4 и практически нерастворим BaSO4 .
По отношению к
нагреванию сульфаты можно подразделить на две группы. Одни из них (например,
соли Na, К, Ва) не разлагаются даже при 1000 °С,
другие (например, соли Cu, Al, Fe) распадаются на
окиселметалла и SO3 при гораздо
более низких температурах. Некоторые содержащие кристаллизационную водусульфаты иногда называют купоросами, например CuSO4 ·5Н2 О – медный купорос, FeSO4 ·7Н2 О – железный купорос.
Многие соли H2 SO4 находят широкое
техническое применение. Особенно велико оно для самой серной кислоты, громадные
количества которой потребляются в промышленности химической, нефтяной, металлургической
и др. Ежегодная мировая выработка серной кислоты составляет свыше 30 млн. т (в
пересчете на моногидрат). Выработка в СССР за 1961 г. составила 5,7 млн. т (что
почти в 50 раз превышает выработку 1913 г.).
Для
промышленного получения серной кислоты в настоящее время применяются два
метода: нитрозный и контактный. Основным исходным продуктом и в том и в другом
случае является сернистый газ, получаемый сжиганием на воздухесеры (в США) или
богатого ею минералапирита – FeS2 (в большинстве
европейских стран, в том числе и СССР). Для производства используется также SO2 из отходящих газов меде– и
цинкоплавильных заводов.
16) Для сжигания
пирита на сернокислотных заводах пользуются специальными механическими печами.
Горение его идет по уравнению:
4FeS2 1102 = i = 2Fe2 O3 8SO2
815 ккал.
Температура в
печи достигает 800–900 °С.
17) Обычный
исходный газ сернокислого производства содержит около 9% SO2 , 10% О2 и 80% N2 . При пользовании для обжигапиритавоздухом,
обогащенным кислородом, концентрация SO2 возрастает. Так,
применение 45% кислорода увеличивает ее до 16%. Введение подобных газов в
сернокислотное производство позволяет резко повысить его производительность.
Нитрозный метод
получения H2 SO4 был впервые
применен в середине XVIII века. Его
химическая сущность может быть выражена следующими реакциями:
I) SO2 Н2 О NO2 = >H2 SO4 NO
II) 2NO О2 = >2NO2
Из первого
уравнения видно, что являющаяся окислителем двуокись азота (NO2 ) восстанавливается до окиси азота (NO), a последняя при взаимодействии с кислородомвоздуха по второму уравнению вновь превращается в двуокись. Таким образом, NO играет роль переносчика кислорода, т. е.
является по существу катализаторомреакцииокисления SO2кислородомвоздуха.
До 20–х годов
текущего века процесс получения серной кислоты нитрозным методом проводился в
больших свинцовых камерах (камерный способ). В настоящее время он
осуществляется в специальных башнях (башенный способ). Получаемая по башенному
способу кислота, как правило, содержит 76% H2 SO4 . Обычно она несколько загрязнена
различными примесями. Основным потребителем этой кислоты является
промышленность минеральных удобрений.
18)
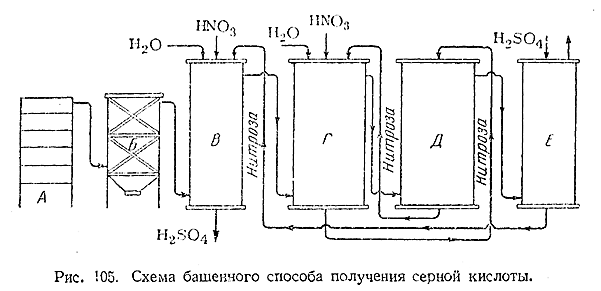
Принципиальная схема башенного способа получения H2 SO4 показана на рис. 105. Башни выкладываются из
кислотоупорных керамических плит с наружным кожухом из листовой стали. Внутри
они неплотно заполнены насадкой из кислотоупорной керамики. Поступающий из печи
для сжигания пирита А газ освобождается от пыли в электрофильтре Б и затем
подается в продукционные башни В и Г, где встречается со стекающей сверху
«нитрозой», т. е. растворомокислов азота в крепкой серной кислоте. Раствор
этот характеризуется следующими равновесиями:
NO NO2 2H2 SO4
< = > N2 O3 2H2 SO4 < = >
2SO2 (OH)ONO H2 O
Таким образом,
нитроза содержит окислы азота и химически связанные (в виде SO2 (OH)ONO – т. н. нигрозилсерной кислоты) и просто
растворенные. Следует отметить, что окисление SO2 осуществляется только последними. При нагревании приведенные
равновесия смещаются влево, при охлаждении – вправо.
В продукционных
башнях, куда поступает горячий газ (и подается также вода), нитрозилсерная
кислота полностью разлагается и происходит окисление практически всего
вводимого сернистого газа. Готовая продукция отбирается из первой башни (В). В
поглотительных башнях Д и Е происходит улавливание окислов азота с образованием
нитрозы, вновь подаваемой затем в продукцион–’ные башни. Выхлопные газы
(свободный азот и др.) удаляются через верхнюю часть последней
поглотительной башни Е, Движение газов в системе поддерживается при помощи
мощного вентилятора. Для компенсации некоторой потери окислов азота в
продукционные башни вводится азотная кислота.
Другой
современный метод получения серной кислоты – контактный– освоен промышленностью
лишь в конце прошлого столетия. Основой его является упоминавшаяся выше
реакция:
2SO2 О2 = >2SO3 46 ккал
В присутствии
платинового катализатора она около 400°С протекает слева направо практически
нацело. Образующийся SO3 улавливают
крепкой серной кислотой (которую затем разбавляют до нужной концентрации).
Стоимость производства по контактному способу несколько выше, чем по
нитрозному, зато серная кислота получается сколь угодно крепкой и очень чистой.
Последнее качество обусловлено тщательной предварительной очисткой образующихся
при сжигании пиритагазов, что необходимо для обеспечения нормальной работы
катализатора. Основными потребителями контактной серной кислоты являются
различные химические производства и нефтепромышленность (для очистки нефтепродуктов).
19)
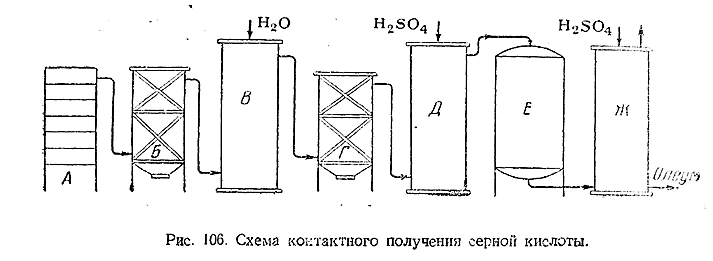
Принципиальная схема получения серной кислоты контактным способом показана на
рис. 106. Образующиеся в печи А газы последовательно проходят через сухой
электрофильтр Б, увлажнительную башню В, влажный электрофильтр Г, осушительную
башню Д, содержащий катализатор контактный аппарат Е и поглотительную башню Ж.
Из нижней части последней отбирается полученный
олеум, а из верхней удаляются выхлопные газы (азот и др. ). Большинство
контактных заводов работает в настоящее время не с платиновым, а с более
дешевыми ванадиевыми катализаторами (V2 O5 с
различными добавками.
Растворы SОз в серной кислоте дымят на воздухе вследствие
выделения паровсерного ангидрида. Поэтому содержащая растворенный SO3серная кислота называется «дымящей»
(иначе – «олеумом»). Так как H2 SO4 растворяет
серный ангидрид в любых соотношениях, выражаемый формулой H2 SO4 ·xSO3 , состав олеума
может быть различным. При х = 1 образуются бесцветные кристаллы пиросерной
кислоты (H2 S2 O7 ),
строение
которой может быть сокращенно выражено формулой; НО–SO2 –О–SO2 –ОН.
Пиросерная
кислота (т. пл. 35 °С) используется в производстве различных органических
веществ. Соли ее (пиросернокислые, или пиросульфаты) могут быть получены
нагреванием соответствующих бисульфатов, например, по реакции:
2KHSO4 = H2 O K2 S2 O7
Они
представляют собой бесцветные кристаллические вещества, под действием воды
переходящие обратно в бисульфаты.
Если крепкий растворбисульфатакалия подвергнуть электролизу, то на катоде происходит выделение водорода и
накопление КОН, а на аноде по схеме
2HSO’4 – 2e– = > H2 S2 O8
образуется
надсерная кислота. Получающийся в результате последующей нейтрализации K2 S2 O8 (н адсер но
кислый калий, или персульфат калия) малорастворим и поэтому осаждается в виде
бесцветных кристаллов. Большинство других солей надсерной кислоты
легкорастворимо в воде. Все персульфаты являются сильными окислителями.
Например, медь медленно взаимодействует с K2 S2 O8 по уравнению:
Cu K2 S2 O8 = CuSO4 K2 SO4
Свободная надсерная кислота представляет собой бесцветные кристаллы, плавящиеся при 65°С
(с разложением). Она обладает очень сильными
окислительными свойствами и при соприкосновении обугливает не только бумагу,
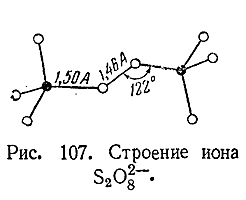
сахар и т. п., но и пара–строение надсерной кислоты выражается формулой HO–SO2 –О–О–SO2 –ОН, т. е. она содержит перекисную цепочку.
Пространственная
структура отвечающего ей иона S2 O82–оказана на рис. 107. Каждая половина этого рисунка в отдельности
соответствует строению сульфат–иона.
20) При взаимодействии H2 S2 O8 с концентрированной
перекисью водорода по уравнению
H2 S2 O8
H2 O2 = 2H2 SO5 образуется мононадсерная кислота, по
своему строению отвечающая серной кислоте, в которой один гидроксил замещен на
группу ООН. Она представляет собой бесцветные кристаллы (т. пл. 45°С с
разложением). Мононадсерная кислота является еще более сильным окислителе м,
чем надсерная, и взаимодействие ее с многими органическими веществами
(например, бензолом) сопровождается взрывом. Соли H2 SO5 малоустойчивы. В них она
фигурирует, как одноосновная кислота.
Еще по теме:
Влияние серы на свойства стали, возможности десульфурации и поведение серы в условиях окислительной плавки — черная и цветная металлургия на
Сера имеет неограниченную растворимость в жидком железе и ограниченную – в твердом железе. При кристаллизации стали по границам зерен выделяются сульфиды железа, которые могут образовать легкоплавкую эвтектику с железом, вызывающую явление красноломкости при нагревании слитков перед прокаткой или ковкой. Красноломкость проявляется сильнее в литой стали в виде трещин или рванин, потому что сульфиды и оксисульфиды скапливаются по границам первичных зерен.
В процессе горячей деформации (прокатки, ковки) сульфидные включения легко деформируются и вытягиваются в строчки по направлению деформации. Строчечные сульфидные включения нарушают сплошность структуры металла, и, если нагрузка на готовое изделие направлена поперек оси деформации (перпендикулярно сульфидным строчкам), металлическая матрица разрушается по границе раздела с сульфидами; в результате снижается пластичность стали в поперечных образцах. В случае испытания образцов металла при низких температурах сульфиды резко снижают пластичность и повышают порог хладноломкости. В частности, низкое содержание серы (и соответственно малое количество сульфидов) очень важно иметь в стали, применяемой при производстве труб большого диаметра для газопроводов, прокладываемых по Крайнему Северу ([S]
В то же время большое количество конструкционных сталей используется для изготовления изделий, у которых основные нагрузки – в направлении вдоль оси прокатки. В таком случае особо низкого содержания серы в металле не требуется, так как сера оказывает благоприятное влияние на обрабатываемость стали на металлорежущих станках (сера увеличивает хрупкость стружки и не дает возможности образования так называемой витой стружки). Поэтому в большинстве марок электростали допустимый верхний предел содержания серы составляет 0,035 % и лишь в высококачественных сталях он не должен превышать 0,020 %. Более низкое содержание серы в стали обычно оговаривается техническими условиями на поставку конкретной марки стали.
Сера попадает в металлический расплав с шихтовыми материалами. Передельный чугун содержит от 0,025 до 0,070 % серы, в чугунном ломе ее примерно столько же, в ломе углеродистых сталей – 0,030…0,050% серы. Кокс, применяемый для науглероживания расплава, содержит до 2 % серы. Некоторое количество серы может перейти в металл из мазута, если мазут используется в топливокислородных горелках. Обычно содержание серы в металле после расплавления выше допустимого для готовой стали, поэтому в процессе плавки и внепечной обработки требуется удалить из металла избыточное количество серы (осуществить десульфурацию металла).
Суть процесса десульфурации металла заключается в переводе серы из металла в десульфурирующую фазу (чаще всего это шлак). На скорость и степень («глубину») десульфурации металла влияют: активность серы в металле и шлаке, наличие поверхностно-активных примесей на поверхности раздела металл-десульфурирующая фаза, величина поверхности контакта металл-шлак, состав и свойства шлака (прежде всего основность, окисленность и вязкость), а также, особо подчеркиваем, количество шлака или другой десульфурирующей фазы.
Активность серы в жидкой стали повышают углерод, кремний, алюминий. Поэтому в полном металлургическом цикле (интегрированные заводы) выгоднее удалять серу из чугуна (в доменной печи или в чугуновозных ковшах, миксерах и т.д.), а при выплавке сталей с повышенным содержанием углерода, кремния и алюминия удается получать металл с более низким содержанием серы. Активность серы в шлаке определяется прежде всего основностью шлака.
Сера является поверхностно-активным элементом, ее концентрация на поверхности раздела фаз существенно выше, чем в объеме металла. Поэтому при проведении десульфурации металла необходимо добиваться увеличения поверхности контакта металла с десульфурирующей фазой (перемешивание металла со шлаком, вдувание в расплав порошков шлакообразующих компонентов и т,п.). Если в металлическом расплаве имеется несколько поверхностно-активных элементов, то поступление серы на поверхность раздела фаз затруднено. Кислород, присутствующий в металле, также является поверхностноактивным элементом, поэтому в окислительных условиях поверхность контакта металл-шлак занята кислородом и десульфурация металла усложняется. При небольших концентрациях кислорода в металле (меньше 0,01 %) адсорбция серы больше, чем адсорбация кислорода, степень удаления серы из металла резко увеличивается.
Самый простой и дешевый способ десульфурации стали – десульфурация основным шлаком. Переход серы из металла в шлак может быть описан следующими схемами:
[FeS] (CaO) = (CaS) (FeO) – при записи в молекулярной форме;
[S] О2- = S2- [О] – при записи в ионной форме.
Вторая схема объясняет взаимосвязь процессов раскисления металла и удаления из него серы. Исходя из этих схем для условий металлургической практики можно утверждать, что, чем выше активность СаО в шлаке и ниже активность FeO и серы в нем, тем выше десульфурирующая способность такого шлака; лучшему переходу серы из металла в шлак способствует меньшее содержание кислорода в металле (меньшая окисленность металла). Степень использования десульфурирующей способности шлака обычно характеризуют величиной полученного в процессе десульфурации коэффициента распределения серы между шлаком и металлом ϒs = (S) / [S], равной отношению концентраций серы в шлаке и металле. Сравнивая его с так называемым «равновесным» коэффициентом распределения, определенным для подобных шлаков в лабораторных условиях для случая равновесия между шлаком и металлом, можно судить о глубине десульфурации.
Многочисленные исследования, проведенные в промышленных и лабораторных условиях, подтвердили влияние основности и окисленности шлака на величину полученного коэффициента распределения серы (рис. 3.2).
Условия окислительного периода плавки (высокая окисленность шлака и металла) не способствуют проведению глубокой десульфурации металла, поэтому в большинстве случаев электрометаллурги стараются удалить основную часть серы при наличии раскисленного металла и шлака: при использовании классической технологии и ее более поздних модификаций в восстановительный период плавки и во время выпуска металла вместе со шлаком; при использовании современной технологии путем внепечной обработки на установках типа ковш-печь, путем продувки твердыми десульфурирующими реагентами и т.д. Учитывая довольное высокое содержание серы в шихте, по нашему мнению, не следует отвергать возможность частичной десульфурации металла в окислительных условиях в конце плавления и в окислительный период плавки (кратность шлака 0,05…0,07), особенно в современных печах, использующих вспененные постоянно обновляющиеся шлаки, обеспечивающие довольно большую величину удельной поверхности контакта шлак-металл. Наши данные (рис. 3.3) свидетельствуют о возможности получения заметных значений коэффициента распределения серы в окислительный период плавки в 100-тонной печи, особенно при повышении основности шлака, и соответственно о возможности удаления в это время до 20 % серы, содержащейся в шихте.
![]()
Кроме того, видно (рис. 3.4), что десульфурирующая способность шлаков окислительного периода полностью не использовалась и фактическая концентрация серы в металле в конце окислительного периода превышала равновесную со шлаком (рассчитанную по формуле Морозова). Причины этого – небольшая длительность окислительного периода и повышенная окисленность металла.
Соли серной кислоты
Серная кислота, будучи двухосновной, образует два ряда солей: средние, называемые сульфатами, и кислые, называемые гидросульфатами. Сульфаты образуются при полной нейтрализации кислоты щелочью (на один моль кислоты приходится два моля щелочи), а гидросульфаты — при недостатке щелочи (на один моль кислоты — один моль щелочи):
Многие соли серной кислоты имеют большое практическое значение.
Качественная реакция на сульфат-ион. Большинство солей серной кислоты растворимо в воде. Соли CaSO4 и PbSO4 мало растворимы в воде, a BaSO4 практически нерастворима как в воде, так и в кислотах. Это свойство позволяет использовать любую растворимую соль бария, например ВаСl2, как реагент на серную кислоту и ее соли (точнее, на ион 
или в ионной форме:
При этом выпадает белый нерастворимый в воде и кислотах осадок сульфата бария.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований

