- Кислородные соединения серы
- Оксид серы — so2
- Природные соединения
- Промышленное производство серной кислоты
- Серная кислота
- Скорость химических реакций
- Способы получения сероводорода
- Строение атомов элементов подгруппы кислорода
- Факторы, влияющие на скорость химической реакции
- Физические свойства
- Химические свойства
- Химические свойства сероводорода
- Химическое равновесие
Кислородные соединения серы
Свойства соединений серы(IV).
Оксид серы(IV) SO2(сернистый газ) – это бесцветный газ, с резким запахом, тяжелее воздуха. при температуре -10оС сгущается в бесцветную жидкость. Диоксид серы менее токсичен, чем сероводород, хорошо растворим в воде (40 объемов в 1 объеме воды). Молекула SO2 имеет угловое строение, связи в молекуле располагаются под углом 120о друг к другу. Связь сера –кислород – полярная связь, молекула SO2 тоже полярна. Длина связи S – О равна 0,143 нм. В промышленности SO2 получают:
а) сжиганием серы в специальных печах:
S О2 = SO2
б) при обжиге сернистых металлов:
4 FeS2 11 О2 = 8 SO2 2 Fe2О3
Сера входит в состав многих твердых горючих ископаемых и при их сжигании выделяется большое количество сернистого газа, загрязняющего атмосферу.
В лаборатории диоксид серы получают действием разбавленной серной кислоты на сульфиты:
Na2SО3 Н2 SО4 (разб.) = Na2SО4 Н2SО3 ;
Н2SО3 = SO2↑ Н2О
или действием концентрированной серной кислоты на медь:
Cu 2 Н2 SО4 (конц.) = CuSО4 SO2↑ Н2О
Оксид серы(IV) химически активное вещество, в окислительновосстановительных реакциях может проявлять двойственные свойства. При пропускании SO2 через сероводородную воду выделяется сера:
SO2 2 H2S = 3 S 2 H2O
Однако для оксида серы(IV) более характерны восстановительные свойства:
5SO2 2KMnO4 2H2O = 2MnSO4 K2SO4 2H2SO4
SO2 Br2 2H2O = H2SO4 2 НВr
В пищевой промышленности SO2 используют для продувки через сок сахарной свеклы (сульфитизация) для его обесцвечивания, обеззараживания и снижения щелочности. В процессах консервирования пюре, соков, плодов он играет роль антисептика, консерванта и антиокислителя. После удаления SO2 (десульфитизация) остаточное содержание диоксида серы в продуктах не должно превышать 0,01 %. Наличие неподеленной электронной пары у атома серы придает молекуле SO2 способность к реакциям присоединения. На прямом солнечном свету SO2 соединяется с хлором, образуя хлористый сульфурил:
SO2 С12 = SO2С12
SO2С12 – бесцветная жидкость с резким запахом, является хлорангидридом серной кислоты, легко гидролизуется:
SO2С12 2H2O = H2SO4 2 НС1
Способность SO2 к реакциям присоединения и его окислительные свойства позволяет использовать диоксид серы для отбелки шерсти, шелка, соломы, для осветления дубильных экстрактов. Однако со временем бесцветные соединения SO2 с окрашивающими материал примесями разрушаются, и материал приобретает свой прежний цвет.
С кислородом диоксид серы взаимодействует с заметной скоростью только в присутствии катализатора (Pt, V2О5 и другие):
2 SO2 О2 = 2 SO3
Оксид серы(IV) проявляет свойства кислотного оксида, при растворении в воде, взаимодействует с ней, образуя, сернистую кислоту:
SO2 Н2О = Н2SО3.
При сжигании угля, содержащего небольшие количества соединений серы, в атмосферу выбрасывается диоксид серы. Растворяясь во влаге, находящейся на листьях или в воздухе, SO2 образует раствор сернистой кислоты, который затем окисляется до серной кислоты. Атмосферная влага с растворенными SO2 и H2SO4 выпадает в виде кислотных дождей, приводящих к гибели растительности.
Свойства сернистой кислоты. Раствор SO2 в воде называется сернистой кислотой. Н2SО3 неустойчивая кислота, существует только в растворах:
Н2SО3 ↔ SO2↑ Н2О
При нагревании равновесие смещается в сторону прямой реакции и можно полностью удалить диоксид серы из раствора. Сернистая кислота является кислотой средней силы. Она двухосновна:
Н2SО3 ↔ Н НSО3— (Кд = 2.10-2)
НSО3— ↔ Н SО32- (Кд = 6.10-8)
Н2SО3 – образует средние соли Na2SО3 (сульфиты) и кислые соли NaНSО3 (гидросульфиты). Сульфиты большинства металлов нерастворимы в воде (кроме щелочных металлов и аммония). Соли подвергаются гидролизу:
Na2SО3 H2O ↔ NaHSО3 NaOH
Все сульфиты и гидросульфиты разлагаются кислотами:
Na2SО3 2 НС1 = 2 NaС1 Н2SО3
Н2SО3 = SO2↑ Н2О
При нагревании сульфиты диспропорционируют:
4 Na2SО3 = 3 Na2SО4 Na2S
Сернистая кислота и ее соли обладают окислительно-восстановительной
двойственностью:
So ← S 4O2 → S 6O42-
5Na2SО3 2КМnО4 8Н2SО4 = 5Na2SО4 2МnSО4 К2SО4 8H2O
Na2SО3 С12 H2O = Na2SО4 2 НС1
SО32- 4Н 4 ē = S 2 H2O, Е° = 0,45
SО32- 2 ОН- — 2 ē = SО42- H2O, Е° = -0,93 В
Восстановительные свойства для производных серы со степенью окисления 4 (диоксид, сернистая кислота и ее соли) более характерны, чем окислительные свойства. Практически мгновенно протекает окисление сульфитов и гидросульфитов многими окислителями (КМnО4, С12, Вr2 и т.д.) На этом основано использование NaНSО3 в качестве антихлора. Сульфит-ион открывают с помощью раствора йода, при этом раствор йода обесцвечивается.
I2 Na 2SО3 Н2О = 2 НI Na2SO4
Сульфиты настолько сильные восстановители, что даже в твердом виде они постепенно окисляются кислородом воздуха:
2 Na2SО3 О2 = 2 Na2SО4
Сульфиты легко присоединяют не только кислород, но и серу:
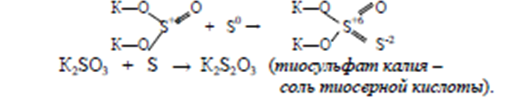
Н2S2О3– тиосерная кислота. По силе эта кислота близка к серной кислоте, но в свободном состоянии неустойчива и разлагается:
К2S2О3 Н2SО4 = К2SО4 Н2S2О3
Н2S2О3 = SО2↑ S↓ Н2О
Соли тиосерной кислоты (известны только средние соли) довольно устойчивы, бесцветны и хорошо растворимы в воде. Свойства этих солей обуславливаются присутствием атомов серы в различных степенях окисления. Наличие S-2 придает им восстановительные свойства. Тиосульфат натрия (гипосульфит) имеет наибольшее практическое значение. Na2S2О3 используется для связывания хлора:
Na 2S2О3 С12 (недостаток) Н2О = Na2SО4 S 2 НС1
Na 2S2О3 4 С12 (избыток) 5 Н2О = Na2SО4 Н2SО4 8 НС1
Na 2S2О3 используется в медицине как противотоксичекое средство при отравлениях соединениями ртути, свинца, синильной кислотой и ее солями, при этом образуются плохо растворимые нетоксичные сульфиты или менее ядовитые тиоцианаты:
S2О3 2- = SО32- S;
Pb2 SО32- = PbSО3↓
S СN— = NСS —
В фотографии Na 2S2О3 (фиксанажная соль) используется для удаления
неразложившегося бромида серебра.
2 Na 2S2О3 AgBr = NaBr Na3[Ag(S2О3)2]
Важным свойством тиосульфата натрия является его способность образовывать с иодом бесцветный тетратионат нария:
I2 2Na 2S2О3 = 2NaI Na2S4O6 (Соль тетратионовой кислоты)
Эта реакция широко используется в аналитической химии (в объемном анализе).
Политионовые кислоты – это кислоты состава: Н2SхО6или Н2(О3S–Sх–SО3), где х = 0-16, В состав политионовых кислот входят зигзагообразные цепи атомов серы. Название кислоты и ее солей определяется числом атомов серы, входящих в состав кислоты или соли:
Na2S6O6 — гексатионат; Na2S5O6 — пентатионат; Na2S4O6 – тетратионат; Na2S2O6 — дитионат. Политионовые кислоты существуют только в водных растворах и медленно разлагаются при хранении:
Н2SхО6 = Н2SО4 SО2 (х-2)S
Соли политионовых кислот щелочных металлов хорошо растворимы в воде. В сухом состоянии довольно устойчивы, при нагревании они разлагаются: Na2S6O6 = Na2SО4 SО2 4 S↓
§
Оксид серы(VI)SО3 (серный ангидрид) при охлаждении до 44,8 оС конденсируется в бесцветную жидкость, состоящую в основном из циклических тримерных молекул (SО3)3. Ниже 16,8оС жидкий SО3 затвердевает в бесцветную кристаллическую массу, напоминающую лед. Молекула SО3 – имеет форму плоского треугольника (sp2-гибридизация), неполярная, поэтому плохо растворима в воде.
Молекулы SО3 легко полимеризуются в кольца (SО3)3 (льдовидная модификация) или цепочки (SО3)n (асбеcтовидная модификация) различной длины. Способность молекул SО3 объединяться в кольца или полимеры, связана с координационной ненасыщенностью в ней атома серы, который может за счет sp3- и sp3d2-гибридизации орбиталей образовывать по четыре и по шесть σ-связей. Поэтому молекулы SО3 склонны к реакциям присоединения:
SО3 НС1 = Н[SО3С1] (сильная хлорсульфоновая кислота)
SО3 NH3 = Н[SО3NН2] (аминсульфоновая кислота)
На воздухе SО3 дымит, так как взаимодействует с парами воды, образуя
мельчайшие капельки серной кислоты (трудноуловимый сернокислотный
туман):
SО3 Н2О = Н2SО4
Оксид серы(VI) лучше растворяется в серной кислоте, чем в воде:
SО3 Н2SО4 <=> Н2S2О7 (дисерная кислота)
В результате получается олеум – густая маслянистая жидкость, дымящая на воздухе. Олеум содержащий до 20- 65% избытка SО3, образует с Н2SО4 полисерные кислоты состава Н2SО4 .nSО3, где n = 1 ÷ 3. Для получения концентрированной серной кислоты олеум смешивают с серной кислотой, содержащей некоторое количество воды.
Серная кислотаН2SО4 – бесцветная маслянистая жидкость, смешивается с водой в любых соотношениях, образуя с ней соединения, которые могут быть выделены при охлаждении в виде кристаллогидратов: Н2SО4·Н2О; Н2SО4·2Н2О; Н2SО4·4Н2О. Поэтому концентрированная серная кислота энергично поглощает воду и используется в качестве осушителя газов. Она способна отнимать у веществ химически связанную воду, обугливая их, например, сахар:
С12Н22О11 Н2SО4 (конц.) = 12 С Н2SО4·11Н2О
При взаимодействии серной кислоты с водой происходит значительное выделение энергии. В связи с этим для приготовления разбавленных растворов Н2SО4 из концентрированной серной кислоты, следует серную кислоту тонкой струей приливать к воде, а не наоборот, чтобы избежать ее разбрызгивания. Концентрированная серная кислота причиняет сильные ожоги.
В водных растворах серная кислота является сильной двухосновной кислотой. Н2SО4 образует средние соли Na2SО4 (сульфаты) и кислые соли NaНSО4 (гидросульфаты). Большинство сульфатов растворимо в воде. Соли серной кислоты гидролизу не подвергаются. Многие соли серной кислоты содержат кристаллизационную воду и являются кристаллогидратами. Эти соли часто называют купоросами, например, CuSО4·5Н2О – медный купорос; FeSО4·7Н2О – железный купорос. При нагревании они легко теряют кристаллизационную воду:
CuSО4·5Н2О → CuSО4 5Н2О
Голубая соль белая соль
Сульфаты щелочных и щелочноземельных металлов не разлагаются даже при сильном нагревании (> 1000 ºC). Безводные сульфаты тяжелых металлов разлагаются при температуре ниже 1000 ºC, с образованием соответствующих оксидов. Для серной кислоты характерно образование двойных солей, называемых квасцами, например, хромовокалиевые квасцы КСr(SО4) 2·12Н2О; алюмокалиевые квасцы КА1(SО4) 2·12Н2О. Качественной реакцией на ионы SО42- в растворе является добавление к нему раствора хлорида бария. В присутствие сульфат-ионов из раствора выпадает белый нерастворимый в кислотах осадок:
Ва2 SО42- = ВаSО4↓
Концентрированная серная кислота – сильный окислитель, особенно при нагревании. Окисляет многие неметаллы и металлы:
С 2 Н2SО4(конц,) = СО2 SО2 Н2О
S 2 Н2SО4(конц,) = 3 SО2 2 Н2О
В окислительно-восстановительных реакциях с металлами степень восстановления серной кислоты зависит от активности металла:
4 Mg 5 Н2SО4 = 4 MgSО4 H2S 4 Н2О
2 Аg 2 Н2SО4(конц,) = Аg2SО4 SО2 2 Н2О
Разбавленная серная кислота окислительных свойств за счет S 6 не проявляет. Металлы, стоящие в электрохимическом ряду металлов до водорода, вытесняют его из разбавленной серной кислоты, если образующаяся соль растворима в кислоте. Металлы, стоящие в ряду напряжений правее водорода, не растворяются в разбавленной серной кислоте.
Mg Н2SО4(разб.) = MgSO4 H2↑
Аg Н2SО4(разб.) ≠
Концентрированная серная кислота в обычных условиях пассивирует некоторые металлы (Fe, Al, Cr, Co, Ni). Поэтому концентрированную серную кислоту перевозят в стальных цистернах. Для серы известны кислоты и соли, содержащие в своем составе пероксогруппу (О – О)2-. Такие кислоты называются пероксокислотами. К ним относятся следующие кислоты серы: Н2SО5 пероксосерная кислота (мононадсерная кислота) и H2S2O8 пероксодисерная кислота (надсерная кислота).
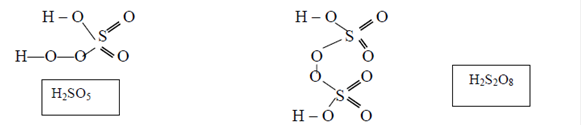
Обе кислоты – бесцветные кристаллические вещества, плавящиеся при нагревании с разложением при температуре 47 оС (Н2SО5) и 65 оС (H2S2O8).
2 Н2SО5 = 2 Н2SО4 О2
Водород, связанный с пероксогруппой в Н2SО5 , на металл не замещается, поэтому для этой кислоты известны только кислые соли КНSО5 (гидропероксомоносульфат калия). Пероксосерные кислоты подвергаются необратимому гидролизу. Гидролиз пероксодисерной кислоты протекает в две стадии:
H2S2O8 H2O = Н2SО5 Н2SО4
Н2SО5 Н2О <=> Н2SО4 Н2О2
H2S2O8 2 Н2О = Н2О2 2 Н2SО4
§
Водородные соединения.
Элементы подгруппы селена
В ряду элементов VI группы главной подгруппы O – S – Se – Te – Poрадиус атомов увеличивается. В связи с этим энергия ионизации уменьшается, поэтому неметаллические свойства элементов убывают, а металлические свойства элементов – растут. В реакциях с азотной кислотой сера и селен ведут себя как неметаллы, а полоний – как металл.
S 2 HNO3 = H2SO4 2 NO
Se 2 HNO3 = H2SeO4 2 NO
Po 8 HNO3 = Po(NO3)4 4 NO2 4 Н2О
По химическим свойствам Se и Te очень сходны с серой. Горят на воздухе с образованием диоксидов:
Se О2 = SeО2; Тe О2 = ТeО2;
SeО2 и ТeО2 твердые вещества. С водородом при повышенных температурах частично взаимодействует лишь селен, теллур непосредственно с водородом не соединяется:
Н2 Se = Н2Se
Сера и селен с водой и разбавленными кислотами не взаимодействуют.
Теллур взаимодействует с водой даже при обычных условиях, а полоний взаимодействует с соляной кислотой:
Те 2 Н2О = ТеО2 2 Н2↑
Ро 2 НС1 = РоС12 Н2↑
Как и сера, селен и теллур окисляются азотной кислотой и другими окислителями до соответствующих кислот, но в более жестких условиях:
Te 2 HNO3 2 Н2О = H6ТeO6 2 NO
4 Se 3 HС1O4 4 Н2О = 4 H2SeO4 3 НС1
Те 3Н2О2 = Н6ТеО6 (30 % раствор Н2О2)
В кипящих водных растворах щелочей селен и теллур, подобно сере, медленно растворяются (диспропорционируют):
3 Se 6 КОН = 2 К2Se К2SeО3 3 Н2О
С усилением металлических признаков склонность элементов данной подгруппы к проявлению отрицательных степеней окисления уменьшается. Поэтому Н2Se и Н2Тe менее устойчивы, чем Н2S, и проявляют более сильные восстановительные свойства. Селеноводород и теллуроводород прямым взаимодействием не получают. Они могут быть получены действием разбавленных кислот на селениды и теллуриды металлов:
2 Na Se = Na2Se (селенид натрия)
Na2Se 2 HCl = H2Se 2 NaCl
H2Se и H2Тe – при нормальных условиях бесцветные газы с неприятным запахом. Селеноводород более ядовит, а теллуроводород менее ядовит, чем сероводород. Растворимость в воде H2Se и H2Тe примерно такая же, как иH2S. Водные растворы этих соединений – проявляют кислотные свойства.
Соли селеноводородной кислоты (селениды) и теллуроводородной кислоты (теллуриды) по свойствам близки к сульфидам.
Таким образом, в ряду H2O – H2S – H2Se – H2Teвосстановительные свойства соединений и кислотные свойства увеличиваются, а термическая устойчивость уменьшается.
Селен и теллур образуют оксиды типа ЭО2 и ЭО3. SeО2 и ТeО2 образуются при сгорании селена и теллура на воздухе, при обжиге селенидов и теллуридов, при сжигании гидридов этих элементов:
2 СdSe 3 О2 = 2 СdО 2 SeО2
2 Н2Те 3 О2 = 2 Н2О 2 ТeО2
SeО2 и ТeО2 – бесцветные кристаллические вещества, проявляющие свойства кислотных оксидов. Им соответствуют селенистая (H2SeО3) и теллуристая (H2ТeО3) кислоты. В воде растворяется диоксид селена, диосид теллура непосредственно с водой не взаимодействует:
SeО2 Н2О = H2SeО3
Селенистая кислота – выделена в свободном состоянии, теллуристая кислота получается косвенным путем, в свободном виде не получена и существует только в водных растворах в виде полимера ТeО2. n Н2О В ряду SО2 – SeО2 – ТeО2 – РоО2происходит ослабление кислотных
свойств и нарастание основных свойств. Так ТeО2 можно растворить в растворе щелочи, как и предыдущие оксиды:
ТeО2 2 КОН = К2ТеО3 Н2О
РоО2 со щелочами взаимодействует только при сплавлении, но взаимодействует с кислотами, проявляя основные свойства:
РоО2 2 КОН = К2РоО3 Н2О
РоО2 2 H2SО4 = Ро(SО4)2 2 Н2О
В ряду H2SО3(Кд1= 2 10-2) – H2SeО3(Кд1= 3,5 10-3) – H2ТeО3(Кд1= 3 10-6)
кислотные свойства уменьшаются. В химических реакциях соединения S 4 преимущественно проявляют восстановительные свойства, соединения Sе 4 и Те 4 проявляют главным образом окислительные свойства, восстанавливаясь свободного состояния.
2 SО2 SeО2 2 Н2О = 2 H2SО4 Se
К2ТеО3 SО2 Н2О = 2 H2SО4 Тe
Восстановительные свойства селенистая и теллуристая кислоты проявляют лишь при взаимодействии с сильными окислителями:
3 H2SeО3 НС1О3 = 3 H2SeО4 НС1
Селеновая и теллуровая кислоты – бесцветные кристаллические вещества, хорошо растворимые в воде. Свободная теллуровая кислота обычно выделяется в виде кристаллогидрата H2ТeО4. 2Н2О или H6ТeО6. В ортотеллуровой кислоте атомы водорода могут частично или полностью замещаться атомами металлов (К6ТeО6). Селеновая кислота по силе близка к серной кислоте, водный раствор теллуровой кислоты проявляет свойства слабой кислоты.
В ряду H2SО4 – H2SeО4 – H2ТeО4(H6ТeО6) кислотные свойства уменьшаются. Селеновая кислота H2SeО4 – белое кристаллическое вещество, жадно притягивающее влагу. Селеновая кислота менее устойчива, чем серная кислота, поэтому она более сильный окислитель, чем H2SО4 . Селеновая кислота обугливает органические вещества. Окислительные свойства теллуровой кислоты слабее, чем у серной кислоты. Концентрированная серная кислота не окисляет концентрированную соляную кислоту, селеновая кислота окисляют НС1 с выделением свободного хлора:
H2SeО4 2 НС1 = H2SeО3 С12 Н2О
За счет выделения атомарного хлора смесь селеновой и соляной кислот растворяет золото и платину. Кроме того, золото не растворяется в горячей серной кислоте, горячая безводная селеновая кислота растворяет его:
2 Au 6 Н2SeО4 = Au2(SeO4)3 3 H2SeО3 3 Н2О
Окисд селена(VI) – бесцветное кристаллическое вещество, хорошо растворяется в воде с образованием селеновой кислоты:
SeО3 Н2О = H2SeО4
H2SeО4 при нагревании не разлагается с образованием триоксида селена, его получают при взаимодействии селената натрия с избытком оксида серы (VI):
Nа 2SeО4 SО3 = Nа 2SО4 SeО3
При нагревании теллуровая кислота разлагается:
H6ТeО6 = ТeО3 3 Н2О (при нагревании до 300 оС)
2 ТeО3 = 2 ТeО2 О2 (при нагревании > 300 оС)
ТeО3 – порошок желтого цвета, не растворяется в воде, а также в разбавленных растворах кислот и щелочей. Триоксид теллура растворяется только в концентрированных водных растворах щелочей:
ТeО3 2 NаОН = Nа2ТeО4 Н2О
Оксид серы — so2
Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся
спички).
Получение
В промышленных условиях сернистый газ получают обжигом пирита.
FeS2 O2 = (t) FeO SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота,
распадающаяся на сернистый газ и воду.
K2SO3 H2SO4 = (t) K2SO4 H2O SO2↑
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Cu H2SO4(конц.) = (t) CuSO4 SO2 H2O
Природные соединения
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.
Получение
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S,
SO2.
H2S O2 = S H2O (недостаток кислорода)
SO2 C = (t) S CO2
Серу можно получить разложением пирита
FeS2 = (t) FeS S
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
H2S H2SO4 = S H2O (здесь может также выделяться SO2)
Химические свойства
Промышленное производство серной кислоты
Какие катализаторы используются при производстве серной кислоты?
Серная кислота — одно из важнейших неорганических соединений в химической промышленности. Сырьем для промышленного производства серной кислоты служат: чистая сера S, железный колчедан (пирит) 
Процессы промышленного производства серной кислоты, начиная с подготовки сырья и кончая получением готового продукта, подразделяются на несколько этапов.
1. Получение оксида серы (IV). 2. Очистка оксида серы (IV). 3. Окисление оксида серы (IV) и получение оксида серы (VI).
1. Получение оксида серы (IV).
Для получения оксида серы (IV) из имеющегося сырья необходимо осуществить следующие химические реакции:
В промышленности для производства 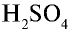
1) реакции обжига проводить при участии чистого кислорода вместо воздуха. Это позволяет увеличить концентрацию одного из реагирующих веществ — кислорода, а следовательно, и скорость реакции;
2) измельчать частицы пирита, при этом увеличивается поверхность столкновения частиц пирита с кислородом, в результате чего реакция ускоряется. Однако чрезмерное измельчение пирита замедляет реакцию, так как пирит спекается и кислород не может проникнуть в уплотненные слои. Но использование чрезмерно измельченного пирита по принципу противотока также дает хорошие результаты. Пирит засыпается в печь для обжига колчедана (окисление 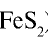 Очистка оксида серы (IV). Процесс получения оксида серы (IV) является каталитическим, в качестве катализатора используется оксид ванадия (V)—
Очистка оксида серы (IV). Процесс получения оксида серы (IV) является каталитическим, в качестве катализатора используется оксид ванадия (V)—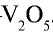
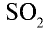
3. Окисление оксида серы (IV) и получение оксида серы (VI).
Для получения оксида серы (VI) из оксида серы (IV) последний окисляется в присутствии катализатора:
Реакция является экзотермической, и при 400°С выход оксида серы (VI) составляет 99,2%. С повышением температуры выход продукта уменьшается, например, при 600°С он составляет лишь 73%.
Теплота, выделяющаяся в ходе реакции, расходуется на нагревание 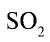
Для выбора оптимальных условий окисления оксида серы (IV) необходимо подобрать факторы, позволяющие сдвинуть равновесие обратимой реакции вправо.
1. Температура. Для увеличения выхода оксида серы (VI) температуру реакции следует постепенно понижать с 600°С до 400—450°С .
2. Катализатор. Катализатором могут служить оксиды железа, платины и ванадия. К катализаторам предъявляются следующие требования: а) низкая цена; б) устойчивость к каталитическим донорам; в) долговечность. В настоящее время в качестве катализатора используется оксид ванадия (V).
3. Оксид серы (IV), поступающий в контактный аппарат, должен быть осушен от водяных паров и очищен от различных твердых частиц и пыли, повреждающих катализатор. Оксид серы (IV), осушенный от водяного пара и очищенный от пыли и различных примесей, в смеси с воздухом поступает в теплообменник, где он нагревается до определенной температуры, а оттуда в контактный аппарат, где он окисляется до 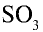
Образовавшийся в контактном аппарате и охлажденный в теплообменнике оксид серы (VI) подается в поглотительную башню.
Гидратация оксида серы (VI), то есть получение серной кислоты.
В поглотительной башне из оксида серы (VI) получается серная кислота, для чего 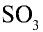
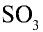
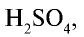
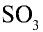
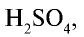
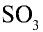
Процесс промышленного производства серной кислоты является непрерывным (рис. 25).
Элементы знаний, умений и навыков: сырье, обжиг пирита, кипящий слой, контактный аппарат, теплообменник, олеум.
Пример:
Во сколько раз увеличится скорость реакции, если коэффициент скорости равен 3, а температура повышена с 50°С до 70°С? При первоначальной температуре (50°С) реакция завершается за 2 мин 15 с, за какое время она завершится при 70°С?
Решение:
1) увеличение скорости реакции (при переходе от 50°С к 70°С) найдем согласно правилу Вант-Гоффа:
Скорость химической реакции увеличится в 9 раз;
2) при начальной температуре 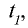
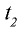
Ответ. 15 с.
Серная кислота
На какие металлы не воздействует концентрированная серная кислота?
Молекулярная формула серной кислоты 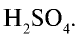
Получение серной кислоты осуществляется с помощью химических реакций, протекающих по следующей схеме:
Физические свойства: Серная кислота — тяжелая бесцветная маслянистая жидкость без запаха. Плотность 96% -ной концентрированной кислоты равна 1,84 г/см3. При растворении в воде она выделяет большое количество теплоты, поэтому при ее разбавлении следует соблюдать осторожность, приливая серную кислоту к воде небольшими частями.
1. Взаимодействует со всеми металлами, стоящими в ряду активности перед водородом, при этом образуются соли и вытесняется водород:
2. Взаимодействует с основными и амфотерными оксидами и образует соли и воду:
3. Взаимодействует с основаниями и образует соли и воду:
4. Взаимодействует с солями слабых и летучих кислот и образует новые соли и новые кислоты:
Концентрированная серная кислота является очень сильным окислителем, поэтому она реагирует почти со всеми металлами, кроме серебра Ag, золота Аu и платины Pt, а также железа Fe при 100% -ной концентрации.
При этом в зависимости от активности металлов, концентрации серной кислоты и условий реакции выделяются газы 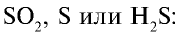
При кипячении концентрированная серная кислота взаимодействует также с неметаллами:
Концентрированная серная кислота обугливает такие вещества, как сахар, бумага, дерево и ткани, вытягивая воду из содержащейся в них целлюлозы:
Для определения серной кислоты и сульфатов на них воздействуют растворимой солью бария (хлорид бария). В результате реакции выпадает осадок белого цвета, не растворимый ни в воде, ни в азотной кислоте:
Сульфаты. Сульфат натрия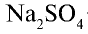
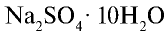 Сульфат кальция
Сульфат кальция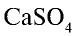
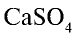
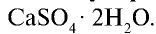
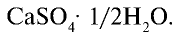
Алебастр — важный строительный материал, часто используемый при строительстве объектов. В медицине гипс используется для наложения всевозможных гипсовых повязок.
Сульфат меди(Н)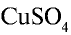
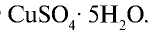 Железный купорос
Железный купорос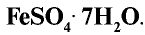
Скорость химических реакций
Можно ли ускорить протекание химических реакций?
Химические реакции протекают с различной скоростью. Некоторые реакции протекают за доли секунды, а другие могут длиться в течение нескольких дней, то есть идут очень медленно. Есть и такие реакции, для завершения которых требуются даже годы.
Если в химическом производстве некоторые реакции требуют ускорения, то некоторые необходимо замедлить. Например, процесс ржавления железных изделий требует замедления.
— Изменение концентраций веществ, участвующих в химической реакции, за единицу времени называется скоростью химической реакции.
Например, начальная концентрация вещества, вступающего в реакцию, равна 1 моль/л. Через 10 с, в течение которых продолжалась реакция, концентрация этого вещества составила 0,4 моль/л. Скорость совершившейся реакции определяется путем выполнения следующих действий.
Скорость химической реакции — v. В течение реакции концентрация вещества уменьшилась на 0,6 моль/л: (1 моль/л — 0,4 моль/л = 0,6 моль/л). Продолжительность реакции — 10 секунд.
Следовательно, скорость этой реакции равна 0,06 моль/л с.
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS 2HCl → FeCl2 H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопытполучения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 3Na2S 6H2O → 2Cr(OH)3 3H2S↑ 6NaCl
Строение атомов элементов подгруппы кислорода
На внешнем энергетическом уровне атомов этих элементов имеется шесть электронов:
Поэтому эти элементы для завершения внешнего энергетического уровня, то есть пополнения восемью электронами, присоединяют два электрона и проявляют в соединениях степень окисления —2. В соединении с фтором 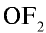
На внешнем энергетическом уровне атомов серы, селена и теллура имеются свободные d-орбитали, на которые могут переходить спаренные р- и s-электроны внешнего уровня.
Присоединяя электроны, S, Se и Те проявляют степени окисления —2, отдавая электроны, проявляют степени окисления 4, 6:
Кислород — элемент второго периода, на внешнем энергетическом уровне его атома нет d-орбиталей, поэтому он не может проявлять степени окисления 4, 6.
Факторы, влияющие на скорость химической реакции
1. Влияние концентрации реагирующих веществ на скорость химических реакций.
При изучении химических свойств кислорода в курсе химии 7 класса вы узнали, что на воздухе сера горит очень медленно, а в присутствии чистого кислорода быстро сгорает ярким пламенем.
При горении серы в присутствии чистого кислорода количество молекул кислорода, ударяющихся о поверхность серы, намного больше, чем в воздухе. Это связано с тем, что кислород занимает 21% объема воздуха.
Скорость химических реакций равна произведению концентраций веществ, участвующих в реакции. Например, для реакции А В=С v = к [А] • [В], где [А] и [В] — молярные концентрации веществ А и В, к — коэффициент пропорциональности.
2. Влияние температуры на скорость химических реакций.
При повышении температуры скорость реакции увеличивается в 2—4 раза:
где 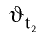
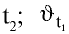
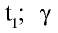
3. Влияние природы веществ на скорость химической реакции.
4. Для твердых веществ скорость реакции прямо пропорциональна поверхности веществ, вступающих в реакцию.
Рассмотрим эту зависимость на примере реакции соединения железа с серой.
Реакция Fe S = FeS протекает быстрее до строго определенной степени измельчения частиц железа. При увеличении степени измельчения частиц до порошкообразного состояния скорость реакции ослабевает, так как происходит спекание, которое снижает взаимное столкновение молекул.
5. Влияние катализатора на скорость химической реакции.
Реакция расщепления пероксида водорода ускоряется в присутствии
МпОг Процесс получения оксида серы (VI) ускоряется в присутствии катализатора оксида ванадия (V).
— Вещества, которые ускоряют химические реакции, но сами остаются без изменений, называются катализаторами.
Ингибиторы — это вещества, которые снижают возможность веществ вступать в химическую реакцию.
Элементы знаний, умений и навыков: скорость химической реакции, концентрация, температура, температурный коэффициент скорости, столкновение молекул, катализатор, ингибитор.
Физические свойства
Дигидросульфид – бесцветный газ с запахом протухших яиц и сладковатым вкусом. Это ядовитое вещество, опасное в больших концентрациях. Благодаря молекулярному строению в обычных условиях сернистый водород не сжижается.
Общие физические свойства сернистого водорода:
- плохо растворяется в воде;
- проявляет свойства сверхпроводника при температуре -70°С и давлении 150ГПа;
- огнеопасен;
- растворяется в этаноле;
- сжижается при -60,3°С;
- превращается в твёрдое вещество при -85,6°С;
- плавится при -86°С;
- кипит при -60°С;
- разлагается на простые вещества (серу и водород) при 400°С.

Химические свойства
Сернистый водород – мощный восстановитель. Основные химические свойства вещества описаны в таблице.
Реакция | Описание | Уравнение |
С кислородом | Горит на воздухе голубым пламенем с образованием диоксида серы. При недостатке кислорода образуется сера и вода | – 2H2S 4O2 → 2H2O 2SO2; – 2H2S O2 → 2S 2H2O |
С окислителями | Окисляется до диоксида серы или серы | – 3H2S 4HClO3 → 3H2SO4 4HCl; – 2H2S SO2 → 2H2O 3S; – 2H2S H2SO3 → 3S 3H2O |
Со щелочами | При избытке щёлочи образуются средние соли, при отношении 1:1 – кислые | – H2S 2NaOH → Na2S 2H2O; – H2S NaOH → NaHS H2O |
Диссоциации | Ступенчато диссоциирует в растворе | – H2S ⇆ H HS–; – HS– ⇆ H S2- |
Качественная | Образование чёрного осадка – сульфида свинца | H2S Pb(NO3)2 → PbS↓ 2HNO3 |
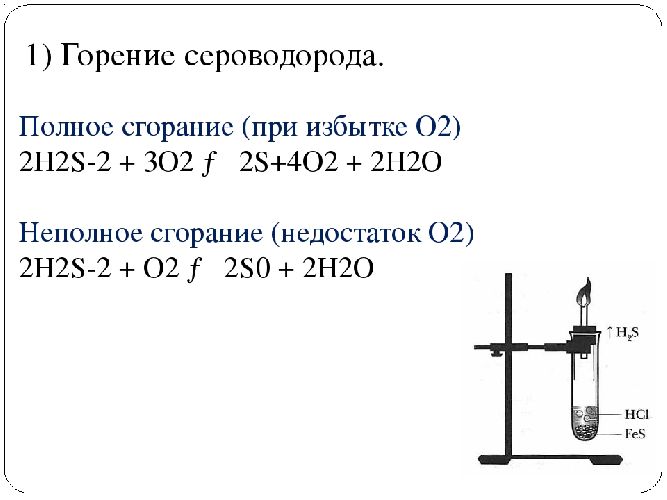
Химические свойства сероводорода
1.В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S 2NaOH → Na2S 2H2OH2S NaOH → NaНS H2O
2.Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S O2 → 2S 2H2O
В избытке кислорода:
2H2S 3O2 → 2SO2 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S Br2 → 2HBr S↓
H2S Cl2 → 2HCl S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S 4Cl2 4H2O → H2SO4 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S 2HNO3(конц.) → S 2NO2 2H2O
При кипячении сера окисляется до серной кислоты:
H2S 8HNO3(конц.) → H2SO4 8NO2 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S SO2 → 3S 2H2O
Соединения железа (III) также окисляют сероводород:
H2S 2FeCl3 → 2FeCl2 S 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S K2Cr2O7 4H2SO4 → 3S Cr2(SO4)3 K2SO4 7H2O
2H2S 4Ag O2 → 2Ag2S 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S H2SO4(конц.) → S SO2 2H2O
Либо до оксида серы (IV):
H2S 3H2SO4(конц.) → 4SO2 4H2O
4.Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S Pb(NO3)2 → PbS 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопытвзаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химическое равновесие
Почему реакция расщепления известняка считается необратимой?
Химические реакции подразделяются на обратимые и необратимые. Необратимые реакции протекают только в сторону образования продуктов реакции. Например,
В обратимых же реакциях химический процесс протекает в противоположные стороны. То есть сначала образуются продукты реакции, которые одновременно могут превращаться в исходные вещества. Например, оксид серы (IV), взаимодействуя с водой, образует сернистую кислоту: 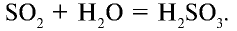
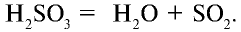
В обратимых химических реакциях по мере расходования исходных веществ их концентрации в растворе уменьшаются. В результате снижается скорость прямой реакции. И наоборот, за счет увеличения концентрации продуктов, образующихся в течение реакции, увеличивается скорость обратной реакции.
Химическое равновесие может быть нарушено при изменении давления, температуры и концентрации веществ. Катализатор не только не сдвигает химическое равновесие, а наоборот, способствует его быстрейшему установлению. Повышение температуры ускоряет реакции, протекающие с поглощением тепла.
Реакция окисления оксида серы (IV) является обратимой экзотермической реакцией: 
Повышение температуры этой реакции ускоряет обратную реакцию, а понижение температуры ускоряет прямую реакцию.
Увеличение давления сдвигает химическое равновесие в сторону реакции, приводящей к уменьшению объема продукта:
Из расчетов, выполненных на основе уравнения реакции, видно, что в прямой реакции происходит уменьшение объема. Значит, увеличение давления ускоряет прямую реакцию.
Увеличение концентрации одного из веществ в реакции, находящейся в состоянии химического равновесия, приводит к сдвигу химического равновесия в сторону расходования этого вещества. Например, в реакционной среде 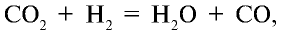
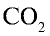
Элементы знаний, умений и навыков: обратимая реакция, прямая реакция, обратная реакция, химическое равновесие, сдвиг равновесия, факторы, обусловливающие сдвиг равновесия.

