2.1. Общие сведения
Нейтрализацией называется реакция обмена между кислотой и основанием, при которой оба соединения теряют свои характерные свойства, и происходит образование солей.
Кислоты и основания в водном растворе диссоциируются, насыщая его катионами Н (кислоты) или анионами ОН– (основания). В результате водородный показатель уменьшается или увеличивается.
Причина диссоциации электролитов (кислот, щелочей и их солей) заключается в полярности молекул воды. Показателем, характеризующим способность электролитов к диссоциации в момент равновесия, когда интенсивности диссоциации и противоположного процесса ассоциации стали одинаковыми, характеризуются показателем a, отношением количества диссоциированных молекул к их первоначальному количеству. Электролиты считаются сильными, если a ![]() 0,5. Например, к сильным кислотам относятся: азотная, соляная (
0,5. Например, к сильным кислотам относятся: азотная, соляная (![]() 0,5. Например, к сильным кислотам относятся: азотная, соляная (
0,5. Например, к сильным кислотам относятся: азотная, соляная ( более 0,9), серная (
![]() = 0,58); к слабым – фтороводородная (
= 0,58); к слабым – фтороводородная (![]() = 0,58); к слабым – фтороводородная (
= 0,58); к слабым – фтороводородная ( = 0,15), уксусная (
![]() = 0,13), угольная (
= 0,13), угольная (![]() = 0,13), угольная (
= 0,13), угольная ( = 0,017); к сильным основаниям – едкий натр (
![]() = 0,84), гашеная известь (
= 0,84), гашеная известь (![]() = 0,84), гашеная известь (
= 0,84), гашеная известь ( = 0,90); к слабым раствор аммиака (
![]() = 0,013). Степень диссоциации можно определять по значению Кдис(константы диссоциации), соответствующей равновесному состоянию, и показателем pКдис = –lgКдис. Чем более полно диссоциируется электролит, тем больше значение Кдис и меньше pКдис. Значения этих показателей приводится в литературе [1].Соли сильных кислот и оснований хорошо диссоциируют (a
= 0,013). Степень диссоциации можно определять по значению Кдис(константы диссоциации), соответствующей равновесному состоянию, и показателем pКдис = –lgКдис. Чем более полно диссоциируется электролит, тем больше значение Кдис и меньше pКдис. Значения этих показателей приводится в литературе [1].Соли сильных кислот и оснований хорошо диссоциируют (a ![]() = 0,013). Степень диссоциации можно определять по значению Кдис(константы диссоциации), соответствующей равновесному состоянию, и показателем pКдис = –lgКдис. Чем более полно диссоциируется электролит, тем больше значение Кдис и меньше pКдис. Значения этих показателей приводится в литературе [1].Соли сильных кислот и оснований хорошо диссоциируют (a
= 0,013). Степень диссоциации можно определять по значению Кдис(константы диссоциации), соответствующей равновесному состоянию, и показателем pКдис = –lgКдис. Чем более полно диссоциируется электролит, тем больше значение Кдис и меньше pКдис. Значения этих показателей приводится в литературе [1].Соли сильных кислот и оснований хорошо диссоциируют (a 0,5) и при этом значение рН воды не меняется. Соли сильных кислот и слабых оснований или слабых кислот и сильных оснований способны гидролизоваться; при этом в первом случае выделяется катион водорода, и значение рН уменьшается, во втором – выделяется гидроксид–ион и значение рН возрастает.
Для уменьшения рН воды ее обрабатывают кислотами, для повышения – основаниями. Преимущественно используют сильные электролиты.
Между концентрацией кислоты и основания и значением рН воды существуют прямые связи; соответствующие формулы приведены в табл. 6.2 [2].
Таблица 6.2
Расчет концентрации ионов Н и ОН-,рНрастворов различных соединений
Раствор | Формула для расчета | Пример | |
1. Сильная кислота разбавленная (например, НCl) | [H ] = Ck; pH = –lgCk; | CHCl = 0,1; [H ] = 0,1 = 10–1; pH = 1; | |
2. Сильная щелочь разбавленная (например, NaOH) | [OH–] = C0; pOH = –lgC0; pH = 14 lgC0; | CNaOH = 0,1; [OH–] = 10–1; pOH = 1; pH = 14 – 1 = 13; | |
3. Слабая кислота (например, СН3СООН) | [H ] = pH = 0,5(pKк – lgCк); pH = 0,5(pKк pCк); |
[H ]= pH = 3 – lg 1,36 = 2,87; | |
4. Слабая щелочь (например, NH4OH) | [OH–] = pOH = 0,5(pKо – lgCо); pOH = 0,5(pKо pCо); |
[OH–]= pOH = 4 – 0,78 = 3,22; pH = 14 – 3,22 = 10,78; | |
5. Слабая кислота в присутствии ее соли (например, СН3СООН СН3СООNa) | [H ] = Kк(Ск/Со); pH = pKк – lg(Со/Ск); pH = pKк pСк – pСс; |
[H ]=1,8×10–5 pH = 5 – lg 3,6 = 4,44; | |
6. Слабая щелочь в присутствии ее соли (например, NH4OH NH4Cl) | [OH–] = Kо(Со/Сс); pOH = pKо – lg(Со/Сс); pOH = pKо pСо – pСс; |
[OH–]=1,8×10–5 pOH = 5 – lg 7,2 = 4,14; pH = 14 – 4,14 = 9,86; | |
7. Соль слабой кислоты и сильной щелочи (например, СН3СООNa) | [H ] = pH=7 0,5(pKк lgСc); pH=7 0,5(pKк – pСc); |
[H ]= = pH = 9 – lg 1,35 = 8,87; | |
Раствор | Формула для расчета | Пример | |
8. Соль слабого основания и сильной кислоты (например, NH4Cl) | [H ] = pH=7 – 0,5(pKк lgСc); pH=7 0,5(pСc –pKо); |
[H ]= pH = 6 – lg 7,4 = 5,13; | |
9. Соль слабой двухосновной кислоты (например, Na2CO3) | [H ] = pH=7 0,5(pK»к lgСc); pH=7 0,5(pK»к – pСc); |
[H ]= = pH = 12 – lg 2,4 = 11,62; | |
10. Кислая соль слабой двухосновной кислоты (например, NaHCO3) | [H ] = pH=0,5(pK’к pK»к); |
[H ]= = pH = 9 – lg 4,2 = 8,38; | |
Принятые обозначения: Ск, Со, Сс– молярные концентрации кислоты, основания, соли; Kк, Kо – константы диссоциации кислоты, основания; K’к, K»к – первая и вторая константы диссоциации слабой двухосновной кислоты; pKк, pKо – показатели (отрицательный логарифм) константы диссоциации кислоты, основания;
pСк, pСс – показатели отрицательных логарифмов концентрации кислоты, соли; pOH = 14 – pH.
Под молярной концентрацией вещества понимается количество его грамм-молекул в 1 л раствора. Связь между молярной концентрацией См и концентрацией С в г/л выражается зависимостью: С = СмМ, где М – молекулярная масса вещества.
Методика определения дозы реагента (кислоты или основания) иллюстрируется примером расчета.
Пример 6.1.Определить дозу серной кислоты, необходимую для снижения рН раствора до 4.
В соответствии с примером № 9 табл. 6.2 раствор получается путем обработки воды кальцинированной содой Na2СО3 и при рН = 11,62.
Решение.
При гидролизе Na2СО3, являющейся солью слабой угольной кислоты и сильного основания (едкого натра), образуется NаОН, за счет чего и увеличивается рН воды.
Определим содержание NаОН для рН = 11,62.
рОН = 14 – рН = 14 – 11,62 = 2,38;
lgСмосн = – рОН = –2,38;
Смосн = 0,00417 моль.
Молекулярная масса едкого натра М = 40,01.
С = 0,00417 × 40,01 = 166,84×10–3 г/л = 166,84 мг/л.
Определим “x”–дозу серной кислоты, необходимого для полной нейтрализации едкого натра. Молекулярная масса Н2SО4 равна 98,0.
Н2SО4 2NаОН = Nа2SО4 2Н2О;
x = 166,84 × 98/2 × 40,01 = 204,3 мг/л.
Определим содержание серной кислоты при рН = 4.
рН = –lgСмкисл; lgСмкисл = –4;
Смкисл = 0,0001 моль; С = 0,0001 × 98 = 9,8 × 10–3 г/л = 9,8 мг/л.
Общая доза серной кислоты: 204,3 9,8 = 214,1 мг/л.
Если ввести к расчетной дозе серной кислоты повышающий коэффициент 1,1, как это обычно рекомендуется, то доза составит около 230 мг/л, а рН=3,48 < 4,0.
Поэтому расчетные дозы считается ориентировочными и дозирование производится в соответствии с показаниями рН-метра.
График нейтрализации многоосновной кислоты (рассматривается нейтрализация трехосновной ортофосфорной кислоты) имеет ступенчатый характер со «скачками» в местах отделения катионов водорода и образования новых анионов.
Если нейтрализуемый раствор обладает буферностью, то до исчерпания буферного резерва увеличение дозы нейтрализующего реагента не вызывает изменения водородного показателя. Причина заключается в том, что вводимые для нейтрализации катионы водорода или гидроксид – ионы связываются компонентами буферных растворов в мало диссоциированные соединения.
Выбор нейтрализующих реагентов производится с учетом их эффективности (продолжительность и полнота процесса, удельные дозы реагента), количества и характера, образующихся при нейтрализации продуктов (газы, осадки, растворенные вещества), условий применения (хранение, подготовка к использованию, удобство дозирования, безопасность обслуживания реагентного хозяйства).
Наиболее часто применяют серную, реже – соляную кислоту, из щелочных реагентов – гашеную известь, кальцинированную соду, едкий натр, реже – известняк и доломит CaMg(CO3)2.
В табл. 6.3 приведены количества продуктов, образующихся при нейтрализации сильных кислот некоторыми щелочными реагентами. Как следует из таблицы, почти во всех рассмотренных случаях образуются хорошо растворимые соли.
Исключением является гипс CaSO4, перенасыщенный раствор которого может вызывать образование трудноудаляемых отложений в коммуникациях и в оборудовании.
Таблица 6.3
Количество продуктов, образующихся при нейтрализации сильных кислот, в расчете грамм на грамм кислоты
Кислоты | Продукты | Основания | ||||
Ca(OH)2 | CaCO3 | NaOH | HCO3– | CaMg(CO3)2 | ||
H2SO4 | CaSO4 | 1,39 | 1,39 | – | – | 0,695 |
Na2SO4 | – | – | 1,45 | – | – | |
MgSO4 | – | – | – | – | 0,612 | |
CO2 | – | 0,45 | – | 0,9 | 0,45 | |
HCl | CuCl2 | 1,53 | 1,53 | – | – | 0,775 |
NaCl | – | – | 1,63 | – | – | |
MgCl2 | – | – | – | – | 0,662 | |
CO2 | – | 0,61 | – | 1,22 | 0,61 | |
HNO3 | Cu(NO3)2 | 1,30 | 1,30 | – | – | 0,65 |
NaNO3 | – | – | 1,25 | – | – | |
Mg(NO3)2 | – | – | – | – | 0,588 | |
CO2 | – | 0,35 | – | 0,70 | 0,35 | |
Реагенты вводятся в виде порошков (известь, кальцинированная сода), водных растворов (едкий натр, гашеная известь и др.), газов, активных загрузок фильтров (дробленый мрамор, известняк, доломит); Если на промышленных предприятиях образуются кислые и щелочные стоки, представляется возможной их взаимная нейтрализация путем смешения в регулируемом режиме.
Химическая реакция нейтрализации проходит мгновенно, но условия, от которых зависит ее возможность, требуют контакта между нейтрализуемым веществом и реагентом в течение 5–10 мин. и более. Наибольшая продолжительность контакта требуется в случае, если реагент вводится в виде суспензии (известковое молоко) или порошков, а также при использовании активных загрузок фильтров (мутационная фильтрация).
Корректировка рН применяется с целью оптимизации многих технологических процессов очистки воды: коагуляции, удаления из воды ионов тяжелых металлов, подготовки к сорбции или к ионному обмену, деструкции загрязнений методами окисления и восстановления.
Рассмотрим некоторые случаи корректировки рН воды.
3.2.3. Окисление пероксидом водорода
Пероксид водорода Н2О2 имеет высокий окислительно-восстановительный потенциал, нормальное значение которого в реакции 2Н2О ↔ Н2О2 2Н 2е– равно 1,77 В. При разложении пероксида образуется кислород и выделяется тепло:
2Н2О2 = 2Н2О О2 98,8 кДж/моль.
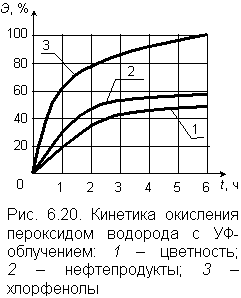 | В условиях химической или физической активации разложение пероксида сопровождается образованием свободных радикалов ОН· и О·, обладающих, как уже отмечалось, чрезвычайно высокой реакционной способностью. В роли катализаторов выступают металлы с переменной валентностью: марганец, медь, железо, кобальт. На рис. 6.20 приведен график, описывающий кинетику окисления фенола пероксидом водорода в присутствии катализатора – двухвалентного железа FeSO4. Окисление продолжается 10–20 минут. За несколько десятков минут в присутствии металлов–катализаторов и в кислой среде полностью (до состояния карбоновой кислоты) разрушаются нитриды, до цианатов – цианиды, органика бытовых сточных вод при рН = 5 на 60 % окисляется до углекислого газа. Сильнейшую активизацию процесса окисления вызывает фотолиз (ультрафиолетовое облучение) в интервале значений рН от 6,5 до 8,0. В этих условиях происходит разложение пероксида водорода и образование свободных радикалов НО·: |
Н2О2 ![]() 2НО·.
2НО·.
Свободные радикалы способны разрушить многие устойчивые соединения. Рассмотрим это на примере окисления предельных углеводородов.
Предельными углеводородами или алканами, к которым относятся метан, этан, пропан и другие, называются соединения, состоящие из атомов углерода и водорода.
Атомы имеют ковалентные связи С–С и С–Н. При разрушении молекулы алкана по связи С–Н образуется углеродный радикал RС и атом водорода.
Например, СН4 (метан) распадается на радикал СН3 (метил) и водород.
Окисление предельных углеводородов свободными радикалами НО· происходит согласно следующим уравнениям реакций:
RСH HO· ↔ RС H2O;
RС O2 ↔ RСOO·;
RСOO· RСH ↔ RСOOH RС;
2RСOOH ↔ RСН RСOO· и т.д.
По японским исследованиям сочетание пероксида водорода с фотолизом позволяет разрушить гуминовые кислоты до углекислого газа и воды, достичь глубокой деструкции СПАВ, нефтепродуктов, пестицидов и ряда других примесей техногенного происхождения.
Достигаемый при этом эффект очистки достаточно высок, как это видно из экспериментальных графиков на рис. 6.20. Исследования были выполнены для воды, содержащей 1,5 мг/л нефтепродуктов, 2,1 мг/л хлорфенола, имеющей цветность 90 градусов. После очистки в воде не содержалось токсичных продуктов окисления.
Применение перекиси водорода имеет то несомненное преимущество, что это наиболее чистый в экологическом отношении способ окисления. В [53] отмечается, что до 25 % производимого в мире пероксида водорода идет на цели охраны окружающей среды.
В табл. 6.5 приводятся некоторые данные о применении пероксида водорода для деструкции различных соединений.
Таблица 6.5
Примеры деструктивных процессов с участием пероксида водорода [53]
Соединение | Уравнение реакции | Удельная доза Н2О2, г/г | рН среды |
Серосодержащие | |||
Сероводород | H2S H2O2 → 2H2O S· | 1 | 6–8 |
Гидросульфиды | HS– H2O2 H → 2H2O S· | 1,03 | £ 8 |
Сульфиды | S2– 4H2O2 → SO42– 4H2O | 4,25 | > 8 |
Меркаптаны и другие тиолсодержащие соединения (RSH) | RSH 3H2O2 OH– → RSO3– 4H2O (2RSH H2O2 → RSSR 2H2O) | > 5 | 2–11 |
Сульфиты | SO32– H2O2 → SO42– H2O | 0,43 | > 8 |
Диалкилсульфиды (RSR) | RSR H2O2 → RSO H2O | > 2 | 2–4 |
Диалкилдисульфиды (RSSR) | RSSR 5H2O2 2OH– → 2RSO3 6H2O | > 5 | 2–11 |
Полисульфиды (SX2–) | S42– 13H2O2 6OH– → 4SO42– 16H2O S52– 16H2O2 8OH– → 5SO42– 20H2O | 3,45 3,4 | > 8 > 8 |
Дитиониты | S2O42– 3H2O2 2OH– → 2SO42– 4H2O | 0,8 | > 8 |
Тиосульфаты | S2O32– 4H2O2 2OH– → 2SO42– 5H2O | 1,21 | > 8 |
Диоксид серы | SO2 H2O2 → H2SO4 | 0,53 | < 6 |
Азот- и хлорсодержащие | |||
Цианиды простые | CN– H2O2 → CNO– H2O (окисление) CNO– H2O H → CO2 NH3 (гидролиз цианатов) | 1,31 | 8,5–10 |
Цианиды комплексные | 2[Cu(CN)3]2– 7H2O2 2OH– → → 2[Cu(OH)2]↓ 6CNO– 6H2O | 1,52 | 9–11 |
Нитриты | NO2– H2O2 → NO3– H2O | 0,74 | 2–5 |
Оксиды азота | NO NO2 2H2O2 → 2HNO3 H2O 2NO2 H2O2 → 2HNO3 | 0,89 0,37 | ³ 10 ³ 10 |
Хлор | Cl2 H2O2 → O2 2HCl | 0,48 | 7–9 |
Гипохлориты | OCl2 H2O2 → O2 Cl– H2O | 0,66 | 7–9 |
Содержащие тяжелые металлы | |||
Перманганаты | 2MnO4– 5H2O2 6H → → 2Mn2 5O2 8H2O | 0,71 | < 3,5 |
Хроматы | 2CrO42– 3H2O2 10H → → 2Cr3 3O2 8H2O | 0,44 | < 3,5 |
Соли железа | Fe2 H2O2 2H → Fe3 2H2O | 0,3 | < 3,5 |
Органосодержащие | |||
Формальдегид | CH2O 2H2O2 → CO2 3H2O | 2,27 | £ 9 |
Гидрохинон | C6H6O2 13H2O2 → 6CO2 16H2O | 4,02 | 4–6 |
Фенол | C6H6OH 14,5H2O2 → 6CO2 18H2O | 5,06 | 3–4 |
Примечание: R – радикал
Свободные радикалы образуются на промежуточных этапах многих реакций окисления с участием пероксида водорода. Это видно, например, из записи многоэтапной реакции окисления двухвалентного железа кислородом воздуха, на четвертом этапе которого образуется пероксид водорода, а на пятом он взаимодействует с катионом двухвалентного железа.
Реактив фентона, состоящий из Н2О2 и Fe2 , служит источником получения свободных радикалов и используется для этой цели при органическом синтезе. Разложение пероксида водорода с образованием свободного радикала происходит в присутствии ионов серебра.
Преимущества пероксида водорода сравнительно с другими окислителями заключается в большей стабильности, простоте аппаратуры, необходимой для обработки воды, избирательным действием по отношению к окисляющимся примесям воды, в пределах которого может применяться этот реагент. Однако, главным преимуществом пероксида водорода является экологическая чистота процесса, о чем упомянуто выше.
Заметим, что в ряде реакций пероксид водорода выступает в качестве восстановителя, а не окислителя. В табл. 6.5 приводятся характерные реакции с участием пероксида водорода при очистке окислением и восстановлением, стехиометрически рассчитанные дозы реагента, рекомендуемые значения рН.
Следует иметь в виду, что дозы должны определяться опытным путем, т.к. зависят от конкретных условий прохождения реакции. Окисление перксидом водорода интенсифицируется в присутствии металлов с переменной валентностью и их окислов (марганец, никель, медь и др.). Как будет показано ниже, пероксид водорода может применяться в сочетании с озонированием.
Как будет показано ниже, пероксид водорода может применяться в сочетании с озонированием.
Окисление кислородом (горение)
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Электродные потенциалы
Каждая окислительно-восстановительная реакция слагается из полуреакций окисления и восстановления. Когда реакция протекает в гальваническом элементе или осуществляется путем электролиза, то каждая полуреакция протекает на соответствующем электроде; поэтому полуреакции называют также электродными процессами.
В § 98 было показано, что протекающей в гальваническом элементе окислительно-восстановительной реакции соответствует е.д. с. этого элемента 

В соответствии с разделением окислительно-восстановительной реакции на две полуреакции, электродвижущие силы также принято представлять в виде разности двух величии, каждая из которых отвечает данной полуреакции. Эти величины называются электродными потенциалами.
Для медно-цинкового элемента реакция, протекающая при его работе
разбивается на полуреакции;
Соответственно э.д. с. этого элемента 





В общем случае любому электродному процессу
соответствует электродный потенциал 



В дальнейшем, говоря об электродных процессах, мы будем записывать их уравнения в сторону восстановления (за исключением, конечно, тех случаев, когда речь будет идти именно об окислении).
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих трех факторов: 1) от природы веществ — участников электродного процесса, 2) от соотношения между концентрациями* этих веществ и 3) от температуры системы. Эта зависимость выражается уравнением:
* Строго говоря, величина электродного потенциала зависит от соотношения не концентраций, а активностей (см. § 86) веществ; во всех рассматриваемых далее уравнениях вместо концентрации должна стоять активность. Но при невысоких концентрациях растворов погрешность, вносимая заменой активности на концентрацию, невелика.
Здесь  — стандартный электродный потенциал данного процесса — константа, физический смысл которой рассмотрен ниже;
— стандартный электродный потенциал данного процесса — константа, физический смысл которой рассмотрен ниже; 









Концентрации (активности) , равные единице, называются стандартными концентрациями (активностями). Поэтому и потенциал, отвечающий этому случаю, называется стандартным потенциалом. Итак, стандартный электродный потенциал — это потенциал данного электродного процесса при концентрациях (точнее говоря, активностях) всех участвующих в нем веществ, равных единице.
Таким образом, в уравнении электродного потенциала первое слагаемое 



Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного процесса принять равным нулю. В качестве эталона для создания такой шкалы принят электродный процесс
Изменение энергии Гиббса, связанное с протеканием этой полуреакции при стандартных условиях, принимается равным нулю. В соответствии с этим и стандартный потенциал данного электродного процесса принят равным нулю. Все электродные потенциалы, приводимые в настоящей книге, а также в большинстве других современных изданий, выражены по этой, так называемой водородной шкале.
Рис. 84. водородный электрод.Рис. 85. Цепь для измерения электродного потенциала: слева — электрод, потенциал которого нужно измерить; справа — каломельный электрод; в середине — соединительный сосуд.
Приведенный выше электродный процесс осуществляется на водородном электроде. Последний представляет собой платиновую пластинку, электролитически покрытую губчатой платиной и погруженную в раствор кислоты, через который пропускается водород (рис. 84).
Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются на атомы (пластина катализирует этот распад). На поверхности соприкосновения платины с раствором кислоты может протекать, окисление атомов или восстановление ионов водорода.
Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов.
Установим, какой вид принимает общее уравнение электродного потенциала для водородного электрода. В соответствии с уравнением электродного процесса (см. стр. 271) 





Поскольку стандартный потенциал рассматриваемого процесса принят равным нулю, то
или, учитывая, что 
Для определения потенциала того или иного электродного процесса нужно составить гальванический элемент из испытуемого и стандартного водородного электродов и измерить его э. д. с. Поскольку потенциал стандартного водородного электрода равен нулю, то измеренная э. д. с будет представлять собою потенциал данного электродного процесса.
Практически при измерениях потенциалов в качестве электрода сравнения пользуются не стандартным водородным, а другими электродами, более удобными в обращении, потенциалы которых но отношению к стандартному водородному электроду известны. При этом необходимо рассчитать э. д. с. элемента согласно уравнению:
Здесь 






Для того чтобы найти значение электродного потенциала, необходимо измерить не напряжение работающего элемента, а именно его э. д. с. При измерениях э. д. с. сопротивление внешней цепи (т. е. измерительного устройства) очень велико. Реакция в элементе при этом практически не протекает.
Таким образом, электродные потенциалы отвечают обратимому протеканию процессов или, что то же самое, состоянию электрохимического равновесия на электродах. Поэтому электродные потенциалы часто называют равновесными электродными потенциалами или просто равновесными потенциалами.
Рассмотрим теперь, какой вид принимает общее уравнение электродного потенциала в важнейших случаях.
1. Электродный процесс выражается уравнением
где 







2. Электродный процесс выражается уравнением:
В этом случае и окисленная 


В этом и в рассматриваемых ниже случаях электрод, на котором протекает электродный процесс, изготовляется из инертного материала. Чаще всего в качестве такого материала применяют платину.
Мы рассмотрели примеры, когда в электродных процессах принимали участие только ионы, состоящие из одного элемента. Однако часто окисляющееся или восстанавливающееся вещество состоит не из одного, а из двух или большего числа элементов. Чаще всего в составе окислителя содержится кислород; при этом в электродном процессе обычно принимают участие также вода и продукты ее диссоциации — ионы водорода (в кислой среде) или гидроксид-ионы (в щелочной среде). Рассмотрим, как будут выглядеть в таких случаях уравнения потенциалов электродных процессов.
3. Электродный процесс выражается уравнением:
Эта полуреакция (при протекании ее в сторону восстановления) играет очень большую роль при коррозии металлов (см. § 196). Кислород — самый распространенный окислитель, вызывающий коррозию металлов в водных средах.
В рассматриваемом электродном процессе в результате восстановления кислорода, протекающего с участием ионов водорода, образуется вода. Следовательно, 






4. Для электродных процессов, записываемых более сложными уравнениями, в выражениях для потенциалов содержится большее число переменных концентраций. Рассмотрим, например, электродный процесс:
Эта полуреакция протекает (в сторону восстановления) при взаимодействии перманганата калия с большинством восстановителей в кислой среде.
Концентрации всех веществ, участвующих в рассматриваемом электродном процессе, кроме воды, — величины переменные. Для этого процесса 

Таблица 18. Электродные потенциалы в водных растворах при 25 °С н при парциальном давлении газов, равном нормальному атмосферному давлению
Продолжение табл. 18
Как уже сказано, зависимость электродного потенциала от природы веществ — участников электродного процесса учитывается величиной 

Положение той или иной электрохимической системы в этом ряду характеризует ее окислительно-восстановительную способность. Под электрохимической системой здесь подразумевается совокупность всех веществ — участников данного электродного процесса.
Окислительно-восстановительная способность представляет собою понятие, характеризующее именно электрохимическую систему, но часто говорят и об окислительно-восстановительной способности того или иного вещества (или иона). При этом следует, однако, иметь в виду, что многие вещества могут окисляться или восстанавливаться до различных продуктов. Например, перманганат калия  может в зависимости от условий, прежде всего от
может в зависимости от условий, прежде всего от  раствора, восстанавливаться либо до иона
раствора, восстанавливаться либо до иона  , либо до
, либо до  , либо до иона
, либо до иона 
Соответствующие электродные процессы выражаются уравнениями:
Поскольку стандартные потенциалы этих трех электродных процессов различны (см. табл. 18), то различно и положение этих трех систем в ряду  . Таким образом, один и тот же окислитель
. Таким образом, один и тот же окислитель  может занимать в ряду стандартных потенциалов несколько мест.
может занимать в ряду стандартных потенциалов несколько мест.
Элементы, проявляющие в своих соединениях только одну степень окисленности, имеют простые окислительно-восстановительные характеристики и занимают в ряду стандартных потенцпалоз мало мест. К их числу относятся в основном металлы главных подгрупп I-III групп периодической системы.
Ряд стандартных электродных потенциалов позволяет решать вопрос о направлении самопроизвольного протекания окислительно-восстановительных реакций. Как и в общем случае любой химической реакции, определяющим фактором служит здесь знак изменения энергии Гиббса реакции.
Если из двух электрохимических систем составить гальванический элемент, то при его работе электроны будут самопроизвольно переходить от отрицательного полюса элемента к положительному, т. е. от электрохимической системы с более низким значением электродного потенциала к системе с более высоким его значением.
Но это означает, что первая из этих систем будет выступать в качестве восстановителя, а вторая—в качестве окислителя. Следовательно, в гальваническом элементе окислительно-восстановительная реакция может самопроизвольно протекать в таком направлении, при котором электрохимическая система с более высоким значением электродного потенциала выступает в качестве окислителя, т. е. восстанавливается.
Если окислитель и восстановитель расположены далеко друг от друга в ряду 


может самопроизвольно идти как слева направо, так и справа налево. Направление ее протекания определяется концентрациями ионов железа и ртути. В этой реакции участвуют две электрохимические системы:
Соответствующим электродным процессам отвечают потенциалы:
Подсчитаем величины 










 Пример. Установить, направление возможного протекания реакции:
Пример. Установить, направление возможного протекания реакции: 
Запишем уравнение реакции в иоино-молекулярной форме: 2Вг~ РЬ02 4Н = РЬ2 Вг2 2НгО
В табл. 18 находим стандартные электродные потенциалы электрохимических систем, участвующих в реакции:
Окислителем всегда служит электрохимическая система с более высоким значением электродного потенциала. Поскольку здесь  значительно больше, чем
значительно больше, чем  , то практически при любых концентрациях взаимодействующих веществ бромид-ион будет служить восстановителем и окисляться диоксидом свинца: реакция будет самопроизвольно протекать слева направо.Чем дальше находится та или иная система в ряду стандартных потенциалов, т. е. чем больше ее стандартный потенциал, тем более сильным окислителем является ее окисленная форма. И, наоборот, чем раньше расположена система в ряду, т. е. чем меньше значение
, то практически при любых концентрациях взаимодействующих веществ бромид-ион будет служить восстановителем и окисляться диоксидом свинца: реакция будет самопроизвольно протекать слева направо.Чем дальше находится та или иная система в ряду стандартных потенциалов, т. е. чем больше ее стандартный потенциал, тем более сильным окислителем является ее окисленная форма. И, наоборот, чем раньше расположена система в ряду, т. е. чем меньше значение 

При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакции — возрастают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает.


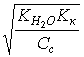 ;
;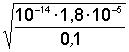 =
=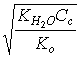 ;
;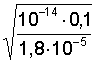 =7,4
=7,4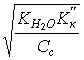 ;
;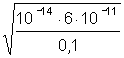 =
=