- Валентность и прочие азы
- Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
- Таблица валентности химических элементов (1 часть):
- Таблица валентности химических элементов (2 часть):
- Таблица валентности химических элементов (3 часть):
- Химические свойства
Валентность и прочие азы
Можно, но очень осторожно. Соответствие между структурной формулой и валентностью атомов весьма запутано, потому что с момента появления электронных представлений о химической связи, единых правил рисования структур так и не появилось, и в химической литературе весьма причудливым образом болтаются остатки сразу нескольких систем, бывших в употреблении, и мало кто обращает на это внимание. Может и не нужно? А это ваше дело, как к этому относиться, это зависит от того, что собственно вы хотите от структуры.
Важно понимать, что валентность старше структуры. Старше и в том смысле, что появилась раньше, и в том, что валентность можно и нужно устанавливать до структуры по химическим взаимоотношениям соединений в рядах, восходящих к простым бинарным соединениям. Азот в азотной кисоте пятивалентен потому что азотная кислота происходит от азотного ангидрида, валентность в котором устанавливается непосредственно по соотношению эквивалентов азота и кислорода. Я постоянно повторяю этот пример, потому что на меня произвело огромное впечатление стремление современных методистов доказать, что азот в азотной кислоте четырёхвалентен, поставив структуру, весьма поверхностно понятую, впереди валентности. И сломав тем самым очевидный ряд. О других, не менее поразительных примерах поговорим дальше.
Мы сейчас понимаем структуру однозначно: как картинку атомов, соединённых химическими связями. Дальше мы начинаем думать, что такое химические связи и какие они бывают, очень часто на этой дороге возникают вопросы, мы сначала честно их пытаемся разрешить, не всегда получается, и в конце концов смиряемся с тем, что всё сложно, а жить надо, и принимаем какую-нибудь упрощённо-компромиссную картину связывания, не всегда корректную.
А вот до появления этих представлений структуры рисовали вполне определенным образом, соединяли элементы черточками, количество черточек соответствовало валентностям. Каждая черточка – единица валентности. Ещё раз – не связь! – а единица валентности. А почему не связь? Некоторые ученые 19 века использовали и такое слово, но по этому поводу были большие споры, а можно ли вообще использовать такое понятие как связь. Не первый раз пишу, что ученые 19 века были строгими позитивистами в философском смысле, за что их совершенно страстно ненавидел Ленин и даже книжку по этому поводу написал, весьма злобный памфлет под названием Материализм и эмпириокритицизм. Ученые настаивали на том, что единственный источник заний – опыт, эксперимент, и его интерпретация, вновь проверяемая опытом. Если что-то нельзя установить опытом, это не предмет науки, вненаучная фантазия. Ленин же настаивал на том, что существует некоторая истина, материя, и существует она сама по себе. Знания о материи истинны. Ленин не озабочивался вопросом, а откуда эти знания берутся, и что делать, если их не получается установить. В этом месте может показаться, что противоречие между позитивистами-учеными и шарлатаном Лениным чисто кажущееся, просто де Ленин намекает на то, что ученые придумают новые эксперименты и разберутся, наука всё время развивается, какие проблемы. Типа, как говорят любители Ленина – смотрел в будущее, “в черепе сотней губерний ворочал…взвешивал мир в течение ночи”. Фокус в том, что великий вождь Ленин и его поклонники, малые вождьки, были совершенно уверены в том, что они имеют инструмент отделения верных знаний от неверных, что они, конечно, не знают каких-то деталей, но имеют некую целостную картину материи, и могут на этом основании отделять правильную науку от неправильной. Ленин на этом пути установил планку и весьма высоко, в памфлете он страстно клеймит великих физиков Больцмана и Клаузиуса, фактически обвиняя их в непонимании физики. Он, типа, лучше понимает Второе начало термодинамики, чем ученые, которые это начало и открыли и разработали. Это совершенно дикая самоуверенность, почти на грани душевной болезни. Не понимая ни одной формулы физики, на основании своих вульгарно-материалистических построений, он крушит всё, что ему не нравится, и что подвергает сомнению его собственную мечту кроить мир в соответствии со своими завиральными идеями. Мы отлично знаем, что было дальше, с каким удовольствием этим же стали пользоваться дальше уже совсем убогие вождьки, и какой страшный урон это нанесло российской науке, вполне передовой в начале 20 века.
Так вот настоящие учёные в 19 веке были позитивистами. И очень осторожно относились к понятию “связь” – в то время трудно было себе представить эксперимент, который можно было бы использовать для обоснования этого понятия. В 19 веке вполне поняли масштаб размеров атомов и молекул, Иоганн Лошмидт в 1865 году оценил диаметр молекулы кислорода в число порядка одного нанометра, одной миллионной части миллиметра. Оптику в те времена знали уже очень хорошо, и без лишних споров поняли, что визуально молекулы рассмотреть не получится возможно никогда. И как ещё их можно рассмотреть тоже понятия не было никакого. Для каких-либо экспериментов на уровне молекул и для их корректной интерпретации нужна квантовая физика, и это всё тогда было сильно впереди и за горизонтом. Поэтому химики того времени старались придерживаться того, что было для них ясно из их экспериментов. Было ясно, что атомы элементов могут каким-то образом связываться с атомами других элементов, но ничего кроме электричества, зарядов, притяжения и отталкивания зарядов для того, чтобы попробовать объяснить как атомы связываются друг с другом, не было. Электричество и электростатика возникли намного раньше электронов. Ученые того времени естественно ходили вокруг электричества, тем более что представление о ионах тоже уже тогда было. Но электричество не может объяснить одну важную вещь – почему атом притягивает (связывает) всегда одно и то же число других атомов. Можно это выразить так – электростатическое взаимодействие не является насыщаемым – пока есть заряд и место вокруг него, он будет притягивать другие заряды. А вот взаимодействие атомов как раз является насыщаемым – как только атом притянет (свяжет) положенное количество других атомов, он больше не хочет, он насытился. И наличие места ни при чём -для некоторых атомов для насыщения достаточно одного другого атома, для других – двух, или трех, или четырех. Все это слишком мало, чтобы занять все место. Явно не в месте дело.
В общем, пришлось признать, что разобраться, как связаны атомы, есть ли между ними какая-то связь, и какова природа этой связи, в 19 веке было невозможно, это было за пределами опыта и разумной интерпретации, и настоящие позитивисты, а это, повторю еще раз, было что-то типа правил приличия для ученого 19 века, признали, что единственное, что они знают и установили из опытов – это соотношения элементов в соединениях, то есть валентность. Валентность – это свойство атомов элемента, определенное экспериментально. Вполне в рамках позитивизма, основной философии научного познания 19 века. Мы не знаем почему это так, но знаем что это именно так из надежных и многократно повторенных опытов. Кто-то считает, что у водорода может быть валентность два – отлично, предъявляйте ваш эксперимент (представление о водородной связи, особенно сильной как в дигидрофторид-ионе появилось уже в 20-м веке, а это можно попробовать интерпретировать как наличие у водорода более одной валентности и потребуются дополнительные соображения чтобы доказать, что это не так). У кислорода три? – данные на стол! – нет? – вон отсюда!!
Если есть валентность, получается весьма стройная теория структуры молекул, не выходящая за рамки опыта и его разумной интерпретации. У каждого атома есть своя валентность, то есть способность соединяться с определенным числом других атомов, в соответствии с их валентностями. Атомы соединяются валентностями. Валентность изображается прямой чертой. Получается то, что мы узнаем как структурные формулы, только у нас в это понятие вложено гораздо больше смысла – мы видим молекулу как конкретный геометрический объект, знаем какие там связи, какие у них длины, какие углы, двугранные углы, знаем кое-что о внутреннем вращении и так далее, и всё это можем увидеть в экперименте с помощью разных дифракционных методов, и с успехом объясняем с помощью какой-нибудь квантовой теории, более простой, типа правил Джиллеспи-Нюхольма, или более сложной типа теории МО или квантовых расчетов разной степени сложности. А в те времена под структурой понимали просто соединение атомов, соответствующее валентностям. И никакой геометрии за исключением одного важного случая – теории Вант-Гоффа и Ле Беля об асимметрическом атоме углерода, это 1870-е, изрядная старина, несколько лет всего после Таблицы Менделеева, тем более это невероятно гениальная теория. Гипотеза Вант Гоффа – Ле Беля потребовалась, чтобы объяснить экспериментальный факт – наличие оптических изомеров. Раз такие изомеры – а это экспериментальный факт – есть, нужно это объяснить. У нас нет ничего кроме валентности (углерод 4-валентен) и из этого не следует ничего, кроме того, что рядом с углеродом 4 других атома. Всё, больше ничего нет. Объяснение, пришедшее в голову одновременно голландцу и французу – образец лаконичного и прямого мышления. Вокруг насыщенного атома углерода четыре валентности и атомы на них образуют тетраэдр.
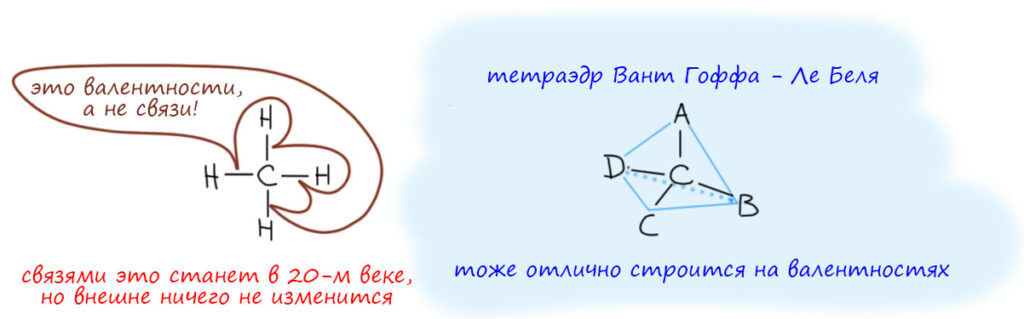
Для этого, обратите внимание, не потребовалось петрить в гибридизации и орбиталях. Вант Гофф и Ле Бель и не петрили, и отлично себя чувствовали, Вант Гофф (точнее ван’т Хофф) даже в конце получил нобелевку, правда не только за это, а по совокупности заслуг перед химией, которых хватило бы на дюжину крупных учёных. Вообще для этого не нужно ничего, кроме догадки о том, что тетраэдр – самое естественное расположение четырех атомов (шариков) вокруг одного атома (шарика): тетраэдр – это просто самая симметричная фигура с четырьмя вершинами, делающая эти четыре вершины наиболее равноправными в пространстве. Самая позитивистская гипотеза из всех возможных – если мы не знаем ничего, кроме того, что вершин четыре, самая простая фигура в пространстве – это тетраэдр. И немного повертев тетраэдр в руках, выясняется, что при четырех разных вершинах получается два разных тетраэдра. Любая другая будет сложнее, потому что придется объяснять, отчего какие-то атомы получили какое-то особое расположение, из чего это следует, откуда данные, из какого эксперимента? Ах нет эксперимента, кроме существования оптических изомеров при четырех разных вершинах, тогда берите самое простое – тетраэдр, и не морочьте нам голову! Всё гениальное просто, не в том смысле что это может понять любой самозваный шарлатан, помусолив на ночь популярную книжицу, а в том смысле, что гениальное всегда проще негениального. Гениальное можно понять, затратив усилия, а негениальное нельзя – в негениальное можно только верить.
Итак, первые структурные формулы отражают именно валентности, а вовсе не химические связи, о которых до появления квантовой теории никто ничего не знал. И в рамках позитивистского мышления не имел права выдвигать гипотезы, не проверяемые опытом. Забудем поэтому пока про связи и убедимся, что с помощью валентностей получается весьма стройная картина структуры на том уровне знаний. В этом месте у многих возникнет вопрос, причём очень горячо сформулированный – а зачем мы копаемся в этом старье, 19 век, позитивизм, ленины всякие, валентности – зачем нам это в 21 веке, мы же в зиллион зиллионов раз умнее тех, сколько знаем всего. Бозон Хиггса нынче в тренде (уже успел выйти, но ещё пахнет), а не доисторические валентности. Не торопитесь. Химия – очень консервативная наука в своих основах, она прочно держится за понятия как раз 19 века, довольно часто даже почти их не изменяя. Мы часто даже не догадываемся, насколько недалеко ушли от тех основоположников и их идей, что говорит не только о нашей косности, но и о том, что идеи были хороши и построены на очень прочном основании непосредственной связи с опытом.
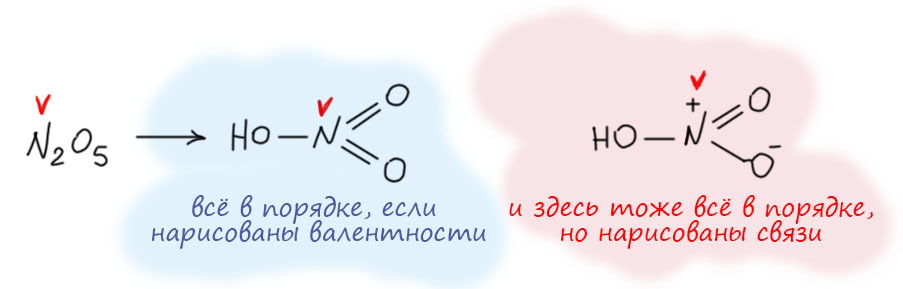
Вот, например, еще раз вспомним, как рисовалась структура азотной кислоты, и увидим понятную картинку. Азот в азотной кислоте 5-валентен. Это очевидно, потому что азотная кислота происходит от азотного ангидрида N2O5, а в нём азот очевидно пятивалентен, потому что на два азота приходится пять кислородов, кислород двухвалентен по определению, на десять валентностей кислорода приходится два азота. Поэтому структура азотной кислоты рисовалась с азотом, у которого 5 чёрточек-валентностей. Мы знаем, что сейчас категорически запрещается так рисовать азотную кислоту, потому что теперь мы рисуем связи, и соблюдаем правило октета, чёрточек-связей поэтому не может быть больше 4-х, получается известная всем формула с разделением зарядов. Отлично! И мы понимаем, почему азот в азотной кислоте пятивалентен, как её ни рисуй. Потому что не может валентность зависеть от способа изображения структуры. Если способ правилен, соответствует представлениям, в рамках которых он используется. Здесь оба способа правильны! Это очень важно понимать. Структура с пятью черточками правильна, если мы оговариваем, что изображаем валентности. Эта структура была в ходу очень долго, и в России (СССР) так азотную кислоту споскойно рисовали еще тридцать-сорок лет назад почти все, а когда кто-то шибко умный рисовал формулу со связями и соблюдением октета, иной раз мог и на проблемы нарваться. Конечно, с тех пор всё же все решили, что с октетом по жизни шагать лучше, чем без октета и теперь проблемы будут у того, кто нарисует с пятью черточками. И правильно будут, потому что в 21 веке уже наверняка никто не помнит, что раньше в структурных формулах изображали валентности.
И всё было бы совершенно здорово, если бы не одно странное обстоятельство. А что если нам нужно изобразить структуру не азотной, а фосфорной кислоты. В 21 веке! Сейчас. К сожалению, придется рисовать не мета- а орто-фосфорную кислоту, потому что мета-фосфорная кислота HPO3, прямой аналог азотной, по каким-то причинам страшно неустойчива, а точнее, не неустойчива, а чудовищно реакционноспособна, и воду вырывает даже у песков пустыни Сахара, образуя орто-фосфорную. Ну или полимеризуется, если воды нет вовсе. Фосфор в фосфорной кислоте пятивалентен, с этим точно никто не спорит, хотел бы я посмотреть на того, кто скажет, что в фосфорной кислоте фосфор четырёхвалентен. Я хочу видеть этого человека! Нет такого человека. В азотной кислоте азот нынче черырехвалентен, а в фосфорной фосфор пятивалентен. Вот как интересно стало в российском образовании, Периодический закон что дышло, вертим как хотим, мы не ждём милостей от химии, мы ею помыкаем. И всё же, вот как нарисуют структуру орто-фосфорной кислоты почти все:
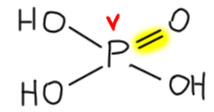
Согласимся, что нам привычна такая формула, мы и сами ее нарисуем, и школьника похвалим, если нарисует. И в литературе мы почти всегда видим такие формулы фосфорной кислоты, фосфатов, полифосфатов. В химической и биохимической литературе, в последней вообще фосфаты, фосфорильные остатки встречаются чаще воды, и рисуют их только так, в нуклеотидах, нуклеиновых кислотах, АТФ, мириадах фосфорилированных биомолекул, и т.п. Отлично.
Только погодите, а что означают эти черточки между фосфором и кислородом? Это связи или валентности? Какие могут быть валентности, что за старьё, в самых современных книжках и журналах только так рисуют, видели последний номер Nature? Любой, ведь какая-нибудь статья про какие-нибудь биомолеклы всегда найдётся, значит будут фосфорильные остатки, и если их разрисуют структурой, у фосфора будет один из кислородов на двойной связи. Не может же в таком современнейшем научном издании быть – валентность!? Значит это связи, ковалентные связи. А почему их пять? Почему у азота нельзя рисовать пять, а у фосфора можно и нужно? Фосфор же прямой аналог азота, прямо под ним стоит хоть в длинной, хоть в короткой Таблицах. В этом месте обычно начинается вкрадчиво-сбивчивый лепет про d-орбитали, типа они, конечно, высоко, но если нужно, а нужно ведь не кому-то там, а фосфорной кислоте и фосфатам, жизнь на Земле на кону, вы что, не понимаете, а вот d-орбитали всё понимают, поэтому так чуть-чуть присели, электрончик с дважды-занятой p-орбитали взяли и тут же использовали на связь с кислородом. А что, это тогда будет sp3d-гибридизация, это же наверное не тетраэдр, а антипризма какая-нибудь, а как вообще выглядит ион фосфата, это же вроде всё же тетраэдр? Да и, ой, а какие же у фосфора d-орбитали?? 2d – так таких не бывает. 3d – так эти только через пять элементов спустятся с небес и начнут принимать электроны, а пока они высоко-высоко, никакой роли играть не могут, что и показано за последние 70 лет всеми возможными способами. Да, был грех, была такая гипотеза, но она давно скисла и растворилась без остатка в анналах химии. Нет никаких сомнений в том, что валентная оболочка фосфора соответствует его статусу p-элемента и состоит, точно так же как у азота из s- и p-электронов, только не из второй, а из третьей оболочки, но это никак не меняет дела – фосфор есть p-элемент и обязан подчиняться правилу октета точно так же как азот. И если рисовать именно связи, нужно соблюдать правило октета, и вот что получится:
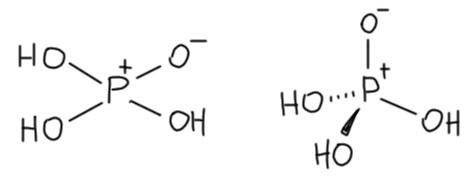
Заодно нарисовали эту молекулу в стереохимической проекции, чтобы увидеть, что форма этой молекулы – тетраэдр. Да, это правильная структурная формула. И здесь черточки изображают не валентности, а настоящие связи, ковалентные. И это не фантазия, а да, так и надо, это полностью соответствует всей совокупности известных данных про эту структуру. Да, рисовать надо именно так, и с этим согласны все, кто хоть немного серьёзно интересовался этой проблемой. А почему так не рисуют? Рисуют иногда, но чаще рисуют по старому, не отдавая себе отчета, что вместо связей рисуют валентности, как это и пошло с 19-го века. Никакого криминала здесь нет, такова традиция, кому надо тот рисует корректную структуру и использует именно ее в работе. Но традиция занятна – вот почему у азота обязательно надо рисовать, соблюдая октет и связями, а у фосфора не обязательно или вообще в голову не берем, поэтому рисуем как в 19 веке валентностями. Такие вещи очень трудно изменить. Особенно это касаеся биохимии, в которой всем до лампочки какие там связи и валентности, им важны фосфорильные остатки для своих нужд, и для них это чисто вспомогательная информация, недаром они часто вообще этот остаток сокращают как P в кружочке.
Ну и никто пока, видимо, не догадывается, что если так нарисовать, то выскочат продвинутые методисты и заявят, что фосфор отныне везде четырёхвалентен. Не буди лихо, хотя, к сожалению, оно уже давно не тихо, но хотя бы в эту сторону не смотрит.
И теперь мы увидим очень простую вещь – октет надо соблюдать для всех p-элементов. Для всех элементов пятой, шестой, седьмой, даже восьмой групп, главных подгрупп. Для фосфора, мышьяка, серы, селена, теллура, даже полония, хлора, брома, иода, даже астата,
сурьмы, висмута. Везде октет, везде максимум четыре ковалентные связи, а если есть пары, то меньше. Попробуем составить табличку из типичных, важных и часто встречающихся соединений самых важных элементов из этого набора, нарисуем структуру из валентностей, и правильную структуру, союлюдающую октет. Слева, на розовом фоне будут формулы, использующие валентности, как в 19 веке постановили их рисовать, в эпоху до открытия природы химической связи. Справа, на голубом, нормальные структурные формулы, соблюдающие октет и дополнительно показывающие стереохимию. Выборка отчасти случайная, можно было бы еще множество соединений добавить и других элементов. Но понятно, что фосфор, сера, хлор важнее всего. Ну и для полноты картины знаменитый тетраоксид ксенона. Везде я пометил валентности красными римскими цифрами (случайно в сернистой кислоте зачеркнуто, это просто перо сорвалось). Видим, что валентность не зависит от способа написания формулы.
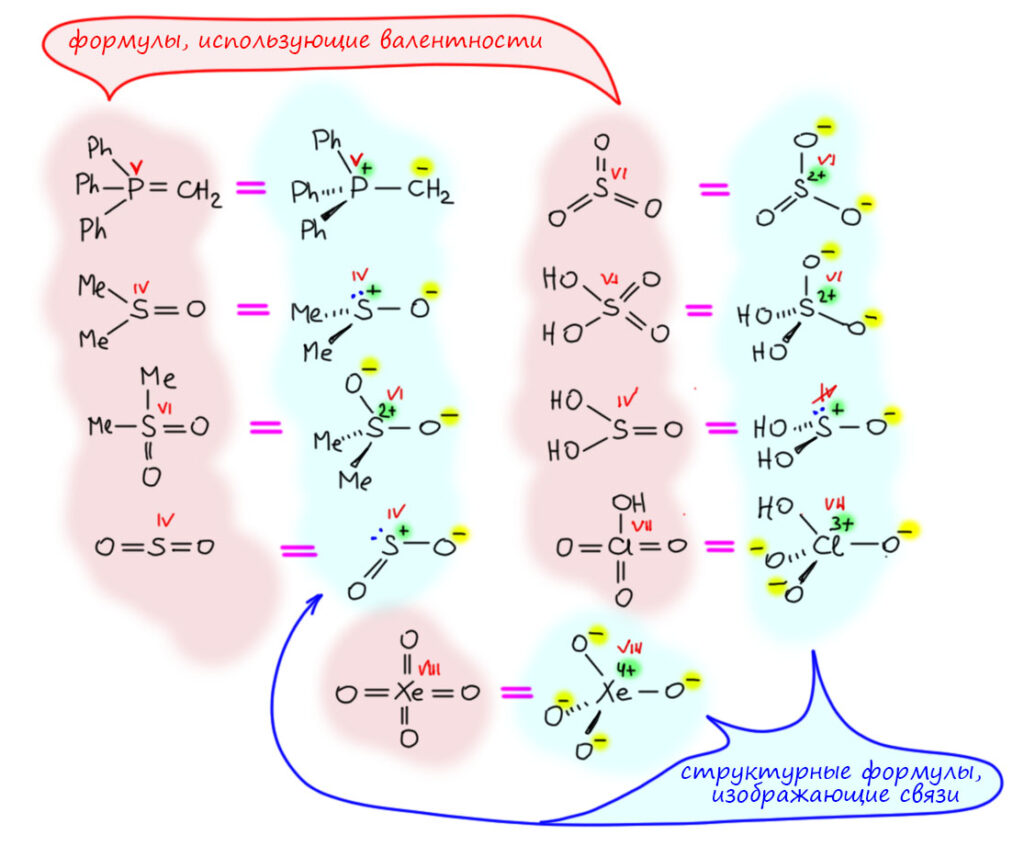
Посмотрим на эту табличку и покопаемся в памяти – к каким формулам мы привыкли. Думаю, почти все скажут, почти всегда к старым, с валентностями, а что они неправильные? Ещё раз – они правильные, но там валентности, а не связи. Если для каких-то целей желательно иметь более точное представление о структуре, тогда нужны связи, а не валентности, и это структуры на голубом фоне, соблюдающие правило октета. Видим презанятнейшую вещь – минимум для двух соединений из этой таблицы, для илидов фосфора и для сульфоксидов структуры сейчас чаще рисуют со связями и соблюдением октета. Вот как все повернулось – выбрали по каким-то причинам два соединения (два типа соединений) и настаивают, чтобы вместо валентностей рисовали связи. Для всех остальных как будто и не настаивают. Так получилось чисто случайно, просто в истории и илидов и сульфоксидов были настойчивые и влиятельные ученые, которые всех приучили рисовать корректные структуры со связями вместо валентностей. Во всех других случаях этого не произошло, пока не произошло. Особенно забавно, например, что для сульфоксидов теперь настаивают на формуле с октетом, а для сульфонов – вообще об этом не вспоминают. Так получилось потому что несмотря на близость сульфонов и сульфоксидов, химия и применение у них драматически различны, и исследователи в обоих областях разные.
Одной из причин массового нежелания использовать октетные формулы явно является необходимость писать заряды на атомах, для шестой-восьмой групп заряды получаются неуютно большими, не всякая рука хладнокровно выведет 2 (на сере, селене и т.д..), 3 (на хлоре, броме, иоде) и уж совсем караул 4 на ксеноне! Фффигня какая-то!! Да нет, все нормально. Это ведь формальные заряды, а не настоящие. Формальные заряды, напомню, рисуются из предположения, что ковалентная связь симметрична, пара электронов поровну делится между атомами. Мы просто считаем свои электроны и сравниваем с числом своих электронов в исходном атоме, разница и будет формальным зарядом. У ксенона, например, четыре ковалентные связи, восемь электронов всего, половина из них ксеноновы, половина от восьми это 4, а в исходном атоме ксенона своих электронов все восемь. Восемь минус четыре равно четырём, это и есть формальный заряд. У кислорода наоборот одна ковалентная связь и три пары свободных (потому что тоже полный октет) – значит “своих” электронов 6 1=7, а у свободного атома своих электронов (6-я группа) шесть. Один электрон сверху получился, формальный заряд -1. Но если мы заинтересуемся не формальными (на бумаге), а фактическими зарядами, которые будут проявлять себя в разных свойствах молекулы, например, в том же дипольном моменте, придется задуматься о распределении электронной плотности. Ведь по-настоящему связь несимметрична, плотность смещена в сторону электронодефицитного атома, во всех этих случаях плотность от кислорода с отрицательным зарядом смещается к центральному атому. Это вполне обычный индуктивный эффект, как мы его понимаем в органике. Этот эффект будет частично гасить положительный заряд на центральном атоме. Фактический заряд будет меньше. Насколько – это зависит от того, как мы выполним деление пространства между атомами (partitioning), это не самая простая задача, ведь между атомами нет границ и нет таможни, которая пропускает или не пропускает чужую плотность в область своего атома, и не берет взяток, не берет потому что ее нет. Была бы, брала бы. В квантовой науке используется несколько разных теоретических схем деления пространства молекулы на атомы – Малликена, Лёвдина, Бейдера. Не будем здесь об этом, мы здесь про самое простое в химии, про валентность, а это к ней не имеет никакого отношения. Но важно не бояться формальных зарядов, если они расставлены правильно. Не позволяйте развести себя на ехидные вопросы типа, а, хлор с тремя плюсами! разве так может быть (десять знаков ? и в голосе слышится: А вы, товарищ, не иностранный ли агент, не враг ли народа, вредитель, гвозди в масло трудящимся не ты положил, сволочь!). Спокойно объясните про то, что такое формальный заряд в химии, не поддавайтесь на провокации.
Увидим и еще одну прикольнейшую вещь. Если бы о таких структурах узнали методисты, продвигающие понимание валентности как подсчет ковалентных связей, вышла бы презабавнейшая вещь, даже две – у всех неметаллов не может быть “валентности” выше 4-х; валентность 4 в этой логике будет признана присущей подавляющему большинству соединений элементов от бора до ксенона, и поди тогда пойми зачем все эти периодические таблицы, коль везде четыре. Вот так и возникают верования. Образовалась бы партия Методистов Свидетелей Четвероицы. Вывод – от греха подальше не рассказывайте ЕГЭшным методистам про то, как надо правильно рисовать структуры соединений неметалов в высоких степенях окисления. А мы еще раз обсудим эту проблему на страничке про гипервалентность, которая скоро тоже будет.
И ещё одна вещь, довольно странная. Есть такая международная общественная организация, ИЮПАК, которая занимается в том числе стандартизацией номенклатуры и вообще всех формальных вещей, которые связаны с химией. Довольно часто получается неплохо, например, та же номенклатура органических соединений, которой мы пользуемся, хотя и видим в ней кучу недостатков. ИЮПАК это не большой-пребольшой дом в одной из пафосных столиц мира, в котором снуют уполномоченные миром специально обученные люди, которые за огромное жалованье неустанно сочиняют все эти правила и рекомендации. Это просто весьма свободное сообщество ученых, которые в свободное время соглашаются делать что-то полезное, бесплатно (иногда им компенсируют расходы на участие в ассамблеях) и так как получится. Получится хорошо, хорошо. Не очень хорошо, тоже хорошо. Совсем нехорошо, всё равно спасибо, ведь старались люди. Большое количество таких документов-рекомендаций просто публикуются в журнале ИЮПАК и остаются незамеченными. Никто не может заставить ни одного ученого, даже самого скромного (напоминаю, что скромность ученого не украшает) пользоваться рекомендациями ИЮПАК или хотя бы знать об их существовании. Номенклатурой – да, заставляют, на этом просто настаивают редакции журналов. Но не очень настойчиво. Один только пример: ИЮПАК требует называть фосфины фосфанами. Ну и часто вы это слово видели в статьях? Только одно издательство, Wiley, в своих журналах требует фосфанов, все остальные даже не замечают, если мы продолжает называть эти важнейшие соединения и лиганды фосфинами. А знаете, как те же правила рекомендуют называть воду? Ни в жисть не догадаетесь и бьюсь об заклад (надеюсь, это мягкая штука), что вы никогда не видели этого слова – оксиданом. Хотели назвать оксаном, но доперли, что ИЮПАК раньше это слово уже успел заиграть за одним гетероциклом.
Так вот это я к чему? К тому, что есть пафосная Рекомендация ИЮПАК-2008, составленная полутора десятками видных ученых из множества стран, и необычайно мелочно описывающая, как нам рисовать химические структуры и формулы (Brecher, J. Graphical representation standards for chemical structure diagrams (IUPAC Recommendations 2008). Pure Appl. Chem. 2008, 80, 277–410). Невероятно мелочно, вплоть до требований соблюдать определенные расстояния между чертами двойной связи и так далее. Большинство этих рекомендаций – просто дань здравому смыслу и обычному вкусу, мы и без них всю дорогу так рисуем. Но есть и крайне странные вещи. Например, рекомендации не рекомендуют использовать заряды рядом с атомами там, где этого можно избежать. И совершенно конкретно – не рисовать вот те самые структуры, соблюдающие октет, если для этого требуются заряды. В этих правилах написано – используйте в таких случаях двойные связи. Причем авторы рекомендаций понимают, что они таким образом рекомендуют нарушать октет – так и пишут, рисуйте двойные связи даже если это нарушает октет. Но не у соединений азота, здесь они крепко держатся за структуры с четырьмя связями. Более того, даже в таких соединениях как сульфоксиды, где уже давно все привыкли рисовать структуру с зарядами, тоже ИЮПАК это не рекомендует. Не просто не рекомендует, а пишет – Not acceptable, то есть неприемлемо. И делает это исключительно исходя из соображений эстетики, как её понимают авторы этих рекомендаций. На мой взгляд, здесь есть одна проблема – вот это слово “неприемлемо” по отношению к вещи, которая обусловлена законами химии. Я точно имею право нарисовать фосфат, сульфат, и так далее как структуру с соблюдением октета. Просто потому что это правильно, хотя и немного громоздко. Но могу согласиться этого не делать по эстетическим причинам, если ИЮПАК мне гарантирует, что всем понятно, что таким образом рисуются не связи, а валентности. Это было бы нормально, но увы, ИЮПАК ни мне, ни кому бы то ни было ещё ничего не гарантирует. Но так консервирует эти формулы с валентностями вместо связей. И продолжают у многих химиков поддерживать неверное представление об абсолютной уникальности азота, для которого нарушать октет – ни-ни, низззя!! – а для всего остального не просто можно, а нельзя по другому.
Вывод из этого прост как кирпич: валентность нас всех переживёт, даже если мы об этом и не догадываемся. И – не читайте рекомендаций ИЮПАК ни до, ни после чего бы то ни было.
Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов.
Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.
Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..
|
Таблица валентности химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Валентность | Примеры соединений | Примечание |
| 1 | Водород | H | I | HCl, H2O2 | |
| 2 | Гелий | He | отсутствует | ||
| 3 | Литий | Li | I | LiOH, Li2O | |
| 4 | Бериллий | Be | I, II | ||
| 5 | Бор | B | III | B2O3 | |
| 6 | Углерод | C | II, IV | ||
| 7 | Азот | N | I, II, III, IV |
| В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным |
| 8 | Кислород | O | II | (NO)F, CaO, O2, H2O2,Cl2O, H2O | |
| 9 | Фтор | F | I | HF, (NO)F | |
| 10 | Неон | Ne | отсутствует | ||
| 11 | Натрий | Na | I | Na2S, Na2O | |
| 12 | Магний | Mg | II | Mg(NO3)2 | |
| 13 | Алюминий | Al | III | Al2O3, Al2S3, AlCl3 | |
| 14 | Кремний | Si | II, IV | ||
| 15 | Фосфор | P | III, V |
| |
| 16 | Сера | S | II, IV, VI |
| |
| 17 | Хлор | Cl | I, III, IV, V, VI, VII |
| |
| 18 | Аргон | Ar | отсутствует | ||
| 19 | Калий | K | I | KOH, K2O, K2S | |
| 20 | Кальций | Ca | II | Ca(OH)2 | |
| 21 | Скандий | Sc | III | Sc2O3 | |
| 22 | Титан | Ti | II, III, IV | ||
| 23 | Ванадий | V | II, III, IV, V | ||
| 24 | Хром | Cr | II, III, VI | ||
| 25 | Марганец | Mn | II, III, IV, VI, VII |
| |
| 26 | Железо | Fe | II, III |
| |
| 27 | Кобальт | Co | II, III | ||
| 28 | Никель | Ni | II, III | ||
| 29 | Медь | Cu | I, II | ||
| 30 | Цинк | Zn | II | ZnSO4, ZnO, ZnS |
Таблица валентности химических элементов (2 часть):
| 31 | Галлий | Ga | I, II, III | ||
| 32 | Германий | Ge | II, IV | ||
| 33 | Мышьяк | As | III, V | ||
| 34 | Селен | Se | II, IV, VI | ||
| 35 | Бром | Br | I, III, V, VII | ||
| 36 | Криптон | Kr | отсутствует | ||
| 37 | Рубидий | Rb | I | RbOH | |
| 38 | Стронций | Sr | II | SrO | |
| 39 | Иттрий | Y | III | Y(NO3)3 | |
| 40 | Цирконий | Zr | II, III, IV | ||
| 41 | Ниобий | Nb | I, II, III, IV, V | ||
| 42 | Молибден | Mo | II, III, IV, V, VI |
| |
| 43 | Технеций | Tc | II, III, IV, V, VI, VII |
| |
| 44 | Рутений | Ru | II, III, IV, V, VI, VII, VIII |
| |
| 45 | Родий | Rh | II, III, IV, V, VI |
| |
| 46 | Палладий | Pd | II, IV | ||
| 47 | Серебро | Ag | I, II, III | ||
| 48 | Кадмий | Cd | I, II | ||
| 49 | Индий | In | I, II, III | ||
| 50 | Олово | Sn | II, IV | ||
| 51 | Сурьма | Sb | III, V | ||
| 52 | Теллур | Te | II, IV, VI | ||
| 53 | Йод | I | I, III, V, VII | ||
| 54 | Ксенон | Xe | отсутствует | ||
| 55 | Цезий | Cs | I | Cs2O | |
| 56 | Барий | Ba | II | Ba(OH)2 | |
| 57 | Лантан | La | III | La2(SO4)3 | |
| 58 | Церий | Ce | III, IV | ||
| 59 | Празеодим | Pr | II, III, IV | ||
| 60 | Неодим | Nd | II, III |
Таблица валентности химических элементов (3 часть):
| 61 | Прометий | Pm | III | PmBr3 | |
| 62 | Самарий | Sm | II, III | ||
| 63 | Европий | Eu | II, III | ||
| 64 | Гадолиний | Gd | II, III | ||
| 65 | Тербий | Tb | II, III, IV | ||
| 66 | Диспрозий | Dy | II, III | ||
| 67 | Гольмий | Ho | III | Ho2(SO4)3 | |
| 68 | Эрбий | Er | III | Er2O3 | |
| 69 | Тулий | Tm | II, III | ||
| 70 | Иттербий | Yb | II, III | ||
| 71 | Лютеций | Lu | III | LuBr3 | |
| 72 | Гафний | Hf | I, II, III, IV | ||
| 73 | Тантал | Ta | I, II, III, IV, V |
| |
| 74 | Вольфрам | W | II, III, IV, V, VI |
| |
| 75 | Рений | Re | I, II, III, IV, V, VI, VII |
| |
| 76 | Осмий | Os | I, II, III, IV, V, VI, VII, VIII |
| |
| 77 | Иридий | Ir | I, II, III, IV, V, VI |
| |
| 78 | Платина | Pt | II, III, IV, V, VI | ||
| 79 | Золото | Au | I, II, III, V | ||
| 80 | Ртуть | Hg | I, II | ||
| 81 | Таллий | Tl | I, II, III | ||
| 82 | Свинец | Pb | II, IV | ||
| 83 | Висмут | Bi | III, V | ||
| 84 | Полоний | Po | II, IV, VI | ||
| 85 | Астат | At | нет данных | ||
| 86 | Радон | Rn | отсутствует | ||
| 87 | Франций | Fr | I | FrOH | |
| 88 | Радий | Ra | II | Ra(OH)2 | |
| 89 | Актиний | Ac | III | Ac2O3 | |
| 90 | Торий | Th | II, III, IV | ||
| 91 | Протактиний | Pa | II, III, IV, V | ||
| 92 | Уран | U | III, IV, V, VI | ||
| 93 | Нептуний | Np | III, IV, V, VI, VII | ||
| 94 | Плутоний | Pu | III, IV, V, VI, VII | ||
| 95 | Америций | Am | II, III, IV, V, VI | ||
| 96 | Кюрий | Cm | II, III, IV | ||
| 97 | Берклий | Bk | III, IV | ||
| 98 | Калифорний | Cf | II, III, IV | ||
| 99 | Эйнштейний | Es | II, III | ||
| 100 | Фермий | Fm | II, III |
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента.
Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента.
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Коэффициент востребованности 5 698
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя(с большинством химических элементов) и свойства восстановителя(только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремниемс образованием оксидов:
S O2 → SO2
Si O2 → SiO2
1.3.Фосфоргорит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P 5O2 → 2P2O5
1.4.С азотомкислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca O2 → 2CaO
Однако при горении натрияв кислороде преимущественно образуется пероксид натрия:
2Na O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe O2→ 2FeO
4Fe 3O2→ 2Fe2O3
3Fe 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS 7O2→ 2Fe2O3 4SO2
Al4C3 6O2→ 2Al2O3 3CO2
Ca3P2 4O2→ 3CaO P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S 3O2→ 2H2O 2SO2
Аммиакгорит с образованием простого вещества, азота:
4NH3 3O2→ 2N2 6H2O
Аммиакокисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 5O2→ 4NO 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 3O2→ CO2 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 O2 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 2O2→ CO2 2H2O
2CH4 3O2→ 2CO 4H2O
CH4 O2→ C 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 O2 → 2CH3-CH=O
