— никеля оксиды — химическая энциклопедия
НИКЕЛЯОКСИДЫ. Монооксид
(минерал бунзенит)-не-стехиометрич. кристаллич. соед. NiOx,
где х ~ 1; в зависимости от способа получения и состояния оксида цвет
кристаллов может меняться от светло- до темно-зеленого и далее до черного; до
252 °С устойчив a-NiO [антиферромагнетик; С0р
44,3 Дж/(моль•К); S0298 38,0 Дж/(моль•К); см.
также табл.]; выше 252°C-b-NiO; т.пл. 1682 °С, однако уже выше 1230
°С начинается диссоциация NiO на металлич. Ni и О2. Обладает
слабоосновными св-вами; в воде не раств.; восстанавливается (Н2,
С, Mg, Al и др.) до металла. С оксидами др. металлов дает двойные оксиды, напр.
типа шпинели BaNiO2.
СВОЙСТВА ОКСИДОВ И ГИДРОКСИДОВНИКЕЛЯ
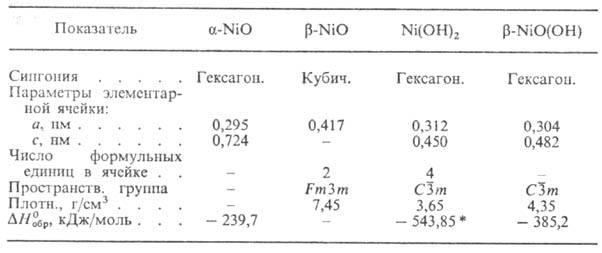
* Для свежеосажденного
DH0oбр — 531,7 кДж/моль,DG0oбр
— 477,32 кДж/моль.
Получают NiO нагреванием
соли Ni(II) при 1000-1100°С или окислением Ni при нагр. на воздухе или в
среде О2. Применяют для получения солей Ni(II) и никельсодержащих
катализаторов и ферритов, как пигмент для стекла, глазурей и керамики. ПДК в
воздухе рабочей зоны 0,005 мг/м3 (в пересчете на Ni).
Из водных р-ров солей Ni(II)
при добавлении р-римых в водегидроксидовметаллов осаждается Ni(OH)2
в виде объемного зеленого геля, кристаллизующегося при стоянии. Ni(OH)2-кристаллы;
плотн. 4,1 г/см3; S0298 80,0 Дж/(моль.К);
произведение р-римости в водном р-ре 2•10-16; легко раств. в NH3
с образованием амминокомплексов; неамфотерен; при 230-250 °С разлагается
до NiO. На электрохим. окислении Ni(OH)2 в щелочном р-ре основано
применение гидроксидов Ni в щелочных железоникелевых или кадмий-никелевых аккумуляторах.
Существование высших оксидов
Ni нельзя считать твердо установленным, хотя имеются сообщения о получении никеляоксида состава NiOl,33-2,0окислением NiO, NiCl2, Ni(OH)2кислородом при 200-400 °С или солей Ni(II) бромом в щелочном р-ре. Однако
индивидуальность выделенных фаз как хим. соед. определенного состава не доказана.
Предполагают, что механизм образования подобных фаз сводится к диффузииатомов
Ni из объема к пов-сти и связыванию их кислородом в неупорядоченные фазы NiOx
(x > 1,0). Имеются сообщения о выделении гидроксида Ni(OH)3
при окислении Ni(OH)2хлором или бромом в щелочном р-ре. Однако индивидуальность
Ni(OH)3 нельзя считать доказанной, поскольку выделенное соед. Ni(III)
из щелочного р-ра идентифицировались либо как двойные оксиды MNiO2,
либо как гидроксидоксид NiO(OH).
Г и д р о к с и д о к с
и д н и к е л я(III) NiO(OH) — черные кристаллы; существует в двух модификациях
g и b- Первую получают окислением Ni смесью Na2O2 с NaOH,
вторую-обработкой бромом щелочного р-ра Ni(NO3)2 или электролизом
этого р-ра. При старении осадка NiO(OH) образуется смешанный
гидроксидоксид состава Ni3O2(OH)4. Используют
NiO(OH) для очистки никелевого электролита от Со.
П. М. Чукуров.
Оксид никеля(ii), химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Опыт 3. получение и свойства гидроксида никеля (ii)
В пробирку налить 1-2 мл раствора NiCl2, добавить столько же раствора щелочи. Наблюдать образование осадка, отметить его цвет. Затем прилить несколько капель пероксида водорода. Изменяется ли цвет осадка?
Требования к результатам опыта:
1. Написать уравнение реакции получения гидроксида никеля (II).
2. Сделать вывод о характере изменения восстановительной активности в ряду Fe(OH)2 – Co(OH)2 – Ni(OH)2.
Опыт 4. Восстановительные свойства иона Fe2
Налить в пробирку 1-2 мл свежеприготовленного раствора FeSO4, добавить 1-2 мл разбавленной серной кислоты и прилить раствор перманганата калия KMnO4. Почему происходит обесцвечивание?
Требования к результатам опыта:
1. Закончить уравнение реакции: KMnO4 FeSO4 Н2SO4 =
2. Сделать вывод, какие свойства, окислительные или восстановительные, проявляют соединения железа (II).
Опыт 5. Окислительные свойства иона Fe3
К 1-2 мл раствора иодида калия KI прилить 1-2 мл хлорида железа (III) FeCl3 до появления коричневой окраски раствора. Раствор разбавить до бледно-желтого цвета и опустить в него полоску йодкрахмальной бумаги. Что наблюдается?
Требования к результатам опыта:
1. Составить уравнение окислительно-восстановительной реакции взаимодействия иодида калия с хлоридом железа (III).
2. Сделать вывод, какие свойства, окислительные или восстановительные, проявляют соединения железа (III).
Опыт 6. Получение комплексных соединений кобальта
К 1-2 мл раствора соли кобальта (II) прилить такой же объем концентрированного раствора KSCN. Образуется комплексная соль кобальта, раствор которой имеет синюю окраску.
Требование к результату опыта:
Составить уравнение реакции образования комплексной соли кобальта, учитывая, что координационное число кобальта равно 4.
Опыт 7. Получение комплексных соединений никеля
Налить в пробирку 1-2 мл раствора соли никеля (II), прилить растворNH4OH до образования осадка основной соли. К полученному осадку прилитьизбыток гидроксида аммония до растворения осадка. Наблюдать образование сине-фиолетового раствора аммиаката никеля.
Требования к результатам опыта:
1. Составить уравнение реакции образования основной соли никеля (II).
2. Составить уравнение реакции образования комплексной соли никеля, учитывая, что координационное число никеля равно 4.
Задачи
№ 22.1. Закончить уравнения реакций: а) Fe H2SO4 (разб.) =;
б) Fe HNO3 (оч. разб.) =; в) Ni H2SO4 (конц.) =; г) Co HCl =
№22.2. Написать в молекулярном и ионном виде уравнения реакций взаимодействия гидроксидов железа (II), кобальта (II) и никеля (III) с соляной кислотой.
№ 22.3. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → FeCl3
№ 22.4. Могут ли в растворе существовать совместно следующие вещества:
а) FeCl3 и SnCl2; б) FeSO4 и NaOH;
в) FeCl3 и K3[Fe(CN)6; г) FeSO4 и K3[Fe(CN)6?
Для взаимодействующих веществ составить уравнения реакций.
№ 22.5. Восстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4 CO = 3FeO CO2.
Вычислить 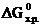 и сделать вывод о возможности самопроизвольного протекания этой реакции при 298 К. В каком направлении сместится равновесие этой реакции при повышении температуры? (
и сделать вывод о возможности самопроизвольного протекания этой реакции при 298 К. В каком направлении сместится равновесие этой реакции при повышении температуры? (  = -1014,2 кДж/моль;
= -1014,2 кДж/моль;
 = -137,1 кДж/моль;
= -137,1 кДж/моль;  = -244,3 кДж/моль;
= -244,3 кДж/моль;
 = -394,4 кДж/моль). (Ответ: 24 кДж).
= -394,4 кДж/моль). (Ответ: 24 кДж).
№ 22.6. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeСl2 → Fe(CN)2 → K4[Fe(CN)6] → K3[Fe(CN)6]
№ 22.7. Закончить уравнения реакций: а) Fe(OH)2 O2 H2O =;
б) Fe(OH)3 HCl =; в) Co(OH)3 HCl =; г) Ni(OH)3 HCl =
№ 22.8. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Ni → Ni(NO3)2 → Ni(OH)2 → Ni(OH)3 → NiCl2
№ 22.9. Какие степени окисления проявляет железо в своих соединениях? Как можно обнаружить ионы Fe2 и Fe3 в растворе? Составить молекулярные и ионные уравнения соответствующих реакций.
№ 22.10. Написать в молекулярном и ионном виде уравнения реакций гидролиза солей: а) FeCl2 H2O ↔; б) NiSO4 H2O ↔;
в) Co(NO3)2 H2O ↔; г) Fe2(SO4)3 H2O ↔.
№ 22.11. Закончить уравнения реакций получения феррата калия и бария (K2FeO4, BaFeO4): а) KOH FeCl3 Br2 = K2FeO4 ….;
б) K2FeO4 BaCl2 =; в) Fe2O3 KNO3 KOH = KNO2 …
№ 22.12. Закончить уравнения реакций образования комплексных соединений и назвать их, учитывая, что координационное число железа равно 6, а кобальта и никеля 4. а) Fe(CN)2 KCN =; б) Co(SCN)2 NH4SCN (избыток) =;
в) NiSO4 NH4OH (избыток) =
№ 22.13. Сколько часов надо вести электролиз раствора FeSO4, чтобы при силе тока в 2 А выделилось 279,2 г чистого железа? (Ответ: 133,6 ч).
№ 22.14. Рассчитать молярную массу эквивалентов и эквивалент восстановителя в реакции: Fe(OH)2 KMnO4 H2O =
№ 22.15. Определить тепловой эффект реакции
4FeS2 11O2 = 2Fe2O3 8SO2,
если в реакции участвует 59,2 г FeS2, а энтальпии образования реагирующих веществ равны:  = -148,5 кДж/моль;
= -148,5 кДж/моль;  = -803,3 кДж/моль;
= -803,3 кДж/моль;
 = -297,4 кДж/моль. (Ответ: -418,3 кДж).
= -297,4 кДж/моль. (Ответ: -418,3 кДж).
№ 22.16. Состав комплексной соли кобальта выражается эмпирической формулой CoCl3 ∙ 4NH3. При взаимодействии с нитратом серебра осаждается лишь одна треть содержащегося в соли хлора. Учитывая, что координационное число кобальта в этом соединении 6, определить, какие лиганды входят в состав комплексного иона и написать координационную формулу соли.
№ 22.17. Вычислить тепловой эффект реакции, протекающей при выплавке чугуна, по стандартным энтальпиям образования веществ
3Fe2O3 CO = 2Fe3O4 CO2.
( 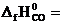 -110,5 кДж/моль;
-110,5 кДж/моль;  -393,5 кДж/моль;
-393,5 кДж/моль;  -822,2 кДж/моль;
-822,2 кДж/моль;  -1117,1 кДж/моль). (Ответ: -50,6 кДж).
-1117,1 кДж/моль). (Ответ: -50,6 кДж).
№ 22.18. Закончить в молекулярном и ионном виде уравнения качественных реакций на ион Fe3 :
а) Fe2(SO4)3 KOH =; б) FeCl3 K4[Fe(CN)6] =; в) Fe(NO3)3 KSCN =
№ 22.19. Закончить уравнения реакций:
а) FeSO4 Br2 H2SO4 =; б) FeCl3 H2S =;
в) FeCl3 Na2CO3 H2O =; г) Fe HNO3(разб) =
№ 22.20. Как влияет на коррозию железа его контакт с другими металлами? Какой металл будет разрушаться первым при повреждении поверхности а) луженого, б) оцинкованного; в) никелированного железа? Составить схемы образующихся гальванических элементов. Написать уравнения реакций катодных и анодных процессов.
Лабораторная работа 23
Галогены
Цель работы: изучить химические свойства галогенов и их соединений.
Задание: получить хлор и хлорную воду, определить ее состав и проверить окислительные свойства; проделать качественную реакцию на иод; получить водородные соединения хлора, брома, иода. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Галогены − фтор, хлор, бром, йод, астат − расположены в главной подгруппе VП группы. Атомы галогенов на внешнем уровне имеют по семь электронов (ns2пp5). Характерная степень окисления галогенов -1. Однако все они, кроме фтора, могут проявлять и положительные степени окисления 1, 3, 5, 7.
В природе галогены встречаются главным образом в виде отрицательно заряженных ионов, и их получение в свободном состоянии сводится к окислению этих ионов. В качестве окислителей используют МпО2, РЬО2, KMnO4, K2Cr2O7, KClO3.
Двухатомные молекулы галогенов неполярны, поэтому они хорошо растворимы в неполярных или слабополярных жидкостях: сероуглероде, бензине, бензоле, хлороформе. Растворимость галогенов в воде сравнительно мала. Фтор в воде не может быть растворен, так как он ее окисляет. В одном объеме воды при 20 °С растворяется 2,5 объема хлора. Этот раствор называется хлорной водой. Растворенный в воде хлор взаимодействует с ней с образованием хлорноватистой НClO и соляной кислот. Хлорноватистая кислота неустойчива и разлагается с образованием атомарного кислорода, вследствие чего хлорная вода обесцвечивает красители.
Йод лучше растворяется в растворе иодида калия. В качестве индикатора для определения йода применяют раствор крахмала. С крахмалом йод образует адсорбционные окрашенные соединения синего цвета, окраска которых исчезает при нагревании.
Свободные галогены являются энергичными окислителями, вступая в реакции с большинством элементов, Окислительная активность галогенов уменьшается от фтора к йоду.
Отрицательные ионы галогенов являются восстановителями (за исключением F‾), причем их восстановительная способность увеличивается от С1‾ к I‾.
Соединения галогенов с водородом – галогеноводороды – бесцветные газы с резким запахом, хорошо растворимы в воде. Их растворы являются кислотами. В ряду HF − НCl − НBr − HI кислотные свойства усиливаются.
В этом же ряду возрастает восстановительная активность.
HCl и HF получают обменной реакцией их солей с концентрированной H2SQ4. НBr и HI подобным образом получить практически невозможно, так как в реакции с серной кислотой они проявляют сильные восстановительные свойства и окисляются до свободных галогенов. НВг и HI получают гидролизом соединений фосфора PBr3 и PI3.
Кислородные соединения галогенов могут быть получены только косвенным путем. Они представляют собой сравнительно малоустойчивые вещества и являются сильными окислителями.
Выполнение работы
Опыт 1. Получение хлора и хлорной воды
(Проводить под тягой!). В сухую пробирку поместить 2 шпателя оксида марганца (IV) MnO2, укрепить ее вертикально в зажиме штатива и прилить 2-3 мл концентрированной HCl. Закрыть пробирку пробкой с газоотводной трубкой, конец которой опустить в пробирку, заполненную наполовину водой. Если реакция протекает недостаточно энергично, содержимое пробирки слегка подогреть. Отметить цвет образующегося газа. Хлор пропускать в воду до полного прекращения реакции. Пробирку с хлорной водой закрыть пробкой и сохранить для следующих опытов.
Требование к результатам опыта:
Составить уравнения реакций получения хлора и хлорной воды.
Опыт 2. Определение состава хлорной воды
В три пробирки налить по несколько капель хлорной воды. В одну пробирку добавить 1-2 капли раствора синего лакмуса и наблюдать переход синей окраски в красную, а затем постепенное исчезновение окраски. В другую пробирку добавить несколько капель АgNO3 до выпадения осадка, в третью – концентрированного раствора щелочи до исчезновения запаха хлорной воды.
Требования к результатам опыта:
1. Объяснить переход синей окраски лакмуса в красную, а затем исчезновение окраски.
2. Написать уравнения реакций AgNO3 с HCl и хлорной воды со щелочью.
3. Сделать вывод о составе хлорной воды.
Опыт 3. Окислительные свойства хлорной воды
Налить в одну пробирку 1-2 мл раствора KBr , в другую – столько же KI и в каждую прибавить по 1-2 мл хлорной воды, В какой цвет окрашиваются растворы? Прилить в обе пробирки по 0,5-1 мл органического растворителя (CCl4, бензина), обратить внимание на его цвет. Содержимое пробирок сильно взболтать. Отметить изменение окраски органического растворителя.
Требования к результатам опыта:
1. Составить уравнения реакций КВг и KI с хлорной водой.
2. Сделать вывод, в чем лучше растворяются бром и йод – в воде или органическом растворителе.
Опыт 4. Растворимость йода и качественная реакция на йод
Поместить в пробирку 1 шпатель кристаллического йода, прилить 2-3 мл воды и энергично взболтать. Отметить окраску раствора. Слить полученную йодную воду в другую пробирку и добавить к ней несколько капель раствора крахмала. Нагреть пробирку, а затем охладить под краном струей холодной воды. Объяснить явления, которые при этом происходят. К оставшимся в первой пробирке кристаллам йода добавить 2-3 мл раствора KI. Что наблюдается?
Требования к результатам опыта:
1. Сделать вывод о растворимости йода в воде и растворе иодида калия.
2. Составить уравнение реакции взаимодействия йода с KI.
Опыт 5. Получение и свойства хлороводорода
(Проводить под тягой!). Поместить в пробирку один шпатель NaClи прилить 1-2 мл концентрированной серной кислоты. Проверить действие выделяющегося газа на влажную индикаторную бумагу.
Требование к результату опыта:
Написать уравнение реакции получения HCl.
Опыт 6. Взаимодействие бромидов и иодидов с концентрированной H2SO4
(Проводить под тягой!). В две сухие пробирки отдельно поместить по 2 шпателя KBr и KI и осторожно добавить в каждую из них по 1-2 мл концентрированной H2SO4. Что наблюдается? Для прекращения реакций в пробирки добавить раствор щелочи.
Требование к результатам опыта:
Составить уравнения реакций бромида и иодида калия с концентрированной H2SO4.
Задачи
№ 23.1. Написать уравнения реакций взаимодействия галогенов с водой и назвать образующиеся соединения галогенов.
№ 23.2. Закончить уравнения реакций: а) I2 Cl2 H2O =;
б) NaClO Ni(OH)2 H2SO4 =; в) NaCrO2 Br2 NaOH =
№ 23.3. Написать уравнения реакций взаимодействия галогенов с растворами щелочей (горячими и холодными) и назвать образующиеся соединения галогенов.
№ 23.4. Рассчитать, какое количество бертолетовой соли KClO3 можно получить из 168 г гидроксида калия. (Ответ: 61,2 г).
№ 23.5. Привести уравнения реакций получения галогеноводородов.
№ 23.6. Сколько литров хлороводорода HCl содержится в 1 л 10 %-ного раствора соляной кислоты (плотность 1,05 г/мл)? Определить молярную концентрацию эквивалентов. (Ответ: 64,4 л; 2,9 моль/л).
№ 23.7. Сколько металлического цинка прореагировало с соляной кислотой, если при этом выделилось 112 мл газообразного водорода (н.у.)?
(Ответ: 0,327 г).
№ 23.8. Сколько металлического алюминия прореагировало с соляной кислотой, если при этом выделилось 336 мл газообразного водорода (н.у.)?
(Ответ: 0,27 г).
№ 23.9. Закончить уравнения реакций:
а) KClO3 FeSO4 H2SO4 =; б) SO2 Br2 H2O =; в) HI H2SO4 =
№ 23.10. В 1 л раствора содержится 8 г HClO4. Определить молярную концентрацию эквивалентов хлорной кислоты, если реакция протекает по уравнению: HClO4 SO2 H2O = HCl H2SO4. (Ответ: 0,64 моль/л).
№ 23.11. Закончить уравнения реакций:
а) KBrO3 KBr H2SO4 =; б) KMnO4 HI =; в) KClO3 KI H2SO4 =
№ 23.12. Вычислить молярную массу эквивалентов и эквивалент окислителя в реакции KIO3 KI H2SO4 = I2 …
№ 23.13. Закончить уравнения реакций: а) Cl2O7 NaOH =;
б) Cl2O Mg(OH)2 =; в) MnO2 HCl =; г) HClO NaOH =
№ 23.14. В результате взаимодействия перманганата калия KMnO4 массой 31,6 г с соляной кислотой был получен хлор (н.у.). Рассчитать, сколько диоксида марганца MnO2 потребуется для получения такого же количества хлора по реакции взаимодействия MnO2 с соляной кислотой. (Ответ: 43,5 г).
№ 23.15. В какой массе воды надо растворить 67,2 л HCl (н.у.), чтобы получить 9 %-ный раствор HCl. (Ответ: 1107 г).
№ 23.16. Закончить уравнения реакций: а ) I2O5 NaOH =;
б) NaCrO2 Br2 NaOH =; в) I2 HNO3 (конц.) =; г) Al Br2 =
№ 23.17. Закончить уравнения реакций получения в свободном виде хлора, брома и иода: а) HCl MnO2 =; б) KMnO4 HCl =;
в) NaBr Cl2 =; г) KI Cl2 =
№ 23.18. Закончить уравнения реакций, в которых ионы Cl‾, Br‾, I‾ являются восстановителями: а) HCl KClO3 =; б) HI H2SO4 (конц.) =;
в) HBr K2Cr2O7 =; г) KI KNO2 HCl = NO …
№ 23.19. Закончить уравнения реакций, в которых галогены (в соединениях) проявляют окислительные свойства:
а) KI NaClO H2SO4 =; б) Na2S NaBrO H2SO4 =;
в) MnSO4 KClO3 KOH =; г) HClO3 H2SeO3 =
№ 23.20. Составить уравнения реакций, которые нужно провести для осуществления следующих превращений: NaCl → HCl → Cl2 → KClO3
Лабораторная работа 24
Кислород. пероксид водорода
Цель работы: изучить химические свойства кислорода и пероксида водорода.
Задание: получить кислород; убедиться на опытах, что пероксид водорода обладает двойственными окислительно-восстановительными свойствами. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Кислород расположен в главной подгруппе VI группы и относится к р-элементам. На внешнем уровне атома кислорода содержится 6 электронов (2s22p4). В соединениях со всеми элементами (кроме фтора) кислород проявляет степень окисления -2, а в пероксиде водорода Н2O2 и его производных -1.
В лаборатории кислород получают чаще всего термическим разложением некоторых кислородсодержащих веществ, например KClO3, КМnО4, KNO3 и др.
Кислород химически активен; при нагревании он непосредственно взаимодействует с большинством простых веществ, образуя оксиды. Общая схема окислительного действия кислорода: O2 4ē = 2О2‾. Кроме того, молекула O2 , присоединяя или теряя электроны, образует соединения пероксидного типа, из которых наибольшее практическое значение имеют производные пероксид-иона O22− − пероксид водорода Н2O2 и пероксиды Na2O2, BаO2.
Пероксиды проявляет как восстановительные, так и окислительные свойства, причем последние выражены сильнее. Для Н2O2 характерен распад по типу диспропорционирования
2Н2О2−1 = 2H2O−2 O20.
Процесс распада ускоряется при освещении, нагревании, а также в присутствии катализаторов (МпO2, Fe2O3 и др.).
Пероксид водорода в водных растворах ведет себя как очень слабая
кислота.
Выполнение работы
Опыт 1. Получение кислорода
Насыпать в сухую пробирку 2 шпателя перманганата калия КМnО4, укрепить ее вертикально в зажиме штатива и нагреть. Выделяющийся газ испытать тлеющей лучинкой.
Требование к результатам опыта:
Составить уравнение реакции разложения перманганата калия, указать окислитель и восстановитель и сделать вывод, к какому типу ОВР относится данная реакция.
Опыт 2. Разложение пероксида водорода
В две пробирки налить по 1-2 мл пероксида водорода. Одну пробирку слегка нагреть, а во вторую добавить немного оксида марганца (IV) MnO2. Внести в пробирку тлеющую лучинку. Отметить свои наблюдения.
Требования к результатам опыта:
1. Написать уравнение реакции разложения H2O2.
2. Сделать вывод о роли оксида марганца (IV) в реакции разложения Н2О2.
Опыт 3. Окислительные свойства пероксида водорода
· Налить в пробирку 1-2 мл иодида калия KI, столько же разбавленной серной кислоты и добавить раствор Н2O2. Какое вещество выделилось?
· В пробирку налить 1-2 мл раствора соли хрома (Ш), добавить концентрированной щелочи до растворения первоначально образующегося осадка и прилить 2-3 мл Н2O2. Наблюдать изменение окраски раствора.
· К 1-2 мл раствора MnSO4 добавить столько же разбавленной щелочи и 2-3 мл раствора пероксида водорода. Что наблюдается?
Требование к результатам опыта:
Закончить уравнения реакций: KI H2O2 H2SO4 =
Cr2(SO4)3 H2O2 NaOH =
MnSO4 H2O2 NaOH =
В каждой реакции указать окислитель и восстановитель.
Опыт 4. Восстановительные свойства пероксида водорода
· Налить в пробирку 1-2 мл раствора перманганата калия KMnO4, подкислить разбавленной серной кислотой и добавить 2-3 мл раствора Н2О2. В пробирку внести тлеющую лучинку. Что происходит?
· К 5-10 каплям раствора нитрата серебра AgNO3 добавить 1-2 мл разбавленной щелочи и 2-3 мл раствора пероксида водорода. Наблюдать образование черного осадка металлического серебра и выделение кислорода.
Требования к результатам опыта:
1. Закончить уравнения реакций: KMnO4 H2O2 H2SO4 =
AgNO3 H2O2 NaOH =
В каждой реакции указать окислитель и восстановитель.
2. Сделать вывод об окислительно-восстановительных свойствах Н2О2.
Задачи
№ 24.1. Составить уравнения реакций получения кислорода в лабораторных условиях. Как получают кислород в промышленности?
№ 24.2. Какой объем кислорода (н.у.) можно получить при разложении 200 мл 15,5 %-ного раствора пероксида водорода Н2О2, плотность раствора 1,1 г/мл? (Ответ: 11,2 л).
№ 24.3. Закончить уравнения реакций: а) P O2 =;
б) Al O2 =; в) H2S O2 =; г) Na2O CO2 =
№ 24.4. Закончить уравнения реакций: а) Na2O SO3 =;
б) Na2O Al2O3 =; в) Al2O3 SO3 =; г) Na2O H2O =; д) Cl2O7 H2O =
№ 24.5. Какие свойства в окислительно-восстановительных реакциях проявляет пероксид водорода? Закончить уравнения реакций:
а) KI H2O2 H2SO4 =; б) Hg(NO3)2 H2O2 NaOH =
№ 24.6. Определить массовую долю (%) пероксида водорода Н2О2 в растворе, если при разложении 500 г его выделилось 5,6 л кислорода (н.у.).
(Ответ: 3,4 %).
№ 24.7. Закончить уравнения реакций: а) Cr2(SO4)3 H2O2 KOH =;
б) Ag2O H2O2 =; в) MnO2 H2SO4 (конц.) =
№ 24.8. При термическом разложении перманганата калия образовался объем кислорода, равный объему О2, который получился в результате разложения водой 18,32 г Na2O2. Рассчитать массу разложившегося KMnO4.
(Ответ: 37,1 г).
№ 24.9. Закончить уравнения реакций: а) AgNO3 H2O2 KOH =;
б) Cl2 H2O2 =; в) Co(OH)2 H2O O2 =
№ 24.10. Вычислить объем моля эквивалентов кислорода при нормальных условиях.
№ 24.11. Закончить уравнения реакций: а) HgCl2 H2O2 K2CO3 =;
б) AuCl3 H2O2 NaOH=; в) KClO3
№ 24.12. Сколько миллилитров 3 %-ного раствора пероксида водорода (плотность раствора 1,1 г/мл) и воды надо взять, чтобы получить 750 мл 0,1 М раствора? (Ответ: 77,27 мл Н2О2; 672,73 мл Н2О).
№ 24.13. Закончить уравнения реакций: а) HgCl2 H2O2 =;
б) Fe(OH)2 O2 H2O =; в) KMnO4
№ 24.14. Какой объем 3 %-ного раствора Н2О2 (ρ = 1,1 г/мл) и кристаллического KMnO4 прореагировало в кислой среде, если в результате реакции выделилось 1,12 л кислорода (н.у.)? (Ответ: 51,52 мл Н2О2; 3,16 г KMnO4).
№ 24.15. Закончить уравнения реакций получения пероксида водорода:
а) BaO2 H2SO4 =; б) Na2O2 H2O =; в) BaO2 CO2 H2O =
№ 24.16. Написать уравнения реакций получения кислорода разложением
а) KMnO4; б) K2Cr2O7; в) HgO.
№ 24.17. Из подкисленного раствора KI раствором Н2О2 массой 0,8 г выделили 0,3 г йода. Вычислить процентное содержание Н2О2 в растворе.
(Ответ: 5 %).
№ 24.18. Для полного обесцвечивания 20 мл 0,02 М раствора KMnO4 в сернокислой среде потребовался равный объем раствора Н2О2. Какова молярная концентрация Н2О2? Какой объем кислорода (н.у.) выделился при этом?
(Ответ: 0,05 М; 22,4 мл).
№ 24.19. Закончить уравнения реакций: а) K2Cr2O7 H2O2 H2SO4=;
б) MnSO4 H2O2 KOH =; в) HIO3 H2O2 =
№ 24.20. Сколько граммов 3,4 %-ного раствора Н2О2 требуется для окисления 100 мл 1 М раствора FeSO4 в присутствии H2SO4? (Ответ: 50 г).
Лабораторная работа 25
Сера
Цель работы: изучить химические свойства серы и ее соединений.
Задание: исследовать поведение серы при различных температурах; получить сероводород и убедиться на опытах, что он проявляет восстановительные свойства; что сульфиды могутбыть только восстановителями, а сульфиты – и восстановителями и окислителями; что концентрированная серная кислота является сильнейшим окислителем. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Сера находится в главной подгруппе VI группы. Атом серы на внешнем уровне имеет 6 электронов (3s23p4). В своих соединениях сера проявляет степени окисления −2, 4, 6 и редко 2.
Сера существует в нескольких аллотропных модификациях. При обычной температуре устойчива ромбическаясера. При 96 оС ромбическая сера переходит в моноклинную. Кристаллы ромбической и моноклинной серы состоят из кольцевых молекул S8 и отличаются друг от друга взаимной ориентацией колец. Моноклинная сера плавится при 119 °С, превращаясь в янтарно-желтую легкоподвижную жидкость. Около 160 °С кольца молекул S8 разрываются, образуя бесконечные опирали S∞, жидкость темнеет и при 200 °С становится темно-коричневой и вязкой, как смола. Дальнейшее нагревание приводит к разрыву и укорачиванию спиральных молекул серы и вязкость жидкой серы уменьшается. При 445 оС сера закипает, образуя оранжево-желтые пары, состоящие из молекул S8 , S6 , S4 , S2. При выливании кипящей серы в холодную воду образуется пластическая сера, которая постепенно переходит в ромбическую.
Сера – достаточно активный неметалл. При нагревании она окисляет многие простые вещества, но и сама довольно легко окисляется кислородом и галогенами. С водой и разбавленными кислотами сера не реагирует. При нагревании взаимодействует с растворами щелочей:
3S 6KOH = K2SO3 2K2S 3H2O
Водородное соединение серы – сероводород Н2S , ядовитый газ с неприятным запахом. Растворяясь в воде, образует слабую сероводородную кислоту. Соли ее называют сульфидами. Сероводород и сульфиды обладают восстановительными свойствами.
В лаборатории сероводород получают действием кислот на сульфид железа. Сероводород горит на воздухе голубоватым пламенем, образуя SО2 и Н2О. При недостатке кислорода он переходит в свободную серу.
Из соединений серы со степенью окисления 4 наибольшее значение имеет диоксид серы (IV). SO2 (сернистый газ) – бесцветный газ с характерным запахом, ядовит, химически активен. SO2 хорошо растворим в воде, при этом частично происходит реакция с водой и образуется сернистая кислота. Н2SO3 неустойчива, в свободном состоянии не выделена, относится к кислотам средней силы. Сернистая кислота и ее соли (сульфиты) обладают окислительными и восстановительными свойствами, причем последние выражены сильнее.
Из соединений серы со степенью окисления 6 наибольшее значение имеет серная кислота – H2SO4. Это сильная кислота, с водой смешивается в любых соотношениях с выделением большого количества теплоты за счет образования гидратов. Легко поглощает пары воды из воздуха, отщепляет воду от многих органических веществ (клетчатка, сахар и др.), обугливая их.
Концентрированная H2SO4 – сильный окислитель. Неметаллы окисляются ею до своих оксидов, а сама серная кислота восстанавливается в SО2. Взаимодействие H2SО4 с металлами протекает различно в зависимости от ее концентрации и активности металла.
Выполнение работы
Опыт 1. Поведение серы при различных температурах
Сухую пробирку на 1/3 ее объема наполнить серой и медленно нагревать на пламени спиртовки, все время встряхивая. Следить за изменением вязкости и цвета расплавленной серы. Кипящую серу тонкой струей вылить в стакан с холодной водой. Слить воду из стакана и убедиться в пластичности серы. Кусочек пластической серы оставить до конца занятия. Сохраняет ли она свои свойства?
Требование к результатам опыта:
Дать объяснение всем наблюдаемым при опыте изменениям.
Опыт 2. Получение и свойства сероводорода
(Проводить под тягой!). Поместить в пробирку 1 шпатель сульфида железа FeS, укрепить ее вертикально в зажиме штатива и прилить 1-2 мл разбавленной соляной кислоты. Быстро закрыть пробирку пробкой с газоотводной трубкой и слегка подогреть. Когда начнется энергичное выделение газа, поднести к отверстию трубки поочередно полоски влажной индикаторной бумаги и фильтровальной бумаги, смоченной раствором соли свинца. Что наблюдается?
Выделяющийся из пробирки газ зажечь у отверстия трубки. Подержать над пламенем влажную индикаторную бумагу. Что наблюдается?
Внести в пламя горящего сероводорода фарфоровую чашку и наблюдать появление на ней желтого пятна.
Требования к результатам опыта:
1. Составить уравнение реакции получения сероводорода.
2. Сделать вывод о кислотно-основных свойствах сероводорода.
3. Закончить уравнения реакций: H2S Pb(NO3)2 =
H2S O2 (избыток) =
H2S O2 (недостаток) =
Опыт 3. Взаимодействие серы со щелочами
В пробирку поместить 1 шпатель порошка серы и прилить 3-4 мл концентрированного раствора щелочи. Содержимое пробирки прокипятить до пожелтения раствори. Раствор сохранить для следующих опытов.
Требование к результатам опыта:
Закончить уравнение реакции S NaОН =, указать окислитель и восстановитель и сделать вывод, к какому типу ОВР относится данная реакция.
Опыт 4. Восстановительные свойства сульфидов и сульфитов
Налить в пробирку 1-2 мл раствора перманганата калия KMnO4, подкислить его разбавленной серной кислотой и прибавить немного раствора, полученного в опыте 3. Что наблюдается?
Требования к результатам опыта:
1. Закончить уравнения реакций: KMnO4 Na2S H2SO4 =
KMnO4 Na2SO3 H2SO4 =
В каждой реакции указать окислитель и восстановитель.
2. Сделать вывод, какими свойствами, окислительными или восстановительными, обладают сульфиды.
Опыт 5. Окислительные свойства сульфитов
К 1-2 мл раствора, полученного в опыте 3, прилить несколько капель разбавленной соляной кислоты. Что происходит?
Требования к результатам опыта:
1. Закончить уравнение реакции: Na2SО3 HCl =
2. Сделать вывод об окислительно-восстановительных свойствах сульфитов.
Опыт 6. Окислительные свойства серной кислоты
В две сухие пробирки поместить по маленькому кусочку серы и угля, налить в них по 1-2 мл концентрированной серной кислоты. Пробирки осторожно нагреть и наблюдать постепенное окисление неметаллов.
Требование к результатам опыта:
Написать уравнения реакций окисления серы и угля (С) концентрированной серной кислотой.
Опыт 7. Водоотнимающее свойство серной кислоты
· В пробирку налить 1-2 мл концентрированной серной кислоты и опустить в нее лучинку.
· В пробирку насыпать 2 шпателя CuSO4∙5Н20 и добавить 1-2 мл концентрированной серной кислоты.
Требование к результатам опыта:
Объяснить наблюдаемые явления.
Задачи
№ 25.1. Закончить уравнения реакций: а) KMnO4 H2S H2SO4 =;
б) H2S H2O2 =; в) H2S NaOH =; г) Na2S H2O ↔
№ 25.2. Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? Составить уравнения реакций взаимодействия H2SO3: а) с сероводородом; б) с кислородом.
№ 25.3. Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Написать уравнения реакций взаимодействия разбавленной серной кислоты с магнием и алюминием и концентрированной – с медью и серебром.
№ 25.4. Сколько литров диоксида серы SO2 при нормальных условиях можно получить при сжигании серы массой 500 г? (Ответ: 350 л).
№ 25.5. Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при взаимодействии: а) с магнием; б) с иодом;
в) с сероводородом? Составить уравнения соответствующих реакций.
№ 25.6. Можно ли окислить сероводород кислородом при 298 К? Ответ мотивировать, вычислив ΔG0 реакции: 2H2S (г) O2 (г) = 2S (к) 2H2O (ж).
(  -33,8 кДж/моль;
-33,8 кДж/моль; 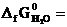 -237,3 кДж/моль). (Ответ: -407 кДж).
-237,3 кДж/моль). (Ответ: -407 кДж).
№ 25.7. Раствор, содержащий 5,12 г серы в 100 г сероуглерода CS2, кипит при 46,67 оС. Температура кипения чистого сероуглерода 46,20 оС. Эбулиоскопическая константа сероуглерода 2,37. Вычислить молекулярную массу серы и установить, из скольких атомов состоит молекула серы. (Ответ: 258; S8).
№ 25.8. Через 100 мл 0,2 н раствора NaOH пропустили 448 мл SO2 (н.у.). Какая соль образовалась? Найти ее массу. (Ответ: NaHSO3; 2,08 г).
№ 25.9. Закончить уравнения реакций: а) H2S SO2 =; б) H2SO3 I2 =;
в) KMnO4 SO2 H2O =; г) HIO3 H2SO3 =
№ 25.10. Привести примеры уравнений реакций (не менее двух на каждый случай) получения SO2, которые: а) сопровождаются изменением степени окисления серы; б) не сопровождаются изменением степени окисления серы.
№ 25.11. Закончить уравнения реакций: а) S KOH =; б) HNO2 H2S =;
в) Na2S NaNO3 H2SO4 =; г) H2S KMnO4 H2O =
№ 25.12. Написать уравнение реакции получения сернистого газа (SO2) из железного колчедана (FeS2). Рассчитать объем SO2 (н.у.), который получится при окислении 1,5 кг железного колчедана. (Ответ: 560 л).
№ 25.13. Закончить уравнения реакций гидролиза в молекулярном и ионном виде: а) Na2S H2O ↔; б) (NH4)2S H2O =;
в) Al2S3 H2O =; г) Cr2(SO4)3 Na2S H2O =
№ 25.14. Закончить уравнения реакций взаимодействия серной кислоты с металлами: а) Cu H2SO4 (конц.) =; б) Mg H2SO4 (конц.) =;
в) Hg H2SO4 (конц.) =; г) Ni H2SO4 (разб.) =
№ 25.15. В 10 л воды растворили 2,24 л газообразного триоксида серы SO3 (н.у.). Рассчитать молярную и молярную концентрацию эквивалентов полученного при этом раствора серной кислоты. (Ответ: 0,008 моль/л; 0,016 моль/л).
№ 25.16. Сколько миллилитров концентрированной серной кислоты
(ρ = 1,84 г/мл), содержащей 98 % H2SO4, теоретически необходимо для перевода в раствор 10 г меди? Какой объем SO2 (н.у.) выделится при этом?
(Ответ: 17 мл; 3,52 л).
№ 25.17. Определить молярную концентрацию эквивалентов раствора Na2SO3, если при окислении 20 мл его в кислой среде требуется 16 мл 0,05 н раствора KMnO4. (Ответ: 0,04 н).
№ 25.18. Сколько литров Н2S (н.у.) потребуется для восстановления в сернокислом растворе 100 мл 5,7 %-ного раствора K2Cr2O7 (ρ = 1,04 г/мл)?
(Ответ: 1,35 л).
№ 25.19. Какими тремя способами можно получить сероводород, имея в своем распоряжении цинк, серу, водород и серную кислоту? Составить уравнения соответствующих реакций.
№ 25.20. Закончить уравнения реакций окисления концентрированной серной кислотой следующих веществ:
а) Zn H2SO4 =; б) KI H2SO4 =; в) C H2SO4 =
Лабораторная работа 26
Азот
Цель работы: изучить химические свойства азота и его водородных и кислородных соединений.
Задание:получить азот, аммиак, исследоать его кислотно-основные и окислительно-восстановительные свойства; получить оксиды азота (II) и (IV); убедиться на опытах, что нитриты проявляют окислительно-восстановительную двойственность. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Азот (1s22s22р3) находится в главной подгруппе V группы, типичный неметалл. В соединениях азот проявляет степени окисления от -3 до 5.
При обычных условиях азот – газ, без цвета и запаха, мало растворим в воде. В лаборатории его получают при нагревании смеси концентрированных растворов хлоридов аммония и нитрита натрия. При комнатной температуре азот химически малоактивен.
При нагревании азот реагирует со многими металлами и неметаллами, образуя нитриды, из которых наибольшее значение имеет аммиак NH3. Это бесцветный газ с характерным запахом, легче воздуха, хорошо растворяется в воде и химически с ней взаимодействует. Раствор аммиака в воде называют гидроксидом аммония и относят к слабым основаниям. В лаборатории аммиак получают нагреванием солей аммония с гидроксидом или оксидом кальция.
Для аммиака характерны реакции присоединения по донорно-акцепторному механизму. При взаимодействии с кислотами NН3 образует соли аммония, содержащие ион NH4 . Все соли аммония термически малоустойчивы, характер разложения зависит от кислоты, образующей соль. Если кислота является окислителем, то при нагревании происходит реакция внутримолекулярного окисления-восстановления
(NН4)2Сг2O7 = N2 Cr2O3 4H2O
Если кислота не является окислителем, то при нагревании солей аммония выделяется аммиак. Выделяющийся аммиак при охлаждении может снова реагировать с кислотой, если она сильная и летучая:
NH4Cl = NH3 HCl.
При действии сильных окислителей аммиак проявляет восстановительные свойства.
Азот образует с кислородом оксиды: N2O, NО, N2O3, NO2, N2O5. Наибольшее практическое значение имеют оксиды NO и NO2. Оксид азота (П) – бесцветный газ, мало растворим в воде и химически с ней не взаимодействует. Это несолеобразующий оксид. В лаборатории его получают при действии разбавленной азотной кислоты на медь. NО легко соединяется с кислородом, образуя NO2.
Оксид азота (IV) в лаборатории получают при действии концентрированной азотной кислоты на медь или нагреванием РЬ(NO3)2. NO2 – газ бурого цвета, при растворении в воде дает две кислоты:
2NO2 Н2O = HNO2 HNO3.
Азотистая кислота НNO2 в свободном состоянии не получена, известна в водных растворах, относится к слабым кислотам. Соли HNO2 – нитриты – получены и вполне устойчивые. В реакциях проявляют свойства окислителей и восстановителей.
Азотная кислота HNO3 относится к сильным кислотам и сильным окислителям. Она при восстановлении может давать различные продукты в зависимости от активности восстановителя, концентрации кислоты и температуры.
Выполнение работы
Опыт 1. Получение азота
В пробирку налить поровну насыщенные растворы нитрита натрия NaNO2 и хлорида аммония NH4Cl (общий объем не более 1/3 пробирки) и слегка подогреть до начала реакции. Ввести в выделившийся газ горящую лучинку. Что наблюдается?
Требование к результатам опыта:
Составить уравнение реакции получения азота.
Опыт 2. Получение аммиака
Поместить в сухую пробирку 2 шпателя смеси, состоящей из равных частей хлорида аммония и оксида кальция CaO. Нагреть. Осторожно понюхать выделяющийся газ. Подержать над отверстием пробирки смоченную водой красную лакмусовую бумажку. Что наблюдается? Смочить стеклянную палочку концентрированной соляной кислотой и поднести к отверстию пробирки. Что происходит?
Требование к результатам опыта:
1. Составить уравнения реакций получения аммиака и взаимодействия его с HCl.
2. Сделать вывод о кислотно-основных свойствах гидроксида аммония.
Опыт 3. Разложение солей аммония
· В небольшую фарфоровую чашку положить 2-3 шпателя дихромата аммония (NH4)2Cr2O7 в виде горки и горящей спичкой нагреть ее сверху. Что наблюдается?
· Поместить в сухую пробирку несколько кристаллов NH4Сl. Нагреть. Через некоторое время на холодных частях пробирки образуется белый налет, на дне ничего не остается.
Требование к результатам опыта:
Составить уравнения реакций разложения дихромата аммония и хлорида аммония.
Опыт 4. Восстановительные свойства аммиака
Налить в пробирку 0,5-1 мл раствора перманганата калия KMnO4 и добавить столько же концентрированного раствора аммиака NH4OH. Смесь слегка подогреть. Что происходит с окраской раствора?
Требования к результатам опыта:
1. Написать уравнение реакции, учитывая, что аммиак окисляется до свободного азота, а перманганат восстанавливается до MnO2.
2. Сделать вывод, какие свойства, окислительные или восстановительные, проявляет аммиак.
Опыт 5. Получение оксида азота (П)
(Проводить под тягой!). В пробирку внести шпатель медных стружек, прилить 2-3 мл разбавленной азотной кислоты. Выделяется бесцветный газ NO, буреющий на воздухе.
Требование к результатам опыта:
Составить уравнение реакции получения оксида азота (П).
Опыт 6. Получение и свойства оксида азота (IV)
(Проводить под тягой!). В пробирку внести шпатель медных стружек, налить 2-3 мл концентрированной азотной кислоты. Образующийся в этой реакции NO2 через газоотводную трубку пропускать в пробирку с водой, в которую добавить 2-3 капли метилоранжа. Что наблюдается? Почему? Затем образующийся NO2 пропускать в пробирку с раствором NаОН. К полученному раствору добавить по каплям подкисленный раствор перманганата калия. Что наблюдается?
Требование к результатам опыта:
Закончить уравнения реакций: Cu HNO3 (конц.) =;
NO2 H2O =;
NO2 NaOH =;
KMnO4 NaNO2 H2SO4 =
В каждой реакции указать окислитель и восстановитель.
Опыт 7. Окислительные и восстановительные свойства нитритов
· К 1-2 мл раствора нитрита калия KNO2 прилить 0,5-1 мл раствора йодида калия KI и столько же разбавленной серной кислоты.
· Налить в пробирку 1-2 мл раствора дихромата калия K2Cr2O7, добавить 2-3 мл раствора нитрита калия и разбавленной серной кислоты.
Требования к результатам опыта:
1. Закончить уравнения реакций: KNO2 KI H2SO4 =
K2Cr2O7 KNO2 H2SO4 =
В каждой реакции указать окислитель и восстановитель.
2. Сделать вывод об окислительно-восстановительных свойствах нитритов.
Задачи
№ 26.1. Привести не менее трех примеров реакций, в которых азот играет роль окислителя, и пример реакции, в которой он является восстановителем.
№ 26.2. Привести примеры характерных для аммиака реакций присоединения и окисления без катализатора и в присутствии катализатора.
№ 26.3. Нитрат аммония может разлагаться двумя путями:
NH4NO3 (к) = N2O (г) 2H2O (г)
NH4NO3 (к) = N2 (г) 1/2O2 (г) 2H2O (г)
Какая из приведенных реакций наиболее вероятна при 298 К? Ответ подтвердить расчетом  . (
. ( 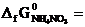 -183,9 кДж/моль;
-183,9 кДж/моль; 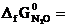 104,1 кДж/моль;
104,1 кДж/моль; 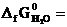 -228,6 кДж/моль).
-228,6 кДж/моль).
№ 26.4. Какова реакция среды в растворах KNO3, NH4NO3, NaNO2, NH4NO2? Составить молекулярные и ионные уравнения реакций гидролиза этих солей.
№ 26.5. Закончить уравнения реакций:
а) Zn NaNO3 NaOH  ; б) NO KMnO4 H2O =;
; б) NO KMnO4 H2O =;
в) Cu HNO3 (разб.); г) AgNO3
№ 26.6. Написать уравнения взаимодействия разбавленной азотной кислоты с ртутью, магнием, фосфором, углем (С).
№ 26.7. Сколько нитрита аммония NH4NO2 требуется для получения 1 л азота при нормальных условиях? (Ответ: 2,86 г).
№ 26.8. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Составить уравнения реакций HNO2:
а) с бромной водой (Br2); б) с HI.
№ 26.9. Почему диоксид азота (NO2) способен к реакциям диспропорционирования? Написать уравнения реакций взаимодействия NO2:
а) с водой; б) гидроксидом натрия.
№ 26.10. Закончить уравнения реакций: а) N2O5 KOH =;
б) N2O3 NaOH =; в) Cu HNO3 (разб) =; г) NO2 O2 Н2О=
№ 26.11. В каком газообразном соединении азот проявляет свою низшую степень окисления? Написать уравнения реакций получения этого соединения: а) при взаимодействии хлорида аммония с гидроксидом кальция; б) разложением нитрида магния водой.
№ 26.12. Почему азотистая кислота способна к реакциям диспропорционирования? Написать уравнение реакции разложения НNO2, учитывая, что при этом азот приобретает степень окисления 2 и 5.
№ 26.13. Составить уравнения реакций окисления азотной кислотой: а) серы до серной кислоты; б) фосфора до фосфорной кислоты Н3РО4; в) углерода до диоксида углерода.
№ 26.14. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
N2 → NO → NO2 → HNO3 → NH4NO3
№ 26.15. Закончить уравнения реакций получения аммиака:
а) H2 N2 =; б) NH4OH  ; в) AlN H2O =; г) NH4Cl Ca(OH)2 =
; в) AlN H2O =; г) NH4Cl Ca(OH)2 =
№ 26.16. Как получить NH4NO3, воспользовавшись в качестве исходных веществ атмосферным азотом и водой?
№ 26.17. Закончить уравнения реакций получения в промышленности азотной кислоты: а) NH3 O2 =; б) NO O2 =; в) NO2 H2O O2 =
№ 26.18. Закончить уравнения реакций разложения азотной кислоты и ее солей: а) HNO3 ; б) Hg(NO3)2
; б) Hg(NO3)2 ; в) Pb(NO3)2
; в) Pb(NO3)2 ; г) NaNO3
; г) NaNO3
№ 26.19. Закончить уравнения реакций: а) KNO2 KMnO4 H2O =
б) KI HNO2 H2SO4 = NO …; в) Na2S NaNO2 H2SO4 = S NO …;
№ 26.20. Привести примеры характерных для аммиака реакций присоединения и окисления.
Лабораторная работа 27
Углерод. кремний
Цель работы: изучить химические свойства соединений углерода и кремния.
Задание: получить оксид углерода (IV) и исследовать его кислотно-основные и окислительно-восстановительные свойства; получить кремниевую кислоту и сравнить ее силу с угольной кислотой. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Углерод и кремний находятся в главной подгруппе IV группы. Их атомы имеют на внешнем уровне 4 электрона (ns2np2), могут проявлять степени окисления от -4 до 4. Наиболее характерной степенью окисления является 4.
Углерод и кремний при обычных условиях весьма инертны, не растворяются в воде, разбавленных кислотах, вступают в реакцию только с очень энергичными окислителями. При нагревании химическая активность их повышается.
Углерод и кремний образуют оксиды СО, СО2, SiO2. Оксид углерода (П) СО – несолеобразующий оксид. При обычных условиях не взаимодействует ни с кислотами, ни со щелочами, является энергичным восстановителем.
Оксид углерода (IV) СO2 – кислотный оксид, реагирует со щелочами, водой. В водном растворе оксида углерода (IV) устанавливается следующее равновесие;
CO2 H2O ↔ H2CO3 ↔ H НСO3‾ ↔ 2H CO32‾
Н2СO3 – слабая непрочная кислота, существует только в разбавленных растворах. Будучи двухосновной кислотой, угольная кислота образует два ряда солей – карбонаты и гидрокарбонаты. Из карбонатов в воде растворимы только карбонаты щелочных металлов и аммония, гидрокарбонаты растворимы почти все. СO2 может быть окислителем при взаимодействии только с очень сильными восстановителями. Например, в его атмосфере горит магний, при этом СО2 восстанавливается до СО или до свободного углерода. В лаборатории СO2 получают в аппарате Киппа по реакции
СаСОз 2HCl = СаСl2 СO2 Н2O
Оксид кремния (IV) SiO2 по своему характеру является кислотным оксидом, химически устойчив. Оксиду кремния соответствует кремниевая кислота Н2SiO3, не растворимая в воде. Осадок имеет вид бесцветного студня, причем состав его отвечает не простой формуле H2SiO3, а более общей nSiO2∙mН2О. Кремниевая кислота очень слабая, легко выделяется из растворов солей другими кислотами, даже угольной. Соли кремниевой кислоты называются силикатами. Из силикатов растворимы только соли щелочных металлов. Их растворы подвергаются гидролизу и имеют щелочную реакцию
2Na2SiO3 2Н2О = Na2Si2O5 2NaOH
Выполнение работы
Опыт 1. Растворение оксида углерода (IV) в воде
В пробирку налить 3-4 мл воды, добавить несколько капель синего лакмуса и пропустить в воду СO2 из аппарата Киппа.
Требование к результатам опыта:
Написать уравнение реакции взаимодействия воды с СО2 и объяснить изменение окраски лакмуса.
Опыт 2. Тушение огня оксидом углерода (IV) (групповой)
Сухой стакан наполнить СO2 из аппарата Киппа. В фарфоровую чашку, налить 15-20 капель спирта и поджечь его. Затем «вылить» из стакана СO2 на горящий спирт. Что наблюдается?
Опыт 3. Окислительные свойства оксида, углерода (IV) (групповой)
Наполнить стакан СО2. Взять щипцами ленту магния, поджечь ее на спиртовке и быстро внести в стакан с СО2, не касаясь его стенок. По окончании горения магния в стакан налить немного воды, обмыть стенки стакана, прилить несколько капель фенолфталеина. Что наблюдается?
Требования к результатам опыта:
1. Закончить уравнения реакций: Mg CO2 =
MgO H2O =
2. Сделать вывод об окислительных свойствах СО2.
Опыт 4. Получение кремниевой кислоты
К 1-3 мл концентрированного раствора Na2SiO3 и добавить 1-2 мл раствора HCl (1:1), перемешать стеклянной палочкой. В результате образования кремниевой кислоты содержимое пробирки застывает в виде прозрачного геля (студенистого осадка).
Требование к результатам опыта:
Написать уравнение реакции получения кремниевой кислоты.
Опыт 5. Сравнение силы угольной и кремниевой кислот
Налить в пробирку 2-3 мл раствора Na2SО3, пропустить ток СO2. Объяснить наблюдаемое.
Требование к результатам опыта:
Написать уравнение реакции взаимодействия Na2SО3 с СO2.
Опыт 6. Гидролиз силикатов
В две пробирки налить по 1-2 мл раствора силиката натрия Na2SiO3. В одну прилить несколько капель фенолфталеина. Что наблюдается? В другую пробирку добавить 2-4 мл раствора хлорида аммония NH4Cl. Определить, какой газ выделяется.
Требования к результатам опыта:
1. Составить уравнение реакции гидролиза силиката натрия.
2. Закончить уравнение реакции Na2SiO3 NH4Cl H2O= и объяснить образование газа.
Задачи
№ 27.1. Сколько кубических метров СО2 (н.у.) можно получить из 1 т известняка, содержащего 95 % СаСО3? (Ответ: 212,8 м3).
№ 27.2. Вычислить объем одного моля эквивалентов СО2 в реакции
С О2 = СО2 при нормальных условиях. (Ответ: 5,6 л).
№ 27.3. Составить уравнения реакций взаимодействия: а) NaHCO3 и HCl; б) NaHCO3 и NaOH; в) Ca(HCO3)2 и NaOH; г) Ca(HCO3)2 и Ca(OH)2.
№ 27.4. Какие типы гибридизации АО характерны для углерода? Описать с позиций метода ВС строение молекул СН4, С2Н4, С2Н2.
№ 27.5. Карбид кальция получают по схеме: СаО С → СаС2 СО. Вычислить массу СаО, необходимую для получения 6,4 т СаС2. Какой объем СО (н.у.) при этом образуется? (Ответ: 5,6 т; 2240 м3).
№ 27.6. Вычислить энтальпию образования оксида магния, исходя из уравнения реакции CO2 2Mg = 2MgO C, ΔH0 = -810 кДж.
ΔfH0 (CO2) = -393,5 кДж/моль. (Ответ: 601,8 кДж/моль).
№ 27.7. Закончить уравнения реакций: а) SiO2 KOH =;
б) SiO2 HF =; в) Si NaOH H2O =; г) SiO2 Mg 
№ 27.8. Реакция протекает по уравнению Si 2NaOH H2O = Na2SiO3 H2. Сколько кремния и воды потребуется для получения водорода, необходимого для наполнения воздушного шара емкостью 200 м3 (условия нормальные)? (Ответ: Si – 125 кг; Н2О – 80,3 кг).
№ 27.9. Вычислить молярную массу эквивалентов карбоната натрия при взаимодействии с кислотой, если образуется:
а) гидрокарбонат; б) угольная кислота. (Ответ: 106 г/моль; 53 г/моль).
№ 27.10. Какие вещества и в каком количестве требуются для получения 1 л SiH4 (условия нормальные)?
№ 27.11. Какие из перечисленных газов при пропускании их через раствор щелочи вступают с ней в реакцию: а) СО; б) СО2; в) HCN; г) CF4?
Составить соответствующие уравнения реакций.
№ 27.12. Вычислить энтальпию образования SiC, исходя из уравнения реакции: SiO2 3C = SiC 2CO, ΔH0х.р. = 510,9 кДж.
Энтальпии образования SiO2 и СО соответственно равны -910,9 кДж/моль
и -110,5 кДж/моль. (Ответ: -179 кДж/моль).
№ 27.13. Закончить уравнения реакций:
а) CO KMnO4 H2SO4 = б) CO K2Cr2O7 H2SO4 =
№ 27.14. Через раствор, содержащий 112 г гидроксида калия, пропустили диоксид углерода, полученный при действии избытка HCl на 300 г карбоната кальция. Какая соль при этом образовалась и какова ее масса?
(Ответ: КНСО3; 200 г).
№ 27.15. Какой объем СО2 (н.у.) может дать огнетушитель, содержащий
20 л8 %-ного раствора NaHCO3 (плотность раствора 1,058 г/см3)?
(Ответ: 448 л).
№ 27.16. Состав минерала асбеста может быть выражен формулой
CaО ∙ 3MgО ∙ 4SiO2. Вычислить процентное содержание SiO2 в асбесте.
(Ответ: 57,7 %).
№ 27.17. Какой объем СО2 (условия нормальные) можно получить из 210 г
NaHCO3: а) прокаливанием; б) действием кислоты? (Ответ: 28 л; 56 л).
№ 27.18. Закончить уравнения реакций: а) CaC2 H2O =;
б) Mg2Si HCl =; в) CO Fe2O3 =; г) SiO2 Na2CO3
№ 27.19. В пробирках находятся растворы: NaOH, NaHCO3, Na2CO3. С помощью каких реакций можно отличить их друг от друга? Составить соответствующие уравнения реакций.
№ 27.20. Закончить уравнения реакций: а) Si HNO3 HF =;
б) Al C  ; в) Na2SiO3 HCl (конц.) =; г) H2SiO3 KOH =
; в) Na2SiO3 HCl (конц.) =; г) H2SiO3 KOH =
Лабораторная работа 28
Углеводороды
Цель работы: изучить понятия «алканы», «алкены», «алкины».
Задание: провести опыты по получению этилена и ацетилена, изучить свойства этилена, ацетилена и бензола. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Углеводороды являются простейшими по составу органическими соединениями, т. к. они состоят только из углерода и водорода. При замещении в молекулах углеводородов атомов водорода на атомы или группы атомов (радикалы) других элементов получаются другие классы органических соединений (производные углеводородов).
По характеру связи между углеродными атомами различают углеводороды с простыми связями, в которых все атомы углерода связаны одной ковалентной связью, и углеводороды с кратными (двойными или тройными) связями. В углеводородах с двойными связями два углеродных атома связаны между собой двумя ковалентными связями. Простейшим из этих углеводородов является этилен СН2=СН2.
Углеводороды с тройной связью содержат атомы углерода, связанные между собой тремя ковалентными связями, например ацетилен Н−С≡С–Н.
Углеводороды с простой связью характеризуются малой химической активностью. Они не вступают в реакции присоединения и, вследствие этого, получили название предельных (насыщенных) углеводородов. Углеводороды с кратными связями способны за счет разрыва второй и третьей связи присоединять водород, галогены и т. д. Например:
CН2=CН2 Br2 → CН2Br−CН2Br.
этилен дибромэтан
Поэтому они названы непредельными (ненасыщенными) углеводородами.
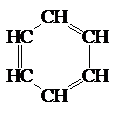 Кратные связи могут содержаться и в молекулах циклических углеводородов. В тех случаях, когда цикл состоит из шести углеродных атомов, связанных между собой чередующимися простыми и двойными связями, углеводороды называются ароматическими. Простейшим из них является бензол.
Кратные связи могут содержаться и в молекулах циклических углеводородов. В тех случаях, когда цикл состоит из шести углеродных атомов, связанных между собой чередующимися простыми и двойными связями, углеводороды называются ароматическими. Простейшим из них является бензол.
Несмотря на то, что в молекулах ароматических углеводородов имеются три двойные связи, они по своим химическим свойствам ближе к предельным углеводородам, т.е. способны, главным образом, к реакциям замещения.
Выполнение работы
Опыт 1. Получение этилена и его свойства
В пробирку налить 1-1,5 мл этилового спирта и 5 мл концентрированной серной кислоты (ρ=1,84 г/мл). Укрепить пробирку в зажиме штатива, закрыть ее пробкой с газоотводной трубкой, конец которой поместить в пробирку с разбавленной бромной водой, и нагреть. Наблюдать обесцвечивание бромной воды. Когда обесцвечивание закончится, переместить конец газоотводной трубки в пробирку со слабо окрашенным раствором КMnO4. Когда раствор обесцветится, вынуть из него трубку и после этого прекратить нагревание.
Требования к результатам опыта:
1. Написать уравнение реакции получения этилена.
2. Закончить уравнения реакций: CН2=CН2 Br2 →
CН2=CН2 [O] H2O →
3. По результатам опыта сделать вывод о химических свойствах этилена.
Опыт 2. Ацетилен и его свойства
В небольшую колбу налить на ⅔ ее объема воды, закрепить ее в штативе, бросить в нее небольшой кусочек карбида кальция СаС2, быстро закрыть отверстие пробирки пробкой с газоотводной трубкой и, опустив конец последней в пробирку с бромной водой, пропустить через бромную воду ток ацетилена. Что происходит с окраской раствора? Пропустить ток ацетилена через подкисленный раствор перманганата калия. Как изменилась окраска раствора?
Требования к результатам опыта:
1. Написать уравнение реакции получения ацетилена при взаимодействиии карбида кальция с водой.
2. Записать уравнения реакций между ацетиленом и бромом (промежуточным продуктом является дибромэтилен, конечным − тетрабромэтан).
3. Закончить уравнение реакции C2H2 KMnO4 H2SO4 →, принимая, что конечными продуктами реакции являются муравьиная кислота НСООН, диоксид углерода, сульфат марганца (II), сульфат калия и вода.
4. По результатам опыта сделать вывод о химических свойствах ацетилена.
Опыт 3. Свойства бензола
В две пробирки налить 1-2 мл бензола, в одну пробирку прилить 1-2 мл бромной воды, в другую пробирку – 1-2 мл раствора перманганата калия, подкисленного серной кислотой, пробирки встряхнуть.
Требования к результатам опыта:
1. Записать наблюдения. Объяснить, почему растворы бромной воды и перманганата калия не обесцвечиваются при добавлении бензола.
2. Охарактеризовать способность бензола к реакциям присоединения и окисления, присущим непредельным углеводородам.
Примеры решения задач
Пример 28.1. Написать уравнения реакций, при помощи которых из метана и неорганических реагентов можно получить бутан.
Решение. 1. Бромированием метана можно получить бромметан:
CH4 Br2 → CH3Br HBr
2. При нагревании бромметана с натрием образуется этан:
2CH3Br 2Na → C2H6 2NaBr
3. При взаимодействии этана с бромом образуется бромэтан:
C2H6 Br2 → C2H5Br HBr
4. Бутан получается из бромэтана по реакции Вюрца:
2C2H5Br 2Na → C4H10 2NaBr
Пример 28.2. При сжигании газообразного углеводорода объемом 2,24 л было получено оксида углерода (IV) массой 13,2 г и воды массой 7,2 г. Плотность газа по воздуху составляет 1,52 (н.у.). Определить молекулярную формулу газа.
Решение. 1. Молярная масса газа равна:
М (возд.) = 29 г/моль; Dвозд.(газа) = 1,52;
М (газа) = 29 г/моль ∙ 1,52 = 44 г/моль.
2. Масса углерода и водорода в 2,24 л углеводорода составляет:
12 г углерода образует 44 г СО2
х « углерода « 13,2 « СО2 х =  3,6 г С,
3,6 г С,
2 г водорода образует 18 г Н2О
y « водорода « 7,2 « Н2О у =  0,8 г Н.
0,8 г Н.
3. Масса углерода и водорода в сожженном газе составляет:
3,6 0,8 = 4,4г.
4. Рассчитаем массу 2,24 л углеводорода:
44 г углеводорода занимает объем 22,4 л
х « углеводорода « « 2,24 « х =  4,4 г.
4,4 г.
5. Значит, газ состоит тлько из углерода и водорода. Следовательно,
С:Н = 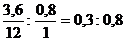 = 1:2,66,
= 1:2,66,
Откуда простейшая формула СН2,66 (М = 14,66). Отношение истинного соединения к массе простейшего соединения составляет 44/14,66 = 3. Следовательно, простейшую формулу надо увеличить в 3 раза, откуда истинная формула газа С3Н8.
Пример 28.3. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
этиловый спирт → Х → Y → Z → бутен-1
Указать условия протекания реакций.
Решение. 1. При нагревании этилового спирта до 180 – 200 оС с концентрированной серной кислотой должен образоваться продукт, реагирующий с бромоводородом. Это этилен (вещество Х). Уравнение реакции:
С2Н5ОН  С2Н4 Н2О
С2Н4 Н2О
2. В результате присоединения бромоводорода к этилену образуется бромэтан (Y):
С2Н4 НBr → C2H5Br
3. При нагревании бромэтана в присутствии натрия образуется бутан (Z)
C2H5Br 2Na → C4H10 2NaBr
4. Дегидрирование бутана в присутствии катализатора, например никеля – один из способов получения алкенов, в частности бутена-1.
CH3−CH2−CH2−CH3 CH2=CH−CH2−CH3 Н2
CH2=CH−CH2−CH3 Н2
Пример 28.4. Написать уравнения реакций, которые надо провести для осуществления следующих превращений:
циклогексан → бензол → толуол → бензойная кислота
Указать условия протекания реакций.
Решение. 1. Циклогексан превращается в бензол при пропускании его паров над нагретым платиновым катализатором:
С6Н12 С6Н6 3Н2
С6Н6 3Н2
2. Ввести алкильную группу в бензольное кольцо можно действием галогеналкила в присутствии хлорида алюминия:
C6H6 CH3Cl  C6H5−CH3 HCl
C6H5−CH3 HCl
3. При действии раствора перманганата калия на толуол образуется бензойная кислота:
C6H5−CH3 3[O]  C6H5−COOH H2O
C6H5−COOH H2O
Задачи
№ 28.1.Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
Al4C3 → CH4 → CH3Br → C2H6 → CO2 → CO → CH4
Указать условия протекания реакций.
№ 28.2. При сгорании 4,3 г образца алкана выделились 6,72 л СО2 и 6,3 г воды (н.у.). Определить формулу алкана.
№ 28.3. Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
СН3−СН3 → СН2=СН2 → СН3−СН2ОН
Указать условия протекания реакций.
№ 28. 4.Сколько граммов 1,6 %-ной бромной воды может обесцветить
1,12 л пропилена при нормальных условиях? (Ответ: 500 г).
№ 28.5.20 г карбида кальция обработали избытком воды, выделившийся ацетилен пропустили через бромную воду, получив 86,5 г
1,1,2,2-тетрабромэтана. Определить выход продукта реакции. (Ответ: 80 %).
№ 28.6.При помощи каких реакций можно различить следующие газы: пропан, пропен и пропин? Написать уравнения реакций.
№ 28.7. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
метан → Х → бензол
Назвать вещество Х. Указать условия протекания реакций.
№ 28. 8. Из 3,36 л ацетилена (условия нормальные) получили 2,5 мл бензола. Определить выход продукта. Плотность бензола равна 0,88 г/мл.
(Ответ: 56,4 %).
№ 28.9. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH3−CH2−CH2Br → CH3−CH=CH2 → CH3−CH2Br−CH3
Указать условия протекания реакций.
№ 28.10.Какой объем метана (н.у.) выделится: а) при гидролизе 72 г Al4C3; б) из 4,1 г безводного ацетата натрия? (Ответ: 33,6 л; 1,12 л).
№ 28.11.При помощи каких реакций можно осуществить следующий цикл превращений:
CH4 → CH3Cl → C2H6 → C2H5Cl → C3H8.
№ 28.12.Как, исходя из метана, можно получить бензол? Сколько литров метана (н.у.) необходимо затратить на получение 7,8 г бензола?
(Ответ: 13,4 л).
№ 28.13.Какой объем 90 %-ного раствора азотной кислоты (плотность
1,483 г/мл) потребуется для нитрования бензола, чтобы получилось 24,6 г нитробензола? (Ответ: 9,44 мл).
№ 28.14. Состав соединения выражается формулой С4Н6. Известно, что это вещество легко взаимодействует с бромной водой, не реагирует с аммиачным раствором оксида серебра, но присоединяет воду в присутствии солей ртути (II). Написать структурную формулу соединения и назвать его.
№ 28.15. Написать уравнения реакций, при помощи которых можно осуществить превращения:
Al4C3 → X → Y → Cu2C2.
Назвать соединения Х и Y.
№ 28.16.Алкен нормального строения содержит двойную связь при первом углеродном атоме. 0,7 г этого алкена присоединил 1,6 г брома, Определить формулу алкена и назвать его.
№ 28.17.Углеводород, состав которого выражается формулой С3Н4, взаимодействует с бромной водой и с натрием с выделением водорода. Определить структурную формулу углеводорода и назвать его.
№ 28.18.При сгорании 3,6 г алкана образуется 5,6 л СО2. Какой объем кислорода (н.у.) потребуется для реакции? (Ответ: 8,96 л).
№ 28.19. Органическое вещество содержит углерод (массовая доля 84,21 %) и водород (15,79 %). Плотность паров вещества по воздуху составляет 3,93 (н.у.). Определить формулу этого вещества.
№ 28.20.Массовая доля углерода в углеводороде составляет 83,33 %. Плотность паров углеводорода по водороду равна 36 (н.у.). Определить формулу углеводорода.
Лабораторная работа 29
Спирты, альдегиды, кетоны
Цель работы: изучить понятия «спирты», «альдегиды», «кетоны» и свойства этих соединений.
Задание: выполнить химический эксперимент по установлению свойств важнейших представителей спиртов, альдегидов и кетонов. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Спирты– это производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильные группы −ОН.
 Химические свойства спиртов определяются гидроксильной группой −ОН, входящей в состав молекулы. Химические реакции спиртов могут протекать с участием всей группы (с разрывом связи С−О) или идти по водороду гидроксильной группы (с разрывом связи О−Н), например реакция этерификации:
Химические свойства спиртов определяются гидроксильной группой −ОН, входящей в состав молекулы. Химические реакции спиртов могут протекать с участием всей группы (с разрывом связи С−О) или идти по водороду гидроксильной группы (с разрывом связи О−Н), например реакция этерификации:
уксусноэтиловый эфир (этилацетат)
Фенолы – это органические соединения, в которых гидроксильная группа соединена непосредственно с атомом углерода бензольного кольца. Простейшим представителем фенолов является гидроксибензол или фенол, имеющий одну гидроксильную группу в бензольном кольце:
или С6Н5−ОН
Фенол – твердок кристаллическое вещество с характерным запахом, плохо растворяющееся в воде. Химические свойства фенолов определяются гидроксильной группой и связанным с ней бензольным кольцом.
Кислотные свойства. Фенолы проявляют кислотные свойства и взаимодействуют со щелочными металлами и щелочами:
2C6H5OH 2Na → 2C6H5ONa H2
C6H5OH NaOH → C6H5ONa H2O
Реакции замещения в бензольном кольце. Гидроксильная группа оказывает очень большое влияние на бензольное кольцо, увеличивая его реакционную способность. Поэтому фенол легко вступает в реакции электрофильного замещения (с ориентацией заместителей в о— и п-положения). Например, он легко бромируется бромной водой с образованием 2,4,6-трибромфенола.
Качественная реакция на фенол. Фенол образует с FeCl3 комплексную соль, окрашенную в фиолетовый цвет.
Под действием окислителей (K2Cr2O7, KMnO4) в присутствии H2SO4 спирты окисляются с образованием альдегидов и кетонов, например:
3С2H5OH K2Cr2O7 4H2SO4 → Cr2(SO)3 K2SO4 3 7Н2О
 уксусный альдегид
уксусный альдегид
Альдегиды и кетоны содержат в молекуле карбонильную группу
В молекулах альдегидов карбонильная группа соединена с углеводородным радикалом и атомом водорода. Первым членом гомологического ряда аль-
дегидов является метаналь
формальдегид
40 %-ный водный раствор формальдегида называется формалином.
 В молекулах кетонов карбонильная группа соединена с двумя одинаковыми или разными радикалами R−CO−R/. Например,
В молекулах кетонов карбонильная группа соединена с двумя одинаковыми или разными радикалами R−CO−R/. Например,
ацетон
По своим химическим свойствам альдегиды являются восстановителями, которые легко окисляются в кислоты. Например, при окислении альдегидов аммиачным раствором оксида серебра образуется карбоновая кислота и происходит выделение металлического серебра. Оно тонким блестящим слоем покрывает стенки сосуда, в котором проводилась реакция, поэтому данная реакция называется «реакцией серебряного зеркала» и является качественной на альдегиды:

