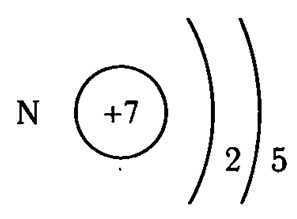
- Азотистая кислота
- Валентность азота.
- Валентность азота:
- Валентность брома в соединениях
- Найди валентность меди в его соединении с кислородом, формула соединения — cu2o.ответ запиши римской цифрой. например: iv. ответ
- Общие сведения о валентности азота
- Общие сведения о валентности брома
- Оксид азота (i)
- Оксид азота (ii)
- Оксид азота (iii)
- Оксид азота (iv)
- Оксид азота (v)
- Определение и формула оксида меди
- Определите валентность азота в n2o, no, n2o3, no2, n2o5.
- Определите валентность азота в следующих соединениях n2o
- Примеры решения задач
- Соединения азота
- Соли азотистой кислоты — нитриты
- Соли азотной кислоты — нитраты
- Способы получения
- Способы получения азота
- Способы получения аммиака
- Способы получения солей аммония
- Строение молекулы и физические свойства
- Таблица валентности химических элементов.
- Таблица характерных значений валентностей некоторых атомов химических соединений.
- Таблица элементов с постоянной валентностью.
- Физические свойства и нахождение в природе
- Химическая формула оксида меди
- Химические свойства
- Химические свойства азота
- Химические свойства аммиака
- Химические свойства солей аммония
Азотистая кислота
Азотистая кислота HNO2— слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты.
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например, соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 HCl → HNO2 AgCl
Химические свойства.
1.Азотистая кислота HNO2 существует только в разбавленных растворах, при нагревании она разлагается:
3HNO2 → HNO3 2NO H2O
без нагревания азотистая кислота также разлагается:
2HNO2 → NO2 NO H2O
2. Азотистая кислота взаимодействует с сильными основаниями.
Например, с гидроксидом натрия:
HNO2 NaOH → NaNO2 H2O
3.За счет азота в степени окисления 3 азотистая кислота проявляет слабые окислительные свойства. Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например, HNO2 окисляет иодоводород:
2HNO2 2HI → 2NO I2 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
2НNO2 2KI 2H2SO4 → K2SO4 I2 2NO 2H2O
Азотистая кислота окисляет соединения железа (II):
2HNO2 3H2SO4 6FeSO4 → 3Fe2(SO4)3 N2 4H2O
4. За счет азота в степени окисления 3 азотистая кислота проявляет сильные восстановительные свойства. Под действием окислителей азотистая кислота переходит в азотную.
Например, хлор окисляет азотистую кислоту до азотной кислоты:
HNO2 Cl2 H2O → HNO3 2HCl
Кислород и пероксид водорода также окисляют азотистую кислоту:
2HNO2 O2 → 2HNO3
HNO2 H2O2 → HNO3 H2O
Соединения марганца (VII) окисляют HNO2:
5HNO2 2HMnO4 → 2Mn(NO3)2 HNO3 3H2O
Валентность азота.
О валентности
Валентность азота
Молярная масса азота
Плотность азота
Степень окисления азота
Температура плавления азота
Температура кипения азота
Теплопроводность азота
Удельная теплоемкость азота
Удельная теплота сгорания азота
Электрическое сопротивление азота
Электропроводность азота
Все свойства атома азота
Валентность азота:
Валентность азота равна I, II, III, IV, но не V! Азот не может быть пятивалентным! Даже в азотной кислоте и своем высшем оксиде атом азота образует только четыре ковалентные связи, являясь четырехвалентным. Азот проявляет переменную валентность.
| Валентность азота в соединениях | |
| I | N2O |
| II | NO |
| III | Na3N, NH3, N2O3 |
| IV | HNO3, N2O5, NO2 |
карта сайта
Все свойства атома азота
Валентность брома в соединениях
Бром – тридцать пятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в четвертом периоде в VIIA группе. В ядре атома брома содержится 35 протонов и 45 нейтронов (массовое число равно 80). В атоме брома есть четыре энергетических уровня, на которых находятся 35 электронов (рис. 1).
Электронная формула атома брома в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p5.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие одного неспаренного электрона свидетельствует о том, что бром способен проявлять валентность I (низшая валентность) в своих соединениях (HBr, HBrO).
Для атома брома характерно наличие нескольких возбужденных состояний из-за того, что орбитали 4d-подуровня являются вакантными (на четвертом энергетическом слое помимо 4s- и 4p-подуровней есть еще и 4d-подуровень). Сначала распариваются электроны 4p -подуровня и занимают свободные d-орбитали, а после – электроны 4s-подуровня:
Наличие трех, пяти и семи неспаренных электронов в возбужденном состоянии свидетельствует о том, что бром проявляет в своих соединениях валентности III (AuBr3, HBrO2), V (HBrO3) и VII (HBrO4) (высшая валентность).
Найди валентность меди в его соединении с кислородом, формула соединения — cu2o.ответ запиши римской цифрой. например: iv. ответ
Общие сведения о валентности азота
Азот – типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду.
Природный азот состоит из двух устойчивых изотопов 14N (99,635%) и 15N (0,365%).
Молекула азота двухатомна. Между атомами азота в молекуле есть тройная связь, вследствие чего молекула N2 исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
В обычных условиях молекулярный азот – газ. Температуры плавления (-210oС) и кипения (-195,8oС) азота очень низкие; он плоха растворяется в воде и других растворителях.
Общие сведения о валентности брома
В виде простого вещества бром представляет собой жидкость красно-бурого цвета, обладающую резким неприятным запахом. Ядовит. Плотность 3,19 г/см3 (при t0 = 0oC). При кипении (t0 = 58,6oC) бром из жидкого состояния переходит в газообразное – образует буро-коричневый пар.
Молекула брома двухатомна Br2.
Оксид азота (i)
Оксид азота (I) – это несолеобразующий оксид. Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получитьоксид азота (I) в лаборатории можно разложением нитрата аммония:
NH4NO3 → N2O 2H2O
Химические свойства оксида азота (I):
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя. Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O H2 → N2 H2O
N2O Mg → N2 MgO
N2O 2Cu → N2 Cu2O
3N2O 2NH3 → 4N2 3H2O
N2O H2O SO2 → N2 H2SO4
Еще пример: оксид азота (I) окисляет углерод и фосфор при нагревании:
N2O C → N2 CO
5N2O 2Р → 5N2 Р2O5
2. При взаимодействии с сильными окислителямиN2O может проявлять свойства восстановителя.
Например, N2O окисляется раствором перманганата в серной кислоте:
5N2O 3H2SO4 2KMnO4 → 10NO 2MnSO4 K2SO4 3H2O
Оксид азота (ii)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например, при действии 30 %-ной азотной кислоты на медь образуется NO:
3Cu 8HNO3(разб.) → 3Cu(NO3)2 2NO 4H2O
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
3FeCl2 NaNO3 4HCl → 3FeCl3 NaCl NO 2H2O
2HNO3 6HI → 2NO I2 4H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
N2 O2 → 2NO
3. В промышленностиоксид азота (II) получают каталитическим окислением аммиака:
4NH3 5O2 → 4NO 6H2O
Химические свойства.
1. Оксид азота (II) легко окисляется под действием окислителей.
Например, горит в атмосфере кислорода:
2NO O2 → 2NO2
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO Cl2 → 2NOCl
NO O3 → NO2 O2
2. В присутствии более сильных восстановителей проявляет свойства окислителя. В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например, оксид азота (II) окисляет водород и сернистый газ:
2NO 2H2 → N2 2H2O
2NO 2SO2 → 2SO3 N2
Оксид азота (iii)
Оксид азота (III), азотистый ангидрид – кислотный оксид. За счет азота со степенью окисления 3 проявляет восстановительные и окислительныесвойства. Устойчив только при низких температурах, при более высоких температурах разлагается.
Способы получения: можно получить при низкой температуре из оксидов азота:
NO2 NO ↔ N2O3
Химические свойства:
1.Оксид азота (III) взаимодействует с водойс образованием азотистой кислоты:
N2O3 H2O ↔ 2HNO2
2.Оксид азота (III) взаимодействует с основаниями и основными оксидами:
Например, оксид азота (III) реагирует с гидроксидом и оксидом натрия с образованием нитрита натрия и воды:
N2O3 2NaOH → 2NaNO2 H2O
N2O3 Na2O → 2NaNO2
Оксид азота (iv)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2NO O2 → 2NO2
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например, при действии концентрированной азотной кислоты на медь:
4HNO3(конц.) Cu → Cu(NO3)2 2NO2 2H2O
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например, при разложении нитрата серебра:
2AgNO3 → 2Ag 2NO2 O2
Химические свойства.
1. Оксид азота (IV) реагирует с водойс образованием двух кислот — азотной и азотистой:
2NO2 H2O → HNO3 HNO2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 2H2O O2 → 4HNO3
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 H2O → 2HNO3 NO
2. При растворении оксида азота (IV) в щелочахобразуются нитраты и нитриты:
2NO2 2NaOH → NaNO3 NaNO2 H2O
4NO2 2Ca(OH)2 → Ca(NO2)2 Ca(NO3)2 2H2O
В присутствии кислорода образуются только нитраты:
4NO2 4NaOH O2 → 4NaNO3 2H2O
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор, уголь, сера, оксид серы (IV) окисляется до оксида серы (VI):
2NO2 2S → N2 2SO2
2NO2 2C → N2 2CO2
10NO2 8P → 5N2 4P2O5
NO2 SO2 → SO3 NO
4. Оксид азота (IV) димеризуется:
2NO2 ⇄ N2O4
Оксид азота (v)
N2O5– оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота:
2NO2 O3 → N2O5 O2
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V):
2HNO3 P2O5 → 2HPO3 N2O5
Химические свойства оксида азота (V).
1.При растворении в воде оксид азота (V) образует азотную кислоту:
N2O5 H2O → 2HNO3
2.Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например, оксид азота (V) реагирует с гидроксидом натрия:
N2O5 2NaOH → 2NaNO3 H2O
Еще пример: оксид азота (V) реагирует с оксидом кальция:
N2O5 CaO → Ca(NO3)2
3. За счет азота со степенью окисления 5 оксид азота (V) – сильный окислитель.
Например, он окисляет серу:
2N2O5 S → SO2 4NO2
4.Оксид азота (V) легко разлагается при нагревании (со взрывом):
2N2O5 → 4NO2 O2
Определение и формула оксида меди
Медь образует два оксида в которых проявляет валентности I и II и степени окисления ( 1) и ( 2) соответственно.
Во влажном состоянии медленно окисляется кислородом воздуха. Не реагирует с водой. Разлагается кислотами и щелочами. Переводится в раствор гидратом аммиака, солями аммония. Восстанавливается водородом, монооксидом углерода, активными металлами.
Не реагирует с водой и разбавленными щелочами. Проявляет амфотерные свойства (с преобладанием основных свойств): реагирует с разбавленными кислотами, концентрированными щелочами, оксидами щелочных металлов при высокой температуре.
Определите валентность азота в n2o, no, n2o3, no2, n2o5.
N2O – I, NO – II, N2O3 – III, NO2 – IV, N2O5 – V.
1. Определите валентность элементов по формулам: HgO, K2S, B2O3, ZnO, MnO2, NiO, Cu2O, SnO2, Ni2O3, SO3, As2O5, Cl2O7.
2. Даны химические символы элементов и указана их валентность. Составьте соответствующие химические формулы.
3. Пользуясь данными таблицы 3 (стр. 56 учебника), составьте химические формулы соединений с кислородом (оксидов) следующих химических элементов: Zn, B, Be, Co, Pb, Ni. Назовите эти соединения.
5. Составьте формулы оксидов (соединений с кислородом): меди (I), железа (III), вольфрама (VI), железа (II), углерода (IV), серы (VI), олова (IV), марганца (VII).
6. Составьте формулы соединений с хлором следующих элементов: K, Ca, Al, Ba.
7. Составьте формулы водородных соединений следующих элементов: S (II), P (III), F (I), C (IV).
Тестовые задания.
Определите валентность азота в следующих соединениях n2o
Прежде, чем перейти к ответу на вопрос «определите валентность азота в следующих соединениях ![]() …» следует дать четкое определение понятию «валентность» и объяснить каким образом её можно определить.
…» следует дать четкое определение понятию «валентность» и объяснить каким образом её можно определить.
Способность атома к образованию химических связей называют валентностью. Количественной мерой валентности принято считать число разных атомов в молекуле, с которыми данный элемент образует связи. Согласно обменному механизму метода валентных связей, валентность химических элементов определяется числом содержащихся в атоме неспаренных электронов. Для s- и p-элементов – это электроны внешнего уровня, для d-элементов – внешнего и предвнешнего уровней.
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Одни химические элементы проявляют во всех своих соединениях одну и ту же постоянную валентность, другие – различную, переменную валентность. Так, натрий, калий в химических соединениях всегда одновалентны; кислород, цинк, магний, кальций всегда двухвалентны.
Для того, чтобы определить валентность азота в составе оксида ![]() …» следует дать четкое определение понятию «валентность» и объяснить каким образом её можно определить.
…» следует дать четкое определение понятию «валентность» и объяснить каким образом её можно определить.
Способность атома к образованию химических связей называют валентностью. Количественной мерой валентности принято считать число разных атомов в молекуле, с которыми данный элемент образует связи. Согласно обменному механизму метода валентных связей, валентность химических элементов определяется числом содержащихся в атоме неспаренных электронов. Для s- и p-элементов – это электроны внешнего уровня, для d-элементов – внешнего и предвнешнего уровней.
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Одни химические элементы проявляют во всех своих соединениях одну и ту же постоянную валентность, другие – различную, переменную валентность. Так, натрий, калий в химических соединениях всегда одновалентны; кислород, цинк, магний, кальций всегда двухвалентны.
Для того, чтобы определить валентность азота в составе оксида  сначала указываем валентность кислорода, которая, как сказано выше, всегда равна II —
сначала указываем валентность кислорода, которая, как сказано выше, всегда равна II — ![]() . Затем находим общее число единиц валентности этого атома:
. Затем находим общее число единиц валентности этого атома:![]() . Затем находим общее число единиц валентности этого атома:
. Затем находим общее число единиц валентности этого атома: .
.
После этого делим полученное значение на число атомов (индекс) азота:![]() ,
,
т.е. валентность азота в составе оксида![]() ,
,
т.е. валентность азота в составе оксида равна I. Аналогичным образом определяем, что валентность этого же элемента в соединениях
равна I. Аналогичным образом определяем, что валентность этого же элемента в соединениях ![]() ,
, ![]() ,
,  ,
, ![]() ,
, ![]() ,
,  и
и ![]() равна II, III, IV, V и V соответственно.
равна II, III, IV, V и V соответственно.
Примеры решения задач
| Задание | При сжигании фосфора массой 1 г в атмосфере кислорода образовался его оксид массой 2,29 г. Найдите формулу оксида. |
| Решение | Определим массу кислорода в составе оксида: m(O) = moxide – m(P); m(O) = 2,29 – 1 = 1,29 г. Обозначим количество моль элементов, входящих в состав соединения за «х» (фосфор) и «у» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y = m(P)/Ar(P) : m(O)/Ar(O); x:y= 1/31 : 1,29/16; x:y= 0,032 : 0,08 = 1 : 2,5 = 2 : 5. Значит формула соединения фосфора и кислорода будет иметь вид P2O5. Это оксид фосфора (V). |
| Ответ | P2O5 |
| Задание | Найдите химическую формулу вещества, в состав которого входит 9 массовых частей алюминия и 8 массовых частей кислорода. |
| Решение | Для того, чтобы узнать, в каких отношениях находятся химические элементы в составе молекулы необходимо найти их количество вещества. Известно, что для нахождения количества вещества следует использовать формулу: n = m / M. Найдем молярные массы алюминия и кислорода (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Известно, что M = Mr, значит M(Al)= 27 г/моль, а М(O) = 16 г/моль. Тогда, количество вещества этих элементов равно: n (Al) = m (Al) / M (Al); n (Al) = 9 / 27 = 0,33 моль. n (O) = m (O) / M (O); n (O) = 8 / 16 = 0,5 моль. Найдем мольное отношение: n(Al) :n(O) = 0,33 : 0,5= 1 : 1,5 = 2 : 3, т.е. формула соединения алюминия с кислородом имеет вид Al2O3. |
| Ответ | Al2O3 |
Соединения азота
Типичные соединения азота:
| Степень окисления | Типичные соединения |
| 5 | оксид азота (V) N2O5 азотная кислота HNO3 нитраты MeNO3 |
| 4 | оксид азота (IV) NO2 |
| 3 | оксид азота (III) азотистая кислота нитриты MeNO2 |
| 2 | оксид азота (II) NO |
| 1 | оксид азота (I) |
| -3 | аммиак NH3 нитриды металлов MeN бинарные соединения азота с неметаллами |
Соли азотистой кислоты — нитриты
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна 3, то они проявляют как окислительныесвойства, так и восстановительные.
Кислород, галогены ипероксид водорода окисляют нитриты до нитратов:
2KNO2 O2 → 2KNO3
KNO2 H2O2 → KNO3 H2O
KNO2 H2O Br2 → KNO3 2HBr
Лабораторные окислители — перманганаты, дихроматы— также окисляют нитриты до нитратов:
5KNO2 3H2SO4 2KMnO4 → 5KNO3 2MnSO4 K2SO4 3H2O
3KNO2 4H2SO4 K2Cr2O7 → 3KNO3 Cr2(SO4)3 K2SO4 4H2O
В кислой среде нитриты выступают в качестве окислителей.
При окислении йодидов или соединений железа (II) нитриты восстанавливаются до оксида азота (II):
2KNO2 2H2SO4 2KI → 2NO I2 2K2SO4 2H2O
2KNO2 2FeSO4 2H2SO4 → Fe2(SO4)3 2NO K2SO4 2H2O
При взаимодействии с очень сильными восстановителями (алюминий или цинк в щелочной среде) нитриты восстанавливаются максимально – до аммиака:
NaNO2 2Al NaOH 6H2O → 2Na[Al(OH)4] NH3
Смесь нитратов и нитритов также проявляет окислительныесвойства. Например, смесь нитрата и нитрита калия окисляет оксид хрома (III) до хромата калия:
3KNO2 Cr2O3 KNO3 → 2K2CrO4 4NO
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
1. Нитраты термически неустойчивы, причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Нитраты щелочных и щелочноземельных металлов (до Mg в электрохимическом ряду) разлагаются до нитрита и кислорода.
Например, разложение нитрата натрия:
2KNO3 → 2KNO2 O2
Исключение – литий.
Видеоопытразложения нитрата калия можно посмотреть здесь.
- Нитраты тяжелых металлов (от Mg до Cu, включая магний и медь) и литийразлагаются до оксида металла, оксида азота (IV) и кислорода:
Например, разложение нитрата меди (II):
2Cu(NO3)2 → 2CuO 4NO2 O2
- Нитраты малоактивных металлов (правее Cu) – разлагаются до металла, оксида азота (IV) и кислорода.
Например, нитрат серебра:
2AgNO3 → 2Ag 2NO2 O2
Исключения:
Нитрит железа (II) разлагается до оксида железа (III):
4Fe(NO3)2 → 2Fe2O3 8NO2 O2
Нитрат марганца (II) разлагается до оксида марганца (IV):
Mn(NO3)2 → MnO2 2NO2
2. Водные растворы не обладают окислительно-восстановительными свойствами, расплавы – сильные окислители.
Например, смесь 75% KNO3, 15% C и 10% S называют «черным порохом»:
2KNO3 3C S → N2 3CO2 K2S
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 H2SO4(конц) → KHSO4 HNO3
2.В промышленности азотную кислоту получают из аммиака. Процесс осуществляется стадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 5O2 → 4NO 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 2H2O O2 → 4HNO3
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды.
NaNO2 NH4Cl → NH4NO2 NaCl
NH4NO2 → N2 2H2O
Суммарное уравнение процесса:
NaNO2 NH4Cl → N2 NaCl 2H2O
Видеоопытвзаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
4NH3 3O2 → 2N2 6H2O
2. Наиболее чистый азот получают разложением азидовщелочныхметаллов.
Например, разложением азида натрия:
2NaN3 → 2Na 3N2
3.Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре ~700 °C:
3CuO 2NH3 → 3Cu N2 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск
ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl Са(OH)2 → CaCl2 2NH3 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопытполучения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторныйспособ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 6H2O → ЗСа(OH)2 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами. Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например, хлорид аммония реагирует с нитратом серебра:
NH4Cl AgNO3 → AgCl NH4NO3
3.Средние соли аммония можно получить из кислых солей аммония. При добавлении аммиака кислая соль переходит в среднюю.
Например, гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
NH4НCO3 NH3 → (NH4)2CO3
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения 82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентностьазота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна 5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Таблица валентности химических элементов.
Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число | Русское / Английское наименование | Химический символ | Валентность |
1 | Водород / Hydrogen | H | (-1), 1 |
2 | Гелий / Helium | He | 0 |
3 | Литий / Lithium | Li | 1 |
4 | Бериллий / Beryllium | Be | 2 |
5 | Бор / Boron | B | -3, 3 |
6 | Углерод / Carbon | C | ( 2), 4 |
7 | Азот / Nitrogen | N | -3, -2, -1, ( 1), 2, 3, 4, 5 |
8 | Кислород / Oxygen | O | -2 |
9 | Фтор / Fluorine | F | -1, ( 1) |
10 | Неон / Neon | Ne | 0 |
11 | Натрий / Sodium | Na | 1 |
12 | Магний / Magnesium | Mg | 2 |
13 | Алюминий / Aluminum | Al | 3 |
14 | Кремний / Silicon | Si | -4, ( 2), 4 |
15 | Фосфор / Phosphorus | P | -3, 1, 3, 5 |
16 | Сера / Sulfur | S | -2, 2, 4, 6 |
17 | Хлор / Chlorine | Cl | -1, 1, ( 2), 3, ( 4), 5, 7 |
18 | Аргон / Argon | Ar | 0 |
19 | Калий / Potassium | K | 1 |
20 | Кальций / Calcium | Ca | 2 |
21 | Скандий / Scandium | Sc | 3 |
22 | Титан / Titanium | Ti | 2, 3, 4 |
23 | Ванадий / Vanadium | V | 2, 3, 4, 5 |
24 | Хром / Chromium | Cr | 2, 3, 6 |
25 | Марганец / Manganese | Mn | 2, ( 3), 4, ( 6), 7 |
26 | Железо / Iron | Fe | 2, 3, ( 4), ( 6) |
27 | Кобальт / Cobalt | Co | 2, 3, ( 4) |
28 | Никель / Nickel | Ni | ( 1), 2, ( 3), ( 4) |
29 | Медь / Copper | Сu | 1, 2, ( 3) |
30 | Цинк / Zinc | Zn | 2 |
31 | Галлий / Gallium | Ga | ( 2). 3 |
32 | Германий / Germanium | Ge | -4, 2, 4 |
33 | Мышьяк / Arsenic | As | -3, ( 2), 3, 5 |
34 | Селен / Selenium | Se | -2, ( 2), 4, 6 |
35 | Бром / Bromine | Br | -1, 1, ( 3), ( 4), 5 |
36 | Криптон / Krypton | Kr | 0 |
37 | Рубидий / Rubidium | Rb | 1 |
38 | Стронций / Strontium | Sr | 2 |
39 | Иттрий / Yttrium | Y | 3 |
40 | Цирконий / Zirconium | Zr | ( 2), ( 3), 4 |
41 | Ниобий / Niobium | Nb | ( 2), 3, ( 4), 5 |
42 | Молибден / Molybdenum | Mo | ( 2), 3, ( 4), ( 5), 6 |
43 | Технеций / Technetium | Tc | 6 |
44 | Рутений / Ruthenium | Ru | ( 2), 3, 4, ( 6), ( 7), 8 |
45 | Родий / Rhodium | Rh | ( 2), ( 3), 4, ( 6) |
46 | Палладий / Palladium | Pd | 2, 4, ( 6) |
47 | Серебро / Silver | Ag | 1, ( 2), ( 3) |
48 | Кадмий / Cadmium | Cd | ( 1), 2 |
49 | Индий / Indium | In | ( 1), ( 2), 3 |
50 | Олово / Tin | Sn | 2, 4 |
51 | Сурьма / Antimony | Sb | -3, 3, ( 4), 5 |
52 | Теллур / Tellurium | Te | -2, ( 2), 4, 6 |
53 | Иод / Iodine | I | -1, 1, ( 3), ( 4), 5, 7 |
54 | Ксенон / Xenon | Xe | 0 |
55 | Цезий / Cesium | Cs | 1 |
56 | Барий / Barium | Ba | 2 |
57 | Лантан / Lanthanum | La | 3 |
58 | Церий / Cerium | Ce | 3, 4 |
59 | Празеодим / Praseodymium | Pr | 3 |
60 | Неодим / Neodymium | Nd | 3, 4 |
61 | Прометий / Promethium | Pm | 3 |
62 | Самарий / Samarium | Sm | ( 2), 3 |
63 | Европий / Europium | Eu | ( 2), 3 |
64 | Гадолиний / Gadolinium | Gd | 3 |
65 | Тербий / Terbium | Tb | 3, 4 |
66 | Диспрозий / Dysprosium | Dy | 3 |
67 | Гольмий / Holmium | Ho | 3 |
68 | Эрбий / Erbium | Er | 3 |
69 | Тулий / Thulium | Tm | ( 2), 3 |
70 | Иттербий / Ytterbium | Yb | ( 2), 3 |
71 | Лютеций / Lutetium | Lu | 3 |
72 | Гафний / Hafnium | Hf | 4 |
73 | Тантал / Tantalum | Ta | ( 3), ( 4), 5 |
74 | Вольфрам / Tungsten | W | ( 2), ( 3), ( 4), ( 5), 6 |
75 | Рений / Rhenium | Re | (-1), ( 1), 2, ( 3), 4, ( 5), 6, 7 |
76 | Осмий / Osmium | Os | ( 2), 3, 4, 6, 8 |
77 | Иридий / Iridium | Ir | ( 1), ( 2), 3, 4, 6 |
78 | Платина / Platinum | Pt | ( 1), 2, ( 3), 4, 6 |
79 | Золото / Gold | Au | 1, ( 2), 3 |
80 | Ртуть / Mercury | Hg | 1, 2 |
81 | Талий / Thallium | Tl | 1, ( 2), 3 |
82 | Свинец / Lead | Pb | 2, 4 |
83 | Висмут / Bismuth | Bi | (-3), ( 2), 3, ( 4), ( 5) |
84 | Полоний / Polonium | Po | (-2), 2, 4, ( 6) |
85 | Астат / Astatine | At | нет данных |
86 | Радон / Radon | Rn | 0 |
87 | Франций / Francium | Fr | нет данных |
88 | Радий / Radium | Ra | 2 |
89 | Актиний / Actinium | Ac | 3 |
90 | Торий / Thorium | Th | 4 |
91 | Проактиний / Protactinium | Pa | 5 |
92 | Уран / Uranium | U | ( 2), 3, 4, ( 5), 6 |
Чего не указано в таблице валентности, это то, что валентность элемента может быть постоянной и переменной.
Виды валентности | ||
Постоянная (у металлов главных подгрупп) | Переменная (у неметаллов и металлов побочных подгрупп) | |
Высшая (равна номеру группы) | Низшая (равна разности между числом 8 и номером группы) | |
Знание валентности элементов необходимы для правильного составления химических формул соединений.
Таблица характерных значений валентностей некоторых атомов химических соединений.
Элементы | Валентность | Примеры соединений |
H, F, Li, Na, K | I | H2, HF, Li2O, NaCl, KBr |
O, Mg, Ca, Sr, Ba, Zn | II | H2O, MgCl2, CaH2, SrBr2, BaO, ZnCl2 |
B, Al | III | BCl3, AlBr3 |
C, Si | IV | CO2, CH4, SiO2, SiCl4 |
Cu | I, II | Cu2O, CuO |
Fe | II, III | FeCl2, FeCl3 |
Cr | II, III, VI | CrCl2, CrCl3, CrO3 |
S | II, IV, VI | H2S, SO2, SO3 |
N | III, IV | NH3, NH4Cl, HNO3 |
P | III, V | PH3, P2O5, H3PO4 |
Sn, Pb | II, IV | SnCl2, SnCl4, PbO, PbO2 |
Cl, Br, I | I, III, V, VII | HCl, ClF3, BrF5, IF7 |
Таблица элементов с постоянной валентностью.
Валентности | Элементы |
I | H, Na, Li, K, Rb, Cs |
II | O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd |
III | B, Al, Ga, In |
Физические свойства и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Химическая формула оксида меди
Химическая формула оксида меди (I) Cu2O. Она показывает, что в состав данной молекулы входят два атома меди (Ar = 64 а.е.м.) и один атом кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу оксида меди (I):
Mr(Cu2O) = 2×Ar(Cu) Ar(O);
Mr(Cu2O) = 2×64 16 = 128 16 = 144.
Химическая формула оксида меди (II) CuO. Она показывает, что в состав данной молекулы входят один атом меди (Ar = 64 а.е.м.) и один атом кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу оксида меди (II):
Mr(CuO) = Ar(Cu) Ar(O);
Mr(CuO) = 64 16 = 80.
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления 5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциируетв водном растворе.
HNO3 → H NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, азотная кислота взаимодействует с оксидом меди (II):
CuO 2HNO3 → Cu(NO3)2 H2O
Еще пример: азотная кислота реагирует с гидроксидом натрия:
HNO3 NaOH → NaNO3 H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например, азотная кислота взаимодействует с карбонатом натрия:
2HNO3 Na2CO3 → 2NaNO3 H2O CO2
4. Азотная кислота частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 O2 2H2O
5.Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот 5.
металл HNO3 → нитрат металла вода газ (или соль аммония)
С алюминием, хромом и железомна холодуконцентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления 4:
Fe 6HNO3(конц.) → Fe(NO3)3 3NO2 3H2O
Al 6HNO3(конц.) → Al(NO3)3 3NO2 3H2O
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 3HCl Au → AuCl3 NO 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) Cu → Cu(NO3)2 2NO2 2H2O
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
10HNO3 4Ca → 4Ca(NO3)2 2N2O 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
8HNO3 (разб.) 3Cu → 3Cu(NO3)2 2NO 4H2O
С активными металлами (щелочными и щелочноземельными), а также оловоми железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
12HNO3(разб) 10Na → 10NaNO3 N2 6H2O
При взаимодействии кальцияи магнияс азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 4Ca → 4Ca(NO3)2 2N2O 5H2O
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
10HNO3 4Zn → 4Zn(NO3)2 NH4NO3 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 S → H2SO4 6NO2 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
5HNO3 P → H3PO4 5NO2 H2O
5HNO3 3P 2H2O → 3H3PO4 5NO
Видеоопытвзаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
4HNO3 C → CO2 4NO2 2H2O
Видеоопытвзаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
10HNO3 I2 → 2HIO3 10NO2 4H2O
7. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др.
Например, азотная кислота окисляет оксид серы (IV):
2HNO3 SO2 → H2SO4 2NO2
Еще пример: азотная кислота окисляет йодоводород:
6HNO3 HI → HIO3 6NO2 3H2O
Азотная кислота окисляет углерод до углекислого газа, т.к. угольная кислота неустойчива.
3С 4HNO3 → 3СО2 4NO 2H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
2HNO3 H2S → S 2NO2 2H2O
При нагревании до серной кислоты:
2HNO3 H2S → H2SO4 2NO2 2H2O
8HNO3 CuS → CuSO4 8NO2 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
4HNO3 FeS → Fe(NO3)3 NO S 2H2O
8. Азотная кислота окрашивает белкив оранжево-желтый цвет («ксантопротеиновая реакция»).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя(с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя(с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (3000оС-5000оС или действие электрического разряда) образуется атомарный азот, который реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой, фосфором, мышьяком, углеродом.
1.3.Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
N2 ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 6Li → 2Li3N
2.Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 3LiH → Li3N NH3
Химические свойства аммиака
1.В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 H2O ⇄ NH4 OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопытрастворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 H2SO4 → NH4HSO4
2NH3 H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 H2O CO2 → NH4HCO3
2NH3 H2O CO2 → (NH4)2CO3
Видеоопытвзаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 HCl → NH4Cl
Видеоопытвзаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 2NH3 2H2O → Fe(OH)2 (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 Cu(OH)2 → [Cu(NH3)4](OH)2
5.Аммиак горит на воздухе, образуя азот и воду:
4NH3 3O2 → 2N2 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 5O2 → 4NO 6H2O
6. За счет атомов водорода в степени окисления 1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 2Na → 2NaNH2 H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 2Al → 2AlN 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 3Cl2 → N2 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 3H2O2 → N2 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 3CuO → 3Cu N2 3H2O
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты, почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 Cl–
2.Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями, если в продуктах образуется газ, осадок или образуется слабый электролит.
Например, карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
(NH4)2CO3 2НCl → 2NH4Cl Н2O CO2
Соли аммония реагируют с щелочами с образованием аммиака.
Например, хлорид аммония реагирует с гидроксидом калия:
NH4Cl KOH → KCl NH3 H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону, т.к. гидроксид аммония — слабое основание:
NH4Cl Н2O ↔ NH3 ∙ H2O HCl
NH4 HOH ↔ NH3 ∙ H2O H
4. При нагревании соли аммония разлагаются. При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
NH4Cl → NH3 HCl
NH4HCO3 → NH3 CO2 H2O
(NH4)2SO4 → NH4HSO4 NH3
NH4HS → NH3 H2S
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
NH4NO2 → N2 2H2O
190 – 245° C:
NH4NO3 → N2O 2H2O
При температуре 250 – 300°C:
2NH4NO3 → 2NO 4H2O
При температуре выше 300°C:
2NH4NO3 → 2N2 O2 4H2O
Разложение бихромата аммония («вулканчик»).Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
(NH4)2Cr2O7 → Cr2O3 N2 4H2O
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду.
Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив.
Видеоопытразложения дихромата аммония можно посмотреть здесь.